Антифосфолипидный синдром (АФС) – системное аутоиммунное заболевание, характеризующееся сосудистыми тромбозами и акушерской патологией, которые обусловлены присутствием циркулирующих антифосфолипидных антител [1]. Впервые АФС был описан в 1986 г. G. Hughes, в зарубежной литературе часто упоминается по имени автора [2].
В настоящее время АФС рассматривается как мультидисциплинарная проблема. При этом термин «АФС-ассоциированная нефропатия» (АФСН) введен в клиническую практику относительно недавно (1999), а изучение данной патологии до недавнего времени ограничивалось небольшими исследованиями [3]. Причиной этого является то, что в большинстве случаев в дебюте АФС наблюдаются тяжелые окклюзивные поражения сосудов других органов, что «маскирует» клинические проявления поражения почек. Дебют заболевания с АСФН возникает, по данным различных исследований, в 1% всех впервые выявленных случаев АФС. Однако проведенные исследования показывают, что АФСН часто является предиктором неблагоприятного прогноза у пациентов с АФС [4]. До сих пор остается неясным ответ на вопрос: действительно ли заболевание редко дебютирует с поражения почек или же на начальных стадиях имеет место клинически «скрытое» течение АСФН, проявляющееся исключительно незначительными изменениями в анализах мочи.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациент Н., 63 лет, переведен в ОРИТ ГКБ № 15 им. О.М. Филатова из ГКБ № 52 в связи с ухудшением состояния после программного гемодиализа (ПГД).
Из анамнеза известно, что при диспансеризации в 1992 г. впервые выявлена протеинурия до 1 г/ сут и повышение артериального давления (АД) до 160/100 мм рт.ст. Дальнейшая динамика развития симптомов у данного больного представлена на рисунке. Вплоть до 2008 г. пациент никак не обследовался и за медицинской помощью не обращался, когда с выраженной слабостью и тошнотой был госпитализирован в ГКБ № 52. При обследовании выявлено повышение уровня креатинина до 460 мкмоль/л, отеки, повышение АД до 150/90 мм рт.ст., анемия (гемоглобин – Hb до 92 г/л). Пациент амбулаторно получал антигипертензивные препараты и эритропоэтин.
С 21.01 по 09.02.2010 г. находился на стационарном лечении в МСЧ № 60 Москвы, куда был госпитализирован в связи с ухудшением общего состояния, а также жалобами на учащенное мочеиспускание. Пациент отметил похудание на 30 кг. При обследовании: протеинурия – 0,99 г/ сут, уровень креатинина – 828 мкмоль/л, мочевины – 30,7 ммоль/л, Hb – 112 г/л. При проведении ультразвукового исследования (УЗИ) обнаружены кисты в обеих почках. Был поставлен диагноз «обострение хронического пиелонефрита, хронический простатит. Хроническая почечная недостаточность (ХПН). Кисты обеих почек. Артериальная гипертензия». Проводилось лечение нитроксолином и леспенефрилом с положительной динамикой.
В мае 2010 г. повторная госпитализация в МСЧ № 60 с жалобами на дизурические расстройства. По данным лабораторных исследований протеинурия составляла 0,23 г/сут, креатинин – 721,5 мкмоль/л, мочевина – 26,1 ммоль/л, уровень Hb – 116 г/л, лейкоциты 5,8×109/л. В общем анализе мочи: лейкоциты – до 100 в поле зрения (в п/зр), эритроциты – 5–6 в п/зр. По данным УЗИ почек и органов малого таза: аденома предстательной железы до 3,5 см. Проводилось лечение леспенефрилом и палином.
В августе 2010 г. отмечено нарастание слабости, одышки, появилась тошнота. Бригадой СМП был госпитализирован в ГКБ № 52. При обследовании: мочевина – 56,4 ммоль/л, креатинин – 900 мкмоль/л, Hb – 112 г/л. В общем анализе мочи: белок – 0,5 г/л, лейкоциты – до 20 в п/ зр, эритроциты – 4–6 в п/зр. Поставлен диагноз «нефропатия неуточненного генеза. ХБП 5 стадии», ПГД через центральный венозный катетер. 08.09.2010 сформирована артериовенозная фистула (АВФ) в дистальной трети левого предплечья. После стабилизации состояния лечение ПГД продолжено амбулаторно.
В 2013 г. частичный тромбоз АВФ, сформирован проксимальный реанастомоз радиоцефальной АВФ на левом предплечье. В течение следующих 3 мес технические трудности при пункции АВФ.
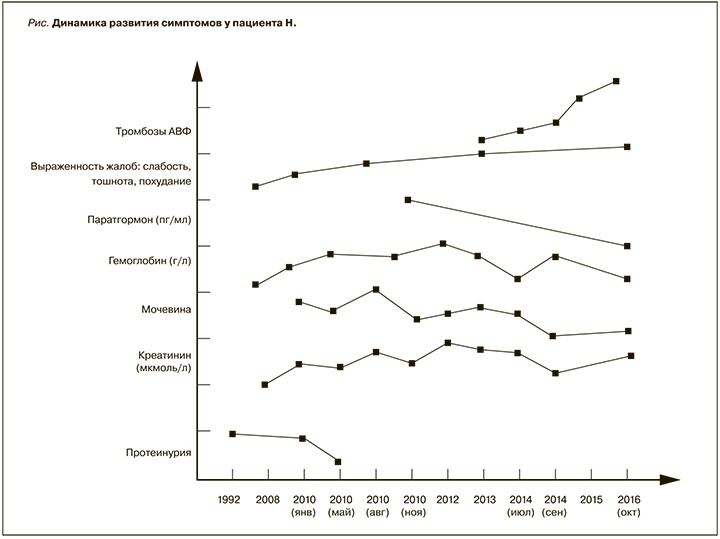
Вновь госпитализирован в ГКБ № 52 16.07.2014 с жалобами на общую слабость и боли в поясничной области. При поступлении АД – 160/100 мм рт. ст., диурез – 150–200 мл/сут. При обследовании: креатинин – 1142 мкмоль/л, мочевина – 20,2 ммоль/л, Hb – 104 г/л. Выявлено отсутствие характерного шума над АВФ. С целью создания сосудистого доступа для проведения ПГД была сформирована АВФ в нижней трети левого предплечья. Учитывая длительное время созревания АВФ, для продолжения лечения ПГД в амбулаторном режиме 22.08.2014 установлен тоннельный центральный венозный катетер (ЦВК).
24.09.2014 г. – тромбоз АВФ, сеанс ПГД был проведен через тоннельный ЦВК. 25.09.2014 выявлено отсутствие шума в области АВФ, выполнена ее реконструкция.
Во время планового сеанса ПГД 24.10.2016 г. выявлен очередной тромбоз АВФ, по СМП доставлен в приемное отделение ГКБ № 52. В связи с неоднократными тромбозами АВФ заподозрен АФС, выявлено повышение в 3 раза анти-β2-гликопротеина (60,6 МЕ/мл, норма 0–20 МЕ/мл) при нормальном значении волчаночного антикоагулянта. В связи с этим пациенту рекомендован постоянный прием пероральных антикоагулянтов. При поступлении пациент был осмотрен хирургом, произведена попытка тромбэктомии – без успеха. По решению хирурга 31.10.2016 г. пациенту имплантирован синтетический сосудистый протез на левом плече. Учитывая плохой прогноз в плане пункции АВФ, необходимость продолжения лечения ПГД предварительно имплантирован тоннельный ЦВК.
На фоне проводимого лечения АД оставалось на уровне 120/80 мм рт.ст., функция почек соответствовала терминальной ХПН. Рекомендовано продолжение лечения ПГД амбулаторно (через ЦВК).
Пациент был госпитализирован в ОРИТ ГКБ № 52 12.01.2018 г. с жалобами на повышение температуры до 39 °С, появление гнойного отделяемого в области выхода ЦВК. ЦВК, как вероятный источник инфекции, удален. При эхокардиографии (Эхо-КГ) выявлен флотирующий тромбоз верхней полой вены с пролабированием в правые отделы сердца. Проводилась антикоагулянтная терапия (далтепарин натрия – 5000 ЕД 2 раза в сутки подкожно), антибиотикотерапия (цефазолин, ванкомицин), ПГД. На основании выраженной воспалительной реакции, а также выявления диастолического шума над аортой заподозрен инфекционный эндокардит, в связи с чем 17.01.2018 больной был переведен в ГКБ № 15 им. О.М. Филатова.
При обследовании в ГКБ № 15 им. О.М. Филатова: общий анализ крови: Hb – 81 г/л, эритроциты – 3,2х109/л, лейкоциты – 3,6х109/л; биохимический анализ крови: общий белок – 62,8 г/л, мочевина – 14 ммоль/л, креатинин – 779 мкмоль/л, С-реактивный белок – 11,4 мг/л, прокальцитонин – 0,2 нг/мл, пресепсин – 2675 пг/ мл; коагулограмма: активированное частичное тромбопластиновое время – 41,9 с, Д-димер – 589 нг/мл; анализ мочи: протеинурия – 1 г/л, гормоны паращитовидной железы: паратиреоидный гормон – 790,0 пг/мл. По данным Эхо-КГ от 17.01.2018 г. выявлены вегетации на аортальном клапане (АК). Умеренная митральная, трикуспидальная недостаточность. Дилатация всех камер сердца. Эхо-КГ от 18.01.2018 г.: данных за тромбоз правых отделов сердца не выявлено. Аортальная регургитация 3 ст., наложения на створках аортального клапана. При чреспищеводной Эхо-КГ данных за тромбоз правых отделов сердца, верхней полой вены не выявлено. Эхо-КГ от 29.01.2018: инфекционный эндокардит аортального клапана с наличием вегетаций размером до 6,5 мм. Тяжелая аортальная недостаточность. Атеросклеротические изменения корня и стенок аорты. Дилатация восходящего отдела аорты. Умеренная митральная, трикуспидальная недостаточность. Дилатация всех камер сердца. Гипертрофия миокарда левого желудочка (ЛЖ) без признаков обструкции выходного тракта. Диастолическая дисфункция ЛЖ 1 типа. Легочная гипертензия 1 ст. Показатели систолической функции ЛЖ в норме (фракция выброса 52%).
Пациент был проконсультирован кардиохирургом, учитывая тяжелую сопутствующую патологию, рекомендована консервативная терапия.
Ультразвуковое ангиосканирование вен верхней конечности: признаки тромбоза латеральной подкожной вены правой руки с признаками реканализации.
Поставлен диагноз: основное заболевание: подострый первичный инфекционный эндокардит с поражением аортального клапана. Антифосфолипидный синдром. Тромботическая микроангиопатия с поражением почек. Осложнения: ХСН 2Б стадии, IV ФК (по NYHA). Тяжелая аортальная недостаточность. Сепсис. Терминальная почечная недостаточность. ПГД с 2010 г. Неоднократные тромбозы АВФ». Синтетический сосудистый протез от 31.10.2016. МЦВК от 26.10.2016 г., удаление от 10.01.2018 г. в связи с дисфункцией. Тромбоз ЛПВР правой в/к с признаками реканализации. Вторичный гиперпаратиреоз. Нефрогенная анемия средней степени тяжести. Артериальная гипертензия 2-й степени, риск сердечно-сосудистых осложнений 4.
В стационаре пациенту проведена антибактериальная терапия (ванкомицин по 1000 мг/ сут в/в капельно, гентамицин по 80 мг/сут в/в, линезолид по 600 мг 2 раза в сутки), сеансы гемодиализа (3 раза в неделю, длительность процедур не менее 5–6 ч), антитромботическая терапия фраксипарином 0,6 мг/сут п/к.
На фоне проведенного лечения состояние улучшилось: нормализировалась температура тела, уровень лейкоцитов в крови, регрессировали симптомы сердечной недостаточности. Пациент был выписан 17.02.2018 г. под наблюдение врача поликлиники по месту жительства. Даны рекомендации: бисопролол по 1,25 мг 1 раз утром, фраксипарин по 0,6 мг п/к в междиализный период, омепразол по 20 мг вечером.
ОБСУЖДЕНИЕ
АФСН – заболевание, обусловленное тромботической микроангиопатией внутрипочечных сосудов (капилляров клубочков, артериол, артерий) у пациентов с циркулирующими антифосфолипидными антителами, которая приводит к развитию ишемии почек и прогрессирующей почечной недостаточности вследствие нарастающего нефросклероза. Заподозрить эту патологию у нашего больного удалось не сразу, принимая во внимание тот факт, что распространенность АФС в общей популяции составляет порядка 1%, а женщины болеют им в 4–5 раз чаще мужчин [5]. Ключевым фактором становится своевременность постановки диагноза АФС, поскольку поражение почек при данной патологии не редкость. Так, распространенность АФСН составляет 25–63% при первичном АФС, 32–68% – при вторичном АФС у больных системной красной волчанкой, 78% – при катастрофическом АФС. К сожалению, поражение почек у больных АФС до настоящего времени остается недооцененным. Возможно, это связано с тем, что зачастую у больных АФС клинические проявления нефропатии отступают на второй план по сравнению с тяжелым поражением центральной нервной системы, сердца и легких.
В зависимости от локализации тромбозов в сосудистом русле почек, протяженности и темпа развития процесса тромботической окклюзии клиническая картина варьируется от острого почечного повреждения и тяжелой, иногда злокачественной артериальной гипертензии до минимального мочевого синдрома, мягкой или умеренной артериальной гипертензии и медленно прогрессирующего нарушения функции почек. В нашем случае исходом у пациента стала терминальная почечная недостаточность.
Диагноз АФС устанавливают на основании австралийских критериев 2006 г. [6]. В случае появления у пациента с диагнозом достоверного АФС признаков поражения почек (впервые возникшая АГ, мочевой синдром, почечная недостаточность) для верификации диагноза необходимо выполнение биопсии почки [7]. При этом наличие тромбоцитопении или проводимая антикоагулянтная терапия ограничивают возможности выполнения биопсии почки у больных АФС из-за высокого риска осложнений, как это было у нашего больного. Тем не менее в последние годы АФСН наряду с тромбоцитопенией, поражением клапанов сердца, хореей и сетчатым ливедо рассматривают как симптом, ассоциированный с циркуляцией антифосфолипидных антител.
До настоящего времени отсутствуют четко определенные подходы к лечению АФСН. Целями терапии являются устранение тромботической окклюзии мелких внутрипочечных сосудов, а также профилактика рецидивов тромбообразования во внутрипочечном сосудистом русле для замедления прогрессирования почечного процесса [8]. Эмпирический подход к терапии больных АФСН при АФС предусматривает использование прямых антикоагулянтов в момент острого эпизода тромбоза и различные режимы применения антикоагулянтов и антиагрегантов при хроническом течении почечного процесса. При этом выбор адекватного профилактического режима у пациентов с АФСН, как и при АФС в целом, основан на стратификации риска тромбообразования.
ЗАКЛЮЧЕНИЕ
В связи с тем, что выявленной у данного больного 24 года назад протеинурии не придавалось достаточного значения, а также не проводился целенаправленный поиск причин почечной недостаточности, АФСН в отсутствии лечения АФС неуклонно прогрессировала. Это привело к резкому ухудшению состояния пациента, непосредственно связанному с прогрессированием АФС, развитию терминальной ХПН, с присоединением инфекционного эндокардита.
Данный клинический случай демонстрирует необходимость определения антител к фосфолипидам у лиц с изолированной протеинурией неуточненного генеза, а также регулярной оценки функции почек у пациентов с установленным диагнозом АФС.


