Изучение матриксных металлопротеиназ (ММР) и их тканевых ингибиторов (TIMP) показало свою актуальность при оценке механизмов развития многих заболеваний. Так, доказана роль ММР в патогенезе сердечно-сосудистых (атеросклероз, инфаркт миокарда, рестеноз, кардиомиопатии, хроническая сердечная недостаточность, инсульт, аневризма аорты), иммунных (ревматоидный артрит, системная красная волчанка, гломерулонефрит, рассеянный склероз), вирусных болезней, семейного остеолиза и др. [1, 2].
MMP принадлежит центральная роль практически во всех физиологических и патологических катаболических процессах экстрацеллюлярного матрикса соединительной ткани [3]. Нарушение баланса между деградацией и синтезом компонентов внеклеточного матрикса вполне очевидно в случаях наследственной, или врожденной, дисплазии соединительной ткани (ДСТ), под которой понимают генетически детерминированные дефекты волокнистых структур и основного вещества, приводящие к нарушению формообразования органов, систем и имеющие прогредиентное течение [4].
Известно, что активность ММР регулируется в том числе взаимодействиями со специфическими ингибиторами – TIMP [3]. Есть основания полагать, что нарушение соотношения ММР/TIMP может быть включено в механизмы возникновения и прогрессирования диспластикозависимых осложнений. Так, имеются сведения об изменении активности ММР при дефиците или нарушении структуры фибриллина-1, который, как известно, стабилизирует ММР. Подобные нарушения отмечены у больных синдромом Марфана и пациентов с двустворчатым аортальным клапаном [5]. В экспериментальных исследованиях продемонстрирована роль ММР-2 в формировании миксоматозного пролапса митрального клапана (ПМК) и различных скелетных аномалий [6]. У пациентов с мезенхимальной дисплазией сердца выявлены увеличенные показатели сывороточной концентрации ММР-9 и отношения ММР-9/TIMP-1 [3].
Между тем понимание механизмов развития ДСТ имеет первостепенное значение для своевременного выявления изменений, которые в дальнейшем обусловливают ассоциированные с соединительнотканными нарушениями осложнения – прогрессирование костно-мышечных дисплазий, кардиального ремоделирования, аритмического синдрома, развитие артериальной гипертензии и т.д.
Цель исследования – оценить показатели системы матриксных металлопротеиназ (MMР-1, ММР-9, TIMP-1) у пациентов с ДСТ.
 МАТЕРИАЛ И МЕТОДЫ
МАТЕРИАЛ И МЕТОДЫ
Обследованы 82 пациента (64 мужчины и 18 женщин, средний возраст 21,96±4,47 года) с ДСТ. Критериями включения в исследование являлись: ДСТ у пациентов обоего пола в возрасте 18–35 лет, подписавших информированное согласие на участие в исследовании. Критерии исключения:
- моногенные наследственные синдромы (Марфана, Элерса–Данло и др.);
- хронические соматические заболевания, в том числе сердечно-сосудистые (артериальная гипертензия, ишемическая болезнь сердца, некоронарогенные заболевания миокарда, пороки сердца и др.);
- острые или обострения хронических воспалительных и/или инфекционных заболеваний в течение последних 3 мес;
- оперативное вмешательство в течение последних 2 мес;
- злокачественные заболевания; беременность и послеродовой период.
Выбор критериев исключения был обусловлен необходимостью устранения заболеваний и состояний, которые могут быть причиной изменения в системе ММР.
ДСТ устанавливали в соответствии с критериями Российских рекомендаций [4, 7]. Фенотип пациентов включал астенический тип конституции (51,22% наблюдений), долихостеномелию (30,49%), арахнодактилию (21,95%), воронкообразную деформацию грудной клетки I степени (15,85%), сколиоз грудного отдела позвоночника I-II степени (41,46%), гипермобильность суставов (15,85%), повышенную растяжимость кожи (2,44%), тонкую, легко ранимую кожу (1,22%), атрофические стрии (4,88%), паховые грыжи (2,44%), продольное плоскостопие I–II степеней (30,49%), аномалии формы желчного пузыря (2,44%), ПМК I (3,0-5,9 мм) или II (6,0-8,9 мм) степени (100%), аневризму межпредсердной перегородки (17,07%), открытое овальное окно (15,85%), аномально расположенные хорды (97,56%), пролапс трикуспидального клапана (1,22%).
 С учетом комплекса внешних и эхокардиографических признаков, клинико-генеалогического анализа были определены следующие диспластические синдромы и фенотипы: первичный миксоматозный пролапс митрального клапана (ПМК) (n=14), первичный семейный ПМК (n=14), спорадический синдром ПМК (n=49), неклассифицируемый фенотип (n=1), повышенная диспластическая стигматизация (n=4). Подобная частота выявления диспластических синдромов и фенотипов, вероятно, обусловлена отбором пациентов на базе поликлинического отделения кардиологического диспансера.
С учетом комплекса внешних и эхокардиографических признаков, клинико-генеалогического анализа были определены следующие диспластические синдромы и фенотипы: первичный миксоматозный пролапс митрального клапана (ПМК) (n=14), первичный семейный ПМК (n=14), спорадический синдром ПМК (n=49), неклассифицируемый фенотип (n=1), повышенная диспластическая стигматизация (n=4). Подобная частота выявления диспластических синдромов и фенотипов, вероятно, обусловлена отбором пациентов на базе поликлинического отделения кардиологического диспансера.
В группе пациентов с ДСТ в 72 (89%) случаях отмечены многочисленные и разнообразные жалобы, преимущественно астеновегетативного характера: боль в области сердца, головокружение при быстром переходе из горизонтального в вертикальное положение тела, учащенное сердцебиение, перебои в работе сердца, чувство нехватки воздуха в душном помещении и при волнении, общая слабость, быстрая утомляемость, головная боль, чувство нехватки воздуха при физической активности (бег).
Контрольную группу составили 15 здоровых людей (10 мужчин, 5 женщин, средний возраст 21,80±0,75 года) без признаков ДСТ.
Проводили иммуноферментный анализ сывороточных уровней ММР-1, ММР-9 и TIMP-1 (BioChemMak, Китай).
 Статистическая обработка осуществлялась с помощью программы IBM SPSS Statistics (версия 21 для Windows). У пациентов с ДСТ распределение значений ММР-1 отличалось от нормального (критерий Колмогорова–Смирнова; р <0,05), а показатели ММР-9 и TIMP-1 соответствовали нормальному распределению (р> 0,05). В связи с этим показатели ММР-1 представлены как медиана и интерквартильные интервалы [Ме (Q25; Q75), а ММР-9 и TIMP-1 в виде среднее ± стандартное отклонение (M±SD)]. При сравнении количественных данных в двух независимых выборках при нормальном распределении использовали Student’s t-test, в трех выборках – однофакторный дисперсионный анализ с поправкой Bonferroni. При распределении, отличном от нормального в двух независимых выборках, применяли критерий Mann–Whitney, в трех независимых выборках – критерий Kruskal–Wallis. При сравнении категоризированных независимых переменных применяли χ2-критерий (Pearson chi-square) с поправкой на непрерывность. Корреляционные связи оценивались с применением коэффициента Spearman. Различия считались статистически значимыми при величине р <0,05.
Статистическая обработка осуществлялась с помощью программы IBM SPSS Statistics (версия 21 для Windows). У пациентов с ДСТ распределение значений ММР-1 отличалось от нормального (критерий Колмогорова–Смирнова; р <0,05), а показатели ММР-9 и TIMP-1 соответствовали нормальному распределению (р> 0,05). В связи с этим показатели ММР-1 представлены как медиана и интерквартильные интервалы [Ме (Q25; Q75), а ММР-9 и TIMP-1 в виде среднее ± стандартное отклонение (M±SD)]. При сравнении количественных данных в двух независимых выборках при нормальном распределении использовали Student’s t-test, в трех выборках – однофакторный дисперсионный анализ с поправкой Bonferroni. При распределении, отличном от нормального в двух независимых выборках, применяли критерий Mann–Whitney, в трех независимых выборках – критерий Kruskal–Wallis. При сравнении категоризированных независимых переменных применяли χ2-критерий (Pearson chi-square) с поправкой на непрерывность. Корреляционные связи оценивались с применением коэффициента Spearman. Различия считались статистически значимыми при величине р <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
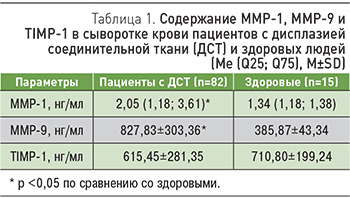
В группе пациентов с ДСТ сывороточное содержание ММР-1, ММР-9 было значительно выше, чем у здоровых людей. Концентрация TIMP-1 в случаях ДСТ достоверно не отличалась от контрольных значений (табл. 1).
Избыточная секреция ММР свидетельствует о несбалансированном протеолизе компонентов внеклеточного матрикса. Известно, что чрезмерная активность ММР приводит к неуправляемой фрагментации коллагена, что делает ткань более аморфной [8]. Таким образом, очевидно участие ММР в патогенезе ДСТ.
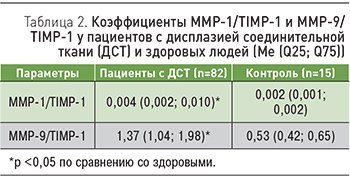
Для оценки баланса между ММР-1, ММР-9 и TIMP-1 использовали индексы ММР-1/TIMP-1 и ММР-9/TIMP-1, рассчитываемые как соотношение соответственно ММР-1 и ММР-9 к TIMP- 1. Распределение значений ММР-1/TIMP-1 и ММР-9/TIMP-1 отличалось от нормального (критерий Колмогорова–Смирнова; р <0,05), поэтому данные представлены в виде Ме (Q25; Q75) (табл. 2).
У больных ДСТ по сравнению со здоровыми коэффициенты ММР-1/TIMP-1 и ММР-9/TIMP- 1 были повышены, подтверждая превышение скорости деградации коллагена матриксными протеиназами над степенью его синтеза. То есть процессы синтеза и утилизации коллагена при ДСТ не сбалансированы.
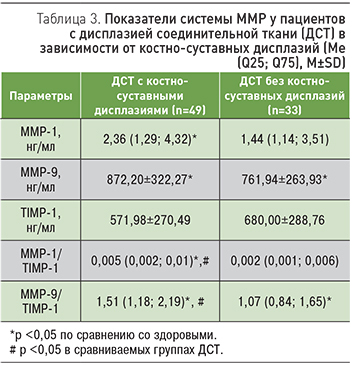
 Для уточнения роли ММР в процессе ремоделирования костно-суставной системы при ДСТ пациенты были разделены на две группы в зависимости от наличия костно-суставных дисплазий: 1-я – с костно-суставными дисплазиями (воронкообразная деформация грудной клетки I степени, долихостеномелия, арахнодактилия, сколиотическая деформация позвоночника I–II степени, гипермобильность суставов, плоскостопие) и 2-я группа – без таковых. За норму принимали значения показателей ММР и TIMP у здоровых людей.
Для уточнения роли ММР в процессе ремоделирования костно-суставной системы при ДСТ пациенты были разделены на две группы в зависимости от наличия костно-суставных дисплазий: 1-я – с костно-суставными дисплазиями (воронкообразная деформация грудной клетки I степени, долихостеномелия, арахнодактилия, сколиотическая деформация позвоночника I–II степени, гипермобильность суставов, плоскостопие) и 2-я группа – без таковых. За норму принимали значения показателей ММР и TIMP у здоровых людей.
Как видно из табл. 3, наибольшее число отклонений в системе ММР зарегистрировано в группе ДСТ с костно-суставными дисплазиями, которая характеризовалась повышенными значениями ММР-1, ММР-9, ММР-1/TIMP-1 и ММР-9/TIMP-1. При этом коэффициенты ММР-1/TIMP-1 и ММР-9/TIMP-1 превышали таковые как у лиц без ДСТ (здоровых), так и у пациентов с ДСТ, но без костно-суставных дисплазий. В последней группе ДСТ наблюдались только повышенные значения ММР-9 и ММР-9/TIMP-1.
Полученные данные сопоставимы с результатами о повышении экспрессии ММР-2 и ММР-9 в ткани плаценты при увеличении степени тяжести недифференцированной ДСТ у беременных [9]. Повышенное сывороточное содержание ММР-1 в группе ДСТ с костно-суставными дисплазиями, возможно, характеризует действие данной коллагеназы на интерстициальные коллагены, распределенные преимущественно в костях, хрящах и сухожилиях [10]. Существенно, что в фенотипе пациентов 1-й группы (с костно-суставными дисплазиями) по сравнению со 2-й доминировал астенический тип конституции (77,55% против 12,12%; χ2=33,79; р <0,05).
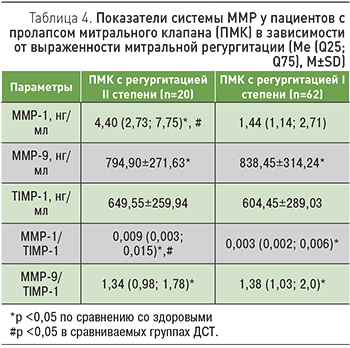
Принимая во внимание высокую частоту встречаемости ПМК в нашем исследовании, представляло интерес сопоставление изучаемых показателей системы ММР с гемодинамической значимостью пролапса. Анализ был проведен группах ПМК с митральной регургитацией II степени и с митральной регургитацией I степени (табл. 4).
У пациентов с митральной регургитацией II степени показатели ММР-1 и ММР-1/TIMP-1 были выше, чем у здоровых и чем у пациентов с митральной регургитацией I степени. Содержание ММР-9 и значения ММР-9/TIMP-1 у пациентов указанных категорий были идентичными и превышали нормальные. Концентрация TIMP-1 в обеих группах ПМК не отличалась от контрольных величин.
 Вполне очевидно, что при клапанном синдроме более выраженная митральная регургитация увеличивает нагрузку на миокард и способствует прогрессивному ремоделированию сердца. С другой стороны, в процессах миокардиального ремоделирования доказано участие ММР, причем преобладание активности последних над их ингибиторами приводило к дилатации левого желудочка [11]. В связи с этим полученные результаты о наиболее высоких показателях ММР-1 и ММР-1/TIMP-1 в случаях митральной регургитации II степени позволяют расценивать их как маркеры сердечного ремоделирования при ПМК.
Вполне очевидно, что при клапанном синдроме более выраженная митральная регургитация увеличивает нагрузку на миокард и способствует прогрессивному ремоделированию сердца. С другой стороны, в процессах миокардиального ремоделирования доказано участие ММР, причем преобладание активности последних над их ингибиторами приводило к дилатации левого желудочка [11]. В связи с этим полученные результаты о наиболее высоких показателях ММР-1 и ММР-1/TIMP-1 в случаях митральной регургитации II степени позволяют расценивать их как маркеры сердечного ремоделирования при ПМК.
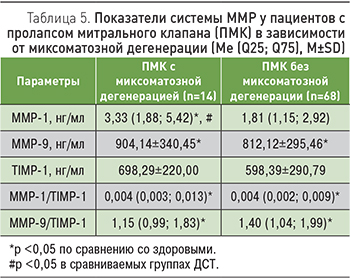
Для уточнения характера сдвигов в системе ММР при миксоматозной дегенерации ПМК изучаемые показатели были сопоставлены в группах с учетом эхокардиографических признаков миксоматоза (табл. 5). Следует отметить, что при миксоматозной дегенерации митрального клапана митральная регургитация II и I степени регистрировалась в равном количестве случаев.
Оказалось, что у пациентов с миксоматозной дегенерацией ПМК содержание ММР-1 было значительно выше, чем у здоровых людей и у пациентов без признаков миксоматозной дегенерации. Показатели ММР-9, ММР-1/TIMP-1, ММР-9/TIMP-1 у пациентов с признаками миксоматоза клапана и без такового характеризовались как идентичные и были выше, чем у здоровых.
Ранее уже сообщалось об увеличенных показателях сывороточной концентрации ММР-9 и индекса ММР-9/TIMP-1 у пациентов с мезенхимальной дисплазией сердца [3]. Впервые выявленная нами связь ММР-1 с миксоматозной дегенерацией ПМК представляется вполне закономерной с позиции высокой активности данного фермента в отношении интерстициальных коллагенов, распределенных в том числе в измененных миксоматозом клапанах сердца с характерным для них выраженным снижением молекулярной организации коллагеновых волокон. Следовательно, ММР-1 можно также рассматривать в качестве показателя выраженности ремоделирования соединительнотканных структур сердца у пациентов с ДСТ.
Не было выявлено зависимости между показателями ММР-1, ММР-9, TIMP-1, ММР-1/TIMP-1, ММР-9/TIMP-1, с одной стороны, и количеством костно-суставных дисплазий и кардиальных аномалий, с другой, а также с отягощенным по ДСТ наследственным анамнезом (р >0,05). В этом контексте использование ММР целесообразно преимущественно для качественной оценки ремоделирования соединительнотканных структур, притом что отсутствие отягощенного семейного анамнеза не исключает наследственной природы заболевания вследствие вклада мутаций de novo [12].
Обращает на себя внимание, что пациенты с ДСТ, в фенотипе которых отсутствовали костно-суставные дисплазии, миксоматозная дегенерация ПМК и митральная регургитация II степени, имели также увеличенные ММР-9, ММР-1/TIMP-1 и/или ММР-9/TIMP-1. В связи с этим следует отметить, что ММР-9 обладает наибольшей активностью в отношении молекул коллагена IV и V типа, составляющих основу базальных мембран и перицеллюлярных коллагенов, формирующих экзоцитоцитоскелет эндотелиальных клеток, ММР-1 активна в отношении распределенного в сосудистой стенке коллагена I типа [11]. Поэтому отклонения от нормальных уровней ММР-9, ММР-1/TIMP-1 и/или ММР-9/TIMP-1 могут, на наш взгляд, отражать свойственную соединительнотканной дисплазии эндотелиальную дисфункцию вследствие структурно-функциональной неполноценности субэндотелиального внеклеточного матрикса [13, 14].
Как известно, эндотелиальная дисфункция является ранним патофизиологическим признаком и независимым предиктором неблагоприятного прогноза при большинстве сердечно-сосудистых заболеваний и состояний [15]. Своевременное выявление эндотелиальной дисфункции имеет особое значение для молодых пациентов с ДСТ вследствие нередкого отсутствия у них на этом этапе большинства традиционных факторов сердечно-сосудистого риска (ожирения, дислипидемии и др.). В связи с этим повышенные уровни ММР-9, ММР-1/TIMP-1 и/или ММР-9/TIMP-1 при ДСТ могут быть использованы в качестве дополнительных маркеров для выделения лиц, нуждающихся в динамическом наблюдении с целью ранней диагностики и профилактики заболеваний и состояний, в основе которых лежит эндотелиальная дисфункция – артериальной гипертензии, аритмий, тромбоэмболических эпизодов и т.д.
ЗАКЛЮЧЕНИЕ
Таким образом, увеличение концентрации ММР- 1, ММР-9, ММР-1/TIMP-1, ММР-9/TIMP- 1 у пациентов с ДСТ отражает превышение скорости деградации коллагена над степенью его синтеза. Более выраженный дисбаланс в системе ММР отмечен при наличии в фенотипе костно-суставных диспластических проявлений, ПМК с признаками миксоматозной дегенерации и/или гемодинамически значимой митральной регургитации. Сывороточные показатели ММР-1 и ММР-9, а также их дисбаланс с тканевым ингибитором ММР-1 могут быть использованы как лабораторные тесты для оценки ремоделирования соединительнотканных структур при ДСТ.


