Прогрессирование многих широко распространенных неинфекционных заболеваний связано со сложным взаимодействием множества факторов, в том числе факторов окружающей среды и внутренней среды организма на различных уровнях, включая генетический [1]. В неврологии это касается всех нейродегенеративных заболеваний, таких как болезнь Альцгеймера, Паркинсона и другие дегенерации, чей этиопатогенез остается до конца не понятным. Кроме того, такое утверждение справедливо и для цереброваскулярных, демиелинизирующих и прочих неинфекционных болезней нервной системы. Многие неврологические заболевания начинаются исподволь и долго остаются незамеченными, их постепенное прогрессирование в итоге приводит к необратимым последствиям, поэтому проблема предотвращения возникновения неврологических заболеваний, т.е. профилактической неврологии, становится все более важной.
Доклиническая диагностика и своевременно предпринятые действия могли бы значительно снизить заболеваемость и увеличить продолжительность активной жизни человека. Не так давно считалось невозможным предотвратить болезнь Альцгеймера и деменцию, однако за последние два десятилетия произошел скачок от фатализма к крупным профилактическим исследованиям, и теперь перспектива отсрочки или предотвращения симптомов деменции уже не выглядит недосягаемой [2, 3]. Пристальное внимание ученых всего мира сосредоточено на поиске факторов, повышающих вероятность развития нейродегенеративных заболеваний, т.е. факторов риска. Результаты этих исследований помогут определению эффективных профилактических стратегий, адаптированных к различным группам риска развития деменции (определяемым в соответствии с возрастом, профилем сосудистых и метаболических изменений, образом жизни, различными биологическими маркерами и когнитивным статусом) [4].
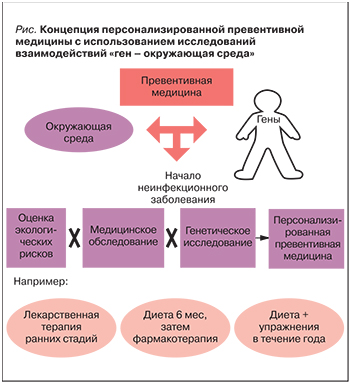 Одним из важных направлений развития превентивной медицины вообще и неврологии в частности является изучение генно-экологических взаимодействий. В исследованиях «ген – окружающая среда» основное внимание уделяется выявлению факторов риска, которые не могут быть обнаружены с помощью обычных эпидемиологических методов, как правило, исключающих точные прогнозы [5]. Конкретные факторы риска могут быть выявлены только после детального анализа взаимодействий между всеми составляющими. На сегодняшний день в ряде когортных исследований получены многообещающие результаты (например, по профилактике ожирения). Однако пока они не имеют достаточной клинической значимости для разработки точной персонализированной превентивной медицины (рис. 1).
Одним из важных направлений развития превентивной медицины вообще и неврологии в частности является изучение генно-экологических взаимодействий. В исследованиях «ген – окружающая среда» основное внимание уделяется выявлению факторов риска, которые не могут быть обнаружены с помощью обычных эпидемиологических методов, как правило, исключающих точные прогнозы [5]. Конкретные факторы риска могут быть выявлены только после детального анализа взаимодействий между всеми составляющими. На сегодняшний день в ряде когортных исследований получены многообещающие результаты (например, по профилактике ожирения). Однако пока они не имеют достаточной клинической значимости для разработки точной персонализированной превентивной медицины (рис. 1).
Выяснение генно-экологических взаимодействий при неинфекционных заболеваниях необходимо для профилактической медицины. Поскольку геномная информация зародышевых клеток остается неизменной на протяжении всей жизни человека, профилактика геномных факторов затруднительна, но ряд экологических факторов, личные привычки и образ жизни (диета, физические упражнения и т.п.) могут быть скорректированы. Именно на этом прежде всего и должны основываться профилактические вмешательства.
Улучшение привычек личного образа жизни будет в центре внимания профилактической медицины всегда, даже в эпоху геномной медицины. Тем не менее информация о генно-экологических взаимодействиях имеет большой потенциал для точной профилактики заболеваний. Одной из задач получения информации о генно-экологических взаимодействиях служит определение правильного образа жизни для конкретного индивидуума, на что должно быть нацелено вмешательство. Крупномасштабные геномные исследования, такие как GWAS (Genome-wide association studies), выявляют только ассоциацию геномных вариаций и начала неинфекционных заболеваний [6]. Информации о необходимых профилактических вмешательствах такие исследования не несут. Следовательно, лицам с генетическими вариациями высокого риска, идентифицированными при GWAS, будут предложены лишь общие рекомендации в области питания и физических упражнений. Анализ же генно-экологических взаимодействий может обеспечить более практическую и точную информацию. Это, к примеру, относится к выяснению комбинаций определенных генетических вариаций и конкретной пищи или питательных веществ (белков, витаминов, минералов и проч.), которые увеличивают или уменьшают риск развития заболевания. Такие данные позволят создавать индивидуальные для каждого человека программы профилактики. Соответственно по сравнению с общими рекомендациями по диете или физиотерапии будут даваться более конкретные и эффективные в плане профилактики инструкции, основанные на результатах исследований генно-экологического взаимодействия.
Примерами исследований генно-экологических взаимодействий могут служить работы [7, 8] в отношении рака и ожирения, в которых частота геномных вариаций сравнивалась между основной и контрольной группами (дизайн «случай – контроль»). Однако в таких исследованиях существует большой риск неточности при анализе взаимодействия генов и окружающей среды, ведь, чтобы выяснить причину заболевания, экологическая информация должна быть собрана до начала болезни, причем необходимо большое количество информации о привычках и образе жизни, которую зачастую трудно вспомнить, особенно если болезнь началась 20–30 лет назад [9].
Исследования с использованием проспективного когортного дизайна имеют преимущества в плане точности, однако связаны с длительными периодами наблюдения (не менее 5 лет, обычно до 10 лет) и нуждаются в огромных размерах выборки для обеспечения статистически значимых результатов. Например, для выявления генно-экологических взаимодействий при инсульте, сахарном диабете или сердечной недостаточности (годовая заболеваемость 0,2%) необходимо 5-летнее наблюдение за 200 тыс. человек, что было рассчитано в программе QUANTO [10]. В настоящее время по всему миру уже проводятся крупномасштабные перспективные геномные когортные исследования [11–13]. Однако большинство из них имеет короткий срок наблюдения. В связи с этим необходимы работы с долгосрочным наблюдением, которые позволят обнаружить новые генно-экологические взаимодействия.
Существуют и более сложные подходы к исследованию генно-экологических взаимодействий: к ним относится метод менделевской рандомизации (основан на втором законе Менделя). Так, в одном из метаанализов, исследующих связь между употреблением алкоголя и началом сердечно-сосудистых заболеваний [12], рандомизацию Менделя проводили с использованием вариантов гена алкоголя дегидрогеназы 1B (ADH1B). Исследование показало, что люди, имеющие вариант фермента со слабой активностью, склонны употреблять меньшее количество алкоголя. В данном исследовании субъекты были разделены на группы с высоким и низким потреблением, основанным на втором законе Менделя. Этот метод пока широко не используется из-за сложности выявления ассоциаций между геномной информацией и фенотипами.
Актуальные задачи
Итак, на сегодняшний день большие надежды в плане получения важных результатов генно-экологических взаимодействий возлагаются на крупномасштабные проспективные когортные исследования. Но существует ряд задач, которые нужно решить:
- выявление «недостающей наследуемости комплексного заболевания» [13], генетические варианты, обнаруженные в GWAS, могут объяснить лишь небольшую долю риска начала заболевания, поскольку GWAS эффективно идентифицируют только варианты с частотой >5%, связанные с распространенными заболеваниями, тогда как низкочастотные варианты (0,01–0,05%) остаются необнаруженными [14], что объясняет значительную часть «недостающей наследуемости». В будущем планируется генно-экологический анализ взаимодействия низкочастотных генных вариантов и факторов окружающей среды, который, безусловно, потребует обработки и анализа огромных объемов данных и новых технологий [15];
- определение стратегии применения результатов генных-экологических взаимодействий: вся информация о генно-экологических взаимодействиях не сможет быть использована в профилактической медицине, даже если она статистически значима (например, невозможно изменить климат и прочие глобальные показатели). Наиболее реальна разработка программ профилактических вмешательств, направленных на улучшение факторов, поддающихся коррекции (личные привычки образа жизни), и первичная профилактика должна базироваться прежде всего на этом;
- разработка эффективных, индивидуализированных программ так называемой персонализированной превентивной медициной, для чего необходимы проспективные исследования, сравнивающие эти программы.
Безусловно, персонализированная профилактическая медицина связана с более высокими затратами, чем обычная профилактическая медицина. Расходы на генетические исследования значительно выше, чем на рутинные анализы крови, мочи, рентгенографию, кардиографию и медицинский осмотр. Решающее значение для проведения персонализированной профилактической медицины имеет грамотность населения и понимание значения геномной информации. Поэтому необходимы образовательные мероприятия, касающиеся «генетической грамотности» населения, особенно пациентов, которым рекомендуются профилактические вмешательства, связанные с высокими дополнительными расходами. Следовательно, предстоит выделение групп населения, в отношении которых профилактическая медицина может быть экономически эффективной.
Таким образом, выявление генно-экологических взаимодействий при неинфекционных заболеваниях представляется одним из перспективных подходов к разработке персонализированной профилактической медицины. Конечно, есть целый ряд вопросов и проблем по ее внедрению в клиническую практику. Но главное: существует сама возможность создания персонифицированной профилактической медицины, о чем свидетельствуют обнадеживающие данные предварительных проспективных исследований.


