Введение
Сосудистый паркинсонизм (СП) – поражение белого вещества, базальных ганглиев, среднего мозга и их связей с лобными долями вследствие ишемического или геморрагического повреждения [1, 4–6, 8–10, 12, 17]. По данным различных эпидемиологических исследований, доля СП в структуре паркинсонизма составляет 4–8% [1, 3–6, 8–10, 12–14, 17]. В клинической практике наблюдается гипердиагностика СП, что обусловлено преобладанием у лиц пожилого возраста положительного сосудистого анамнеза, отсутствием четко сформулированных диагностических критериев заболевания [1–6, 8–10, 12–15, 17].
Клиническая картина СП характеризуется симметричностью симптомов паркинсонизма с преобладанием в нижних конечностях и аксиальной мускулатуре, ранним нарушением ходьбы в виде лобной дисбазии, астазии, постуральной неустойчивости, тремором смешанного характера, очаговой неврологической симптоматикой, когнитивными расстройствами смешанного типа, низкой эффективностью препаратов леводопы, прогрессирующим течением заболевания [1, 3–6, 8–10, 12–15, 17]. В анамнезе прослеживается связь с сосудистым заболеванием головного мозга. При нейровизуализации выявляются изменения в виде множественных двухсторонних инфарктов в базальных ганглиях, лобных долях, таламусе, подкорковый лейкоареоз [4–6, 8, 9, 12, 15, 17]. Наличие у пожилых пациентов дисциркуляторной энцефалопатии (ДЭ) со схожей клинической картиной вызывает трудности при дифференциальной диагностике с СП [1, 3–6, 8–10, 12, 15]. Неверный диагноз влечет за собой трудность курации больных, ошибки лечения, нерациональные траты на лекарственные препараты как государства, так и граждан, что снижает качество оказания медицинской помощи [1, 4–13, 15, 17].
Цель исследования – выделение клинических признаков, влияющих на ошибки при диагностике СП, оценка качества оказания амбулаторно-поликлинической помощи пациентам.
Материал и методы
Проанализированы данные 162 пациентов, наблюдавшихся у невролога в территориальной поликлинике с 16.01.2016 по 31.06.2018: 91 (56,2%) мужчина и 71 (43,8%) женщина. Средний возраст больных составил 64,7±7,8 года, возраст начала заболевания 56,5±6,3 года, длительность заболевания 7,2±4,4 года. При постановке диагноза СП использовали критерии клинической диагностики мультисистемных дегенераций и СП NINDS-SPSP (Litvan I. и соавт., 1996) [16].
Статистическую обработку данных производили с использованием программных пакетов для статистических расчетов NCSS 2001, Microsoft Ecxel, 2005 и Statistica for Windows (Stat. Soft.Inc., версия 6.0).
Результаты и обсуждение
После консультации диагноз СП установлен у 34 (21%) больных (22 мужчины и 12 женщин). В оставшихся 128 (79%) случаях были диагностированы: болезнь Паркинсона (БП) – у 54 (33,3%) пациентов, ДЭ – у 34 (21%), нейродегенеративное заболевание – у 23 (14,2%), эссенциальный тремор – у 7 (4,3%), деменция телец Леви – у 6 (3,7%), мультисистемная атрофия – у 4 (2,5%) больных.
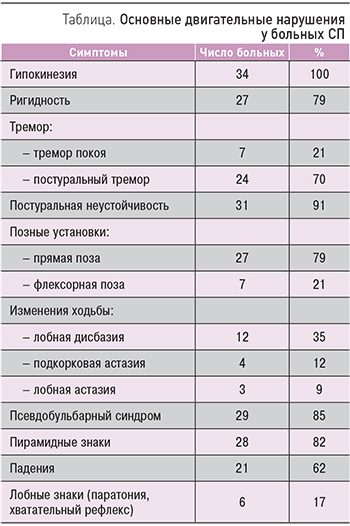 Возраст пациентов с СП колебался от 58 до 79 лет (средний 67,4±8,2 года). Продолжительность заболевания от момента появления первых симптомов паркинсонизма составила в среднем 2,9±1,3 года. Тяжесть двигательного дефекта соответствовала III или IV стадиям по Хен–Яру. Возраст начала болезни был выше у больных СП по сравнению с больными БП (64,8±3,7 vs 58,1±7,2). В 24 (71%) случаях СП развивался постепенно. У 11 (32%) из этих больных за 1–2 года до диагностики паркинсонизма отмечались транзиторные ишемические атаки или малые инсульты с полным восстановлением, в 8 (24%) случаях паркинсонизм возник подостро (в 2 случаях после внутримозгового кровоизлияния, в 6 – после ишемического инсульта), в 14 (41%) случаях острые эпизоды отсутствовали.
Возраст пациентов с СП колебался от 58 до 79 лет (средний 67,4±8,2 года). Продолжительность заболевания от момента появления первых симптомов паркинсонизма составила в среднем 2,9±1,3 года. Тяжесть двигательного дефекта соответствовала III или IV стадиям по Хен–Яру. Возраст начала болезни был выше у больных СП по сравнению с больными БП (64,8±3,7 vs 58,1±7,2). В 24 (71%) случаях СП развивался постепенно. У 11 (32%) из этих больных за 1–2 года до диагностики паркинсонизма отмечались транзиторные ишемические атаки или малые инсульты с полным восстановлением, в 8 (24%) случаях паркинсонизм возник подостро (в 2 случаях после внутримозгового кровоизлияния, в 6 – после ишемического инсульта), в 14 (41%) случаях острые эпизоды отсутствовали.
У 7 (21%) больных отмечалось одностороннее начало, однако у 4 из них в течение нескольких месяцев присоединялась симптоматика и с противоположной стороны. У 29 (85%) больных первым симптомом было затруднение ходьбы, у 5 – общая замедленность или скованность.
Таким образом, при СП в отличие от БП встречалось подострое развитие и достоверно реже, чем при БП (21 vs 93%), отмечалось одностороннее начало (p <0,001). Возможность спонтанного регресса симптомов и длительного стационарного течения – характерный признак СП, не наблюдающийся при БП. Тем не менее значимость этого признака весьма ограниченна, поскольку он наблюдается у сравнительно небольшого числа больных. Облигатным проявлением СП явилась гипокинезия, признаки которой выявлялись у всех 34 (100%) больных (табл.).
Гипокинезия проявлялась замедленностью движений, затруднением их инициации, гипомимией, ахейрокинезом. Ригидность отмечалась у 27 (79%) больных и чаще имела равномерный («восковидный») характер. Феномен «зубчатого колеса» отмечался лишь у 11 (32%) больных, как правило, имевших постуральный или постурально-кинетический тремор. Тремор покоя отмечен у 7 (21%) больных, т.е. достоверно реже, чем при БП (p <0,001). У 4 больных он был двусторонним, у 3 – односторонним. Во всех случаях тремор покоя был непостоянным, умеренным по амплитуде, более высокочастотнымй, чем типичный тремор покоя при БП. Рисунок тремора покоя у больных СП отличался от классического «скатывания пилюль» и преимущественно состоял из вертикальных осцилляций. У 24 (70%) больных был отмечен умеренный постуральный тремор в руках.
Если развитию СП предшествовал инсульт, то более выраженная гипокинезия и ригидность выявлялись на стороне предшествовавшего гемипареза значительно чаще, чем при БП, симптомы паркинсонизма были относительно симметричны. При СП распределение ригидности и гипокинезии в конечностях было более равномерным. У 27 (79%) больных гипокинезия и ригидность были более выражены в нижней половине тела, прежде всего в ногах. Сгибательная (флексорная) поза, нередкая при БП и обусловленная преобладанием тонуса в сгибателях над тонусом в разгибателях туловища, хотя и отмечалась у 7 (21%) больных СП, но значительно реже и в менее выраженной степени, чем при БП (64%).
У 31 (91%) больного наблюдались постуральная неустойчивость и расстройства ходьбы (в виде неустойчивости, частых падений, замедленности, укорочения длины шага, затрудненной инициации ходьбы, шарканья). Постуральная неустойчивость у больных СП отмечалась чаще, чем в группе БП (p <0,01), и к тому же, как правило, развивалась быстрее, чем при БП: в среднем клинически значимая постуральная неустойчивость с частыми падениями проявлялась через 1,9±1,4 года от начала заболевания (при БП через 4,2±2,1 года; p <0,001; табл.). У 24 (71%) больных отмечалось нарушение движений туловища, которое выражалось в затруднениях при попытке сесть, лечь, встать на колени, повернуться в постели с одного бока на другой и было связано с туловищной гипокинезией или нарушением постуральных рефлексов. Частые падения отмечались у 21 (62%) больных СП и лишь у 17% больных БП (p <0,001).
Положительный эффект препаратов леводопы отмечен у 9 (26%) больных СП и был минимальным или умеренным. Ни в одном из случаев СП на фоне приема препаратов леводопы не отмечено развития дискинезий.
Выраженные нарушения ходьбы отмечены у 28 (82%) больных СП и 56% больных БП (p <0,001). Нарушения ходьбы при СП были многообразными. В 8 случаях походка напоминала изменения ходьбы при БП (микробазия с уменьшением длины шага, неширокой площадью опоры и параллельным расположением стоп, шарканьем, затруднениями при инициации ходьбы и поворотах, преимущественным «подтаскиванием» одной из ног). У 12 (35%) больных нарушения ходьбы имели признаки лобной дисбазии, у 3 (9%) больных – лобной астазии, у 4 (12%) больных – подкорковой астазии. При лобной дисбазии отмечались выраженные нарушения инициации ходьбы с феноменом топтания, шарканья, значительные затруднения и застывание при поворотах и изменение программы ходьбы на фоне умеренной постуральной неустойчивости. При ходьбе площадь опоры была широкой, а стопы располагалсь под углом. У части больных, после того как они сдвигались с места, походка становилась более уверенной, ширина шага увеличивалась, однако при поворотах и преодолении препятствий ходьба вновь затруднялась. Движения рук при ходьбе были несколько более размашистыми, чем обычно бывает при БП. При лобной астазии вследствие неадекватных постуральных и локомоторных синергий были нарушены координированные движения туловища и конечностей. В результате при попытке ходьбы ноги перекрещивались или слишком широко расставлялись и не могли удержать вес тела. При подкорковой астазии отмечалось выраженное нарушение равновесия с тенденцией к падению назад в результате резкого нарушения защитных и выпрямляющих постуральных рефлексов, в то время как первичные механизмы ходьбы (ритм ходьбы и общий рисунок движений) были относительно сохранны и при поддержке больные успешно имитировали ходьбу.
Пирамидные знаки, отсутствовавшие при БП, отмечались у 28 (82%) больных СП. Чаще всего они были умеренными и представлены двусторонним, но, как правило, асимметричным оживлением сухожильных рефлексов, преимущественно с нижних конечностей с расширением рефлексогенных зон в сочетании с клонусом стоп или патологическими разгибательными или сгибательными стопными знаками.
У 29 (85%) больных СП выявлялся псевдобульбарный синдром в виде дизартрии, симптомов орального автоматизма, насильственного смеха и плача. При СП псевдобульбарный синдром был значительно более тяжелым и нарастал быстрее, чем при БП. Лобные знаки (хватательный рефлекс, паратония) отмечены у 6 (17%) больных СП (табл.). У больных СП отмечались более тяжелые аксиальные нарушения, псевдобульбарные нарушения, нарушения равновесия и ходьбы, но значительно в меньшей степени был выражен тремор.
Тазовые нарушения чаще всего по типу учащенного мочеиспускания, особенно в ночное время, отмечены у 21 (62%) больных СП, т.е. примерно с той же частотой, что и при БП (52%). Однако особенностью СП было то, что тазовые расстройства развивались на более раннем этапе заболевания (на 1–2 годах болезни) и не сопровождались другими проявлениями периферической вегетативной недостаточности.
Таким образом, сопоставление клинической картины СП и БП показало, что для СП в отличие от БП характерно отсутствие или малая выраженность тремора покоя, преобладание симптоматики в нижней половине тела, раннее и более быстрое развитие постуральных нарушений, изменения ходьбы, особенно по типу лобной дисбазии, лобной или подкорковой астазии, тазовые нарушения, редкость флексорной позы, более быстрое прогрессирование псевдобульбарных симптомов, более выраженное нарушение следящих движений глаз вверх, наличие пирамидных и мозжечковых знаков, гемидистонии, лобных знаков, низкая эффективность дофаминергических средств. Некоторые из этих синдромов наблюдались только при СП, но отсутствовали при БП (например, пирамидные и мозжечковые знаки). Другие синдромы отмечены при обоих заболеваниях, но развивались при СП чаще и на более раннем этапе, чем при БП. К ним, например, относятся выраженный псевдобульбарный синдром, деменция, парез взора вверх, тазовые расстройства. Вместе с тем следует отметить, что указанные клинические отличия СП от БП не абсолютны.
Анализ проводимого лечения у пациентов с СП выявил следующие ошибки:
- отсутствие лечения паркинсонизма у 11 (32,4%) больных;
- позднее назначение препаратов леводопы в 14 (41,2%) случаях;
- нерациональное назначение холинолитиков в 19 (55,9%) случаях;
- самостоятельная отмена противопаркинсонических средств 13 (38,2%) пациентами (основные причины – плохая переносимость, наличие побочных эффектов, отсутствие «яркого» эффекта лечения);
- необоснованное назначение вазоактивных и ноотропных препаратов в 34 (100%) случаях; госпитализация 34 (100%) пациентов.
Заключение
Таким образом, для правильной диагностики СП большое значение имеют тщательно собранный анамнез заболевания; навыки при исследовании и интерпретации симптомов гипокинезии, ригидности, тремора, постуральной неустойчивости, результатов нейропсихологического исследования, нейровизуализации; знание дифференциально-диагностических критериев. Трудности диагностики СП связаны с недостаточным знанием особенностей заболевания, отсутствием четких диагностических критериев СП, убеждением врачей в том, что сосудистый генез заболевания является основным. Диагностические ошибки влекут за собой неадекватную терапию, несоблюдение утвержденных медико-экономических стандартов, что увеличивает стоимость лечения. Результаты проведенного исследования указывают на необходимость проведения образовательных программ среди врачей первичного звена по вопросам экстрапирамидной патологии.


