Хроническая обструктивная болезнь легких (ХОБЛ) и хроническая сердечная недостаточность (ХСН) являются двумя часто встречающимися в клинической практике заболеваниями. ХОБЛ развивается в большинстве случаев после 40 лет, и, как правило, к этому времени у пациента появляется сопутствующая патология. ХСН, по данным различных авторов, выявляется у 30–62% больных ХОБЛ старших возрастных групп. Распространенность ХСН в популяции составляет не менее 1,8–2%, а среди лиц старше 65 лет ее частота возрастает до 6–10%, при этом самой частой причиной госпитализации больных пожилого возраста становится декомпенсация заболевания. У больных ХОБЛ с большей вероятностью развивается застойная сердечная недостаточность (65,9%) по сравнению с пациентами без ХОБЛ (52,0%) [1]. Причиной частой ассоциации ХСН и ХОБЛ может быть наличие общих факторов риска, таких как курение, пожилой возраст (возрастные морфофункциональные изменения органов дыхания и сердечно-сосудистой системы), малоподвижный образ жизни, неправильное питание, прием некоторых лекарственных средств и др. [2].
Вплоть до 2003 г. считалось, что ХСН нечасто встречается при ХОБЛ и связана в основном с правожелудочковой недостаточностью вследствие хронического легочного сердца [3]. В основу таких выводов легли исследования, опубликованные до 1970 г.: в них выборка пациентов была представлена преимущественно молодыми пациентами с тяжелой ХОБЛ в отсутствии инфаркта миокарда. В этих исследованиях систолическая дисфункция левого желудочка встречалась в 0–16 % случаев.
В период с 1975 по 1984 г. были опубликовано еще пять исследований, в которых частота ХСН варьировала уже от 10 до 46% [3]. В 2003 г. McCullough et al. опубликовали работу, в которой частота недиагностированной ХСН составляла уже 21% у 417 пациентов с ХОБЛ и бронхиальной астмой, обратившихся за экстренной помощью по причине одышки [4]. В 2005 г. в другом исследовании эти данные были подтверждены у пациентов со стабильной ХОБЛ [5].
Сочетание ХОБЛ и ХСН порождает ряд клинических, в том числе диагностических, проблем, которые пока окончательно не разрешены. Сложности диагностики начинаются со схожести клинической симптоматики этих заболеваний.
Цель исследования – выявить клинические особенности ХСН у больных ХОБЛ.
МАТЕРИАЛ И МЕТОДЫ
Проведено открытое нерандомизированное исследование 127 пациентов, которые проходили обследование и лечение на базе пульмонологического и кардиологического отделений ГУЗ «Областная клиническая больница» г. Саратова (табл. 1). Все пациенты поступали в больницу с признаками декомпенсации ХСН и/или обострения ХОБЛ.

Больные с ХСН были разделены в зависимости от наличия ХОБЛ на две группы: в первую вошли 88 пациентов с ХОБЛ, во вторую – 39 больных без ХОБЛ. Для оценки особенностей ХСН, в зависимости от ее генеза, первая группа пациентов была разделена на 2 подгруппы: первую составили 43 (48,9%) пациента с инфарктом миокарда (ИМ) в анамнезе, вторую – 45 (51,1%) больных без ИМ в анамнезе (наиболее вероятная причина ХСН – декомпенсация хронического легочного сердца).
Все пациенты, участвовавшие в любой из частей исследования, подписывали форму информированного согласия на участие в исследовании, что было обязательным условием включения для каждого пациента. Пациенты обследовались анонимно, каждому из них присваивался индивидуальный числовой код, исключавший возможность идентифицировать пациента третьими лицами. Исследование было одобрено локальным этическим комитетом Саратовского государственного медицинского университета им. В.И. Разумовского Минздрава России.
Критериями включения в исследование были мужской пол, возраст старше 40 лет и менее 80 лет, наличие ХОБЛ, диагностированной в соответствии с рекомендациями GOLD (2006), и/или наличие ХСН у больных с перенесенным ИМ, установленной согласно рекомендациям Российского кардиологического общества 2013 г. [6]. Критериями исключения служили нестабильная ишемическая болезнь сердца (ИМ, острый коронарный синдром) и острое нарушение мозгового кровообращения менее чем за 3 мес до включения в исследование, сахарный диабет; пороки сердца, миокардит, кардиомиопатии, неконтролируемая АГ, острые и хронические заболевания в фазе обострения; другие респираторные заболевания; онкологические заболевания.
Всем пациентам проводили физикальное обследование. Оценка тяжести ХСН производилась согласно тесту 6-минутной ходьбы по общепризнанной методике.
Больным осуществлялось биохимическое исследование крови согласно стандартам оказания медицинской помощи при ХОБЛ и ХСН. Помимо этого, определялись уровни N-концевого фрагмента натрийуретического пептида (NT-proBNP) с использованием набора реагентов NT-proBNP, производства BIOMEDICA (Словакия); галектина-3 с использованием набора реагентов Human Galectin-3 Platinum ELISA, производства Bender MedSystems GmbH (Австрия); высокочувствительного С-реактивного белка (вч-СРБ) с использованием реагентов CRP U-hs, производства DiaSys (Германия).
Эхокардиография (Эхо-КГ) проводилась на комплексе Acuson 128 XP/10 с использованием М-модального режима, двухмерного (В) режима, режима импульсной и постоянно-волновой допплерографии в стандартных эхокардиографических позициях по общепризнанной методике [7].
Для статистической обработки материала были использованы методы описательной статистики. Для определения типа распределения данных применяли графический метод с использованием критерия Колмогорова–Смирнова и Шапиро–Уилка. При значениях р, превышающих 0,05, распределение признавалось нормальным. Для обработки непрерывных данных в случае их нормального распределения применялся t-тест для независимых выборок. При распределении данных, отличном от нормального, использовались непараметрические методы: при сравнении двух независимых величин – ранговый U-критерий Манна–Уитни для независимых групп, трех и более групп – ранговый анализ вариаций по Краскелу–Уоллису. Различия между значениями показателей признавались достоверными при уровне р <0,05.
Для сравнения частот бинарного признака в двух несвязанных группах использовался критерий χ2. Для анализа взаимосвязей между различными показателями использовался корреляционный анализ: в случае нормального распределения данных – метод Пирсона, при ненормальном распределении данных – метод Спирмена. Коэффициент корреляции r считался достоверным при уровне р <0,05. При описании признаков использовали следующие формы описания: если распределение нормальное, то данные представляли в виде M±SD, где М – среднее арифметическое, SD – стандартное отклонение; если распределение отличное от нормального, тогда результаты представлялись в виде Me [Q1; Q3], где Ме – медиана, Q1 и Q3 – первый и третий квартили соответственно [8]. Для статистической обработки полученных данных использовалась программа Microsoft Office Excel 2010 (Microsoft Corp., США) и пакет прикладных программ Statistica 8.0 (StatSoft Inс., США).
РЕЗУЛЬТАТЫ
Больные с наличием и отсутствием ХОБЛ были сопоставимы по возрасту, индексу массы тела, частоте встречаемости артериальной гипертензии, величинам систолического и диастолического артериального давления, выраженности ХСН (на основании функционального класса по NYHA) (см. табл. 1).
Длительность одышки у пациентов с сочетанной патологией превышала таковую у больных с изолированной ХСН. При этом отличий в зависимости от генеза ХСН по этому параметру выявлено не было. У больных ХОБЛ и ХСН найдена зависимость длительности одышки от функционального класса (ФК) ХСН (r=0,27; p <0,05), толерантности к физической нагрузке (r=-0,34; p <0,01). У пациентов с изолированной ХСН выявлены взаимо-связи между выраженностью одышки и возрастом (r=0,35; p <0,05), ФК ХСН (r=0,38, p <0,05), степенью гипоксемии (r=-0,46; p <0,01).
У больных ХСН и ХОБЛ чаще отмечалась гипоксемия при поступлении в стационар и была в большей степени снижена толерантность к физической нагрузке. Так, SaO2 <90% отмечалась у 42 (47,7%) больных ХОБЛ и ХСН, а среди больных изолированной ХСН таких пациентов оказалось всего 6 (15,4%) (χ2 с поправкой Йетса=10,69; p <0,01).
Расстояние >300 м по результатам теста 6-минутной ходьбы смогли преодолеть лишь 9 (10,2%) больных ХОБЛ и ХСН и 5 (12,8%) пациентов с ХСН без ХОБЛ (p >0,05).
Определение ФК позволяет оценить выраженность ХСН и дает возможность прогнозировать риски сердечно-сосудистых катастроф, так как с увеличением ФК прогноз ухудшается. По нашим данным, у 53 (60,2%) больных ХОБЛ и ХСН установлен III ФК ХСН, у 3 (3,4%) – II ФК и у 32 (36,4%) – IV ФК. У пациентов c изолированной ХСН также преобладал III ФК – 25 (64,1%); у 5 (12,8%) больных диагностирован II ФК и у 9 (23,1%) пациентов – IV ФК.
Больные с сочетанной патологией и наличием II и III ФК ХСН имели меньшие индекс массы тела (28,39±6,14 и 31,45±6,05 кг/м2 соответственно, p <0,05), длительность одышки (6,82±4,66 и 9,83±6,24 лет соответственно, p <0,05), уровень галектина-3 (11,84±6,83 и 14,32±8,61 нг/мл соответственно, p <0,05), количество баллов по ШОКС (5,09±1,64 и 9,44±4,01 баллов соответственно, p <0,05), чем больные с IV ФК. Среди пациентов с изолированной ХСН больные со II и III ФК имели меньшую, чем больные с IV ФК, длительность одышки (4,87±2,76 и 7,63±2,62 лет соответственно, p <0,05), уровень NT-proBNP (236,7 [177,9; 435] и 664,3 [358,6; 1298,7] пг/мл соответственно, p <0,05), количество баллов по ШОКС (6,60±1,16 11,89±2,42 соответственно, p <0,05). У пациентов с ХОБЛ и ХСН найдены взаимосвязи между ФК ХСН и толерантностью к физической нагрузке (r=-0,61, p <0,001), количеством баллов по ШОКС (r=0,59, p <0,001), уровнем галектина-3 (r=0,24, p <0,05), гипоксемией (r=-0,40, p <0,001). У лиц с изолированной ХСН выявлены зависимости между ФК ХСН и толерантностью к физической нагрузке (r=-0,66, p <0,001), количеством баллов по ШОКС (r=0,79, p <0,001).
Более объективным методом определения тяжести ХСН может служить шкала клинического состояния, разработанная R.J. Cody [9] в модификации В.Ю. Мареева (2000). Однако по некоторым вопросам у пациентов с сочетанной патологией могут быть получены не вполне объективные ответы. Примером может служить возможность отсутствия хрипов из-за выраженности эмфиземы, обусловленность одышки дыхательной недостаточностью и др. У больных ХОБЛ и ХСН количество баллов по ШОКС было достоверно меньше, чем у лиц с изолированной ХСН. У пациентов этой группы количество баллов по ШОКС коррелировало с ФВ левого желудочка (r=-0,29; p <0,01), толерантностью к физической нагрузке (r=-0,54, p <0,001), ОФВ1(r=-0,28; p <0,01).
У лиц с изолированной ХСН отмечены взаимосвязи между количеством баллов по ШОКС и фракцией выброса левого желудочка (r=-0,32; p <0,05), гипоксемией (r=-0,33; p <0,05), частотой пульса (r=0,41; p <0,05).
При оценке отдельных параметров ШОКС отмечено, что больных ХОБЛ и ХСН достоверно чаще беспокоила одышка в покое по сравнению с пациентами с ХСН независимо от перенесенного ИМ. Такая особенность может быть обусловлена выраженностью легочной патологии. Так, среди больных ХОБЛ и ХСН с наличием одышки в покое у 94,8% пациентов имелась тяжелая и крайне тяжелая выраженность обструкции (95,2% с наличием ИМ, 94,6% в отсутствие ИМ, p >0,05). Пациенты с ХОБЛ и ХСН с жалобами на одышку в покое по сравнению с пациентами с одышкой только при физической нагрузке имели более длительный анамнез одышки (9,71±6,54 и 7,15±4,65 лет соответственно; p <0,05), более выраженные кашель (15,77±9,75 и 12,20±8,15 лет соответственно; p <0,05), нарушение толерантности к физической нагрузке (90 [50; 200] и 240 [170; 290] м соответственно; p <0,001), гипоксию (83,89±8,57 и 88,47±9,92% соответственно; p <0,05), тяжесть обструкции (27,90±11,87 и 45,36±13,37% соответственно; p <0,001), большее количество баллов по результатам CAT теста (26,47±5,65 и 19,69±7,32 соответственно, p <0,001), более высокую ЧСС (88,18±16,28 и 81,83±16,02 соответственно; p <0,05). Эти результаты свидетельствуют, что одышка в покое у пациентов данной группы в большей степени является симптомом ХОБЛ.
Больные с одышкой в покое чаще предъявляли жалобы на перебои в работе сердца, чем пациенты с одышкой при физической нагрузке (p <0,001), у них чаще выявляли влажные незвучные мелкопузырчатые хрипы над всей поверхностью легких (6,9 и 0%; p <0,05), увеличение печени (20,7 и 0% соответственно; p <0,001).
На перебои в работе сердца предъявляло жалобы большее количество больных ХСН без ХОБЛ, чем пациентов с сочетанной патологией.
Горизонтальное положение в постели достоверно чаще занимали больные с сочетанной патологией. В то же время приступы одышки, вынуждавшие больных принимать положение сидя, чаще развивались у больных ХОБЛ и ХСН с наличием ИМ в анамнезе относительно пациентов без ИМ и лиц без ХОБЛ.
Систолическое артериальное давление >120 мм рт.ст. достоверно чаще отмечалось у больных ХОБЛ, ХСН без перенесенного ИМ, чем у пациентов без ХОБЛ. Это, вероятно, обусловлено сохранением систолической функции левого желудочка у большинства больных с сочетанной патологией.
При сравнении данных, полученных по результатам теста с 6-минутной ходьбой и ШОКС для определения ФК ХСН, было отмечено, что в большинстве случаев постановка II ФК совпадала при использовании обеих методик. В то же время только у 21,3% больных ХОБЛ и ХСН результаты 6-минутного теста и ШОКС совпадали при постановке III ФК и у 35,5% – при постановке IV ФК.
Полученные результаты могут говорить о сильном влиянии сочетанного генеза одышки при физической нагрузке у больных ХОБЛ и ХСН на результаты теста 6-минутной ходьбы. Необходимо учитывать, что этот симптом является объединяющим для обеих патологий.
У больных ХОБЛ и ХСН количество баллов по ШОКС было взаимосвязано с ФК ХСН (r=0,56; p <0,001), результатом теста 6-минутной ходьбы (r=-0,53; p <0,001), количеством обострений (r=0,30; p <0,001), ОФВ1 (r=-0,26; p <0,01), количеством баллов по САТ (r=0,29; p <0,001), mMRC (r=0,48; p <0,001), индексом коморбидности Charlson (r=0,25; p <0,01). При этом у больных без ИМ дополнительно обнаружены взаимосвязи между ШОКС и интенсивностью курения (r=0,26; p <0,05), а у пациентов с ИМ – между ШОКС и уровнем NT-proBNP (r=0,45; p <0,05), уровнем вч-СРБ (r=0,35; p <0,05), сердечного белка, связывающего жирные кислоты (r=0,35; p <0,05), SaO2 (r=-0,34, p <0,05). У больных ХСН без ХОБЛ найдены взаимосвязи только между количеством баллов по ШОКС и SaO2 (r=-0,38; p <0,05), возрастом (r=0,28; p <0,05).
Таким образом, для больных ХСН и перенесенным ИМ предпочтительно использовать ШОКС для более точной оценки выраженности ХСН и подбора адекватной терапии при ее декомпенсации. Отмечена значимая недооценка ФК ХСН у больных ХОБЛ и ХСН по сравнению с пациентами группы сравнения, особенно в случае высокого функционального класса ХСН. Также ШОКС может давать более объективные результаты оценки выраженности ХСН, чем тест 6-минутной ходьбы, имеющий очевидные, более значимые ограничения при интерпретации его у пациентов с ХОБЛ и ХСН.
Учитывая сложности диагностики ХСН у больных ХОБЛ, дополнительно исследуются биомаркеры, повышенный уровень которых свидетельствует о более вероятном наличии сердечной недостаточности. Наиболее признанными биомаркерами являются NT-proBNP и галектин-3. Согласно нашим данным, повышение их уровня выявлено у всех исследуемых больных. При этом достоверных отличий по данным параметрам между больными с наличием и отсутствием ХОБЛ найдено не было (табл. 2). У пациентов с сочетанной патологией уровень NT-proBNP был взаимосвязан с выраженностью системного воспаления (уровень вч-СРБ) (r=0,28; p <0,05), гипоксемией (r=-0,35; p <0,05), у больных с изолированной ХСН – с частотой пульса (r=0,52; p <0,01). У больных ХОБЛ и ХСН ишемического генеза дополнительно выявлены взаимосвязи между уровнем NT-proBNP и количеством баллов по ШОКС (r=0,45; p <0,05).
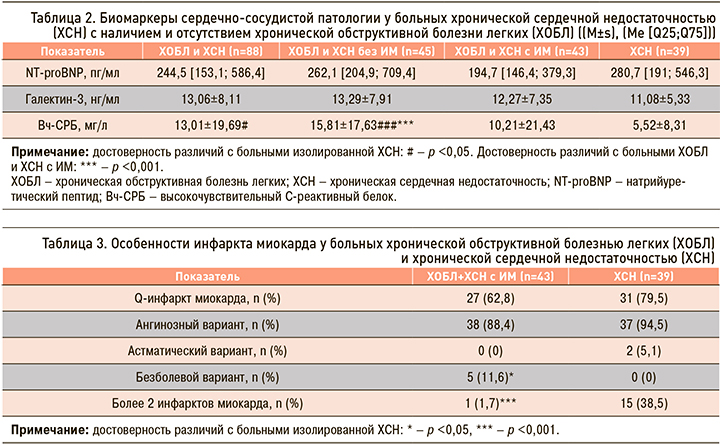
При анализе особенностей ИМ у больных ХОБЛ и ХСН отмечено, что Q-инфаркт встречается реже (62,8 и 79,5% соответственно; p >0,05), а безболевая форма ИМ встречается чаще (11,6 и 0% соответственно; p <0,05), чем у пациентов с изолированной ХСН (табл. 3). Связано это, может быть, с явлениями безболевой ишемии, достаточно часто фиксируемой у больных ХОБЛ. С этим может быть связана и достоверная разница по количеству перенесенных ИМ между обследованными больными (р <0,001).
При изучении особенностей проявлений ХСН у больных с наличием ХОБЛ отмечено, что признаки ХСН по большому кругу (отеки нижних конечностей, асцит, застойные изменения печени) были выявлены у 70 (79,6%) пациентов, по малому кругу (влажные хрипы в легких, плевральный выпот, характерные изменения при рентгенологическом исследовании) – у 36 (40,9%) (табл. 4).
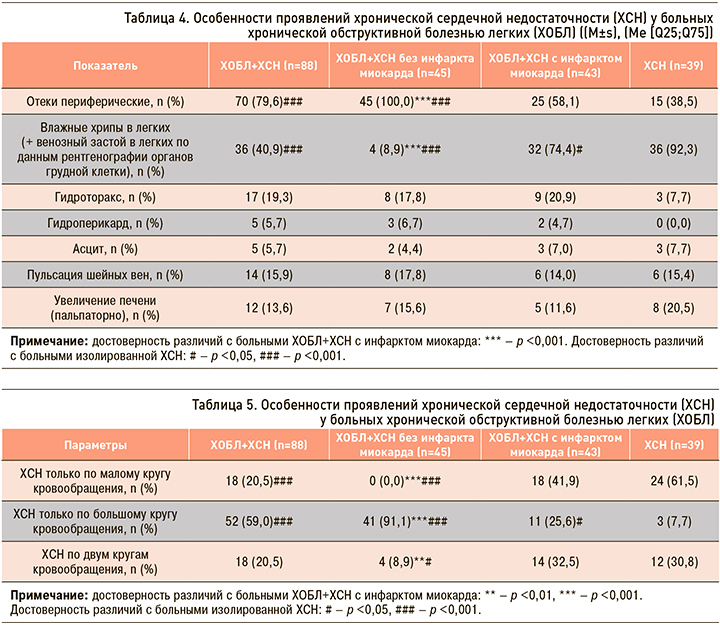
Недостаточность кровообращения по большому кругу встречалась в 2,6 раза чаще у больных ХОБЛ и ХСН без перенесенного ИМ, чем у пациентов с ХСН без ХОБЛ (χ2=38,77, р <0,001). Недостаточность кровообращения по малому кругу кровообращения чаще отмечалась у больных ХСН в отсутствии ХОБЛ (точный критерий Фишера p <0,001).
У больных ХОБЛ и ХСН достоверно чаще встречались изолированные проявления ХСН по большому кругу кровообращения по сравнению с лицами с изолированной ХСН (р <0,001). При этом изолированное поражение малого круга кровообращения статистически чаще отмечалось у больных ХСН без ХОБЛ (p <0,05) (табл. 5).
Фракция выброса (ФВ) левого желудочка служит одним из ключевых показателей гемодинамики при сердечной недостаточности (СН) и имеет большое прогностическое значение: чем меньше ФВ, тем хуже прогноз. Согласно рекомендациям Европейского кардиологического общества [10], основные термины, используемые для описания СН, являются эмпирическими и основаны на измерении ФВ левого желудочка. Широкий спектр пациентов с СН варьирует от больных с сохраненной (нормальной) ФВ левого желудочка (≥50%; СН-сФВ) до пациентов со сниженной ФВ ЛЖ (<40%; СН-нФВ). Пациенты с ФВ в диапазоне 40–49% находятся в так называемой серой зоне, которую сейчас обозначают как СН-срФВ.
У больных ХСН ишемического генеза ФВ левого желудочка была достоверно ниже, чем у больных с ХСН неишемического генеза (46,57±11,54 и 59,37±8,74% соответственно; p <0,001). Систолическая дисфункция левого желудочка (ФВ <40%) отмечена у 14 (15,9%) пациентов с ХОБЛ и ХСН, у 11 из них имелся ИМ в анамнезе. Изолированную ХСН с ФВ <40% имели 20 (51,3%) пациентов (χ2=17,25; р <0,001 по сравнению с больными ХОБЛ и ХСН). Было выявлено 17 (19,3%) пациентов с сочетанной патологией, имеющих ХСН с ФВ 40–49%: 16 больных с ХСН ишемического и 1 пациент неишемического генеза. Такая ФВ диагностирована у 13 (33,3%) больных с изолированной ХСН (p >0,05).
Сохраненная ФВ (>50%) выявлена у 57 (64,8%) пациентов с ХОБЛ и ХСН: у 41 (91,1%) больных ХСН неишемического генеза и у 16 (37,2%) больных ХСН ишемического генеза. У 6 (15,4%) больных с изолированной ХСН установлена ФВ >50% (χ2=26,37; р <0,001 по сравнению с больными ХОБЛ и ХСН).
Нарушение диастолической функции ЛЖ выявлено у 80,7% больных ХОБЛ и ХСН, что совпадает с данными других авторов о высокой частоте встречаемости диастолической дисфункции левого желудочка среди пациентов с ХОБЛ [11]. У пациентов с изолированной ХСН диастолическая дисфункция обнаружена в 69,2% случаев (p >0,05 по сравнению с больными ХОБЛ и ХСН). Диастолическая дисфункция с одинаковой частотой выявлялась у больных с наличием и отсутствием ИМ в анамнезе.
ОБСУЖДЕНИЕ
В настоящее время патологический процесс при ХОБЛ рассматривается как системный. Доказанными экстрапульмональными проявлениями ХОБЛ выступают дистрофия скелетной мускулатуры, кахексия, ишемическая болезнь сердца (ИБС), СН и др. [12, 13]. Каждое из вышеперечисленных состояний способно приводить к повышению госпитализаций и смертности этой когорты больных. Доказано, что пациенты с ХОБЛ умирают в большей степени от сердечно-сосудистых заболеваний (ССЗ), чем непосредственно от легочных осложнений [14].
Среди ССЗ особое внимание обращает на себя СН. Связано это, во-первых, с тем, что ХСН занимает второе место среди причин смерти больных ХОБЛ [15]. Во-вторых, она является наиболее частой причиной госпитализации среди всех других кардиоваскулярных причин у пациентов с ХОБЛ [16]. И в-третьих, ХСН представляет собой особую сложность в диагностике у больных ХОБЛ, особенно в случае ее обострения.
В среднем распространенность ХОБЛ среди больных с ХСН находится в диапазоне 20–32% [17].
С другой стороны, ХСН диагностируется более чем у 20% больных с ХОБЛ [18, 19]. Риск развития ХСН у больных ХОБЛ в 4–5 раз выше, чем у лиц без ХОБЛ после поправки на возраст и другие сердечно-сосудистые риски [20].
Взаимосвязь между ХОБЛ и ХСН не вполне ясна. Есть указания, что ХОБЛ и ХСН имеют общие факторы риска (курение, пожилой возраст, малоподвижный образ жизни и др.), схожие черты клинической картины и общность некоторых звеньев патогенеза.
Именно взаимосвязью между ХОБЛ и ИБС (прежде всего развитием ИМ) объясняют более высокую частоту выявления систолической дисфункции левого желудочка у больных ХОБЛ [21]. Так, в нашем исследовании систолическая дисфункция миокарда встречалась у 14 (15,9%) больных ХОБЛ, из которых только трое не имели признаков ИБС.
Согласно полученным нами данным, у больных ХОБЛ и ХСН достаточно часто диагностируется стенокардия напряжения высокого ФК и безболевая форма ИМ в анамнезе. Более длительный анамнез одышки у больных с сочетанной патологией может быть обусловлен тем, что у пациентов с ХОБЛ развитие одышки происходит постепенно, тогда как лица с изолированной ХСН ведут ее отсчет с момента развития ИМ, который сопровождается сильными эмоциональным и физическим компонентами и хорошо запоминается больными. Так, среди пациентов с изолированной ХСН 25 (64,1%) больных стали отмечать одышку после перенесенного ИМ.
Различий по ФК ХСН между больными исследуемых групп найдено не было. Однако стоит отметить, что у пациентов с ХОБЛ ФК ХСН может быть не совсем объективным параметром, так как выраженность одышки у них обусловлена, помимо всего прочего, наличием и выраженностью легочной патологии, приводящей к формированию дыхательной недостаточности. Это может предопределять гипердиагностику тяжести ХСН у пациентов с сочетанной кардиореспираторной патологией. В данном случае необходимым исследованием становится определение уровня NT-proBNP. Этот биомаркер является наиболее признанным и широко применяемым в диагностике и лечении ХСН [22], в том числе у больных ХОБЛ [23]. С его помощью происходит оценка выраженности ХСН, прогноза неблагоприятных исходов у больных, мониторинг эффективности проводимой терапии.
Относительно новым биомаркером ХСН служит галектин-3. Согласно проведенным исследованиям, он также может быть полезен в диагностике ХСН [24]. По нашим данным, уровень NT-proBNP и галектина-3 у всех пациентов с сочетанной патологией был выше нормы. С увеличением ФК ХСН у больных ХОБЛ происходило статистически значимое повышение уровня галектина-3, тогда как у больных без ХОБЛ – повышение уровня NT-proBNP.
У больных с сочетанной патологией преобладает поражение большого круга кровообращения, в том числе изолированного его вовлечения, по сравнению с больными изолированной ХСН, в основном за счет больных без ИМ в анамнезе. Такая особенность позволяет предположить ведущую роль в генезе ХСН декомпенсации хронического легочного сердца. Так, в России ХСН по причине ХОБЛ занимает 3-е место (13%) [6].
Снижение систолической функции у больных с сочетанной патологией происходило в основном за счет перенесенного инфаркта миокарда. Лишь у 3 пациентов с ХОБЛ и ХСН без ИМ отмечена систолическая дисфункция левого желудочка.
В большинстве случаев у таких больных диагностируется ХСН со средней и сохранной ФВ.
Сочетание ХОБЛ и ХСН сопровождалось более выраженным снижением толерантности к физической нагрузке и гипоксемией в покое, что может говорить о более тяжелом течении ХСН при наличии легочной патологии. Хроническое персистирующее системное воспаление вносит весомый вклад в патогенез атеросклероза и ССЗ у больных ХОБЛ [25, 26]. Так, у больных с сочетанной патологией уровень вч-СРБ оказался достоверно выше такового у лиц с изолированной ХСН.
ЗАКЛЮЧЕНИЕ
ХСН у пациентов с ХОБЛ характеризуется более тяжелым течением, преимущественным поражением большого круга кровообращения по сравнению с пациентами с изолированной ХСН. Существуют определенные особенности течения ХСН у больных ХОБЛ в зависимости от ее генеза.



