Искусственная вентиляция легких (ИВЛ) – один из основных методов лечения больных, находящихся в критическом состоянии. По данным литературы, респираторную поддержку начинают у более половины пациентов, поступающих в отделения интенсивной терапии [1]. Наиболее частым показанием к ИВЛ служит развитие дыхательной недостаточности, при которой не обеспечивается поддержание нормального газового состава крови, либо оно достигается за счет более интенсивной работы аппарата внешнего дыхания и системы кровообращения [2, 3]. В 20% случаев респираторную поддержку начинают по «неврологическим» причинам, например, вследствие угнетения уровня бодрствования до 10 и менее баллов по шкале комы Глазго, возникновения патологических ритмов дыхания, рефрактерного эпилептического статуса [1, 2].
Современная реализация ИВЛ, несмотря на многочисленные положительные эффекты, может иметь негативные последствия для пациента. Одна из проблем аппаратной респираторной поддержки – ее противоречие физиологии дыхания. При спонтанном вдохе возникает отрицательное давление в легких, а выдох происходит вследствие образования положительного давления в дыхательных путях за счет работы дыхательной мускулатуры [4]. При ИВЛ поступление газа в дыхательные пути на вдохе осуществляется «насильственно» за счет положительного давления, создаваемого аппаратом, на выдохе газ пассивно выходит в дыхательный контур. Кроме того, выделяют вентилятор-ассоциированное повреждение легких при неправильной настройке параметров ИВЛ, когда используют избыточные дыхательные объемы, давление в дыхательных путях, неадекватное конечно-экспираторное давление и высокие фракции кислорода [2, 5, 6].
Основная задача ИВЛ – поддержание нормального легочного газообмена в условиях минимального внутригрудного давления [6]. Несмотря на современное развитие аппаратуры и совершенствование методов, а также положительное влияние респираторной поддержки на организм больного, ИВЛ не может продолжаться бесконечно долго. Основными критериями перевода пациента на самостоятельное дыхание являются устранение причины, по поводу которой была начата ИВЛ, стабилизация общего состояния пациента и восстановление уровня бодрствования до 11 и более баллов по шкале комы Глазго.
Длительное проведение ИВЛ приводит к угнетению спонтанного дыхания, атрофии диафрагмы и межреберных мышц. Отдельной проблемой становится полиневромиопатия, возникающая при развитии у пациента критических состояний, инфекционных осложнений, полиорганной недостаточности и проявляющаяся мышечной слабостью и затруднением прекращения ИВЛ [7]. Сохраняющаяся потребность в аппаратной поддержке дыхания зачастую ограничивает перевод пациента из реанимационного отделения к дальнейшим этапам реабилитации.
Залогом успеха в отлучении пациента от респираторной поддержки служит проведение ИВЛ в рамках концепции защиты легких, которая заключается в профилактике вентилятор-ассоциированного повреждения легких, ограничении применения миорелаксантов и максимально допустимом участии больного в акте дыхания с самого начала и на весь период протезирования функции дыхания. Скорейшее создание «автономности» организма от методов интенсивной терапии может быть важнейшим фактором успешного выздоровления. Большинство пациентов удается быстро и рутинно перевести на самостоятельное дыхание, 10–15% больных нужен системный подход, который позволяет в пределах 2–3 сут завершить дыхательную реабилитацию. Группа вентилятор-зависимых пациентов, требующих длительного отлучения от ИВЛ (более 1–2 нед), составляет 5–10% [8].
Выделяют «сложное отлучение» (менее 3 неудачных попыток перевода на самостоятельное дыхание или менее 7 сут после первой попытки) и «длительное отлучение» (более 3 неудачных попыток или более 7 сут после последнего эпизода самостоятельного дыхания) [8]. В 1% случаев дыхательная реабилитация невозможна. В настоящее время одной из серьезных проблем респираторной медицины является перевод пациента на самостоятельное дыхание после длительной ИВЛ.
Постепенное прекращение респираторной поддержки, независимо от длительности и применяемых методов, называют отлучением от ИВЛ (weaning). По данным литературы, более чем в 20% случаев не удается провести отлучение с первой попытки, и оно может занимать до 40% времени проведения вентиляции легких [9, 10]. Под термином «отключение от ИВЛ» считают полное прекращение респираторной поддержки и отсоединение пациента от респиратора.
Важнейшим вопросом остается определение подходящего времени начала и скорости проведения дыхательной реабилитации. Длительное отлучение от ИВЛ может сопровождаться развитием инфекционных и тромбоэмболических осложнений, желудочно-кишечных кровотечений, увеличением сроков нахождения больного в отделении интенсивной терапии, повышением смертности [11]. Слишком раннее отлучение от ИВЛ приводит к стрессу кардиопульмональной системы, замедляет выздоровление, повышает риск «реинтубации» трахеи [11]. По данным литературы, частота неудачной экстубации, потребовавшей повторной установки трубки в трахею, составляет от 6 до 47% [12]. У пациентов, которым была выполнена реинтубация трахеи, значительно увеличиваются сроки проведения ИВЛ, частота возникновения пневмонии, длительность нахождения в отделении реанимации и стационаре, повышается госпитальная летальность [13–15]. По данным A. Torres и соавт. (1995), частота развития нозокомиальной пневмонии у пациентов после неудачной экстубации трахеи на 37% выше, по сравнению с больными, которым реинтубацию не проводили [16]. Летальность у пациентов в этом случае составляет 30-40% [17]. Существует несколько гипотез, объясняющих причины увеличения смертности после неудачной экстубации трахеи. Одна из них заключается в том, что неудачная дыхательная реабилитация возникает у наиболее сложной категории пациентов, а неэффективность отлучения от ИВЛ может служить дополнительным признаком тяжелого состояния пациента. По второй гипотезе реинтубация трахеи как инвазивная процедура сама по себе может увеличить смертность в связи риском возникновения опасных для жизни событий, таких как остановка сердца, интубация пищевода, эндобронхиальная интубация, аспирация содержимого желудка и сердечные аритмии [12].
Выделяют субъективные критерии, свидетельствующие о возможности отлучения больного от ИВЛ, к которым относят способность пациента самостоятельно откашливать мокроту, малое количество секрета из трахеобронхиального дерева, отсутствие необходимости в применении миорелаксантов, седативных препаратов, восстановление уровня бодрствования [18]. Объективными критериями для начала дыхательной реабилитации являются стабилизация гемодинамики (отсутствие или минимальные дозы применяемых вазоинотропных препаратов), частота сердечных сокращений менее 140 ударов в минуту, уровень гемоглобина в плазме крови более 80 г на литр, систолическое артериальное давление в пределах 90-160 мм рт.ст., температура тела 36,0–38,0 °С [8, 19]. Важным фактором является способность организма поддерживать адекватный газообмен перед началом отлучения от ИВЛ [8, 12, 19].
Критерии для начала отлучения от ИВЛ:
- дыхательный объем >5 мл/кг;
- частота дыхания (ЧД) <35 в минуту;
- напряжение кислорода в артериальной крови (РаО2) >60 мм рт.ст.;
- напряжение двуокиси углерода в артериальной крови (РаСО2) <60 мм рт.ст.;
- положительное конечное давление выдоха (ПДКВ) <8 см вод.ст.;
- отсутствие респираторного ацидоза (рН ≥7,3);
- максимальное давление на вдохе (PImaх) <25–30 см вод.ст.;
- насыщение гемоглобина кислородом в артериальной крови (SpO2) ≥90% при фракции кислорода в дыхательной смеси (FiO2) ≤40% или отношение РаО2/FiO2 ≥200.
В 2001 г. был предложен протокол отлучения от респиратора Spontaneous breathing trial (SBT), который основывался на оценке возможности пациента самопроизвольно дышать, получая минимальную или отсутствующую аппаратную поддержку [11]. Для оценки возможности отлучения от ИВЛ больного отключали от респиратора или снижали поддержку по давлению до 5 см вод.ст. на 30–120 мин, в течение которых мониторировали состояние пациента. Критерии эффективности теста: приемлемые показатели газообмена (SpО2 ≥85–90%; PО2 ≥50–60 мм рт.ст.; pH 7,32; увеличение PaСО2 ≤10 мм рт.ст.), стабильные параметры дыхания и гемодинамики (частота сердечных сокращений и систолическое артериальное давление изменились не более чем на 20%, ЧД изменилась не более чем на 50%) [11]. Оценку самостоятельного дыхания считали неудачной при изменении в ментальном статусе (развитие сомноленции, возбуждения, тревоги, угнетение уровня бодрствования), появлении дискомфорта, потливости, признаков избыточной работы дыхания (использование дополнительных дыхательных мышц, торакоабдоминальный парадокс). В последующем тест оценки спонтанного дыхания (SBT) стал использоваться как независимый метод отлучения от ИВЛ [8, 12].
Для повышения безопасности и эффективности дыхательной реабилитации постоянно разрабатываются дополнительные критерии готовности пациента к отлучению от аппарата ИВЛ:
Индекс поверхностного дыхания (RSBI) – отношение ЧД к величине дыхательного объема. RSBI рассчитывают по формуле:
RSBI = f/Vt,
где f – частота дыхания (в минуту), Vt – дыхательный объем (в литрах).
RSBI <105 дыханий/мин/л позволяет сделать предположение о безопасной экстубации трахеи у пациента (85–90% случаев), а при повышении индекса частоты/объема дыхания более 120 дыханий/мин/л больному предпочтительно продолжение ИВЛ [20, 21].
Волюметрическая капнография: метод основан на определении «коэффициента мертвого пространства» (Vd/Vt) – отношения части дыхательного объема, не участвующего в газообмене (анатомическое и физиологическое мертвое пространство респираторной системы) (Vd) к общему дыхательному объему. Расчет производят по формуле Энгхоффа–Бора, для чего определяют содержание CO2 в артериальной крови и на выдохе [22]. Существуют аппараты ИВЛ, которые автоматически рассчитывают Vd/Vt по данным проводимой капнографии и уровню РаСО2, который врач вносит в интегрированный в респиратор калькулятор. A. Gonzalez-Castro et al. (2011) показали высокую чувствительность и специфичность (OR=1,52 (95% CI 1,11–2,09; p=0,008)) метода волюметрической капнографии в предсказании успешности экстубации трахеи у пациентов, которым проводили длительную ИВЛ. Коэффициент мертвого пространства был достоверно ниже у пациентов, которым была проведена удачная экстубация трахеи (Vd/Vt – 0,48), по сравнению с больными, которых не удалось отлучить от ИВЛ (Vd/Vt – 0,65) [23].
Сопротивление в дыхательных путях и податливость респираторной системы. Динамическое снижение сопротивления в дыхательных путях и прирост податливости легких могут быть косвенными критериями повышения вероятности эффективного отлучения больного от ИВЛ. Однако эти критерии очень косвенны и могут носить лишь вспомогательный характер при принятии решения об экстубации трахеи. Например, величину сопротивления дыхательных путей можно уменьшить подбором оптимального диаметра эндотрахеальной или трахеостомической трубок, своевременным тщательным удалением бронхиального секрета, что не может свидетельствовать о быстром повышении дыхательного реабилитационного потенциала больного.
Давление окклюзии (Р0,1) – давление, которое создает пациент в течение первых 100 мс попытки спонтанного вдоха на фоне ИВЛ. Р0,1 отражает функциональную способность дыхательного центра к управлению вентиляцией и уровень проводимости импульсов к дыхательным мышцам. P0,1/PImax >0,3 может свидетельствовать о возможности удачной экстубации трахеи.
Производное давление-время (PTP) – уровень снижения давления в дыхательных путях во время попытки вдоха по отношению ко времени, в течение которого это снижение сохраняется. PTP рассчитывают по формуле:
PTP = ∆P × time,
где ∆P – уровень снижения давления в дыхательных путях при вдохе, time – время, в течение которого сохраняется снижения давления в дыхательных путях при вдохе.
Функция диафрагмы. Определение состояния диафрагмы и степени ее атрофии может быть критерием успешности экстубации трахеи. Для оценки функционального состояния диафрагмы применяют ультразвуковые (определение толщины диафрагмы, степени ее участия в акте дыхания) и нейрофизиологические (измерение электрической активности диафрагмы) методы исследования [24]. Прикроватным методом оценки активности диафрагмы может служить применение аппаратов ИВЛ, в которых инициация вдоха происходит за счет определения электрического сигнала с диафрагмы датчиком, который установлен через пищевод (функция NAVA) [25].
Работа дыхания. Современные аппараты ИВЛ позволяют измерить работу дыхания пациента отдельно от работы респиратора для обеспечения дыхания. Наиболее точная оценка может быть получена при измерении транспищеводного давления с помощью специального баллона, устанавливаемого в пищевод. Увеличение спонтанной работы дыхания больного позволяет прогнозировать успешность его отлучения от респиратора [26].
Следует отметить, что все представленные критерии готовности пациента к дыхательной реабилитации несовершенны и не должны использоваться по отдельности. Для повышения безопасности и эффективности методов отлучения от респиратора проводят комплексную динамическую оценку состояния больного, на основании которой предполагают алгоритм дальнейших действий индивидуально для каждого пациента.
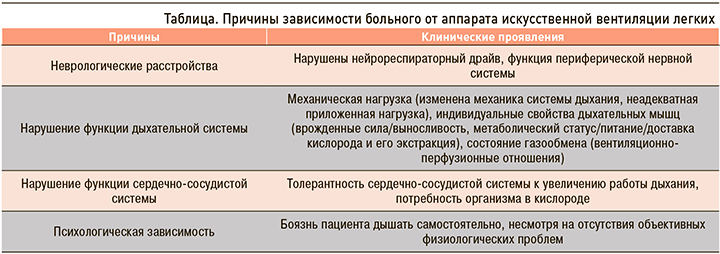
Зачастую неудачные попытки перевода на самостоятельное дыхание связаны с индивидуальными особенностями больного, которые не могут быть диагностированы при помощи стандартных критериев. Причинами зависимости пациента от аппарата ИВЛ могут быть неврологические расстройства, нарушения функции дыхательной и сердечно-сосудистой систем, психологическая зависимость от респиратора (табл.).
В доступной литературе представлено большое количество рекомендаций по отлучению больного после длительной ИВЛ, отличия между которыми зачастую носят символический характер.
К основным способам дыхательной реабилитации относятся использование протокола спонтанного дыхания (SBT), самостоятельное дыхание через Т-образную трубку и применение вспомогательных режимов ИВЛ.
Метод SBT основан на чередовании спонтанного дыхания и ИВЛ. Один из вариантов реализации такого подхода – отключение пациента от аппарата ИВЛ на короткие промежутки времени несколько раз в сутки. При эффективности спонтанного дыхания постепенно удлиняют длительность и частоту интервалов прекращения респираторной поддержки до полного отключения от ИВЛ. Другим подходом являются тренировки дыхания, выполняемые один раз в сутки, но на длительное время. Эффективность однократного продолжительного отключения от ИВЛ может быть выше по сравнению с многократными короткими промежутками дыхательной реабилитации вследствие меньшего регресса адаптационных изменений, более интенсивной тренировки дыхательной мускулатуры. Недостатком более агрессивного способа SBT может быть ограничение восстановления спонтанного дыхания у ослабленных пациентов, прогрессирование дыхательной недостаточности и декомпенсация состояния больного.
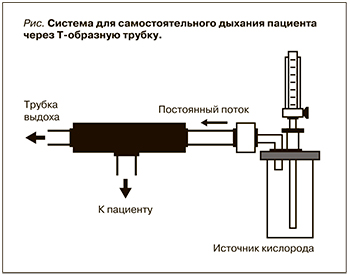 Другой вариант отлучения от ИВЛ – перевод пациента на самостоятельное дыхание через Т-образный коннектор, в один из просветов которого подается поток увлажненной дыхательной смеси с достаточной скоростью для предотвращения попадания выдыхаемого газа через противоположный просвет коннектора обратно в легкие (рис.). Кратность и длительность интервалов дыхательной реабилитации подбирают в зависимости от состояния больного. Преимуществом самостоятельного дыхания через Т-трубку по сравнению с SBT-протоколом является быстрота отлучения от респиратора; недостатками является отсутствие контроля над объемом дыхания пациента, высокий риск ателектазирования легких, переутомления больного, больше затрат труда персонала.
Другой вариант отлучения от ИВЛ – перевод пациента на самостоятельное дыхание через Т-образный коннектор, в один из просветов которого подается поток увлажненной дыхательной смеси с достаточной скоростью для предотвращения попадания выдыхаемого газа через противоположный просвет коннектора обратно в легкие (рис.). Кратность и длительность интервалов дыхательной реабилитации подбирают в зависимости от состояния больного. Преимуществом самостоятельного дыхания через Т-трубку по сравнению с SBT-протоколом является быстрота отлучения от респиратора; недостатками является отсутствие контроля над объемом дыхания пациента, высокий риск ателектазирования легких, переутомления больного, больше затрат труда персонала.
Наиболее безопасный способ дыхательной реабилитации – применение вспомогательных режимов ИВЛ, которые позволяют контролировать дыхание больного. К наиболее распространенным относятся метод синхронизированной перемежающейся вентиляции легких (SIMV) и респираторная поддержка по давлению (PS-pressure support). Независимо от выбранного способа изначально снижают фракцию кислорода в дыхательной смеси до 30% и менее. В режиме SIMV постепенно уменьшают частоту аппаратных вдохов, тем самым повышая спонтанную дыхательную активность больного. На следующем этапе снижают уровень давления, которым поддерживаются дыхательные попытки пациента. Более быстрым является переход на PS режим ИВЛ, при котором все вдохи инициируются больным. Последующая задача – плавное уменьшение давления на вдохе до минимальных значений, а затем отключение пациента от ИВЛ.
В настоящее время все большее внимание уделяют «интеллектуальным» режимам респираторной поддержки, которые позволяют проводить дыхательную реабилитацию в зависимости от состояния легочной механики, спонтанной дыхательной активности пациента и уровня газообмена [6, 27]. Аппарат регистрирует множество параметров, на основании которых изменяет степень поддержки дыхания в соответствии с задачами, которые устанавливает врач. Несмотря на то что в основе «интеллектуальных» режимов заложены известные протоколы дыхательной реабилитации, такой способ отлучения от ИВЛ может быть наиболее безопасным и эффективным для больного. В некоторых случаях максимально деликатное проведение дыхательной реабилитации может привести к увеличению сроков отлучения от ИВЛ в связи с высокой комфортностью такого дыхания и отказом пациента дышать самостоятельно с нагрузкой.
ЗАКЛЮЧЕНИЕ
Эффективное и быстрое отлучение пациента от ИВЛ остается нерешенной проблемой интенсивной терапии больных, находящихся в критическом состоянии. Несмотря на многочисленные разработанные протоколы дыхательной реабилитации, совершенствование аппаратуры и создание интеллектуальных режимов, нет единого мнения, какой из методов может считаться предпочтительным.
У ряда категорий больных, например, с повреждением головного мозга, все имеющиеся подходы не показали своей результативности. Основной рекомендацией к отлучению от респиратора остается индивидуальный подбор метода, тщательный контроль над состоянием пациента на всех этапах реабилитации.


