Злокачественные новообразования и заболевания сердечно-сосудистой системы на сегодняшний день занимают лидирующие позиции в рейтинге заболеваемости, а также являются одними из ведущих причин смерти населения планеты [1, 2].
Среди онкологических заболеваний у женщин на первый план выходит рак молочной железы (РМЖ) – диагноз, который ежегодно выставляется сотням тысяч пациенток по всему миру. В США, по данным Американского онкологического общества (American Cancer Society), в 2019 г. у женщин выявлено 268 600 новых случаев инвазивного РМЖ [3], в России на 2015 г. было зарегистрировано 66 366 новых случаев этого заболевания [2].
Новейшие схемы радио-, гормоно- и химиотерапии позволили значительно повысить эффективность лечения, увеличив тем самым процент выживаемости у этой группы пациенток [4]. Но такие агрессивные схемы лечения приводят к частому поражению сердечно-сосудистой системы, в частности, к развитию систолической и диастолической дисфункции миокарда, хронической сердечной недостаточности, что неизбежно увеличивает смертность этой категории больных от ранних и отдаленных сердечно-сосудистых осложнений (ССО) [5]. Эта взаимосвязь привела к необходимости создания тесного взаимодействия между кардиологами и онкологами, что послужило первым шагом к формированию такого интегративного направления, как кардиоонкология [6].
Множество крупномасштабных исследований подтвердило кардиотоксический потенциал химиопрепаратов, в частности антрациклинов, наиболее часто используемой группы лекарств в лечении РМЖ [7, 8]. В последнее время отечественные и зарубежные кардиоонкологические школы в большинстве своем занимаются изучением и разработкой схем профилактики и мониторинга кардиотоксичности, уделяя большое внимание субклиническим маркерам поражения сердца [9]. При этом сосудистая стенка, выступающая одним из важнейших звеньев регуляции и поддержания гомеостаза, остается недооцененной мишенью. Немногочисленные существующие исследования обнаруживали нарушение структурно-функционального состояния сосудистой стенки на фоне применения химиотерапии. Например, в работе Herrmann J. et al. [10] описывается три механизма васкулотоксичности: острый тромбоз, ускоренный атеросклероз и острый вазоспазм, ‒ впоследствии приводящих к развитию фатальных и нефатальных ССО. Важно отметить, что характер и стойкость существования этих изменений остаются до конца не изученными. Одним из первых маркеров, реагирующих на токсическое воздействие, служит такой интегральный показатель, как сосудистая жесткость, отражающий нарушение морфофункционального состояния артериальной стенки, ухудшение ее эластических, демпфирующих свойств и являющийся независимым предиктором ССО.
Цель нашего обзора – описание наиболее распространенных в клинической практике методов определения сосудистой жесткости, анализ имеющихся результатов их применения у больных РМЖ, а также обсуждение перспективных направлений раннего выявления и профилактики сосудистых осложнений у данной группы пациентов.
АРТЕРИАЛЬНАЯ ЖЕСТКОСТЬ: ОСНОВНЫЕ ПОНЯТИЯ И МЕТОДЫ ОЦЕНКИ
Необходимо напомнить, что сосудистое русло является самой распространенной сетью организма и представляет собой гигантский паракринный орган, обеспечивающий транспорт сигнальных молекул и медиаторов воспаления, реализующий связь различных органов и систем. Активное участие эндотелия в регуляции гомеостаза выражается в поддержании баланса между образованием вазоконстрикторных и вазодилататорных медиаторов, провоспалительных и антивоспалительных цитокинов, пролиферативных и антипролиферативных веществ.
Артериальная сеть, помимо прочего, обладает эластическими и демпфирующими свойствами, что определяет ее способность к расширению и восстановлению прежней формы, а также возможность погашения колебаний давления, вызванных циклической работой левого желудочка (ЛЖ). Эту совокупность упруго-эластических свойств отражает такой показатель, как артериальная жесткость (АЖ). Именно она служит одним из наиболее рано реагирующих маркеров повреждения сосудистой стенки, позволяющим выявить нарушение буферной функции сосудов [11].
Как известно, сосудистая стенка обладает высокой восприимчивостью к таким факторам, как гипертриглицеридемия, повышенное артериальное давление (АД), гипергликемия, чрезмерное употребление поваренной соли, воздействие которых приводит к ее структурно-функциональным изменениям еще до клинической манифестации сердечно-сосудистых заболеваний (ССЗ) [12]. У пациентов, получающих химиотерапию, эндотелиальная выстилка сосуда непосредственно контактирует с агрессивным препаратом, что может потенцировать васкулотоксический эффект. В частности, в экспериментальной работе Hadas B.-J. et al. у мышей в режиме реального времени in vivo было визуализировано повреждающее действие антрациклинов на сосуды, выражающееся в вазоспазме и повышении проницаемости, которые отмечались сразу после введения препарата [13]. Таким образом, АЖ может быть перспективным показателем, реагирующим еще на стадии доклинических проявлений заболевания.
Говоря о характеристиках АЖ, важно вспомнить о морфологических отличиях в строении центральных и периферических артерий. Среди клеточных компонентов стенки аорты и крупных артерий преобладают эластические волокна, в средних и мелких сосудах периферии – коллагеновые, что способствует увеличению АЖ от центральных к дистальным участкам (формирование градиента АЖ). Это клинически проявляется увеличением показателей АД от центра к периферии [14].
Артериальную жесткость можно подразделить на системную, локальную и региональную [15]. Системная АЖ отражает совокупность системной артериальной податливости и определяется такими параметрами, как системное сосудистое сопротивление, общий сосудистый импеданс, емкостный артериальный комплаенс, рефлективный артериальный комплаенс. Недостаток оценки системной АЖ состоит в том, что долгосрочные исследования не подтвердили ее прогностическую значимость в качестве независимого предиктора ССО; это не позволяет ее применять в качестве скринингового метода диагностики.
Определение локальной АЖ основано на оценке пульсационного изменения диаметра изучаемой артерии (аорты, общей сонной, плечевой артерии). При расчете локальной АЖ вычисляются систолической и диастолический диаметр артерии, растяжимость и коэффициент растяжимости, податливость и коэффициент податливости, модуль эластичности Петерсона, модуль эластичности Юнга, индекс жесткости β, деформация. Эти параметры вычисляются с помощью ультразвукового сканирования в B-режиме, а также при помощи магнитно-резонансной визуализации [15].
Для нас непосредственный клинический интерес представляет вычисление региональной АЖ как наиболее доступного для определения параметра, неинвазивного, легко воспроизводимого и используемого в проанализированных нами исследованиях. Региональная АЖ обладает обширной доказательной базой, широко применяется практикующими врачами и исследователями как за рубежом, так и в нашей стране. Методом оценки региональной АЖ является определение скорости распространения пульсовой волны (СПВ).
Прежде чем говорить о практической оценке этого показателя, необходимо вспомнить о физиологическом происхождении пульсовой волны и влияющих на нее параметрах. Пульсовая волна является суммой ударной волны, генерируемой левым желудочком (ЛЖ) и следующей антеградно по ходу сосудистого дерева, и волны отражения. Последняя представляет собой ретроградно направленную пульсовую волну, сформированную отражением антеградной пульсовой волной о места разветвлений артериального дерева и нарастающим к периферии градиентом АЖ.
Увеличение жесткости артериальной стенки, количества и близости точек отражения приводят к формированию феномена амплификации, что клинически выражается в увеличении амплитуды пульсовой волны, систолического АД и пульсового АД (ПАД) по направлению к периферии. Это позволяет поддерживать адекватную перфузию органов и тканей. В норме отраженная волна возвращается в аорту во время диастолы, тем самым поддерживая оптимальное центральное диастолическое АД (цДАД) в аорте и обеспечивая необходимый коронарный кровоток.
Каким же образом изменение АЖ влияет на такой важный параметр, как центральное аортальное давление (ЦАД)? При увеличении сосудистой жесткости происходит увеличение СПВ, что приводит к более быстрому ретроградному распространению отраженной волны, которая возвращается в аорту во время систолы, увеличивая тем самым центральное систолическое АД (цСАД) в аорте. Этот количественный прирост АД (за счет раннего появления волны отражения) характеризует индекс аугментации (AIx). Увеличение цСАД приводит к увеличению постнагрузки на ЛЖ, оказывая тем самым негативное влияние на его систоло-диастолическую функцию и приводя к последующему ремоделированию [11]. Таким образом, ЦАД и индекс аугментации могут использоваться как косвенные характеристики АЖ [14].
Говоря о практических аспектах оценки региональной АЖ, необходимо напомнить, что «золотым стандартом», обладающим высокой прогностической значимостью в отражении сердечно-сосудистого риска (ССР), считается определение СПВ на каротидно-феморальном сегменте (СПВкф), которая рассчитывается следующим образом: расстояние между двумя участками, на которых регистрируется волна, делится на время прохождения волны от первого до второго участка. В 2012 г. от лица Ассоциации по исследованию артериальной структуры и физиологии (Association for Research into Arterial Structure and Physiology) был издан консенсусный документ по измерению СПВкф в повседневной практике, отражающий рекомендации относительно процедур измерения СПВкф и устанавливающий в качестве пороговой точки значение 10 м/с [16]. Нельзя не упомянуть, что при измерении СПВ в бедренной области оператор может столкнуться с некоторыми трудностями, в частности, у пациентов, страдающих ожирением. Это инициировало поиск других точек определения СПВ.
Соответственно, помимо СПВкф, возможно определение СПВ на плече-лодыжечном и каротидно-лучевом сегментах. Оценка пульсовой волны может выполняться при помощи апланационной тонометрии, осциллометрического измерения, ультразвукового сканирования, а также магнитно-резонансной томографии.
Важно отметить, что СПВ зависима от ряда параметров: уровня АД во время измерения, частоты сердечных сокращений, а на периферических участках приобретает значение вазомоторный тонус, влияние симпатической и ренин-ангиотензин-альдостероновой систем. В этом отношении более независимым параметром является сердечно-лодыжечный индекс CAVI, отражающий сердечно-лодыжечную пульсовую волну. Этот индекс находится методом объемной сфигмографии, он не зависит от уровня растягивающего давления во время измерения, что делает его более достоверным в отношении определения АЖ [11].
Состояние артерий периферии отражают лодыжечно-плечевой (ЛПИ) и пальце-плечевой индексы (ППИ). ЛПИ характеризуется как отношение систолического АД на лодыжке к систолическому АД на плече, ППИ – отношению пальцевого давления к давлению на плече. Оба показателя являются маркерами заболеваний периферических артерий, а ЛПИ также зарекомендовал себя как предиктор неблагоприятных кардиоваскулярных событий.
В 2018 г. в России был опубликован согласительный документ, по оценке АЖ в клинической практике [11], где подробно освещается важность оценки этого параметра и способы его регистрации, а также приводится перечень состояний, при которых следует оценивать сосудистую жесткость с особым вниманием.
ОБЗОР ИССЛЕДОВАНИЙ ВОЗМОЖНОСТИ ОЦЕНКИ И ИНТЕРПРЕТАЦИИ АРТЕРИАЛЬНОЙ ЖЕСТКОСТИ НА ФОНЕ ХИМИОТЕРАПИИ
Поиск исследований выполнялся в платформах Google Scholar, PubMed, eLIBRARY, Mendeley. Использовались следующие ключевые слова: arterial stiffness, aortic stiffness, breast cancer, anthracyclines, chemotherapy, vascular toxicity. Для нашего обзора мы отобрали 7 исследований, из них 6 – зарубежных и 1 – отечественное. Период публикации статей варьируется с 2010 по 2019 г. Преимущественной категорией пациентов, включавшихся в исследования, были больные РМЖ, в двух исследованиях выборка была дополнена больными лейкемией и лимфомами. Магнитно-резонансное сканирование в качестве метода определения СПВ в аорте применялось в трех исследованиях, в остальных четырех использовались осциллометрические и ультразвуковые методики определения АЖ. Краткие характеристики исследований приведены в таблице.
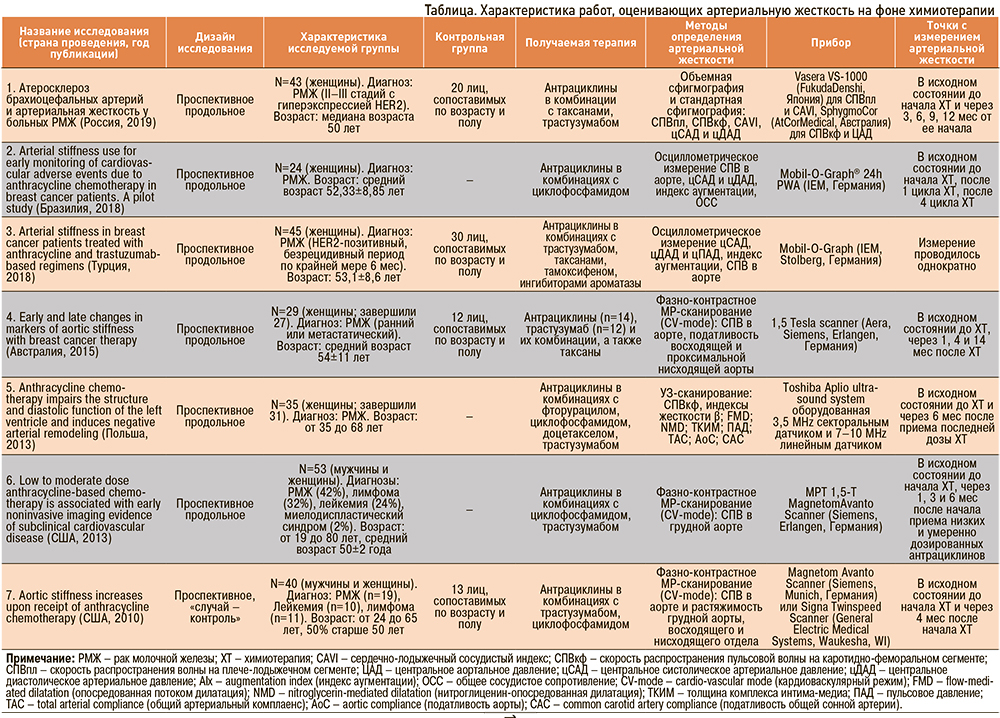
В проспективном исследовании 2010 г., выполненном в США и включавшем 40 пациентов с онкологическим диагнозом (РМЖ, лейкемии, лимфомы) и 13 пациентов группы контроля, оценивалось влияние антрациклинсодержащей химиотерапии на показатели сосудистой жесткости. Скорость пульсовой волны и растяжимость грудной аорты оценивались при помощи фазно-контрастной магнитно-резонансной томографии в кардиоваскулярном режиме. Конечными точками были выбраны момент до химиотерапии и 4 мес от начала лечения. Исследователями было выявлено значительное увеличение жесткости аорты по сравнению с исходным уровнем в исследуемой группе, о чем свидетельствовали снижение растяжимости аорты (р <0,0001) и увеличение СПВ в аорте (р <0,0001) через 4 мес от начала химиотерапии, чего не наблюдалось в группе контроля. Эти изменения сохранялись после учета возраста, пола, сердечного выброса, приема кардиоактивных препаратов и сопутствующих заболеваний (артериальной гипертензии, сахарного диабета) (р <0,0001) [17].
В более позднем проспективном исследовании 2013 г., также при помощи магнитно-резонансного контрастного исследования оценивалось влияние низких и умеренных доз антрациклиновой химиотерапии на объем ЛЖ, фракцию выброса ЛЖ, окружную деформацию ЛЖ (circumferential strain), СПВ в аорте, позднее повышение уровня гадолиния. Из лабораторных параметров осуществлялось определение сывороточного натрийуретического пептида B-типа, тропонина I, а также оценивалось влияние лечения на качество жизни пациентов (опросник Quality of life – QOL) до начала, через 1, 3 и 6 мес после начала химиотерапии. В исследуемую группу вошли 53 пациента (мужчины и женщины), критерием включения, помимо прочих, являлись уставленный РМЖ, лейкемия или лимфома. Конечно-систолический объем ЛЖ (p=0,02), деформация ЛЖ (p=0,0003), СПВ (p=0,0006) увеличивались, качество жизни, по данным опросника QOL (p=0,008), ухудшалось, тогда как фракция выброса ЛЖ уменьшалась (p=0,0002) в течение 6 мес после приема химиотерапии. Полученные результаты не зависели от возраста, пола, расы, эквивалентной дозы доксорубицина и метода его введения (р=0,02–0,0001) [18].
Проспективное исследование, выполненное польскими коллегами в 2013 г., включало 35 женщин (возраст 50±9 лет) с РМЖ, которым была назначена стандартная антрациклиновая химиотерапия. Клиническая оценка проводилась исходно до химиотерапии и через 6 мес после приема последней дозы (период наблюдения 9–12 мес). На всех этапах наблюдения показатели систолической функции ЛЖ оставались сохранными, тогда как параметры диастолической функции, по данным трансмитральной и тканевой допплерографии, ухудшились, что сопровождалось увеличением индекса E/E’ (р <0,0001). При оценке сосудистых параметров было обнаружено увеличение толщины комплекса интима-медиа (ТКИМ) сонных артерий (р <0,0001), снижение комплаентности аорты (р=0,042) и общей сонной артерии (ОСА) (р=0,004), а также увеличение показателей жесткости аорты и ОСА (р=0,046 и р=0,003 соответственно), что свидетельствовало о негативном сосудистом ремоделировании [19].
Австралийское проспективное исследование 2015 г. оценивало обратимость негативных сосудистых изменений у 29 пациентов, получавших химиотерапию (14 получали антрациклины, 12 – трастузумаб), в качестве группы контроля были набраны 12 практически здоровых добровольцев. Магнитно-резонансная томография в кардиоваскулярном режиме проводилось до начала химиотерапии, через 1, 4 и 14 мес после терапии и включало измерение СПВ в аорте, растяжимости восходящей аорты и проксимальной нисходящей аорты. У исследуемой группы и группы контроля не было выявлено значимых различий до начала лечения. Однако через 4 мес у онкологических больных СПВ резко увеличивалась (р=0,002), а затем снижалась к 14 мес (р <0,001), также наблюдалось снижение растяжимости восходящей аорты в течение 1 (р=0,001) и 4 мес (р <0,001) от начала терапии. Что касается нисходящей аорты, то было выявлено достоверное снижение ее растяжимости на 14 мес по сравнению с исходным уровнем (р <0,001). Это свидетельствует о том, что после химиотерапии при РМЖ возникают острые изменения, наблюдаемые в СПВ и растяжимости восходящей аорты, и они частично регрессируют через год после прекращения терапии, причем большее снижение растяжимости восходящей аорты со временем отмечалось в группе, принимавшей антрациклины (р=0,005 через 1 мес; р <0,001 через 4 мес; р=0,009 через 14 мес) [20].
Два проспективных исследования, опубликованные в 2018 г., изучали параметры АЖ с помощью осцилометрического измерения СПВ, цСАД и цДАД, индекса аугментации. Исследование Yersal O. et al. [21] включало 45 пациенток с РМЖ, которые находились под наблюдением в течение 6 мес после завершения адъювантной химиотерапии, и 30 пациентов группы контроля, тогда как в работе Souza C.A. et al. [22] была только исследуемая группа из 24 больных РМЖ.
Результаты исследования [21] обнаружили значительное увеличение средних значений СПВ у больных РМЖ по сравнению с контрольной группой, а также увеличение СПВ у пациентов, получавших ингибиторы ароматазы, по сравнению с пациентами, получавшими тамоксифен.
Исследование [22] ставило перед собой цель оценить роль осцилломтерического метода определения АЖ в качестве маркера сердечно-сосудистых нежелательных явлений, связанных с химиотерапевтическими препаратами на основе доксорубицина. Параметры, характеризующие АЖ (СПВ, цСАД и цДАД, индекс аугментации), сопоставлялись с эхокардиографической фракцией выброса ЛЖ. Достоверной разницы между гемодинамическими показателями, оцениваемыми осциллографическим методом, и фракцией выброса ЛЖ не было выявлено, что позволило исследователям высказать утверждение об оправданности использования осцилометрического измерения АЖ как маркера васкулотоксического действия химиотерапии.
Одним из последних исследований стала работа российских ученых, опубликованная в 2019 г., целью которой была оценка состояния сосудистой стенки, а также выявление предикторов развития атеросклероза брахиоцефальных артерий у пациентов с диагностированным РМЖ. Комплексное обследование, включавшее определение СПВкф и плече-лодыжечной СПВ, показателей ЦАД, было выполнено у 45 больных РМЖ и у 20 пациентов группы контроля. Интересной особенностью данной работы являлась оценка параметров клеточного иммунитета у группы РМЖ, при проведении которой была выявлена активация Т-клеточного звена иммунитета у исследуемой группы в сравнении с контролем. Исследователями было выявлено снижение систолического АД, показателей ЦАД, увеличение жесткости сосудистой стенки по данным СПВ на плече-лодыжечном и каротидно-феморальном сегментах, которое нивелировалось к моменту завершения адъювантной химиотерапии (для показателей систолического АД, цСАД, СПВкф). Диастолическое АД и CAVI не показали достоверных изменений. Также была выявлена связь уровня липопротеида (а) выше 12,8 мг/дл с прогрессированием атеросклеротического поражения брахиоцефальных артерий. Авторами был сделан вывод об увеличении жесткости сосудистой стенки у больных РМЖ, которое было ассоциировано с активацией эффекторных популяций Т-лимфоцитов [23].
ОБСУЖДЕНИЕ
Исходя из полученных результатов приведенных выше исследований, остро возникает необходимость понимания всей важности комплексного мониторирования состояния сердечно-сосудистой системы. Негативное артериальное ремоделирование подтверждается результатами приведенных в обзоре исследований, но остаются до конца не изученными длительность и стойкость изменений функционального состояния артерий. В частности, исследование Grover S. et al. [20] говорит о волнообразном изменении растяжимости восходящей аорты: к 4 мес от начала ХТ происходит ухудшение этого показателя, а к 14 мес указанные изменения нивелируются. В то же время для проксимальной нисходящей аорты отмечалось значимое уменьшение растяжимости, выявленное на 14 мес. Результаты Филатовой А.Ю. с соавт. [23] также отражают нестойкий токсический эффект химиотерапии. Все это свидетельствует о необходимости проведения исследования с большим отдаленным периодом наблюдения.
В этом отношении интересной представляется работа Koelwyn G.J. et al. [24], в которой у пациентов с РМЖ, ранее получавших химиотерапию от 2 до 15 лет до момента включения (от 2 до 15 лет до момента включения, в среднем 6,5±3,6 лет от момента антрациклиновой терапии), в отдаленном периоде оцениваются параметры левожелудочково-артериального сопряжения посредством кардиопульмонального тестирования, а также исследуется морфофункциональное состояние артерий. Различия в параметрах левожелудочково-артериального сопряжения были выявлены только при физической нагрузке в исследуемой группе РМЖ, никаких различий в показателях не наблюдалось в покое, что подчеркивает важность использования стресс-теста для выявления субклинической сердечно-сосудистой дисфункции после антрациклинсодержащей терапии. Что же касается сосудистой структуры и функции, исследователями не было выявлено значимого ухудшения опосредованной потоком дилатации, показателей локальной и регионарной АЖ, толщине комплекса интима-медиа (КИМ) в последующие годы после применения антрациклиновой химиотерапии при сравнении с группой контроля.
Относительно длительности сохранения негативных сосудистых изменений для нас представляют собой интерес результаты двух исследований, проведенных в популяции детей, имевших в анамнезе онкологический диагноз и получавших антрациклинсодержащую терапию. В исследование [25] были включены 96 пациентов (57 мальчиков и 39 девочек, средний возраст 14,9±5,3 лет), находившихся в ремиссии по крайней мере 5 лет. Среднее время от момента последнего курса ХТ составило 10 лет. Лимфомы и лейкемии (63 случая), опухоль Вильмса (нефробластома, 14 случаев) и другие солидные опухоли (19 случаев) являлись критерием включения в исследование. 67 пациентов в прошлом получали терапию, включающую антрациклины (группа 1), 29 получали химиотерапию без этой группы препаратов (группа 2). В качестве контрольной группы было отобрано 72 человека. Исследователями было обнаружено снижение опосредованной потоком дилатации податливости аорты, индекса жесткости в исследуемых группах в сравнении с контролем, с более выраженным снижением показателей в группе, принимавшей антрациклины (p <0,01). Любопытно, что показатель эндотелийнезависимой дилатации (нитрат-опосредованной) не показал значимого различия среди исследуемых и контрольной групп. Значимая отрицательная корреляция (r=0,39, р <0,02) была выявлена между уровнем триглицеридов и опосредованной потоком дилатацией.
В исследовании 2017 г. [26], выполненном через 4–20 лет после завершения антрациклинсодержащей химиотерапии на пациентах разных возрастных групп (13–15, 16–18 и 19–24 лет), были получены следующие результаты. Так, достоверное увеличение C-AI75 и C-AP75 (индекса аугментации центральной пульсовой волны и давления аугментации, стандартизированные на частоту сердечных сокращений – 75 уд./мин) в сравнении с практически здоровыми добровольцами отмечено у пациентов в более старших возрастных группах (16–18 и 19–24 лет). Индекс Бакберга (центральный коэффициент жизнеспособности субэндокарда – SEVR) также был снижен у пациентов в самой старшей возрастной группе. Эти субклинические изменения могут говорить о токсическом влиянии антрациклинов на артериальную стенку и сердце, развивающемся в детском и подростковом возрасте, которые сохраняются и могут быть обнаружены уже в старшем возрасте.
Обнаруженное негативное артериальное ремоделирование может способствовать раннему сосудистому старению, тем самым потенцируя повышенный сердечно-сосудистый риск у детей, перенесших рак и получавших терапию, включающую антрациклины.
Таким образом, мы имеем противоречивые результаты, которые не позволяют однозначно судить о выраженности и длительности васкулотоксического эффекта. Результаты, полученные на популяции лиц, перенесших рак в детском возрасте, в отдаленном периоде наблюдения подтверждают морфофункциональные изменения сосудистого русла, в то время как исследования среди взрослых, получавших химиотерапию, говорят о преимущественной регрессии этих эффектов.
Малое число исследований, небольшие выборки и сравнительно короткий период наблюдения создают необходимость для дальнейшего изучения стойкости васкулотоксических изменений и предпосылки для поиска новых маркеров, отражающих повреждение сосудистой системы.
ПЕРСПЕКТИВНЫЕ НАПРАВЛЕНИЯ ИССЛЕДОВАНИЙ
Необходимо упомянуть, что ССЗ и РМЖ обладают общими факторами риска, такими как возраст, диета, семейный анамнез, употребление алкоголя, заместительная гормональная терапия, ожирение/избыточный вес, физическая активность, табакокурение [27]. Это делает важным выделение групп риска среди больных с верифицированным диагнозом РМЖ еще до начала специфической терапии с целью особо внимательного отслеживания состояния сердечно-сосудистой системы на протяжении всего периода лечения, а также после его завершения. Именно СПВ может позволить лучше идентифицировать группы высокого риска в процессе терапии, что позволит лучше управлять сердечно-сосудистым риском у этих пациентов [28].
Как мы уже отмечали выше, важную позицию занимает поиск новых маркеров, отражающих поражение сосудистой стенки при терапии антрациклинами. В этом отношении представляют интерес маркеры эндотелиальной дисфункции, которая, как известно, является краеугольным камнем в развитии ССЗ. Антрациклиновые антибиотики обладают низкой избирательностью действия, что выражается в широком спектре их побочных эффектов. Помимо негативного воздействия на вторичную спирализацию ДНК, они запускают синтез активных форм кислорода и инициируют каскад перекисного окисления липидов. Оксидативный и нитрозативный стресс способствуют развитию эндотелиальной дисфункции вследствие разобщения синтазы оксида азота, окислительного повреждения липидов, белков и ДНК в сосудистых эндотелиальных клетках. Таким образом, происходит поражение эндотелиоцитов, что приводит к ухудшению продукции эндогенного оксида азота, повышению экспрессии провоспалительных цитокинов, последующему развитию вялотекущего системного воспаления в стенке сосуда и возникающему вслед за ним фиброзу. Эти процессы играют важную роль в повышении жесткости артерий, развитии атеросклеротических и артериосклеротических процессов [29].
Именно поэтому определение сывороточных концентраций провоспалительных цитокинов, оксида азота, эндотелина-1, эндотелиальных микрочастиц, тромбомодулина, анализ прооксидантных и антиоксидантых систем может помочь своевременному выявлению повреждений до развития клинических форм заболеваний [30].
Анализ этого звена может нести в себе потенциал для разработки методов воздействия и новых схем лекарственной терапии, изучения возможного применения в качестве профилактики ССО антиоксидантных, антифибротических и противовоспалительных препаратов.
Качество жизни, восстановление в послеоперационном периоде, а также социальная адаптация должны быть выведены на первый план наряду с профилактическими осмотрами. Важным аспектом хорошего прогноза является включение регулярной физической активности, в особенности аэробных тренировок [31], в повседневный режим как пациентов с ССЗ, так и больных РМЖ. Для поддержания степени приверженности возможно включение таких пациентов в групповые занятия и проведение разъяснительных бесед о пользе физической активности.
Работа Pereira T. et al. [32], оценивающая влияние специально разработанной программы физических упражнений на параметры АЖ у пожилых людей, показала следующие результаты: спустя 3 мес от начала исследования у группы пациентов, выполнявших силовые и аэробные нагрузки, было обнаружено значимое снижение СПВ в аорте (p >0,001), а также уменьшение систолического АД (p=0,01).
Интересным нам показалось исследование Do J. et al. [33], в котором изучается влияние реабилитационной программы на качество жизни, сердечно-легочную функцию и утомляемость у больных РМЖ. Авторами работы было обнаружено статистически значимое улучшение этих показателей в обеих исследуемых группах после 4-недельной мультимодальной реабилитационной программы, включавшей нагрузки по 80 мин в сутки, 5 раз в неделю.
Другие исследования, проведенные среди больных РМЖ [34, 35], своими конечными результатами также подтверждают важность физической реабилитации и говорят о ее потенциальной эффективности как немедикаментозной составляющей в комплексе профилактических мер в борьбе с ССЗ. Следовательно, разработка режимов и комплексов физических упражнений, проведение исследований, оценивающих их эффективность, представляют собой почву для будущих исследований.
ЗАКЛЮЧЕНИЕ
Завершая наш обзор, мы хотим подчеркнуть необходимость мониторинга васкулотоксического эффекта химиотерапии РМЖ при помощи методик, определяющих АЖ, как в течении периода лечения для групп повышенного риска, так и в посттерапевтическом периоде. Методики должны быть общедоступными, легко воспроизводимыми и экономически целесообразными. Феномен васкулотоксичности, его длительность во времени и меры профилактики требуют дальнейшего изучения.
Важной вехой в истории современной медицины стала разработка такого направления, как кардиоонкология. Следующим шагом континуума по борьбе с кардиоваскулярными заболеваниями у больных РМЖ должен быть поиск новых маркеров повреждения сосудистой системы, создание мультидисциплинарной программы реабилитации, включающей плановые физикальные осмотры с применением специализированных методик обследования, занятия физическими упражнениями по разработанным схемам и привлечение психологов.


