В 2019 г. мир столкнулся с ранее неизвестной, высоко контагиозной респираторно-вирусной инфекцией COVID-19, опасной тяжелыми осложнениями (прежде всего у пациентов с хроническими заболеваниями на фоне высокого уровня воспаления). В отличие от других респираторных заболеваний COVID-19 может протекать бессимптомно или относительно легко у большинства пациентов. Однако у ряда пациентов эта инфекция приводит к тяжелому пневмониту и острой дыхательной недостаточности. Основной задачей терапии COVID-19 является предотвращение летального исхода. В настоящее время апробируются разные методики лечения.
Для инфекции COVID-19 характерна полиорганная патология. Помимо поражения тканей легких и возникающих вследствие этого нарушений функции дыхания, отмечаются дисфункции других систем органов, в том числе:
- нарушения профиля свертываемости крови (включая повышение уровней D-димера) и диссеминированное внутрисосудистое свертывание крови [2];
- «цитокиновый шторм» — лавинообразное нарастание уровней многих маркеров воспаления в крови (интерлейкина-1β (ИЛ-1β), интерлейкина-6 (ИЛ-6), С-реактивного белка (СРБ), фактора некроза опухоли-α, интерферона-γ, ферритина и др.);
- дисфункция печени (повышение уровней маркеров аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), альбумина, билирубина) [2] и наличие симптоматики со стороны желудочно-кишечного тракта (тошнота, рвота, диарея);
- повреждение тканей почек, сердца и других органов [4, 5].
Эти полиорганные осложнения ассоциированы с тяжелым течением COVID-19 и высоким риском летального исхода [6]. Для более быстрого купирования осложнений COVID-19 требуется использование тех или иных фармакологических средств. К сожалению, каждое из перечисленных выше осложнений требует применения отдельных препаратов, что приводит к неизбежной полипрагмазии и увеличению ятрогенной нагрузки на гепатобилиарную систему.
Поэтому выбор лекарственного средства для лечения пациентов с COVID-19 на фоне полиорганной патологии имеет принципиальное значение для решения основной задачи терапии — снижения смертности. Полипептидный препарат Лаеннек (АТХ A05BA — препараты для лечения заболеваний печени, L03 — иммуностимуляторы), разработанный российскими и японскими учеными, обладает существенным потенциалом в лечении COVID-19.
Лаеннек зарегистрирован в России в качестве гепатопротектора и иммуномодулятора, повышающего функциональную активность фагоцитов и Т-клеток, предотвращающего гибель гепатоцитов и других паренхимальных клеток. Он характеризуется высокой степенью фармацевтической стандартизации и разнонаправленностью терапевтического действия. По нозологической классификации (МКБ-10) Лаеннек предназначен пациентам с заболеваниями печени (K76.9 — болезнь печени неуточненная, K70.0 — алкогольная жировая дистрофия печени, K76.0 — жировая дегенерация печени, не классифицированная в других рубриках), вирусными инфекциями (B00.9 — герпетическая инфекция неуточненная) и болезнями, характеризующимися повышенным фоном воспаления, в том числе аллергического (L20 — атопический дерматит) [6]. Соответственно Лаеннек обладает потенциалом для компенсации полиорганной патологии, характерной для COVID-19. Недавно закончившееся исследование применения этого препарата при неалкогольной жировой болезни печени показало его высокую эффективность в снижении показателей системного воспаления, в том числе уровня ферритина [7].
Известно, что при COVID-19 поражение печени развивается не только за счет высокой экспрессии рецепторов АСЕ2 в гепато- и холангиоцитах, но и вследствие ее гипоксического и лекарственного повреждения, что в целом ухудшает прогноз [3].
Целью настоящей работы стала оценка применения препарата Лаеннек у пациентов среднего и пожилого возраста с достаточно длинным и застойным течением COVID-19, дисфункцией печени и высоким риском «цитокинового шторма», а также с высокой коморбидной нагрузкой (хронические заболевания у 11 из 14 (79%) пациентов) [8].
МАТЕРИАЛ И МЕТОДЫ
В исследование была включена группа пациентов со средним/тяжелым течением COVID-19, которые проходили лечение в COVID-центре, развернутом на базе Российского геронтологического научно-клинического центра (РГНКЦ). Под наблюдением находились 14 пациентов (6 мужчин и 8 женщин в возрасте 39—86 лет), 6 из которых страдали ишемической болезнью сердца (ИБС), 4 — сахарным диабетом 2 типа (СД2), одна пациентка — склеродермией. Диагнозы больных кодировали как U07.1—U08.1, базисную терапию осуществляли согласно Временным методическим рекомендациям по лечению COVID-19 Минздрава России (Версия 4 от 27.03.2020).
Пациенты характеризовались дисфункцией печени (средние значения АЛТ 113±121 ед./л, АСТ — 90,8±87,8 ед./л) и высоким риском «цитокинового шторма»: СРБ 5—52,6 мг/л, относительное содержание лимфоцитов менее 25% у 10 из 14 пациентов, ферритин 480—1762 мкг/л у мужчин и 274,7—493 мкг/л у женщин при норме 20—250 мкг/л и 10—120 мкг/л соответственно. Общий и биохимический анализы крови проводились с использованием стандартных методик, ферритин определялся спектрофотометрически, методом иммуноферментного анализа.
С первого дня заболевания все больные отмечали жалобы на отсутствие аппетита, нарастающую непреодолимую слабость, не исчезающую после сна, потливость, боли в мышцах. У всех были отмечены потеря обоняния, кашель со скудной мокротой, признаки конъюктивита. При осмотре отмечалась одышка в покое, усиливающаяся при нагрузке (ходьба, подъем по лестнице). Пациенты были малоактивны, быстро уставали, имели повышенную температуру тела (37—39°), бледность кожных покровов, учащенное дыхание. Полусидячее положение облегчало дыхание.
При поступлении в РГНКЦ частота дыхания у пациентов составляла 26—30 раз/мин, наблюдались сниженная оксигенация крови (SpO2 <90%), сниженное парциальное давление кислорода (РаО2 <60 мм рт.ст.), сниженное систолическое артериальное давление (САД, менее 100 мм рт.ст.). Троим пациентам из 14 потребовалось применение искусственной вентиляции легких (ИВЛ), остальные получали высокопоточную назальную оксигенацию. До применения препарата Лаеннек у 6 из 14 пациентов отмечалось отсутствие какой-либо положительной динамики в течение 1—2 нед.
Оценку состояния тяжести пациентов проводили посредством компьютерной томографии (КТ). У больных были зарегистрированы двухсторонние изменения с преимущественным поражением нижних долей (более 3 очагов уплотнения по типу «матовое стекло» с максимальным диаметром <3 см в сочетании с очагами консолидации). По данным КТ оценивалась общая площадь повреждений (0—100%) и степень повреждения в баллах (0—5 баллов). Степень повреждения вычислялась как среднее по каждой из пяти долей легких (1 балл — вовлечено <5% ткани, 2 балла — 5—25%; 3 балла — 26—49%; 4 балла — 50—75%; 5 — >75%).
Пациенты были госпитализированы на 5—10 день от начала заболевания, что соответствует стадии прогрессирования (5—8 дни заболевания) и пиковой стадии COVID-19 (10—13 дни заболевания). По данным КТ, стадия прогрессирования характеризовалась увеличением распространенности симптома матового стекла, локальных ретикулярных изменений и появлением очагов консолидации. На пиковой стадии на КТ отмечалось формирование перилобулярных уплотнений.
В дополнение к стандартной рекомендованной терапии больным назначали полипептидный препарат Лаеннек, зарегистрированный в России в качестве гепатопротектора и иммуномодулятора. В зависимости от тяжести состояния пациента Лаеннек применялся от 3 до 10 сут (6 мл на 350 мл 0,9% раствора NaCl, внутривенно капельно, ежедневно). Пациенты были выписаны после комплексной оценки общего состояния с учетом данных биохимии крови, оксигенации крови, в стадии разрешения пневмонита по КТ.
Для стандартной обработки результатов исследования использовались методы математической статистики, включающие расчет числовых характеристик случайных величин, проверки статистических гипотез с использованием параметрических и непараметрических критериев, корреляционного и дисперсионного анализа. Сравнение прогнозируемых и наблюдаемых частот встречаемости исследуемых признаков проводилось с помощью критерия Хи-квадрат (χ2), T-критерия Вилкоксона—Манна—Уитни и теста Стьюдента. Использовалась прикладная программа STATISTICA 10.0 и электронные таблицы Microsoft Excel.
Помимо стандартных методов статистики, в ходе исследования были использованы современные методы интеллектуального анализа данных, в том числе метод анализа метрических сгущений в пространстве параметров, метод метрических карт [7] и методы прогнозирования числовых таргетных переменных [8, 9]. Математические детали использованных методов (в том числе сравнение с другими подходами и алгоритмами) приведены в нашем цикле работ по топологическому анализу данных [7—9]. Метод анализа метрических сгущений отличается высокой чувствительностью и позволяет детектировать кластеры (сгущения) точек, даже если различия в плотности точек не превышают нескольких процентов.
РЕЗУЛЬТАТЫ
Применение препарата Лаеннек приводило к положительной клинической динамике, снижению уровней ферритина, увеличению оксигенации крови до диапазона нормы, уменьшению площади повреждения легких по данным КТ, повышению процента лимфоцитов, нормализации маркеров дисфункции печени (АСТ, АЛТ), креатинина и САД (p <0,05 для всех показателей). Все пациенты достигли устойчивой ремиссии в течение 3—15 дней после начала применения Лаеннека и были выписаны с отрицательным тестом на SARS-CoV-2 под наблюдение врача по месту жительства для дальнейшей реабилитации.
Применение препарата Лаеннек приводило к комплексным изменениям значений показателей состояния пациентов, которые приведены на метрической карте (рис. 1).

Метрическая карта клинического исследования представляет собой наглядную диаграмму, на которой каждому из исследованных показателей состояния (например, уровню ферритина) соответствуют две точки на плоскости — значения показателя до и после терапии («ферритин, исх.» и «ферритин, после»).
Расстояние между любыми двумя точками метрической карты отражает степень ассоциации показателей. Сгущения (кластеры) точек соответствуют показателям, значения которых тесно взаимодействуют друг с другом.
Метрические карты позволяют изучать не только комплексные взаимосвязи между показателями состояния пациентов [9, 10], но и проводить комплексную оценку эффективности терапии, а также выбирать наиболее информативные предикторы для прогнозирования эффективности терапии и респондеров/нон-респондеров (см. далее). При низкой эффективности терапии (с точки зрения всех исследованных параметров) положение точек практически не изменяется, и сохраняется единственный кластер параметров. Эффективная терапия приводит к существенной перегруппировке точек, соответствующих исследуемым параметрам, в отдельные кластеры.
В настоящем исследовании установлено четкое разделение метрической карты на кластер значений параметров до начала терапии и кластер значений параметров после терапии (см. рис. 1А). Иначе говоря, в результате применения препарата Лаеннек у больных с достаточно тяжелым течением COVID-19 происходит согласованное комплексное изменение многих показателей состояния, соответствующее движению точек «слева направо» на метрической диаграмме (см. рис. 1Б).
Как показывает анализ отдельных параметров, это комплексное изменение свидетельствует об отчетливой положительной динамике состояния пациентов — уменьшении воспаления, улучшении функции легких, снижении маркеров дисфункции печени и почек.
Прежде всего терапия препаратом Лаеннек пациентов с COVID-19 приводила к достоверному снижению уровней маркеров воспаления (ферритин, СРБ) и повышению относительного содержания лимфоцитов (рис. 2). Достоверные улучшения этих параметров наблюдались как во всей группе пациентов, так и в подгруппах мужчин и женщин. В среднем по всей группе ферритин снижался от 675±433 до 432±192 мкг/л (р=0,039). При этом достоверное снижение ферритина наблюдалось и у мужчин (от 910±473 до 462±145 мкг/л; р=0,033), и у женщин (от 372±86 до 244±140 мкг/л; p=0,034).
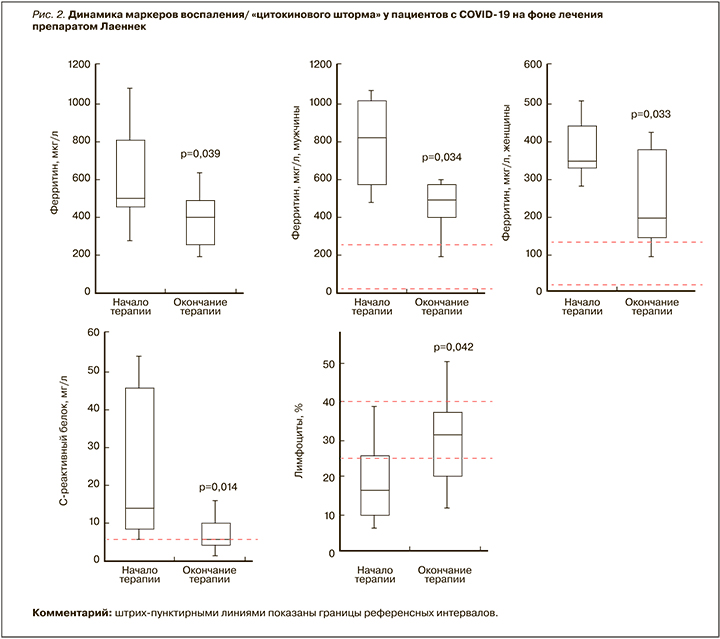
Уровни СРБ, являющегося белком острой фазы воспаления, снижались с 23,1±18,9 до 9,0±6,8 мг/л (p=0,014). Хотя после окончания терапии уровни СРБ достигли верхнего интервала нормы (5 мг/л) только у 4 из 14 пациентов, медианное значение этого показателя (6 мг/мл) существенно приблизилось к референсному интервалу по сравнению с исходным медианным значением (14,2 мг/мл).
Относительное содержание лимфоцитов (LYM%), указывающее на состояние противовирусного иммунитета, достоверно повышалось от 20,0±10,9 до 27,8±11,6% после лечения препаратом Лаеннек (р=0,042). До начала лечения значения LYM% более 25% (нижняя граница референсного интервала) были выявлены только у 3 пациентов, а после лечения — у 9. Этот результат соответствует достоверному снижению риска значений LYM% менее 25% по тесту χ2 (ОШ 0,15; 95% ДИ 0,03—0,81, p=0,022), т.е. активации противовирусной системы организма.
Снижению маркеров воспаления соответствовала положительная клиническая динамика — увеличение степени оксигенации крови по данным пульсоксиметрии (SpO2), снижение степени и площади поражения легких по данным КТ, уменьшение жалоб на непреодолимую слабость (рис. 3).
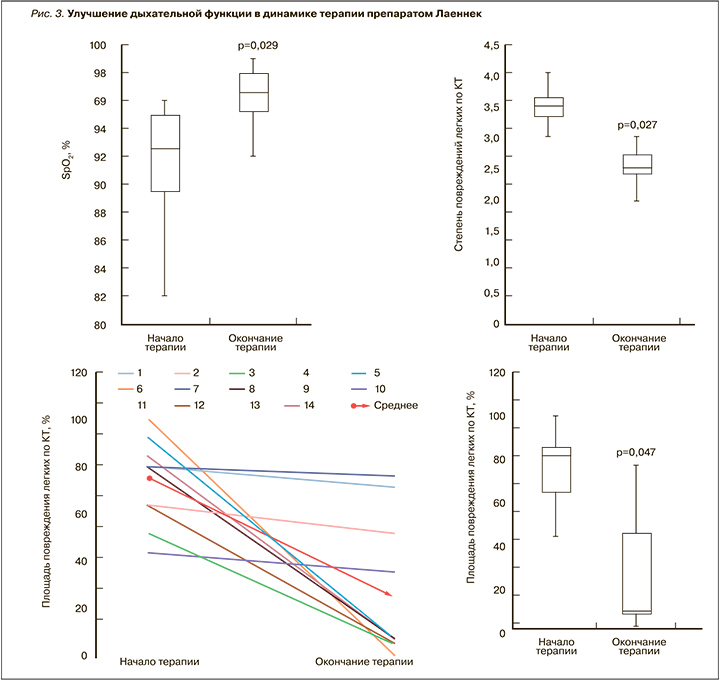
Терапия препаратом Лаеннек приводила к повышению степени оксигенации крови SpO2 от 91,4±4,6 до 96,2±3,2% (p=0,0029). Значения SpO2 менее 95%, соответствующие дыхательной недостаточности, были отмечены у 11 пациентов до начала терапии и только у 3 после терапии, что указывает на 13-кратное снижение риска дыхательной недостаточности (ОШ 0,07; 95% ДИ 0,01—0,45, р=0,0025). Заметим, что уже со второго дня терапии препаратом Лаеннек было установлено достоверное снижение частоты дыхания с 18,9±2,4 до 17,5±1,2 раз/мин (p=0,029); у пациентов улучшился сон и повысилось настроение.
Улучшение оксигенации крови сопровождалось снижением степени поражения легких по данным КТ (снижение балла от 3,35±0,50 до 2,71±0,61, p=0,0027) и снижением площади поражения легких по данным КТ от 73,4±17,2 до 63,1±13,9% (p=0,047). На фоне объективного улучшения дыхательной функции отмечено и снижение жалоб пациентов на непреодолимую слабость: до начала терапии на общую слабость жаловались 9 пациентов, после терапии — только 2 (11-кратное снижение риска, ОШ 0,09; 95% ДИ 0,01—0,59, p=0,0068).
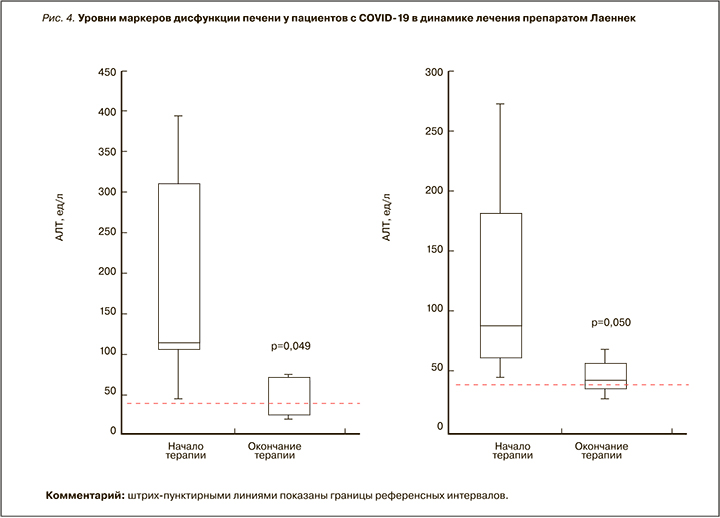
Применение препарата Лаеннек привело к достоверным улучшениям маркеров состояния печени. Уровни АСТ снижались от 121,3±102,5 до 45,7±15,7 ед./л (p=0,050). Исходно повышенные уровни АСТ (более 40 ед./л) были выявлены у 14 пациентов, после лечения — только у 7 (ОШ 0,07; 95% ДИ 0,007—0,70, p=0,0091). Уровни АЛТ снижались от 164±155 до 49±28 ед./л (р=0,049). При этом абнормально высокие уровни АЛТ (более 41 ед./л) были установлены у 13 пациентов на момент начала терапии и у 8 больных после применения препарата Лаеннек (ОШ 0,10; 95% ДИ 0,01—1,00, p=0,029) (рис. 4).
Также было отмечено улучшение азотовыделительной функции почек в виде снижения креатинина с 105,3±87,8 до 20,5±9,2 мкмоль/л (p=0,049).
ОБСУЖДЕНИЕ
Проведенные нами ранее исследования состава Лаеннека указали целесообразность применения препарата у пациентов с COVID-19. В самом деле в составе препарата были найдены пептиды-ингибиторы белка IKKB, способствующие снижению системного воспаления за счет ингибирования каскада NF-kB, значительное количество иммуномодулирующего микроэлемента цинка, который необходим для активации врожденных систем противовирусной защиты при COVID-19 (11), а также пептиды-ингибиторы ряда киназ протеома человека, способствующие снижению воспаления, и др. Клинический опыт применения препарата Лаеннек указывает на нормализацию уровней провоспалительных цитокинов ИЛ-6, ФНО-α и значительное снижение уровней ферментов АСТ, АЛТ [7]. Поэтому мы предположили, что противовоспалительное действие Лаеннека может эффективно тормозить формирование опасного для жизни «цитокинового шторма» у пациентов с тяжелым течением COVID-19.
В настоящей работе в качестве биомаркеров «цитокинового шторма» мы изучали ферритин, СРБ и относительное содержание лимфоцитов в динамике лечения препаратом Лаеннек. Известно, что у пациентов с тяжелым течением COVID-19 отмечаются повышенные уровни ферритина, ассоциированные с высокой летальностью [12, 13]. Ферритин — белок-переносчик железа, найденный практически во всех тканях. В норме его уровни в крови составляют 10—120 мкг/л у женщин и 20—250 мкг/л у мужчин. Повышенные уровни ферритина в сыворотке крови не только связаны с нарушениями накопления железа в организме (гемохроматоз и др.), но и свидетельствуют о воспалении, сопровождающем тяжелое течение ОРВИ, дисфункцию печени, аутоиммунные или опухолевые заболевания и др.
У пациентов с COVID-19 уровни ферритина резко возрастают и вследствие острой фазы воспаления, и вследствие массовой гибели эритроцитов, при которой образуется так называемый катаболический ферритин. При выполнении биохимического анализа крови невозможно отличить «провоспалительный» ферритин от «катаболического». Тем не менее общий ферритин служит эффективным маркером тяжести коронавирусной инфекции: у пациентов с легким течением COVID-19 были отмечены более низкие уровни ферритина в сыворотке крови (в среднем на -398 мкг/л, р <0,001) [14, 15]. В настоящем исследовании установлено достоверное снижение общего ферритина в динамике лечения (у мужчин на -386 мкг/л, у женщин на -80 мкг/л).
В результате применения препарата Лаеннек обнаружена положительная динамика СРБ — маркера острой фазы воспаления, вырабатываемого в печени. Метаанализ, включивший 16 исследований пациентов с COVID-19 (n=3962), подтвердил, что для пациентов с менее тяжелым течением заболевания характерны более низкие уровни СРБ (-41,8 мг/л, p <0,001) и других маркеров воспаления (ИЛ-6, скорость оседания эритроцитов, ферритин) [15]. В настоящем исследовании исходные значения СРБ у всех обследованных были очень высокими (23,1±18,9 мг/л при норме 0—5 мг/л, уровни более 5 мг/л найдены у 12 из 14 пациентов); это свидетельствует о чрезвычайной активности воспалительного процесса, что предрасполагает к образованию микротромбов в микрососудистой сети легких и других тканях. Соответственно снижение СРБ в ходе терапии до 9,0±6,8 мг/л (p=0,014) указывает не только на угасание «цитокинового шторма», но и снижение риска тромботических осложнений COVID-19.
Повышенные уровни СРБ, лейкоцитопения и лимфоцитопения — важные особенности течения COVID-19 [16, 17]. В начале лечения относительное содержание лимфоцитов (LYM%) составило 20,0±10,9%, причем в диапазоне нормы (25—40%) значения LYM% были установлены только у 3 пациентов. Варианты течения СOVID-19, сопровождающиеся снижением содержания лимфоцитов в крови, соответствуют повышенному риску затяжного течения заболевания и снижению темпов реабилитации. Терапия препаратом Лаеннек приводила к достоверному повышению LYM% до 27,8±11,6% (p=0,042).
Повышение содержания лимфоцитов в крови — показатель активации противовирусной защиты организма. Как было отмечено ранее, в препарате Лаеннек найдено значительное количество цинка, который стимулирует белки интерфероновой защиты организма от одноцепочечных РНК-вирусов, к которым относится и SARS-CoV-2 [4].
Кроме того, в составе препарата Лаеннек содержатся 14 пептидов, характеризующихся противовирусными эффектами на всех стадиях жизненного цикла ДНК-/РНК-вирусов. Пептиды Лаеннека могут тормозить активацию вирусов внутри клетки (специфическое ингибирование клеточного белка HCFC1), слияние вирусной оболочки с плазматической мембраной на стадии инфицирования вирусом клетки-хозяина (ингибирование клеточного белка CD4), репликацию вируса (ингибирование белка CTBP1), созревание вириона (ингибирование белков CRM1, VPS4B, TPR, пролин изомеразы), отпочкование вирусных частиц от клеточной мембраны (ингибирование белка NEDD4) [18]. Таким образом, повышение процентного содержания лимфоцитов может быть связано с противовирусным действием пептидов и цинка в составе препарата.
Преодоление «цитокинового шторма» и активация противовирусного иммунитета ассоциированы с улучшением дыхательной функции. Степень оксигенации крови SpO2 служит неинвазивным, но достаточно объективным методом оценки дыхательной недостаточности. Улучшение оксигенации крови в динамике лечения препаратом Лаеннек с 91,4±4,6 до 96,2±3,2% (p=0,0029; уровни SpO2 >95% были достигнуты у 11 из 14 пациентов) следует рассматривать как восстановление нормального газообмена между альвеоцитами и эритроцитами. Оцененные по данным КТ сокращение степени (-0,64 балла, p=0,0027) и площади поражения легких (-10,4%, р=0,047) соответствуют хорошему темпу регенерации ткани легких в результате лечения. Этот вывод подтверждается достоверным снижением жалоб пациентов на непреодолимую слабость (11-кратное снижение риска, p=0,0068).
Заметим, что препарат Лаеннек способствует повышению регенераторных возможностей организма и используется в терапии синдрома хронической усталости (СХУ). Положительные эффекты препарата при этом состоянии связаны, в частности, с модуляцией функции митохондрий. В составе препарата Лаеннек найдены пептиды PGVSCR, HMVLLH, EALPGPL, LPGPLNP и др., способствующие:
- торможению апоптоза клеток в условиях оксидативного/токсического стресса (за счет активации антиапоптотического белка BcL-2);
- снижению гиперинсулинемии (активация рецептора PPARA);
- повышению интенсивности энергетического метаболизма митохондрий (ингибирование МАР-киназ и киназ пируватдегидрогеназы).
Кроме того, Лаеннек содержит биологически активные пептиды, стимулирующие регенерацию поврежденных тканей и улучшающие реакцию организма на стресс (фрагменты проэнкефалина A, пептиды—ингибиторы киназ CDK1, IKKB и mTOR). В эксперименте были показаны геропротекторные свойства Лаеннека: его добавление увеличивало продолжительность жизни модельных животных C.Elegans на 92% по сравнению с контролем, в том числе в условиях продолжительного оксидативного стресса [11].
Применение препарата Лаеннек привело к достоверному улучшению значений маркеров состояния печени (уровни АЛТ, АСТ) и почек (уровни креатинина). Следует подчеркнуть, что инфекция COVID-19 ассоциирована с полиорганной патологией, следовательно, хронические коморбидные заболевания не только утяжеляют течение коронавирусной инфекции, но и сам вирус SARS-CoV-2 стимулирует или усугубляет повреждения органов.
На фоне COVID-19 отмечаются дисфункция печени (повышение уровней маркеров АСТ, АЛТ, альбумина, билирубина) [3], почек (протеинурия, гематурия) [19] и выраженные нарушения коагуляционного профиля крови (в том числе повышение уровней D-димера и продуктов деградации фибрина) [2], что ассоциировано с более высоким риском смертности от этой инфекции. Дисфункция печени встречается у 24—37% пациентов с COVID-19 [20], дисфункция почек — у 27—44% [19].
В настоящем исследовании дисфункция печени наблюдалась у всех пациентов (повышенные уровни АСТ и АЛТ). Применение препарата Лаеннек приводило к достоверному снижению АСТ и АЛТ у всех пациентов, причем интервалы норм АСТ/АЛТ были достигнуты у половины больных. Этот результат был вполне ожидаем, поскольку Лаеннек зарегистрирован как гепатопротектор (АТХ A05BA). В эксперименте и клинической практике показано, что препарат устраняет гемосидероз (хроническую перегрузку железом) печени, снижает повреждения гепатоцитов и клеток других органов. В эксперименте продемонстрировано кардиопротекторное действие Лаеннека на модели адреналинового повреждения сердца и увеличение антиоксидантного ресурса крови [6]. Молекулярные механизмы регенераторного действия препарата на различные ткани были нами описаны выше [21].
Острая почечная недостаточность является важным фактором риска смертности пациентов с COVID-19 [19]. На момент начала лечения уровни креатинина у обследованных нами пациентов были выше верхних границ референсных интервалов (у мужчин 62—106 мкмоль/л, у женщин 44—80 мкмоль/л) у 5 человек. Использование препарата Лаеннек способствовало достоверному снижению креатинина с 105,3±20,5 до 87,8±9,2 мкмоль/л (р=0,049), т.е. в сторону диапазонов значений, соответствующих референсным интервалам. Таким образом, Лаеннек способствовал улучшению функции почек у пациентов с COVID-19.
Также заметим, что анализ метрической карты (см. рис. 1), отражающей динамику состояния пациентов в ходе терапии, позволяет строить эффективные алгоритмы предиктивного моделирования различных параметров на момент окончания лечения. Такие алгоритмы, основанные на топологической теории распознавания [22, 23], дают возможность оценить эффективность терапии COVID-19 препаратом Лаеннек на основании исходных данных у конкретного пациента.
В частности, получены и верифицированы (в кросс-валидации) модели прогнозирования длительности госпитализации (коэффициент корреляции r(c)=0,73), уровней ферритина (r(c)=0,49), СРБ (r(c)=0,50), АЛТ (r(c)=0,62), креатинина (r(c)=0,54), гемоглобина (r(c)=0,84), тромбоцитов (r(c)=0,57), относительного содержания лимфоцитов (r(c)=0,65) и таких важных показателей дыхательной функции, как SpO2 (r(c)=0,88), частоты дыхания (r(c)=0,50), степени повреждений по КТ (r(c)=0,51) и площади поражения по КТ (r(c)=0,87). Разработанные алгоритмы предиктивного моделирования являются темой отдельной статьи.
ЗАКЛЮЧЕНИЕ
В настоящее время тестируются различные подходы к фармакотерапии COVID-19. Принятие решений о выборе фармакотерапии должно учитывать все важные особенности этой инфекции и прежде всего ее тяжелое течение на фоне коморбидных патологий. Общеизвестно, что большинство лекарств, использующихся в терапии вирусных заболеваний, отличается высокой токсичностью и не всегда может быть использовано у пациентов с дисфункцией печени, ИБС, СД2 и другими хроническими заболеваниями. Поэтому при тяжелом течении COVID-19, особенно на неблагоприятном коморбидном фоне, существенно повышаются требования к безопасности выбираемой фармакотерапии.
Полипептидный препарат Лаеннек отличается хорошим профилем безопасности, высокой степенью фармацевтической стандартизации [1] и характеризуется выраженными гепатопротекторными, противовоспалительными и иммуномодулирующими свойствами [18, 21].
Применение препарата Лаеннек в терапии COVID-19 у пациентов с коморбидной нагрузкой (ИБС, СД2), дисфункцией печени (повышение АСТ, АЛТ в 2—3 раза) и высоким риском «цитокинового шторма» (повышение СРБ, ферритина, снижение относительного содержания лимфоцитов) привело к положительной клинической динамике и улучшению практически всех исследованных лабораторных показателей.
Особенно важно отметить снижение уровней ферритина (р=0,039), увеличение оксигенации крови до диапазона нормы (р=0,0029) и снижение площади повреждения легких по данным КТ (р=0,0027). Устойчивая ремиссия была достигнута у всех больных в течение 3—15 дней после начала применения препарата Лаеннек, пациенты были выписаны с отрицательным тестом на вирус SARS-CoV-2. Собранные данные позволят разработать алгоритмы предиктивного моделирования эффективности терапии COVID-19 препаратом Лаеннек.


