Хроническая обструктивная болезнь легких (ХОБЛ) – заболевание с высоким уровнем распространенности, инвалидизации и ожидаемым ростом заболеваемости в течение следующих 25 лет, который связан с увеличением количества курильщиков в развивающихся странах и продолжающимся старением популяции в регионах с высоким уровнем жизни. Так, по результатам анализа, опубликованного в журнале Lancet в 2017 г., на 2015 г. ХОБЛ в мире страдали около 174 млн человек [1]. По данным ВОЗ (Исследования глобального бремени болезни), в 2016 г. распространенность этой болезни в мире была на уровне 251 млн случаев. Согласно оценкам ВОЗ, 3,17 млн человек в мире умерли от ХОБЛ в 2015 г., что составило почти 5% всех случаев смерти в мире в том году [2]. При этом смертность от ХОБЛ продолжает расти: заболевание поднялось на третье место в списке ведущих причин смертности в мире и уступает только сердечно-сосудистым заболеваниям (ССЗ) [3].
Необходимо учитывать, что ХОБЛ – системное заболевание с множественными внелегочными проявлениями, представленными наиболее частыми заболеваниями сердечно-сосудистой системы (ишемической болезнью сердца, хронической сердечной недостаточностью), на долю которых, по некоторым данным, приходится около 62 % смертельных случаев у больных ХОБЛ [4]. Также к коморбидной патологии при ХОБЛ относятся метаболические нарушения, остеопороз, болезни опорно-двигательного аппарата, заболевания желудочно-кишечного тракта, тревожно-депрессивные расстройства, когнитивные нарушения [5]. Проблема коморбидности в последнее время заняла значимое место в связи с увеличением продолжительности жизни населения: так, средний возраст пациента с ХОБЛ составляет около 55–70 лет. [6]. У пациентов с этой болезнью в 54% случаев имеется не менее 4 сопутствующих заболеваний [5]. В исследовании Echave J.M. et al. изучалась частота сопутствующей патологии у больных ХОБЛ (977 пациентов, возраст 70,1±9,8). При расчете индекса Charlson коморбидные состояния выявлены у 65,7% исследуемых [7, 8].
ХОБЛ и степень снижения легочной функции независимо связаны с увеличением риска сердечно-сосудистых событий [9, 10]. Установлено, что снижение основного показателя бронхообструкции – объема форсированного выдоха за первую секунду (ОФВ1) – является столь же сильным предиктором сердечно-сосудистой смертности, как и основные факторы сердечно-сосудистого риска (ССР). В исследовании The Lung Health Study (5887 курильщиков, возраст 35–60 лет, умеренная степень бронхиальной обструкции) установлено, что при снижении ОФВ1 на 10% фиксируется возрастание показателя общей смертности на 14%, сердечно-сосудистой смертности – на 28%, риска развития ишемической болезни сердца (ИБС) – на 20% [11]. Риск развития ССЗ у пациентов с ХОБЛ превышает таковой у пациентов той же возрастной группы без ХОБЛ с учетом анамнеза курения в 2–3 раза [12]. ССЗ распространены при любой стадии ХОБЛ, но чаще всего они остаются не диагностированными, и пациенты остаются без своевременно назначенной терапии [13].
В настоящее время достаточно четко установлены общие патогенетические механизмы развития и прогрессирования ХОБЛ и сердечно-сосудистой патологии:
- воспаление на легочном и системном уровне;
- оксидативный стресс и дисбаланс в системе оксидант/антиоксидант;
- эндотелиальная дисфункция и сосудистое повреждение с акцелерацией процессов атерогенеза;
- нейрогуморальная активация (активация ренин-ангиотензин-альдостероновой и симпатоадреналовой систем) [14].
ХОБЛ признается полиорганной (системной) патологией с коморбидными ССЗ. Основными патогенетическими механизмами развития и прогрессии этой коморбидной патологии выступают системное воспаление и оксидативный стресс [15, 16]. Эпицентром воспаления и оксидативного повреждения у больных ХОБЛ являются легкие с распространением воспалительных цитокинов в кровоток («spill over» эффект – эффект «перелива»), что ведет к формированию системного воспаления [16–19]. Воспалительные стимулы приводят к кардиореспираторному повреждению: снижению легочной функции, легочному ремоделированию (эмфизема и гиперинфляции, фиброз), сосудистому повреждению и атерогенезу с дальнейшим развитием ССЗ.
Таким образом, не вызывает сомнений, что ХОБЛ – состояние, связанное с высоким риском сердечно-сосудистых событий. Однако ХОБЛ как заболевание не входит в шкалы стратификации ССР и его наличие не учитывается при формировании профилактических стратегий.
В связи с вышеизложенным было сформулирована цель настоящего исследования – рассчитать ССР у больных ХОБЛ с помощью стандартных шкал и методик и оценить адекватность используемых профилактических стратегий в этой группе пациентов.
МАТЕРИАЛ И МЕТОДЫ
Основная группа (пациенты с ХОБЛ) была сформирована в результате проведения скрининга в случайной выборке 1000 человек в возрасте от 40 до 75 лет прикрепленного населения амбулаторного учреждения ведомственного подчинения. Группа обследуемых была лишена профессиональных факторов риска развития ХОБЛ, имела высокий социально-экономический статус и образовательный уровень (94% с высшим образованием). Подробное описание методологии скрининга и формирования группы представлено в предыдущей статье [20]. В результате была сформирована группа больных ХОБЛ из 41 человек. Для сравнительного анализа была подобрана контрольная группа, сопоставимая по демографическим показателям (полу, возрасту) и статусу курения.
Лабораторное исследование включало определение следующих показателей: общий анализ крови, общий анализ мочи, общий холестерин (ОХС), холестерин липопротеинов низкой плотности (ХС ЛПНП), триглицериды, креатинин с расчетом скорости клубочковой фильтрации (СКФ) по формуле CKD-EPI (2009). Для оценки системного воспаления в сыворотке крови определяли высокочувствительный С-реактивный белок (вч-СРБ) иммунотурбодиметрическим методом.
Наряду с этим проводилось спирометрическое исследование на оборудовании Spirolab III (MIR (МИР), Италия). Для оценки обратимости обструкции всем обследуемым выполнялся бронходилатационный тест с β2-агонистом короткого действия (сальбутамол 400 мкг через дозированный аэрозольный ингалятор). Все пациенты проходили оценочный тест ХОБЛ – COPD Assessment Test (CAT), а также заполняли вопросник для диагностики ХОБЛ – Chronic Airways Diseases, A Guide for Primary Care Physicians, 2005 (CAD) [21,22].
Для оценки ССР в исследуемых группах на первом этапе выделялись категории высокого и очень высокого риска (больные с ССЗ, сахарным диабетом, хронической болезнью почек или очень высокими уровнями отдельных факторов риска) в соответствии с текущими рекомендациями [23].
Далее оставшимся после первичного отбора участникам исследования было произведено определение риска по шкале SCORE, которая оценивает риск смерти от ССЗ (включая коронарные события, аневризму брюшного аорты, мозговой инсульт). Измерение ССР по шкале SCORE базируется на пяти факторах: это пол, возраст, курение, уровень систолического АД (САД) и ОХС. Риск считается очень высоким, если показатель составляет более 10 %, высоким – при 5–10 %. ССР считается умеренным и низким, если этот показатель ниже 5 % [23].
Также нами использовалась шкала риска Рейнольдса для оценки риска ССЗ, которая учитывает пол, возраст, САД, ОХС, холестерин липопротеидов высокой плотности (ХС ЛПВП), СРБ, инфаркт миокарда в анамнезе у ближайших родственников (отец, мать) до 60 лет, курение, уровень гликированного гемоглобина у пациентов, страдающих сахарным диабетом.
Для оценки коморбидной патологии применялся индекс коморбидности Charlson, предложенный в 1987 г. Он представляет собой систему оценки наличия определенной сопутствующей патологии с учетом возраста пациента. Коморбидной патологии присвоено определенное количество баллов; с учетом возраста пациента добавляется 1 балл на каждую декаду жизни после 40 лет [24].
При статистическом анализе для описания использовали медиану, первый и третий квартиль. Согласно критерию Колмогорова–Смирнова, выборки имели преимущественно нормальное распределение. При сравнении двух независимых выборок применяли U-критерий Манна–Уитни. Сравнение двух независимых выборок, сводимых к дихотомическим, проводили по двустороннему точному критерию Фишера. Сравнение нескольких независимых выборок было осуществлено путем сравнения посредством однофакторного дисперсионного анализа с поправкой Бонферрони (выборки имели нормальное распределение). Корреляционный анализ выполнялся методом Спирмена. Статистически значимыми считались различия при p <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Сравнительная характеристика основной (пациенты с ХОБЛ) и контрольной групп исследования представлена в таблице 1.
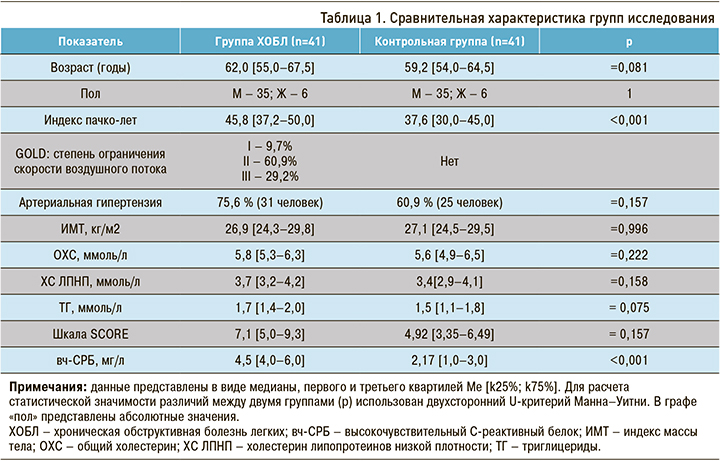
Статистически значимых различий между группами по полу, по возрасту, индексу массы тела (ИМТ) не было. По распространенности АГ показатель не достиг статистической значимости, однако встречаемость этого ССЗ в группе больных ХОБЛ была на 15% выше, чем в контрольной группе.
Контрольная группа, не имеющая диагноза ХОБЛ, отличалась от группы ХОБЛ индексом пачко-лет – 37,6 [30,0–45,0] и 45,8 [37,2–50,0], соответственно (р <0,001). По уровню вч-СРБ также были получены статистически значимые различия: в контрольной группе этот показатель составил 2,17 [1,0–3,0] мг/л, а в группе ХОБЛ – 4,5 [4,0–6,0] мг/л (р <0,001).
При первичной оценке ССР 36,5 % пациентов с ХОБЛ и 24,4% лиц контрольной группы автоматически относились к категории высокого и очень высокого ССР виду наличия ССЗ, сахарного диабета и/или хронической болезни почек и не нуждались в применении шкалы SCORE. При расчете риска фатальных сердечно-сосудистых событий по шкале SCORE у всех больных ХОБЛ выявлен высокий и очень высокий риск (7,1 [5,0–9,3]), значительно превышающий аналогичный показатель контрольной группы (4,92 [3,35–6,49]). ССР возрастал по мере прогрессирования ХОБЛ: GOLD I–II – 6,7%, GOLD III – 9,0%. Это указывает на возрастающую вероятность фатальных сердечно-сосудистых событий (табл. 2).
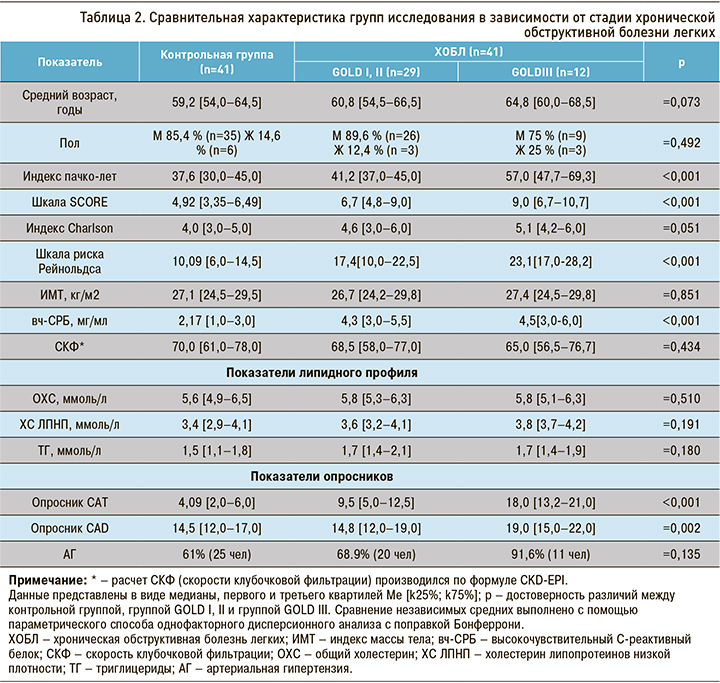
При анализе изучаемых показателей в зависимости от степени тяжести ХОБЛ с данными контрольной группы обращало на себя внимание увеличение по мере прогрессирования заболевания показателя системного воспаления (вч-СРБ), что согласуется с литературными данными.
При проведении корреляционного анализа по Спирмену между уровнем вч-СРБ и степенью тяжести ХОБЛ коэффициент корреляции r составил 0,518, что соответствует среднему уровню корреляционной связи. Связь между исследуемыми признаками прямая, зависимость признаков статистически значима (p <0,05).
Статистические значимые отличия получены для калькуляторов ССР (шкала SCORE, шкала Рейнольдса), показатели которых также увеличивались по мере прогрессирования ХОБЛ. Это еще раз подчеркивает важность оценки этих шкал у больных ХОБЛ, не имеющих сердечно-сосудистой патологии.
 Получены статистически значимые и ожидаемые различия по вопросникам САТ (p <0,001), CAD (p=0,002) в сравнении с курящими пациентами без ХОБЛ. Оценочный тест САТ используется для оценки степени влияния ХОБЛ на качество жизни пациента, CAD применяется для диагностики ХОБЛ; результаты этих тестов также изменялись по мере прогрессирования заболевания.
Получены статистически значимые и ожидаемые различия по вопросникам САТ (p <0,001), CAD (p=0,002) в сравнении с курящими пациентами без ХОБЛ. Оценочный тест САТ используется для оценки степени влияния ХОБЛ на качество жизни пациента, CAD применяется для диагностики ХОБЛ; результаты этих тестов также изменялись по мере прогрессирования заболевания.
Согласно полученным результатам в процессе прогрессировании ХОБЛ увеличивается и число пациентов с АГ. Частота встречаемости АГ среди пациентов с легкой и среднетяжелой степенью ограничения скорости воздушного потока составляет 68,9%, а при тяжелой степени – более 90%. Эти показатели значительно превышают значения в контрольной группе (61%). При проведении корреляционного анализа по Спирмену получен коэффициент корреляции r=0,723, зависимость признаков статистически значима (p <0,05), связь прямая. Согласно общей классификации корреляционных связей (Ивантер Э.В., Коросов А.В., 1992 г.), связь АГ и степени тяжести ХОБЛ определяется как сильная.
Данные ранее проведенного исследования ECLIPSE показывают, что у пациентов с ХОБЛ основным фактором ССР выступает АГ, распространенность которой составляла 43%. Это значительно ниже, чем в нашем исследовании [25].
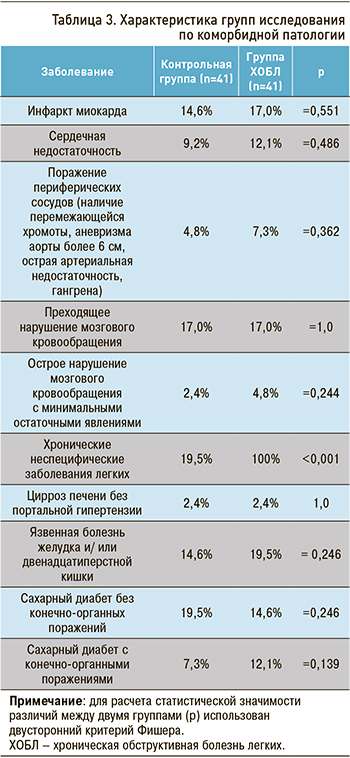
При анализе коморбидной патологии в основной и контрольной группах получены клинически значимые, но статистически недостоверные данные, подтверждающие более высокую встречаемость сердечно-сосудистой патологии среди больных ХОБЛ (табл. 3).
Индекс коморбидности Charlson показал прямую зависимость от степени тяжести ХОБЛ: он увеличивался в зависимости от стадии прогрессирования ХОБЛ и статистически значимо превышал показатель контрольной группы (см. табл. 3, 4).
В ранее выполненном исследовании индекс коморбидности Charlson составлял для GOLD II 4,23±1,33 балла, для GOLD III – 4,51±1,3 балла [26].
 В настоящее время не вызывает сомнений, что ХОБЛ служит независимым фактором риска развития ССЗ и фатальных сердечно-сосудистых событий. Однако ХОБЛ не включена в существующие шкалы стратификации ССР, и не существует рутинной клинической практики расчета риска сердечно-сосудистых осложнений у больных изолированной ХОБЛ без диагностированной сердечно-сосудистой патологии. Поэтому для нас представлял практический интерес анализ показаний к назначению и частоты использования гиполипидемической терапии у больных ХОБЛ, а также оценка достижения целевых показателей липидного спектра. В работе использовались клинические рекомендации по первичной и вторичной профилактике ССЗ 2016 и 2017 гг. [23, 27].
В настоящее время не вызывает сомнений, что ХОБЛ служит независимым фактором риска развития ССЗ и фатальных сердечно-сосудистых событий. Однако ХОБЛ не включена в существующие шкалы стратификации ССР, и не существует рутинной клинической практики расчета риска сердечно-сосудистых осложнений у больных изолированной ХОБЛ без диагностированной сердечно-сосудистой патологии. Поэтому для нас представлял практический интерес анализ показаний к назначению и частоты использования гиполипидемической терапии у больных ХОБЛ, а также оценка достижения целевых показателей липидного спектра. В работе использовались клинические рекомендации по первичной и вторичной профилактике ССЗ 2016 и 2017 гг. [23, 27].
В группе ХОБЛ 41,6% пациентов автоматически распределялись в группу очень высокого и высокого ССР с учетом наличия ИБС, транзиторной ишемической атаки, острого нарушения мозгового кровообращения, реваскуляризации коронарных и других артерий, сахарного диабета и/или хронической болезни почек. Обращало на себя внимание увеличение группы пациентов с показаниями для вторичной профилактики по мере прогрессирования ХОБЛ (табл. 5). Ни у одного пациента не были достигнуты целевые значения ХС ЛПНП.
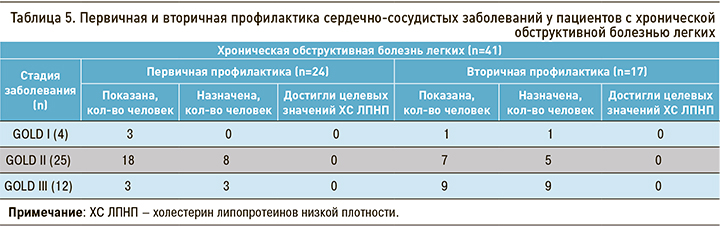
Для первичной профилактики ССЗ назначение гиполипидемической терапии было показано в 58,6% случаев в группе ХОБЛ и менее чем в половине случаев в контрольной группе. В ходе проведенного исследования гиполипидемическая терапия была назначена в качестве первичной профилактики 45,8 % (n=11) пациентам с ХОБЛ. Целевые значения ХС ЛПНП также не были достигнуты ни у одного пациента. За целевой уровень принимались показатели ХС ЛПНП <2,6 ммоль/л для высокого ССР и <1,8 ммоль/л для очень высокого риска [23].
Таким образом, у всех пациентов группы ХОБЛ, которая была сформирована в результате активного скрининга в группе прикрепленного контингента в амбулаторных условиях, были показания для назначения гиполипидемической терапии.
Принимая во внимание ужесточение целевых уровней ХС ЛПНП, которое было постулировано в европейских и отечественных рекомендациях 2019–2020 гг., необходима разработка профилактических стратегий в отношении больных ХОБЛ с обязательной оценкой ССР у всей когорты пациентов с назначением интенсивной гиполипидемической терапии для достижения рекомендованных целевых значений липидного спектра. Это позволит значительно снизить ССР в данной когорте пациентов.
ЗАКЛЮЧЕНИЕ
ХОБЛ – болезнь с высоким риском развития и прогрессирования сердечно-сосудистой патологии, что предопределяет необходимость разработки ранних профилактических стратегий. Она не внесена в стратификационные схемы оценки ССР, поэтому в реальной клинической практике отсутствует практика рутинного расчета этого риска у больных ХОБЛ без манифестирующей сердечно-сосудистой патологии. Однако литературные данные и результаты проведенного исследования доказывают необходимость активного выявления ХОБЛ и калькуляции ССР с целью определения показаний для первичной и вторичной профилактики и разработки профилактических стратегий, включая установление показаний для раннего назначения гиполипидемической терапии.


