Сочетание хронической сердечной недостаточности (ХСН) и хронической обструктивной болезни легких (ХОБЛ) создает серьезные диагностические и терапевтические проблемы у амбулаторных и стационарных пациентов.
ХСН и ХОБЛ имеют ряд общих факторов риска, среди которых прежде всего необходимо отметить курение, и сходные патофизиологические механизмы развития, нередко сосуществующие у отдельно взятого пациента. Согласно данным Российского медицинского общества по артериальной гипертонии и Российского респираторного общества, среди пациентов с ХОБЛ ХСН диагностируется в 23,6% случаев [1].
Частота выявления ХСН у пациентов, госпитализированных по поводу ХОБЛ, достаточно высока (36,2%) [2]. Дополнительное влияние на формирование ХСН оказывают такие факторы, как курение, выраженность бронхообструктивных нарушений, гипоксемия, увеличение ЧСС. Результаты различных исследований продемонстрировали двунаправленный характер взаимосвязи ХОБЛ и ХСН. С одной стороны, ХСН ухудшает прогноз и увеличивает частоту госпитализаций у больных ХОБЛ. С другой стороны, отмечается увеличение распространенности ХСН и сердечно-сосудистых осложнений по мере нарастания степени тяжести ХОБЛ [3]. Определенные трудности представляет диагностика ХСН у больных ХОБЛ, что обусловлено прежде всего сходными клиническими симптомами, которые могут маскировать респираторную или кардиальную симптоматику. Диагностическая оценка обоих состояний, присутствующих у одного и того же пациента, часто затруднена. ХОБЛ является причиной отсроченной диагностики сердечной недостаточности, и наоборот. Также не до конца оценена диагностическая значимость мозгового натрийуретического пептида для выявления ХСН у коморбидных пациентов с ХОБЛ [4]. В многочисленных исследованиях показана гиподиагностика ХСН на фоне ХОБЛ, что может влиять на терапевтические методы и прогноз [5]. Ввиду этого целесообразно рассмотреть методы диагностики ХСН при ХОБЛ.
Цель исследования – выявить особенности диагностики ХСН при ХОБЛ.
МАТЕРИАЛ И МЕТОДЫ
Согласно поставленной цели, было обследовано 100 больных с ХОБЛ II–IV степени в пульмонологическом отделении городской клинической больницы № 1 г. Челябинска в 2016–2019 гг. Пациентами было подписано информированное согласие. Исследование одобрено комитетом по этике Южно-Уральского государственного медицинского университета, протокол № 10 от 27.12.2016. Пациенты были распределены на 2 группы: 1 – пациенты с ХОБЛ в сочетании с ХСН (n=40); 2 – пациенты с ХОБЛ без ХСН (n=60). Средний возраст больных составлял 64,3±1,55 лет. Сравниваемые группы были сопоставимы по возрасту и тяжести течения ХОБЛ. Средний возраст в группе 1 был равен 65,8±1,16 лет, в группе 2 – 63,4±0,94 лет (р=0,055). Соотношение OФВ1/ФЖЕЛ (индекс Генслера) в группе 1 составил 53,2±1,72%, в группе 2 – 50,1±1,64% (p=0,193).
Критериями включения были мужской пол, возраст 40–74 лет, наличие диагностированной ХОБЛ II–IV степени. Критериями исключения служили наличие острого коронарного синдрома менее чем за 3 мес до включения, пороков сердца, миокардитов, кардиомиопатий. Диагноз ХОБЛ устанавливали в соответствии с критериями GOLD (2017) [6]. Для подтверждения диагноза ХОБЛ и оценки ее степени тяжести проводили спирометрию на прессотахоспирографе Спиролан плюс SP0303T. При проведении спирометрии производилось измерение объема воздуха, выдыхаемого при форсированном выдохе от точки максимального вдоха, – форсированная жизненная емкость легкого (ФЖЕЛ), и объем воздуха, выдыхаемый в первую секунду при форсированном выдохе, – объем форсированного выдоха за первую секунду (ОФВ1). Постбронходилатационный показатель ОФВ1/ФЖЕЛ <0,7 подтверждал наличие персистирующего ограничения скорости воздушного потока и, следовательно, ХОБЛ.
Наличие ХСН I–IIБ стадии по классификации Н.Д. Стражеско–В.Х. Василенко и II–IV функционального класса (ФК) по NYHA устанавливали на основании жалоб, анамнеза, оценки клинического состояния, данных эхокардиографии (ЭхоКГ), определения уровня N-концевого фрагмента мозгового натрийуретического пептида (NT-proBNP). Анализ тяжести клинической симптоматики ХСН проводили по шкале оценки клинического состояния (ШОКС в модификации В.Ю. Мареева).
Для определения уровня толерантности к физической нагрузке и объективизации ФК ХСН использовали тест 6-минутной ходьбы.
Для оценки структурно-функционального состояния сердца использовали стандартную ЭхоКГ на приборе EKO7. Частота используемого датчика составляла 2,75 МГц с одновременной регистрацией ЭхоКГ и допплерэхокардиограммы в импульсном режиме. ЭхоКГ исследование включало оценку планиметрических и гемодинамических параметров правых и левых отделов сердца. Проводили измерения следующих параметров левого желудочка (ЛЖ): конечно-диастолический размер левого желудочка (КДР, мм), конечно-систолический размер левого желудочка (КСР, мм), толщина межжелудочковой перегородки (мм) в диастолу, толщина задней стенки левого желудочка (мм) в диастолу, индекс массы миокарда ЛЖ (ИММЛЖ), фракция выброса левого желудочка (ФВ ЛЖ, %) по методу Simpson. В апикальной позиции в В-режиме определяли линейные размеры левого желудочка (мм), левого предсердия (мм), индекс объема левого предсердия (мл/ м2). Диастолическую функцию ЛЖ оценивали с использованием импульсно-волнового допплера методом тканевого допплеровского исследования. Для оценки диастолической функций ЛЖ на уровне митрального фиброзного кольца измеряли пик S (см/с), пик Е – раннее диастолическое наполнение (см/с) и пик е’ –
усредненная максимальная тканевая скорость раннего диастолического смещения септальной и латеральной частей кольца митрального клапана (см/с), отношение E/е’. Также определяли показатель dp/dt, отражающий скорость нарастания давления в ЛЖ в начале систолы (dp/dt ЛЖ, мм рт.ст./с).
Для правых отделов сердца измеряли следующие показатели: конечно-диастолический размер правого желудочка (мм), толщину передней стенки правого желудочка (ПЖ), линейные размеры ПЖ и правого предсердия, площадь правого предсердия в конце систолы, процент коллабирования нижней полой вены на вдохе, систолическое и среднее давление в легочной артерии (мм рт.ст.), скорость трикуспидальной регургитации, фракцию укорочения ПЖ. Оценка регионарной систолической функции TAPSE осуществляли посредством определения систолической экскурсии кольца трикуспидального клапана. Определение индекса Теi ПЖ позволяло получить информацию одновременно о систолической и диастолической функции.
Исследование NT-proBNP проводили с помощью набора реагентов для иммуноферментного определения пептида в сыворотке крови производства «ЗАО Вектор-Бест», Новосибирск. Нормальную концентрацию NT-proBNP считали в диапазоне 0–200 пг/мл. Значения более 200 пг/мл расценивали как вероятную ХСН.
Исследователи использовали шкалу оценки клинического состояния (ШОКС) при ХСН, опросник CAT (COPD Assessment Test), модифицированную шкалу одышки mMRC (Мodified Medical Research Council Dyspnea Scale) [9]. Пульсоксиметрическое исследование выполняли с помощью прибора MirOxi фирмы Medical International Research. Оценку системного воспаления осуществляли методом определения высокочувствительного С-реактивного белка.
Статистическую обработку проводили с использованием пакета SPSS Statistics 19. Использовали критерии Манна–Уитни и критерий Фишера. Различие между изучаемыми параметрами признавалось статистически значимым при р <0,05.
РЕЗУЛЬТАТЫ
У всех исследуемых пациентов при проведении спирографии был подтвержден диагноз ХОБЛ II– IV степени (группы 1 и 2). Среди 100 обследованных пациентов у 40 была выявлена ХСН. Группы были сопоставимы по возрасту.
Как видно из таблицы 1, при сравнительном анализе гемодинамических и лабораторно-инструментальных данных между группами пациенты не отличались по возрасту, ОФВ1, отношению OФВ1/ФЖЕЛ. При этом статистические различия получены в отношении ШОКС, что лишний раз подтверждает необходимость рутинного использования этой шкалы при первичном осмотре больного. Степень mMRC была выше в группе с сочетанной патологией, так же как и оценочный тест САТ, указывающие на тяжесть симптомов ХОБЛ и отрицательный прогноз выживаемости больных ХОБЛ и ХСН. Пациенты с ХОБЛ и ХСН имели более высокую частоту сердечных сокращений (ЧСС) как признак гиперактивации симпатоадреналовой системы. Полученные данные теста 6-минутной ходьбы указывали на достоверное снижение толерантности к физической нагрузке в группе 1, что было обусловлено меньшей переносимостью нагрузок, мышечной атрофией и более тяжелым течением ХОБЛ.
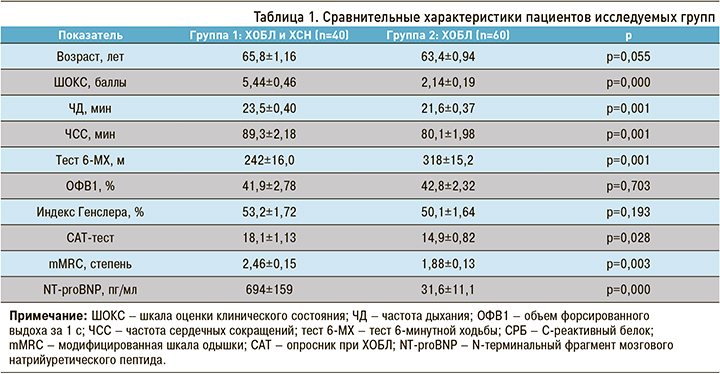
Были получены достоверные различия в показателях структурных изменений левых отделов сердца – индексе объема левого предсердия и ИММЛЖ (табл. 2). ФВ ЛЖ в двух группах также различалась. Среди пациентов группы 1 сохраненная ФВ ЛЖ более 50% была отмечена у 24 больных. У 8 пациентов имелась сниженная ФВ (менее 40%) и еще у 8 – средняя ФВ. Все они относились к группе с сочетанной патологией, что объясняется более тяжелым течением ХСН у больных ХОБЛ.
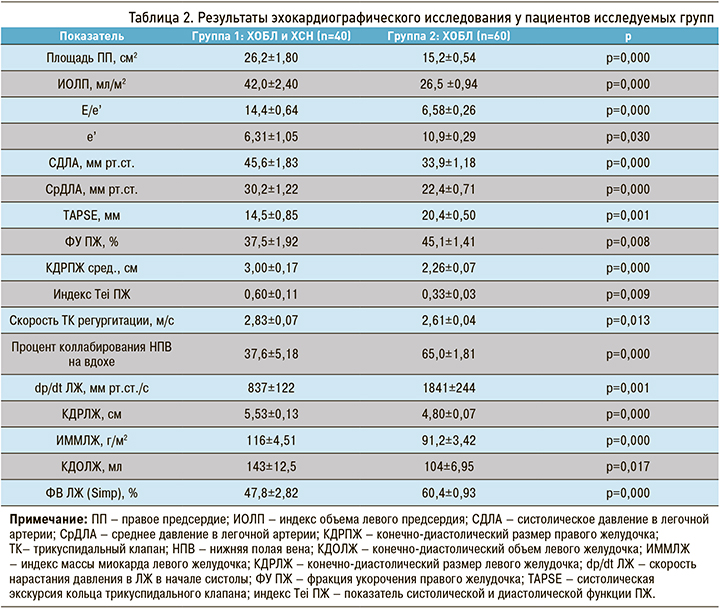
При анализе параметров правых отделов сердца в группе 1 можно отметить бóльшие размеры ПЖ, площади правого предсердия, увеличение индекс Tei ПЖ, снижение фракции укорочения ПЖ и процента коллабирования нижней полой вены на вдохе. Эти показатели свидетельствовали о признаках правожелудочковой недостаточности. С большой вероятностью вышеуказанные изменения являются вторичными по отношению к легочной гипертензии, значения которой достоверно выше в группе 1.
ОБСУЖДЕНИЕ
Как известно, гиперинфляция, гипоксемия и соответственно гиперкапния, присутствующие при ХОБЛ, больше выражены при наличии сопутствующей ХСН. В свою очередь, это приводит к подавлению вазодилатирующих медиаторов в виде простациклина и оксида азота, что дает начало развитию и прогрессированию легочной гипертензии [7].
Значения систолического и среднего давления в легочной артерии были достоверно выше в группе ХОБЛ и ХСН. Легочная гипертензия может развиться в результате высокого давления наполнения ЛЖ и, как следствие, прекапиллярной вазоконстрикции, обусловленной в том числе гипоксемией [8].
Индекс Tei ПЖ достоверно различался между двумя группами, что говорит о сниженной насосной функции ПЖ в группе 1. Доказано, что Tei-индекс имеет прогностическое значение при легочной гипертензии.
Показатели индекса объема левого предсердия, ИММЛЖ достоверно позволяли определить посткаппилярную гипертензию, особенно при параллельном исследовании NT-proBNP.
Наличие увеличенных линейных размеров правых камер сердца (площадь правого предсердия, конечно-диастолический размер ПЖ), увеличение скорости трикуспидальной регургитации свидетельствовали о ранней вовлеченности правых камер сердца.
Необходимо заметить, что существуют технические сложности и ограничения при ХОБЛ: узкое акустическое окно, сниженная визуализация структур сердца в условиях гиперинфляции, эмфиземы, ожирения. Использование тканевого допплеровского исследования позволяет на ранних этапах выявить диастолическую дисфункцию ЛЖ и ПЖ. ЭхоКГ является одним из основных референсных тестов в диагностике ХСН. Правильность проведения и оценки параметров ЭхоКГ особенно важна для диагностики ХСН с сохраненной и промежуточной ФВ ЛЖ [9, 11]. Закономерности структурно-функционального ремоделирования сердца у больных ХСН в сочетании с ХОБЛ (см. табл. 2) представлены преимущественно нарушениями диастолической функции ЛЖ и ПЖ и сохраненной ФВ ЛЖ.
ХОБЛ, осложненная ХСН, сопровождалась более выраженным развитием гипертрофии миокарда и легочной гипертензии. Учитывая сложности оценки клинических симптомов, для своевременной диагностики ХСН у больных ХОБЛ особую значимость приобретает определение уровня биохимического маркера ХСН – NT-proBNP. Повышенные уровни этого пептида могут наблюдаться при дисфункциях ПЖ, вторичных по отношению к легочным заболеваниям, без снижения ФВ ЛЖ [4, 10, 12]. Поэтому измерение уровней NT-proBNP полезно при диагностике нарушений функции ПЖ у пациентов с ХОБЛ и ХСН с сохраненной ФВ. Определение NT-proBNP у больных ХОБЛ с подозрением на ХСН производится в соответствии с современными рекомендациями по диагностике ХСН. У пациентов с ХОБЛ плазменные натрийуретические пептиды – достоверные маркеры в диагностике ХСН [13]. Своевременное выявление ХСН у пациентов ХОБЛ позволяет назначить кардиотропную терапию для предотвращения прогрессирования сердечно-сосудистых и респираторных осложнений [3].
ЗАКЛЮЧЕНИЕ
- ХСН на фоне ХОБЛ характеризуется более тяжелым течением, что проявляется выраженным нарушением толерантности к физической нагрузке, более высоким ФК ХСН и повышенными показателями ЧСС.
- В целях диагностики ХСН у больных ХОБЛ целесообразно применение ЭхоКГ и тканевой допплерометрии с оценкой диастолической функции обоих желудочков.
- Исследование мозгового натрийуретического пептида является полезным маркером диагностики ранних форм ХСН на фоне ХОБЛ.


