Согласно статистике, только в США более 2,5 млн людей получает антикоагулянтную терапию по поводу различных состояний: развития венозных тромбоэмболий (ВТЭ), фибрилляции предсердий (ФП), имплантации электрокардиостимулятора (ЭКС), протезирования клапанов сердца механическим протезом [1]. В российской литературе общих данных о частоте приема антитромботической терапии не представлено, однако с каждым годом увеличивается количество случаев, требующих ее назначения. Так, в настоящее время в России проживает не менее 2,5 млн человек с ФП [2], отмечено около 340 000 новых подтвержденных эпизодов развития тромбоэмболии легочной артерии (ТЭЛА) в год [3], зафиксировано 162 535 случаев впервые возникших инфарктов миокарда (ИМ) и 24 591 случай повторных ИМ [4], причем с каждым годом эти показатели только растут.
В связи с этим проблема периоперационного ведения данной категории больных остается сложным вопросом для клинициста любой специальности (хирурга, терапевта, кардиолога, анестезиолога) и требует персонифицированного подхода с учетом общих правил. Перед врачом встает задача сохранения баланса между эффективностью получаемой пациентом антикоагулянтной или дезагрегантной терапии и максимальным снижением рисков возможных периоперационных кровотечений.
Рассмотрим более подробно возможные ситуации, требующие коррекции антитромботической терапии в периоперационном периоде.
СОВРЕМЕННЫЕ ВОЗМОЖНОСТИ АНТИТРОМБОТИЧЕСКОЙ ТЕРАПИИ
Все антитромботические препараты могут быть условно разделены на 2 большие группы – антикоагулянты и дезагреганты. Механизм действия антикоагулянтов заключается в предотвращении образования тромбина из протромбина и соответственно формирования тромба, в то время как дезагреганты влияют непосредственно на тромбоциты, предотвращая их агрегацию [5, 6]. В таблице 1 приведены основные группы антитромботических препаратов, применяемых в настоящее время в клинической практике [5–7].
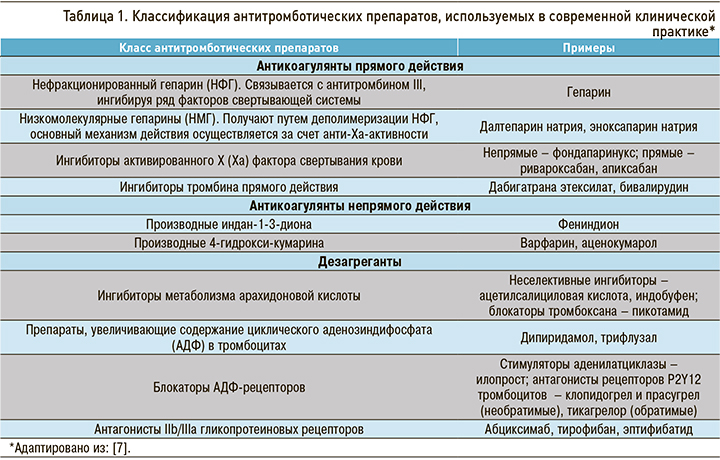
Для антикоагулянтов показаниями к назначению на длительный срок являются первичная и вторичная профилактика венозных и артериальных тромбозов, ФП, имплантация ЭКС и механических клапанов сердца, некоторые виды легочной гипертензии, для антиагрегантов – острый ИМ, острый коронарный синдром (ОКС), стенокардия напряжения, имплантация коронарных стентов при выполнении чрескожного коронарного вмешательства (ЧКВ), перенесенное острое нарушение мозгового кровообращения (ОНМК), некоторые случаи артериального тромбоза [6].
СХЕМЫ ПРЕРЫВАНИЯ И ВОЗОБНОВЛЕНИЯ АНТИТРОМБОТИЧЕСКОЙ ТЕРАПИИ В ПЕРИОПЕРАЦИОННОМ ПЕРИОДЕ
Для решения вопроса о тактике назначения и коррекции антитромботической терапии врачу необходимо оценить возможный периоперационный риск тромботических и геморрагических осложнений (табл. 2–4).
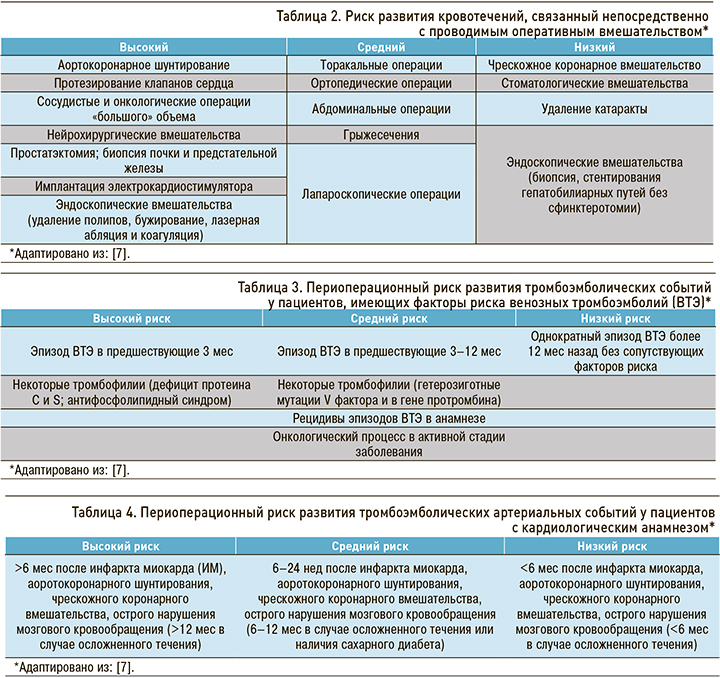
При наличии у пациента постоянной формы ФП необходимо провести оценку риска возможных тромбоэмболических осложнений по шкале CHA2DS2-VASc [2].
I. Отмена и возобновление дезагрегантной терапии
В большинстве случаев терапия ацетилсалициловой кислотой может быть продолжена в обычном режиме. При наличии высокого операционного риска кровотечения препарат может быть отменен за 5–7 дней до планируемого вмешательства и возобновлен в течение первых суток после операции, начиная с нагрузочной дозы [8]. Клопидогрел и тикагрелор должны быть отменены за 5–7 дней до планируемого вмешательства и возобновлены в течение первых суток после операции, начиная с нагрузочной дозы (при необходимости дополнительной коагуляции рекомендован переход на низкомолекулярные гепарины (НМГ) по схеме bridge-therapy).
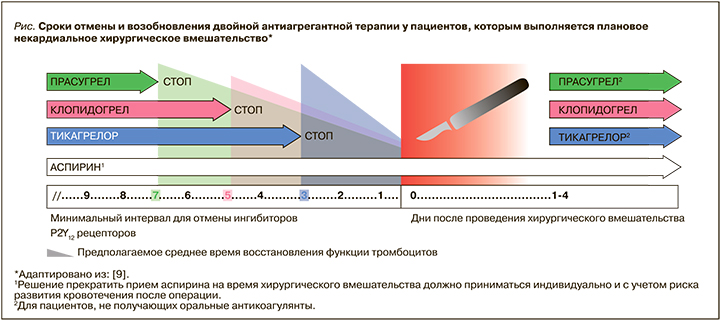
Рассмотрим также более подробно ведение в периоперационном периоде пациентов, получающих двойную антиагрегантную терапию (ДАТ) по поводу стентирования коронарных артерий. По данным литературы, до 25% больных с коронарными стентами подвергаются различным внесердечным оперативным вмешательствам в первые 5 лет после проведенного ЧКВ. Для определения тактики антиагрегантной терапии необходимо учитывать совокупность следующих факторов: риск тромбоза стента, возможные последствия отсрочки проведения операции и риск периоперационного кровотечения. По возможности рекомендовано отложить проведение планового оперативного вмешательства до полного окончания курса приема ДАТ. При наличии среднего и в части случаев высокого риска кровотечения рекомендована отмена клопидогрела и тикагрелора с продолжением приема аспирина. Согласно рекомендациям, если хирургическое лечение не может быть отсрочено на весь необходимый период приема ДАТ, то оно может быть выполнено через 1 мес с момента начала приема терапии вне зависимости от характеристик стента (голометаллический или с лекарственным покрытием). При этом желательна госпитализация в стационар, оснащенный для проведения ЧКВ. У пациента с недавно перенесенным ИМ и/или высоким риском повторных ишемических событий, принимающего ДАТ, плановое оперативное вмешательство должно быть перенесено на 6 мес [9]. На рисунке представлены рекомендуемые сроки отмены и возобновления приема антиагрегантов в периоперационном периоде.
II. Отмена и возобновление антикоагулянтной терапии
Если пациент принимает варфарин или новые оральные антикоагулянты (НОАК), схема отмены антикоагулянтов зависит от вида и объема планируемого оперативного вмешательства. При проведении стоматологических процедур, офтальмологических операций (по поводу катаракты и на передней камере глаза), эзофагогастродуоденоскопии и колоноскопии (в том числе с биопсией, но без полипэктомии) терапия антикоагулянтами может быть продолжена по принимаемой ранее пациентом схеме, без отмены [2]. При наличии у больного ФП (CHA2DS2-VASc <2 баллов) или эпизода ВТЭ (более 3 мес назад) рекомендована отмена антикоагулянтов за 5 дней до оперативного вмешательства (для апиксабана – за 48 ч), контроль международного нормализованного отношения (МНО) накануне операции, при уровне МНО >2,0 – прием витамина К. При наличии у больного ФП (CHA2DS2-VASc >2 баллов), рецидивирующих эпизодах ВТЭ (менее 3 мес назад), протезировании клапанов сердца в анамнезе рекомендована отмена антикоагулянтов за 5 дней до оперативного вмешательства (для апиксабана – за 48 ч)а, через 2–3 дня после этого необходимо начать терапию НМГ или нефракционированным гепарином (НФГ) в лечебных дозах. При этом последняя доза НМГ должна быть ведена за 24 ч до операции, НФГ – за 12 ч, с контролем коагулограммы. В дальнейшем возобновление приема варфарина или НОАК должно быть начато сразу же после достижения хирургического гемостаза и отсутствия риска кровотечений [2]. Терапия варфарином начинается под «прикрытием» гепаринов (могут быть назначены через 6–48 ч после операции в зависимости от коагуляции) и может быть отменена при достижении целевых значений МНО в двух последовательных анализах. Такая схема назначения и отмены антикоагулянтов получила в литературе термин bridge-therapy, или терапия «моста» [2]. У пациентов, находившихся на терапии дабигатрана этексилатом и имеющих клиренс креатинина <50 мл/мин, возможна отмена препарата за 5 дней до оперативного вмешательства без использования терапии «моста». Целью bridge-therapy служит минимализация риска кровотечений при сохранении антитромботических эффектов [6].
III. Возможные пути нейтрализации эффектов антитромботических препаратов при проведении экстренных хирургических вмешательств
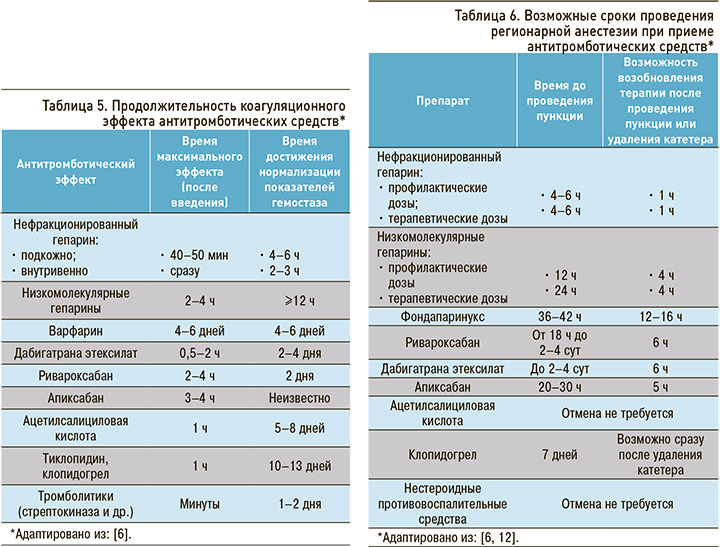
Для оценки необходимости использования препаратов, ингибирующих эффекты антитромботических средств, необходимо знать пик действия и время нормализации показателей гемостаза после введения антикоагулянтов или дезагрегантов, которые отражены в таблице 5.
Для ингибирования действия НФГ рекомендовано внутривенное болюсное введение протамина из расчета 1 мг на 100 МЕ НФГ, при неэффективности – длительная инфузия протамина под контролем активированного частичного тромбопластинового времени (АЧТВ). В отношении НМГ протамин менее эффективен и снижает их активность только на 50%, при необходимости используют переливание концентрата протромбинового комплекса или свежезамороженной плазмы (СЗП) [10].
При передозировке варфарина, а также с целью достижения нормального уровня МНО рекомендуется переливание концентрата протромбинового комплекса или СЗП, дополнительно в некоторых случаях – введение витамина К (средняя доза 5 мг) или его синтетического аналога – фитоменадиона (при МНО < 9 – 1–2,5мг, при МНО≥ 9 – 5 мг) [11].
Для ингибирования эффектов НОАК и фондапаринукса необходимо переливание концентрата протромбинового комплекса или СЗП. Нейтрализация действия фондапаринукса и дабигатрана этексилата может быть достигнута применением активированного VII фактора свертывания.
Для купирования эффектов дезагрегантов рекомендовано переливание тромбоцитарной массы, что не всегда является эффективной мерой.
IV. Тактика антитромботической терапии при выполнении регионарной анестезии
Регионарная анестезия в настоящее время используется при большом количестве вмешательств малого объема и диагностических процедур, имея ряд преимуществ перед общей анестезией. Риск возникновения гематомы (что может приводить к тяжелому неврологическому дефициту) при проведении нейроаксилярной анестезии достаточно высок, в особенности у пациентов, получающих антитромботическую терапию. На риск развития гематомы после проведения данной манипуляции могут влиять различные факторы, которые необходимо учитывать: прием антитромботических препаратов, наличие коагулопатий, время с момента введения последней дозы антикоагулянта/ дезагреганта, пожилой возраст, женский пол, анатомические особенности позвоночника и спинномозгового канала, используемый инструментарий (диаметр игл и катетеров). Выполнение регионарной анестезии рекомендовано при уровне тромбоцитов более 50×109/л, МНО ≤1,5 и АЧТВ ≤45 с [12]. Возможные сроки для проведения нейроаксиальной анестезии представлены в таблице 6 [6, 12].
ЗАКЛЮЧЕНИЕ
Существующие в настоящее время схемы и алгоритмы для ведения пациентов, получающих антитромботическую терапию в периоперационном периоде, несомненно, требуют внимания и, возможно, дальнейшей коррекции. Практический интерес к вопросу предоперационной подготовки пациента с сопутствующей патологией не вызывает сомнения. Стоит отметить, что проведение антитромботической терапии является сложной задачей и требует индивидуальной оценки всех факторов риска (как тромботических, так и возможных геморрагических осложнений у конкретного больного), мультидисциплинарного взаимодействия терапевта, оперирующего хирурга и анестезиолога.


