Пандемия новой коронавирусной инфекции SARS-CoV-2 – глобальная медицинская и социальная угроза, один из наиболее серьезных вызовов, когда-либо стоявших перед современной цивилизацией. Борьба с этим заболеванием, требующая огромных усилий практикующих врачей, ученых, организаторов здравоохранения и фармакологической индустрии, сегодня находится в центре внимания мирового врачебного сообщества [1].
Однако необходимость лечения и профилактики COVID-19 не должна снижать качество оказания медицинской помощи при других заболеваниях и патологических состояниях. Число лиц с неинфекционной хронической патологией не стало меньше: в период строгого карантина (lockdown) в развитых странах мира отмечается достаточно большое количество обострений терапевтических заболеваний. В частности, многие эксперты сообщают о серьезных проблемах, связанных с наиболее распространенными болезнями скелетно-мышечной системы, такими как остеоартрит (ОА) и хроническая неспецифическая боль в спине (НБС) [2–4].
Так, Endstrasser F. et al. [5] оценили состояние 63 больных ОА, нуждавшихся в эндопротезировании, но у которых проведение операции было отложено из-за сложной эпидемической обстановки. Было показано существенное ухудшение состояния пациентов – усиление боли (по визуальной аналоговой шкале), тяжести состояния (по индексу WOMAC) и снижение качества жизни (по SF-12). 79% из этих больных настаивали на скорейшем проведении оперативного лечения.
Toprak Celenay S. et al. [6] сравнили наличие скелетно-мышечной боли в период пандемии COVID- 19 у 375 человек, находившихся на самоизоляции, и у 311 лиц, продолжавших работать в обычном режиме. Было отмечено, что у людей, пребывавших дома, НБС возникала достоверно чаще, чем у работающих (p <0,05). Любопытно также, что у работающих в период пандемии людей частота скелетно-мышечной боли (боль в спине, области шеи, плеча, локтя) была достоверно ниже, чем до нее.
Опрос жителей Италии, выполнявших во время пандемии работу в удаленном режиме (на дому), показал, что у них НБС возникала в 41,2% случаев, а боль в области шеи – в 23,5% [7].
Можно было бы предположить, что значительное снижение двигательной активности и серьезных нагрузок в указанных условиях должно свести к минимуму число эпизодов выраженной НБС и люмбоишиалгии, однако данные популяционных исследований демонстрируют обратное. Так, Kuitunen I. et al. [8] провели анализ 40 653 случаев обращения в отделения экстренной помощи в Финляндии в период строгого карантина. Их общее количество сократилось в сравнении с допандемическим периодом всего на 16%, при этом число обращений, связанных с НБС, – примерно на треть (31%). Важно отметить, что число эпизодов экстренной медицинской помощи, связанной с инфарктом миокарда и ишемическим инсультом, в период пандемии осталось на уровне, соответствующем предыдущим годам.
НЕМЕДИКАМЕНТОЗНЫЕ ПОДХОДЫ
К основным факторам, которые способствуют прогрессированию скелетно-мышечных заболеваний в период пандемии COVID-19, относятся ограничение двигательной активности, гиподинамия, снижение мышечного тонуса и саркопения (уменьшение эффективной мышечной массы), метаболические нарушения (ожирение, гипергликемия, дислипидемия и гиперурикемия), а также затруднения с получением квалифицированной врачебной помощи. Необходимо отметить, что развитие хронической боли – основного проявления ОА и НБС – во многом определяется психическими и социальными факторами. Поэтому длительная изоляция, тревожные и депрессивные настроения, в том числе коронафобия, ограничение общения с близкими людьми и материальные проблемы, связанные со строгим карантином, способствуют усилению болевых ощущений и ухудшению ассоциированных с болью функциональных нарушений [2–4].
Хроническая патология скелетно-мышечной системы оказывает серьезное негативное влияние на макроорганизм, способствуя развитию и прогрессированию коморбидных заболеваний, таких как гипертоническая болезнь (ГБ), сахарный диабет (СД) 2 типа и ишемическая болезнь сердца (ИБС) [9]. Так, Cleveland R. et al. [10], проведя обзор серии эпидемиологических исследований, показали, что риск летального исхода для пациентов с ОА коленного и тазобедренного суставов на 40–60% выше в сравнении с лицами, соответствующими по возрасту и полу, но не страдающими ОА. При этом известно, что вероятность неблагоприятного течения инфекции COVID-19 существенно выше у больных с патологией сердечно-сосудистой системы и СД. По данным методического обзора и метаанализа, представленного Biswas M. et al. [11], наличие кардио- и цереброваскулярных заболеваний повышает риск летального исхода при инфекции COVID-19 в 3–4,8 раза, СД и АГ – примерно в 2 раза. Таким образом, наличие заболеваний суставов и позвоночника, сопровождающееся хронической болью и значительными функциональными нарушениями, создает весьма неблагоприятный фон при инфицировании COVID-19.
Это определяет необходимость оптимизации терапии скелетно-мышечных заболеваний в непростых условиях пандемии. Так, одним из основных направлений рационального ведения пациентов с ОА и НБС становится обучение, психологическая поддержка и стимуляция физической активности. Было показано, что планомерное поддержание активного двигательного режима (кратковременные прогулки (10–15 мин в день) и занятия физкультурой дома) позволяет существенно повысить мышечный тонус, настроение и эффективную функцию суставов и позвоночника у пациентов старших возрастных групп, страдающих ОА [12, 13].
Доказательством эффективности немедикаментозных методов при лечении скелетно-мышечных заболеваний стал недавно опубликованный метаанализ 23 клинических исследований, в которых изучалось применение образовательных программ и комплекса физических упражнений при ОА. Было показано, что структурированное обучение пациентов, диета и регулярные индивидуализированные занятия, ход которых и полученные результаты контролируются специалистами, обеспечивают значимое улучшение состояния больных, восстановление функции и существенное снижение затрат на лечение. Эффект образования пациентов, диетотерапии и дозированной физической активности во многих случаях выше, чем результаты «рутинной» практики лечения ОА с использованием стандартной фармакотерапии [14].
Особое значение в период пандемии приобретает телемедицина – использование электронных средств коммуникации, которые дают возможность осуществлять дистанционный контроль течения болезни и проводить коррекцию терапии без непосредственного контакта врачей и пациентов, а также сократить количество посещений последними медицинских учреждений, что позволяет существенно снизить риск заражения COVID-19 [15, 16]. В качестве примера успешного использования телемедицинских технологий в условиях пандемии можно привести работу Tornero-Molina J. et al. [17], показавших хороший контроль состояния 469 пациентов с заболеваниями суставов и позвоночника (включая 21% с ревматоидным артритом) при использовании регулярных дистанционных консультаций.
ПРИМЕНЕНИЕ АНАЛЬГЕТИКОВ
Много вопросов возникает относительно фармакотерапии скелетно-мышечных заболеваний в период пандемии. Это связано с рядом сообщений (в том числе активно транслируемых СМИ) о негативном влиянии тех или иных лекарственных средств на риск инфицирования и тяжесть течения инфекции COVID-19. В частности, противоречивые мнения высказываются насчет возможности регулярного использования нестероидных противовоспалительных препаратов (НПВП) [18].
Это наиболее популярный класс анальгетиков, который занимает ведущую позицию при лечении острой и хронической скелетно-мышечной боли. Другие классы быстро действующих обезболивающих препаратов не могут считаться приемлемой альтернативой НПВП. Например, парацетамол, который ранее широко рекомендовался в качестве препарата первой линии при ОА и НБС, в последние годы признан большинством экспертов относительно малоэффективным обезболивающим средством, чье использование оправдано лишь при умеренно выраженной боли или в комбинации с другими анальгетиками [19]. Опиоиды, несмотря на плохую переносимость, риск формирования зависимости и глобальную программу борьбы с опиоидной эпидемией, продолжают достаточно широко использоваться для лечения неонкологической боли в западных странах [20, 21]. Однако в России вследствие более жесткого контроля за оборотом наркотических препаратов этот класс анальгетиков применяют для купирования боли при ОА и НБС очень редко.
В связи с этим для российских врачей очень важно определиться с возможным риском применения НПВП во время пандемии COVID-19.
Теоретически НПВП могут в определенной степени влиять на вероятность развития COVID-19, поскольку обладают прогипертензивным действием и способны опосредованно повышать синтез ангиотензинпревращающего фермента 2 – мембранного белка, при взаимодействии с которым SARS-CoV-2 проникает в клетки-мишени. Также обсуждается способность НПВП подавлять активность макрофагов, синтез ряда цитокинов и хемокинов, хемотаксис нейтрофилов, базофилов и моноцитов, что может снижать эффективность неспецифического иммунного ответа на ранних стадиях развития вирусной и бактериальной инфекции. Имеются данные о более тяжелом течении бактериальных пневмоний у больных, регулярно применявших НПВП; возможно, это связано со способностью последних маскировать основные проявления инфекционного процесса (лихорадку, артралгии и миалгии) и тем самым замедлять сроки назначения этиотропной и патогенетической терапии [18].
Также существует риск тромбоэмболических осложнений при использовании НПВП, связанный с блокадой циклооксигеназы (ЦОГ) 2 и снижением синтеза простациклина, одного из важнейших эндогенных антитромботических факторов. Этот момент приобретает особое значение с учетом ключевой роли, которую играют иммуноопосредованные нарушения свертывающей системы крови в патогенезе острого респираторного дистресс-синдрома (ОРДС) при неблагоприятном течении инфекции COVID-19 [22].
С другой стороны, ряд экспериментальных исследований демонстрирует способность НПВП подавлять эндоцитоз и репликацию SARS-CoV-2, блокировать развитие иммунного воспаления, вызванного реакцией на вирусную инфекцию (снижая синтез интерферона, ингибируя NFkb и препятствуя образованию инфламмасомы NLRP3, подавляя активацию Th1/Th17 лимфоцитов и др.), и тем самым предотвращать развитие «цитокинового шторма», лежащего в основе формирования ОРДС [23].
На сегодняшний день опубликовано несколько национальных эпидемиологических исследований, в которых оценивалась взаимосвязь между регулярным приемом НПВП (в период до заражения SARS-CoV-2) и риском развития тяжелой формы COVID-19. Ученые из Южной Кореи Jeong Н. et al. [24] оценили течение COVID-19 у 354 больных, принимавших НПВП, и 1470 больных, не получавших эти препараты. Данная работа показала негативное влияние НПВП: число пациентов с неблагоприятным течением заболевания (общее число лиц с необходимостью искусственной вентиляции легких и/или перевода в реанимационное отделение, развитием сепсиса и летальным исходом) было достоверно выше среди получавших НПВП: 6,2 и 3,5% соответственно. Число эпизодов кардиоваскулярных осложнений и острой почечной недостаточности (ОПН) также было несколько выше среди пациентов, получавших НПВП, однако отличие было недостоверным: 2,5 и 1,5% и 0,9 и 0,3% соответственно.
Иной результат был получен датскими исследователями Lund L. et al. [25], сравнившими течение COVID-19 у 248 больных, принимавших НПВП, и 8988 больных, не использовавших эти лекарства. Согласно полученным данным, прием НПВП достоверно не влиял на вероятность развития тяжелых форм COVID-19. Так, относительный риск (ОР) госпитализации составил 1,16 (95% доверительный интервал (ДИ): 0,87–1,53; p=0,31), 30- дневной летальности – 1,02 (95% ДИ: 0,57–1,82; p=0,95), перевода в реанимационное отделение – 1,04 (95% ДИ: 0,54–2,02; p=0,90), искусственной вентиляции легких – 1,14 (95% ДИ: 0,56–2,30; p=0,72), необходимости гемодиализа из-за развития ОПН – 0,86 (95% ДИ: 0,24–3,09; p=0,81).
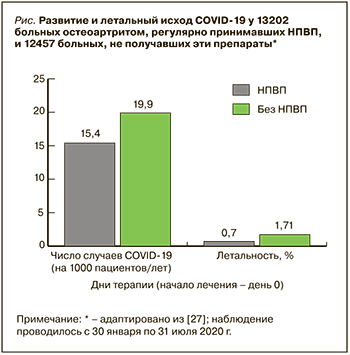 Аналогичные данные были получены в исследовании ученых из Великобритании Bruce Е. et al. [26], основанном на оценке выживаемости 1222 больных COVID-19, среди которых 54 (4,4%) до начала вирусной инфекции регулярно принимали НПВП. Было показано, что использование этих лекарств ассоциировалось с более высокой смертностью от COVID-19.
Аналогичные данные были получены в исследовании ученых из Великобритании Bruce Е. et al. [26], основанном на оценке выживаемости 1222 больных COVID-19, среди которых 54 (4,4%) до начала вирусной инфекции регулярно принимали НПВП. Было показано, что использование этих лекарств ассоциировалось с более высокой смертностью от COVID-19.
Наиболее доказательной работой, демонстрирующий отсутствие существенного вреда от приема НПВП во время пандемии, можно считать исследование Chandan J. et al. [27]: они сравнили развитие и течение COVID-19 у 13 202 пациентов с ОА, которым были назначены НПВП, и 12 457 пациентов с ОА, получавших другие анальгетики (парацетамол в сочетании кодеином или дигидрокодеином). ОР развития COVID-19 (оцениваемый по числу врачебных консультаций с подтвержденным диагнозом этого заболевания) и летального исхода составил для принимавших НПВП 0,79 (95% ДИ: 0,57–1,11) и 0,85 (95% ДИ: 0,61–1,20) соответственно, т.е. оказался даже ниже в сравнении с больными, получавшими другие анальгетики (рис.).
Хотя лечение COVID-19 не входит в число вопросов, рассматриваемых в настоящем обзоре, тем не менее нельзя не отметить мнение ряда экспертов, которые считают применение НПВП при этом заболевании эффективным и безопасным. Так, Hong W. et al. [28] провели экспериментальное исследование, в ходе которого целекоксиб в дозе 400 и 200 мг/сут назначался на срок 7–14 дней 37 больным COVID-19, госпитализированным в связи с тяжелым течением этого заболевания. Применение целекоксиба на фоне комплексной терапии позволило добиться выздоровления у 100 и 87% больных. В то же время среди 7 больных, составивших контроль, выздоровели лишь 4 (57%).
Таким образом, в настоящее время нет однозначных данных, которые стали бы основанием для ограничения использования НПВП у пациентов со скелетно-мышечными заболеваниями в период пандемии. Тем не менее эти препараты нужно применять с максимальной осторожностью и по четким показаниям, учитывая возможность развития класс-специфических нежелательных реакций со стороны сердечно-сосудистой системы (ССС), желудочно-кишечного тракта (ЖКТ) и почек. Особого внимания требует использование этого класса анальгетиков у пациентов старших возрастных групп с серьезными коморбидными заболеваниями.
ЛОКАЛЬНАЯ ТЕРАПИЯ
Локальные инъекции глюкокортикоидов (ГК) и препаратов гиалуроновой кислоты занимают важное место в лечении скелетно-мышечных заболеваний. Однако возможность применения ГК в условиях пандемии COVID-19, в том числе в виде внутрисуставных и околосуставных инъекций, вызывает определенные опасения [29]. Это связано с имеющимися данными о повышении риска бактериальных и вирусных инфекций на фоне использования этого класса лекарств [30, 31]. К примеру, по данным метаанализа 10 наблюдательных исследований, выполненных в периоды эпидемий гриппа, среди больных, получавших ГК, отмечалась более высокая смертность (ОР 1,75; p=0,0002), более высокая частота вторичной бактериальной или грибковой инфекции (ОР 2,0; p=0,04), а также большая длительность пребывания в реанимационных отделениях (ОР 2,1; p=0,0001) [32].
Очень показательны данные Sytsma T. et al. [33], оценивших риск развития гриппа в течение 5 эпидемических сезонов (2010–2017) у 4804 вакцинированных пациентов, получавших внутрисуставные инъекции ГК. Риск развития гриппа у них был достоверно выше в сравнении с контролем (вакцинированными пациентами, которые не получали ГК) – ОР 1,52 (95% ДИ: 1,20–1,93).
В ряде работ было показано, что применение ГК у пациентов до заражения SARS-CoV-2 негативно влияет на течение инфекционного процесса [34, 35]. Так, Pablos J. et al. [36] сопоставили тяжесть течения и исход COVID-19 у 228 больных ревматическими заболеваниями и аналогичного по числу контроля из пациентов, не имевших ревматологической патологии. ОР неблагоприятного исхода при использовании любых доз ГК составил 2,20 (95% ДИ: 1,36–3,54; р=0,001).
С другой стороны, в настоящее время ГК (в частности, дексаметазон) активно применяют для терапии тяжелых форм COVID-19; их использование вошло в российские рекомендации по лечению этого заболевания [37]. Эффективность ГК при COVID-19 подтверждается серией наблюдательных работ и рандомизированных контролируемых исследований (РКИ), а также результатами соответствующих метаанализов [38–40].
Нам удалось найти только одно исследование, в котором оценивалось влияние внутрисуставного введения ГК на развитие COVID-19. Это небольшая наблюдательная работа Newton А. et al. [41], проследивших частоту развития этого заболевания у 30 пациентов с ОА, которым были проведены внутрисуставные инъекции триамцинолона или метилпреднизолона. COVID-19 возник лишь у одного пациента, причем симптомы болезни появились на 29-й день после инъекции, а положительный тест – на 32-й. Это позволило авторам исключить связь между внутрисуставной инъекцией и развитием вирусной инфекции.
Таким образом, пока нет убедительных данных, свидетельствующих о негативном влиянии локальных инъекций ГК на риск инфицирования и развитие тяжелых форм COVID-19. Поэтому этот метод лечения скелетно-мышечной боли может использоваться при наличии четких показаний (выраженные болевые ощущения, связанные с локальным асептическим воспалительным процессом). Это положение, в частности, обозначено в рекомендациях Французского общества ревматологов по ведению больных ревматическими заболеваниями в период пандемии COVID-19 [42].
Нам не удалось найти в системе PubMed каких-либо сообщений насчет использования локальных инъекций гиалуроновой кислоты в период пандемии COVID-19. Однако, учитывая отсутствие значимого системного влияния этих препаратов на состояние иммунной системы, едва ли можно предполагать, что на фоне их применения будет повышаться риск инфицирования и развития тяжелых форм COVID-19.
МЕДЛЕННО ДЕЙСТВУЮЩИЕ СИМПТОМАТИЧЕСКИЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ОСТЕОАРТРИТА
В период пандемии особое значение в общей стратегии ведения больных ОА приобретает использование медленно действующих симптоматических средств (SYSADOA), к которым относятся такие пероральные препараты, как диацереин (Диафлекс), глюкозамин, хондроитин, неомыляемые соединения авокадо и сои, а также ряд инъекционных форм, в частности гликозаминогликан-пептидный комплекс (Румалон). Эти лекарственные средства обладают собственным анальгетическим потенциалом и способностью замедлять прогрессирование ОА [43, 44]. Применение SYSADOA позволяет существенно снизить потребность в НПВП, а значит, опасность серьезных системных нежелательных реакций, связанную с использованием последних. Учитывая, что многие случаи хронической НБС определяются ОА суставов позвоночника, применение SYSADOA представляется целесообразным и при этой патологии. Так, в нашей стране было проведено несколько исследований, демонстрирующих успешный контроль хронической боли при НБС при использовании диацереина и ГПК (Диафлекс и Румалон) [45, 46].
Принципиальное достоинство SYSADOA – низкая частота системных осложнений и возможность применения этих лекарств у пациентов с серьезными коморбидными заболеваниями, прежде всего ССС [43]. В этом плане большой интерес представляет диацереин, который не только не повышает риск прогрессирования заболеваний ССС, но обладает способностью оказывать системное противовоспалительное действие и снижать выраженность метаболических нарушений, играющих важную роль в развитии кардиоваскулярной патологии [47].
Так, недавно Guo S. et al. [48] представили данные метаанализа 5 РКИ, в которых сравнивалась эффективность диацереина и плацебо при СД 2 типа. Общее число больных, участвовавших в РКИ, составило 278 человек, длительность наблюдения – от 2 до 24 нед. Было показано, что применение диацереина достоверно снижало уровень гликемии натощак – отличие средних (ОС) значений составило 0,52 (95% ДИ: от -0,89 до -0,14; р <0,05). Использование диацереина также ассоциировалось со значительным снижением гликозилированого гемоглобина (HbA1c): ОС составило -0,71 (95% ДИ: от -1,07 до -0,36; р <0,001).
Еще один метаанализ 7 исследований был выполнен Nowrouzi-Sohrabi Р. et al. [49], которые также показали значимое благоприятное влияние приема диацереина на уровень HbA1c. Кроме этого, было продемонстрировано достоверное снижение индекса массы тела у принимавших этот препарат: взвешенное ОС составило -0,55 (95% ДИ: от -1,03 до -0,07; р=0,026).
В плане подтверждения благоприятного воздействия диацереина на системные метаболические нарушения большой интерес представляет недавно опубликованное исследование Leite N. et al. [50], которые сравнили влияние этого препарата и плацебо на течение неалкогольной жировой болезни печени (НАЖБП). Исследуемую группу составили 69 больных, длительность курса лечения – 24 мес, основным методом контроля состояния печени была эластография (Fibroscan®). Было установлено достоверное преимущество диацереина: в сравнении с плацебо он обеспечил значимое снижение плотности печеночной ткани – на 1,6 kPa (95% ДИ: от -2,6 до -0,5; p=0,003). Снижение стадии фиброза было отмечено у 7 больных в группе диацереина и лишь одного в группе плацебо (р=0,02).
Интересно, что недавно группой ученых de Oliveira P. et al. [51] в обзоре «Диацереин: потенциальное мультитаргетное средство при COVID-19» (Diacerein: A potential multi-target therapeutic drug for COVID-19) была высказана гипотеза о целесообразности применения этого препарата в комплексной терапии COVID-19. Авторы обзора указывают на способность диацереина связывать ряд клеточных рецепторов (таких, как TLR4), подавлять активность цитокинов (интерлейкина-1, интерлейкина-6, интерлейкина-8, интерлейкина-12, интерлейкина-18, фактора некроза опухоли-α), а также блокировать провоспалительные сигнальные пути (в частности, ассоциированные с NF-κB, NALP3 и МАРК), участвующие в развитии цитокинового шторма при ОРДС. Кроме этого, для основного активного метаболита диацереина – реина – показано наличие противовирусного действия в отношении вирусов семейства SARS-CoV.
Разумеется, возможность использования диацереина в комплексной терапии COVID-19 следует рассматривать как теоретическое предположение, требующее для своей реализации серьезного экспериментального и клинического изучения. Однако гипотеза de Oliveira P. et al. является еще одним доводом в пользу активного использования этого препарата как эффективного и безопасного (в том числе в отношении риска развития COVID-19) средства для лечения скелетно-мышечной боли.
ЗАКЛЮЧЕНИЕ
Проблема оптимизации терапии скелетно-мышечных заболеваний во время пандемии COVID-19 представляется важной и актуальной. Связанная с карантином изоляция, малоподвижный образ жизни, тревожное состояние создают предпосылки для развития рецидивов ОА и НБС, прогрессирования коморбидных заболеваний. Необходимо развивать телемедицинские технологии, позволяющие контролировать состояние и проводить коррекцию лечения пациентов без непосредственного контакта. Принципиальное значение приобретает поддержание двигательной активности и мышечного тонуса, в том числе путем дистанционных занятий, формирования индивидуальных программ лечебной физкультуры, трудотерапии и здорового питания. Нет четких данных, свидетельствующих о повышении риска инфицирования и развития тяжелых форм COVID-19 при использовании НПВП. Тем не менее использовать эти лекарства следует с осторожностью, учитывая риск нежелательных реакций, особенно у пациентов старших возрастных групп. Это же относится к локальным инъекциям ГК.
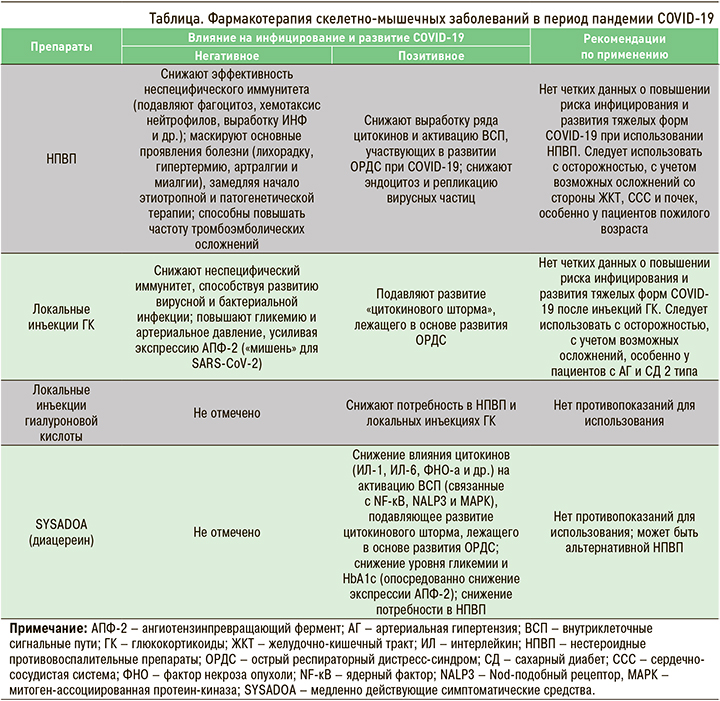
Особое значение во время пандемии приобретает широкое использование SYSADOA, таких как диацереин, которые позволяют успешно контролировать скелетно-мышечную боль, но при этом обладают хорошей переносимостью и не вызывают прогрессирования коморбидных заболеваний (табл.). Согласно данным последних исследований, применение диацереина позволяет успешно контролировать метаболические нарушения, связанные с СД и нарушением обмена липидов.


