Одной из тенденций клинической медицины конца XX – начала XXI в. является превалирование коморбидности в структуре заболеваемости [1, 2]. Основная причина одновременного наличия у одного больного нескольких заболеваний – глобальное постарение населения [3]. Общеизвестно, что количество сосуществующих патологий увеличивается с возрастом: так, если в 19–20 лет коморбидность встречается в 10%, то среди лиц старше 80 лет она составляет 80% [4].
Особого внимания заслуживает кардиореспираторная коморбидность, составляющая около 60% в структуре заболеваемости у пожилых [5, 6]. Половина пациентов с хронической обструктивной болезнью легких (ХОБЛ) старше 50 лет имеет хронические заболевания сердечно-сосудистой системы [6]. На сегодняшний день ХОБЛ считается системно-воспалительным заболеванием с множественными проявлениями [7, 8]. У пациентов, страдающих ею, статистически значимо чаще наблюдаются различные формы ишемической болезни сердца (ИБС) и хроническая сердечная недостаточность (ХСН) [9, 10]. Среди причин кардиореспираторной коморбидности можно назвать приверженность больных к табакокурению, оксидативный стресс, эндотелиальную дисфункцию, эндогенную интоксикацию [7, 8, 11]. Тревожным фактом является развитие у больных с ХОБЛ острых сосудистых катастроф, в частности инфаркта миокарда (ИМ) [12–14].
Рост коморбидности диктует необходимость коррекции алгоритмов ведения больных с несколькими заболеваниями, учета взаимодействия лекарственных средств, назначаемых по поводу разных нозологических форм, поиска высокоинформативных диагностических и прогностических маркеров.
Оценка интегральных гематологических индексов, по мнению ряда авторов, служит доступным и информативным методом в диагностике воспалительных процессов и определении выраженности эндогенной интоксикации [15, 16]. К наиболее распространенным индексам клеточной реактивности относятся лейкоцитарный индекс интоксикации, лимфоцитарный индекс и индекс сдвига лейкоцитов крови [17, 18]. Сопоставление данных индексов у больных с осложненным и неосложненным течением ИМ на фоне ХОБЛ позволит понять, могут ли они служить маркерами осложненного течения ИМ и можно ли опираться на них в прогнозировании течения этого заболевания.
Цель исследования – сопоставить интегральные гематологические индексы интоксикации (лейкоцитарный индекс интоксикации и индекс сдвига лейкоцитов крови) у больных ИМ на фоне ХОБЛ в зависимости от наличия осложнений в раннем периоде инфаркта.
МАТЕРИАЛ И МЕТОДЫ
Обследовано 225 пациентов с ИМ, находившихся на стационарном лечении в региональном сосудистом центре «Александро-Мариинская областная клиническая больница» г. Астрахани в период 2016–2019 гг. У 130 больных ИМ не было ХОБЛ в качестве коморбидной патологии, у 195 больных ИМ развился на фоне этого заболевания.
Для диагностики инфаркта применялись клинические рекомендации «Четвертое универсальное определение инфаркта миокарда» 2018 г. [19]. Лечение больных ИМ с подъемом сегмента ST осуществлялось в соответствии с клиническими рекомендациями «Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы» 2016 г. [20], без подъема сегмента – согласно клиническим рекомендациям «Диагностика и лечение больных с острым коронарным синдромом без подъема сегмента ST электрокардиограммы» 2015 г. [21].
У всех больных ИМ на фоне ХОБЛ диагноз легочной патологии был верифицирован ранее. Для установления диагноза и определения степени тяжести ХОБЛ использовали клинические рекомендации GOLD пересмотра 2019 г. [22]. В группе пациентов с ХОБЛ были отмечены средняя и тяжелая степени тяжести легочного процесса. Длительность течения ХОБЛ составила 16,4 (2; 23) года. Анамнез курения имелся у 100% больных, на момент исследования продолжали курить 88,2% участников. Индекс курения был равен 34,5 (19; 47) пачка/лет.
Средний возраст больных ИМ составил 54,6±6,9 года, больных с ИМ на фоне ХОБЛ – 48,6±7,4 лет. В группе больных ИМ без ХОБЛ у 112 человек это сердечно-сосудистое заболевание возникло впервые, у 28 – повторно. В «коморбидной группе» (ИМ на фоне ХОБЛ) аналогичные показатели составили 123 и 72 человека соответственно.
Критериями исключения из исследования служили возраст старше 65 лет, наличие сахарного диабета, артериальной гипертензии, хронических заболеваний почек, психических заболеваний, онкопатологии.
Группы больных ИМ и ИМ на фоне ХОБЛ были разделены на 2 подгруппы каждая в зависимости от наличия или отсутствия осложнений раннего периода. Среди пациентов с ИМ без ХОБЛ 95 (73%) человек не имели таких осложнений, 35 (27%) – имели. В группе больных ИМ на фоне ХОБЛ количество больных с неосложненным и осложненным течением инфаркта составило 114 (58,5%) и 94 (41,5%) человека соответственно. Среди осложнений ИМ наблюдались нарушения ритма и проводимости, острая левожелудочковая недостаточность (кардиогенный шок, сердечная астма и отек легких).
В исследование также были включены 2 группы сравнения: в первую вошли 110 соматически здоровых лиц жителей Астраханской области, во вторую – 104 больных ХОБЛ вне обострения, проживающих в г. Астрахани. Группы сравнения были сопоставимы по гендерно-возрастным характеристикам с обследуемыми больными.
Проведение клинического исследования было одобрено Региональным независимым этическим комитетом (протокол от 18.01.2016 № 12). Обязательным условием включения в исследование служило получение письменного информированного согласия пациентов.
Абсолютное содержание лейкоцитов (кл/л) определяли в двухкамерной сетке Горяева. Для подсчета лейкоцитарной формулы готовили мазок крови и окрашивали его по Романовскому–Гимзе. Для регистрации клеток использовали гематологический анализатор ABX PENTRA 120 (HORIBA ABX Diagnostics Inc, Франция).
Для расчета лейкоцитарного индекса интоксикации использовалась формула:
ЛИИ = [(4 мц. + 3 ю. + 2 п/я + с/я) × (пл. кл. + 1)]/ [(лимф. + мон.) × (э. + 1)], где мц. – моноциты; ю. – юные нейтрофилы; п/я – палочкоядерные нейтрофилы; с/я – сегментоядерные нейтрофилы; пл – плазматические клетки Тюрка; лимф. – лимфоциты; мон. – моноциты; э. – эозинофилы; б. – базофилы.
Нормой считается ЛИИ, равный 1±0,5 [17, 18].
Лимфоцитарный индекс представляет собой соотношение лимфоцитов и всех клеток миелоцитарного ряда (миелоциты, метамиелоциты, юные, палочкоядерные, сегментоядерные нейтрофилы). Этот показатель отражает взаимоотношение гуморального и клеточного звена иммунной системы. Он рассчитывался по формуле:
ЛИ = лимф./ н., где лимф. – лимфоциты; н. – нейтрофилы.
В свою очередь, индекс сдвига лейкоцитов крови определялся по формуле:
ИСЛК = [(э. + б. + н. (с/я, п/я, юн., мц.)]/ (мон. + лимф.), где э. – эозинофилы; б. – базофилы; н. – нейтрофилы (с/я – сегментоядерные, п/я – палочкоядерные, ю. – юные нейтрофилы, мц. – моноциты); мон. – моноциты; лимф. – лимфоциты.
В норме ИСЛК составляет 1,96±0,56 и не зависит от общего числа лейкоцитов крови. Повышение ИСЛК свидетельствует об активном воспалительном процессе и нарушении иммунологической реактивности организма.
Статистическая обработка данных проводилась с помощью пакета программ STATISTICA 12.0. Оценка нормальности распределения полученных данных осуществлялась посредством построения частотных гистограмм и с использованием критериев Колмогорова–Смирнова. Поскольку распределение было отличным от нормального, значения представлены в виде медианы, 25-го и 75-го процентилей. Для выявления статистической значимости в трех и более исследуемых группах применялся критерий Краскела–Уоллиса с расчетом критического уровня статистической значимости по формуле: n = 0,5 × N × (N – 1), где N – количество изучаемых групп. Уровень статистической значимости при шести сравниваемых группах составил 0,003.
Для оценки значимости взаимосвязи между двумя переменными в таблицах сопряженности признаков использовался хи-квадрат Пирсона (χ2).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ЛИИ имел статистически значимые различия у обследованных (H=124,53; р <0,003). Полученные данные о ЛИИ в изучаемых группах пациентов представлены на рисунке 1. У больных с неосложненным течением ИМ этот индекс составил 1,96 (0,7; 3,02), что было статистически значимо выше, чем у лиц контрольной группы: 1,08 (0,5; 2,23; H=30,81; р <0,003).
У больных с осложненным течением ИМ ЛИИ составил 3,68 (0,92; 4,83), что было статистически значимо выше, чем у лиц группы контроля (H=44,86; р <0,003) и больных с неосложненным течением ИМ (H=43,08; р <0,003).
В группе больных ИМ на фоне ХОБЛ с неосложненным течением инфаркта ЛИИ был равен 1,07 (0,56; 2,26), что не отличалось статистически значимо от его значений в группе контроля (H=0,006; р=0,8) и у пациентов с ХОБЛ (H=0,02; р=0,88), но было статистически значимо ниже значений ЛИИ у больных ИМ с неосложненным течением (H=46,35; р <0,003).
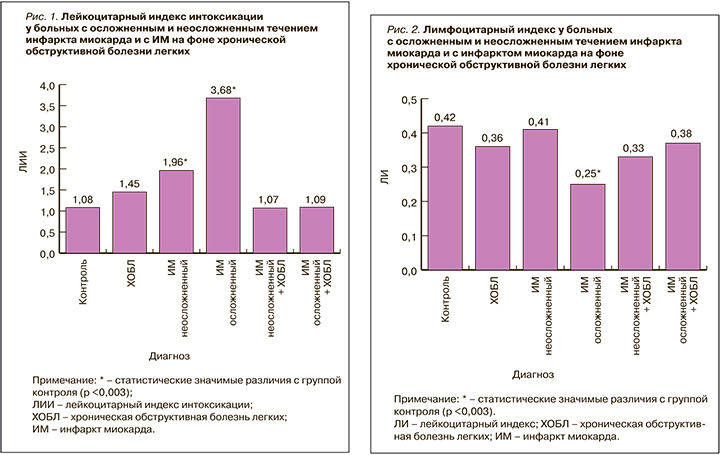
У больных ИМ на фоне ХОБЛ с осложненным течением инфаркта ЛИИ составил 1,09 (0,48; 2,28): эта величина была сопоставима со значениями в группе контроля (H=0,008; р=0,93) и у пациентов с ИМ на фоне ХОБЛ, не имевших осложнений (H=0,15, р=0,69), но в то же время была статистически значимо ниже, чем у больных ИМ с осложненным течением (H=55,82; р <0,003). Статистически значимых отличий по сравнению с ЛИИ в группе больных ХОБЛ не наблюдалось (H=0,04; р=0,84).
Таким образом, только в группе больных ИМ выявлена зависимость значений ЛИИ от наличия осложнений в раннем периоде инфаркта. В группе с осложненным течением инфаркта ЛИИ был более высоким. У больных ИМ на фоне ХОБЛ ЛИИ не зависел от того, протекал ИМ с осложнениями или без.
ЛИ имел статистически значимые различия в группах обследованных в зависимости от наличия осложнений раннего периода (H=51,6; р <0,003). Полученные данные о значениях этого параметра представлены на рисунке 2.
У больных ИМ без осложнений ЛИ был равен 0,41 (0,21; 0,66), что было сопоставимо со значениями в группе контроля – 0,42 (0,12; 0,8; H=1,13; р=0,29). У пациентов с осложненным течением ИМ ЛИ составил 0,25 (0,17; 0,39) – это было статистически значимо ниже как по сравнению с группой контроля (H=23,29; р <0,003), так и по сравнению с группой больных ИМ с неосложненным течением заболевания (H=44,26; р <0,003).
В группе больных ИМ на фоне ХОБЛ с неосложненным течением ЛИ составил 0,33 (0,19; 0,61), что было сопоставимо со значениями в группе контроля (H=4,41, р=0,04) и с группой пациентов с ХОБЛ (H=0,9; р=0,34), но статистически значимо ниже по сравнению с группой больных ИМ без осложнений (H=16,01; р <0,003).
 У больных с ИМ на фоне ХОБЛ с осложненным течением ЛИ равнялся 0,37 (0,18; 0,64): это было сравнимо со значениями в группе контроля (H=2,4; р=0,12) и в группе больных ИМ с неосложненным течением (H=0,28; р=0,6), но статистически значимо выше, чем у больных ИМ с осложненным течением (H=18,57; р <0,003). ЛИ у больных с ИМ на фоне ХОБЛ с осложненным течением и в группе пациентов с ХОБЛ были сопоставимы (H=0,14; р=0,7).
У больных с ИМ на фоне ХОБЛ с осложненным течением ЛИ равнялся 0,37 (0,18; 0,64): это было сравнимо со значениями в группе контроля (H=2,4; р=0,12) и в группе больных ИМ с неосложненным течением (H=0,28; р=0,6), но статистически значимо выше, чем у больных ИМ с осложненным течением (H=18,57; р <0,003). ЛИ у больных с ИМ на фоне ХОБЛ с осложненным течением и в группе пациентов с ХОБЛ были сопоставимы (H=0,14; р=0,7).
Таким образом, ЛИ продемонстрировал аналогичные с ЛИИ закономерности. В группе больных ИМ выявлены статистически значимые его отличия в зависимости от наличия осложнений раннего периода. В группе больных с ИМ на фоне ХОБЛ такой закономерности отмечено не было.
ИСЛК также имел статистически значимые различия в группах обследованных в зависимости от наличия осложнений (H=184,74, р <0,003): полученные данные представлены на рисунке 3.
У больных с неосложненным течением ИМ ИСЛК составил 1,78 (1,04; 3,2), что не отличалось статистически значимо от значений в группе контроля: 2,08 (1,13; 5,25; H=4,27; р=0,04).
В группе больных ИМ с осложненным течением ИСЛК равнялся 3,0 (2,13; 4,38), и это статистически значимо превышало аналогичные значения в группе контроля (H=13,64; р <0,003) и у пациентов с ИМ без осложнений (H=37,66; р <0,005).
В группе участников с ИМ на фоне ХОБЛ без осложнений ИСЛК достиг величины 3,33 (2,5; 4,55), что опять же было статистически значимо выше показателей в группе контроля (H=41,94; р <0,003), в группе пациентов с ИМ без осложнений раннего периода (H=105,33; р <0,003) и в группе больных ХОБЛ (H=63,47; р <0,003).
У больных ИМ на фоне ХОБЛ с осложнениями раннего периода ИСЛК составил 3,23 (2,36; 4,76). Это было статистически значимо выше значений ИСЛК в группе контроля (H=38,54; р <0,003), сопоставимо со значениями в группе участников с ИМ на фоне ХОБЛ без осложнений раннего периода заболевания (H=0,51; р=0,48) и в группе больных ИМ с осложнениями раннего периода (H=7,75; р=0,005), но статистически значимо выше значений в группе пациентов с ХОБЛ (H=52,96; р <0,003).
Таким образом, только в группе больных ИМ была выявлена зависимость ИСЛК от наличия осложнений раннего периода. Максимально высокими были значения у пациентов с ИМ, имевших осложнения раннего периода инфаркта. У больных ИМ на фоне ХОБЛ значения ИСЛК не отличались в группах с осложненным и неосложненным течением заболевания.
По итогам проведенного нами исследования можно сделать вывод, что зависимость значений гематологических индексов от наличия осложнений в раннем периоде выявлена только у больных ИМ. Это касалось всех анализируемых индексов. Максимальные значения ЛИИ, ЛИ и ИСЛК получены в группе с осложненным течением инфаркта. Полученные данные свидетельствуют о более выраженном уровне эндогенной интоксикации у больных с осложненным течением ИМ. Анализируя причинно-следственные связи, можно предположить, что именно накопление кардионекротических аутотоксинов обусловливает развитие осложнений в раннем периоде ИМ. Этот постулат требует дальнейшей проработки и изучения уровня эндогенной интоксикации у больных с ИМ.
Что касается больных с ИМ на фоне ХОБЛ, то ни один из анализируемых гематологических индексов не продемонстрировал зависимости от наличия осложнений в раннем периоде. Можно предположить, что хронический воспалительный процесс, каковым является ХОБЛ, приводит к нарушению взаимоотношения гуморального и клеточного звена иммунной системы и изменению иммунологической реактивности организма в целом. Мы согласны с мнением Ю.В. Саранчиной (2017), что «при хронизации патологического процесса общий анализ крови становится менее информативным в отношении показателей воспаления» [23].
3АКЛЮЧЕНИЕ
Отсутствие зависимости индексов клеточной реактивности от наличия осложнений раннего периода у больных ИМ на фоне ХОБЛ свидетельствует об изменении реактивности организма при наличии у больного ИМ сопутствующей ХОБЛ и требует поиска чувствительных маркеров синдрома эндогенной интоксикации у коморбидных пациентов.


