Неалкогольная жировая болезнь печени (НАЖБП) является наиболее распространенной хронической болезнью печени во всем мире, которая диагностируется у 10–30% населения [1]. На фоне инсулинорезистентности, гиперлипидемии и нейровегетативного дисбаланса у пациентов этой категории значительно возрастает риск развития сердечно-сосудистых заболеваний (ССЗ) [2–4]. На сегодняшний день доказано, что НАЖБП выступает независимым фактором риска развития и прогрессирования ССЗ [2]. Большинство авторов оценивает соответствующий вклад НАЖБП через призму активации атеросклеротического процесса на фоне нарушений липидного обмена, выделения провоспалительных цитокинов, активации окислительного стресса [5, 6]. Однако НАЖБП оказывает влияние не только на процесс атеросклероза, но и на состояние вегетативной нервной системы [1], а нейровегетативный дисбаланс, определяемый при изучении вариабельности сердечного ритма (ВСР), признается одним из наиболее ранних и чувствительных прогностических методов оценки сердечно-сосудистых осложнений [7–9].
Благодаря неинвазивности и высокой воспроизводимости, изучение ВСР широко используется во всем мире для оценки вегетативной регуляции работы сердца и сосудов [8, 9]. Показано, что на фоне клинически значимых изменений этих показателей существенно снижается стрессоустойчивость к внешним неблагоприятным факторам [10, 11] и извращаются адаптационные механизмы [12].
Низкий уровень ВСР связан с увеличением смертности у пациентов с ишемической болезнью сердца, хронической сердечной недостаточностью, постинфарктным кардиосклерозом [13, 14], ассоциирован с прогрессированием артериальной гипертензии (АГ), ишемической нефропатией и НАЖБП [1, 16, 17]. Уровень ваготонии, который может быть оценен степенью снижения ВСР, на фоне ССЗ или патологии печени не просто указывает на тяжесть заболевания, но и служит надежным прогностическим критерием риска неблагоприятного исхода. Этот прогностический метод применим и у клинически здоровых субъектов [18, 19, 21]. При этом следует отметить, что высокие показатели ВСР (выше референсных значений) также не говорят о повышении защитных механизмов, поскольку увеличивают риск развития атриовентрикулярной блокады, синдрома слабости синусового узла и фибрилляции предсердий [1, 8].
К настоящему времени выполнено множество исследований по изучению ВСР у пациентов с различными ССЗ, однако роль НАЖБП в изменении нейровегетативного баланса у пациентов с АГ изучена недостаточно. Поэтому целью представленного исследования стало изучение изменений ВСР и риска сердечно-сосудистых осложнений у пациентов с АГ и НАЖБП.
МАТЕРИАЛ И МЕТОДЫ
При планировании исследования были определены характер (поперечное, сравнительное) его проведения, критерии включения и исключения.
В исследование включались 45–65-летние пациенты обоего пола с АГ I–II степени (с НАЖБП или без нее). Критериями исключения были вторичные гипертензии, сахарный диабет (СД) 1 и 2 типа, ожирение II–III степени и другие заболевания, которые могли повлиять на результаты исследования.
Были проанализированы данные инструментального обследования 91 пациента. В (основную) группу 1 вошли 50 больных с АГ и НАЖБП, во 2 (контрольную) – 41 пациент с АГ без НАЖБП. На всех этапах исследования авторы руководствовались этическими принципами Хельсинкской декларации Всемирной медицинской ассоциации (2008) и Соглашением по надлежащей клинической практике (ICH GCP). Все пациенты подписали информированное согласие на участие. Исследование было одобрено локальным этическим комитетом Волгоградского государственного медицинского университета (протокол № 001- 2019, экспертное заключение № 001/5).
Анализ ВСР осуществлялся при помощи аппарата ПолиСпектр 8/Е с компьютерным модулем «ВНС-Спектр» (Нейрософт, Россия) по последовательности R-R интервалов в течение 20 мин с вычислением стандартных временных и спектральных характеристик в соответствии с методическими рекомендациями Р.М. Баевского и соавт. (2001) [22].
Применялся кратковременный тип (5 мин на каждом этапе) измерения ВСР с активной ортостатической пробой. Запись показателей ритмокардиограммы (РКГ) делалась не ранее чем через 1,5–2,0 ч после приема пациентами пищи, в тихой комнате с комфортной температурой (20–22 °С); накануне этого участникам исследования были отменены все физиотерапевтические процедуры и медикаментозная терапия. Перед началом исследования больной проходил период адаптации в положении лежа в течение 10 мин. Затем снималась РКГ с четкой регистрацией временных параметров: первые 5 мин пациент лежал (фоновый период), потом его просили перейти в вертикальное положение в течение 1 мин (переходный период), а затем постоять 5 мин (ортостатический период).
Были обработаны следующие показатели временной области:
- минимальный и максимальный R-R интервал (R-R min и R-R max);
- SDNN – стандартное отклонение ряда нормальных интервалов (с исключением экстрасистол);
- RMSSD – стандартное отклонение межинтервальных различий пар интервалов R-R;
- pNN50 – процентная доля пар интервалов, различающихся более чем на 50 мс, от общего количества последовательных пар.
Рассчитывались следующие параметры:
- ИН – индекс напряжения регулирующих систем по формуле ИН = АМо/2 × Мо × (R-R max – R-Rmin), где Мо – мода R-R-интервалов, АМо – амплитуда моды R-R-интервалов;
- соотношение ИН2/ИН1 для оценки вегетативной реактивности, где ИН1 – фоновый параметр, а ИН2 – после ортостатической пробы [24].
Также определялись спектральные компоненты ВСР: мощность спектра высокочастотного (High Frequency – HF), низкочастотного (Low Frequency – LF) и очень низкочастотного (Very Low Frequency – VLF) компонентов. Для оценки относительной активности подкоркового симпатического нервного центра вычислялся индекс LF/ HF [23].
Проводился расчет индекса стеатоза (FLI) по Bedogni G. et al. (2006). При его значениях <30,0 наличие жировой дистрофии печени исключалось. Уровень FLI ≥60,0 свидетельствует о наличии жирового перерождения печени.
Для расчета 5-летнего риска кардиоваскулярных осложнений применяли калькулятор ADVANT AGE (Les Laboratoires Servier, France), в котором, согласно методике D’Agostino R.B. et al. (2008), учитывались пол, возраст, фактор курения, систолическое артериальное давление, уровень общего холестерина (и его фракций) и гликемии. Для оценки общего сердечно-сосудистого риска и 10-летнего фатального риска использовали шкалу SCORE (Systemic Coronary Risk Evaluation; http://www.escardio.org/Guidelines-&-Education/Practice-tools/ССЗ-prevention-toolbox/SCORE-Risk-Charts)).
Статистический анализ выполняли с использованием непараметрических критериев с помощью пакета статистических программ Statistica 10 (StatSoft Inc., USA). Для описательной статистики применяли параметры медианы (Ме) и интерквартильный интервал (IQR). При сравнении несвязанных групп использовали U-критерий Манна–Уитни (для количественных значений) и точный критерий Фишера (для качественных переменных), для анализа связанных групп – тест Вилкоксона; значимость взаимосвязи между количественными данными определяли по коэффициенту ранговой корреляции Спирмена (r). По результатам показателя p <0,05 различие групп считали статистически значимым.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На начальном этапе обработки полученных данных для исключения систематической ошибки мы сравнили основные клинико-демографические показатели пациентов обеих групп. Группы 1 и 2 (табл. 1) были сопоставимы (p >0,05) по возрасту и полу, длительности АГ, показателям систолического (САД), диастолического (ДАД), пульсового артериального давления (ПАД), частоты сердечных сокращений (ЧСС) и количеству курящих больных.
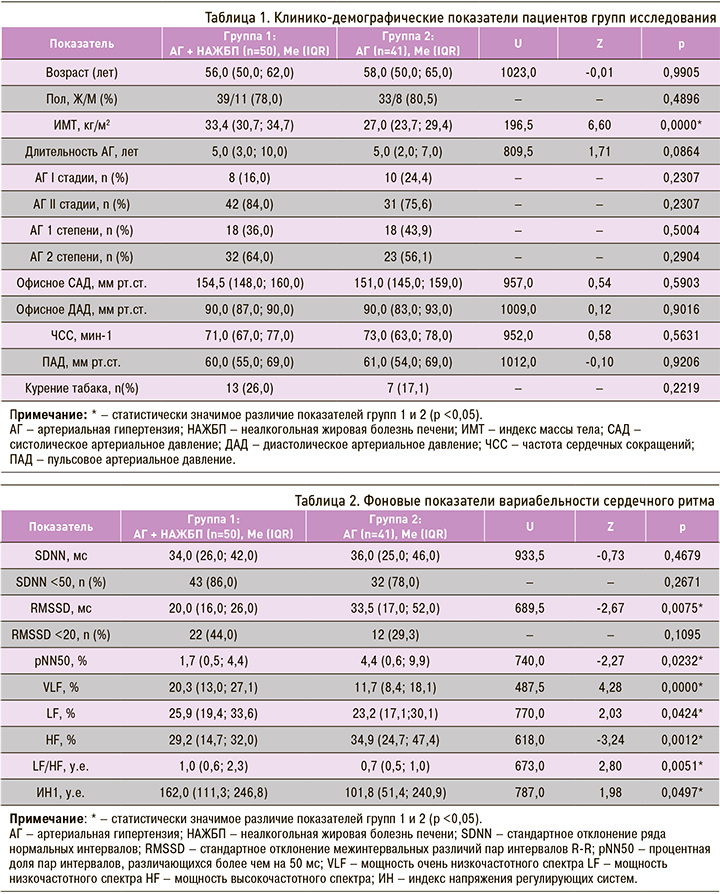
При этом в группе пациентов с АГ и НАЖБП по сравнению с больными изолированной АГ было достоверно больше пациентов с ожирением I степени: 39 (78%) против 6 (14,6%) наблюдений. Это объясняется характером коморбидного фона (НАЖБП).
Фоновые показатели ВСР представлены в таблице 2. При оценке показателя SDNN в обеих группах у большинства пациентов наблюдалось его снижение ниже 50 мс, что говорит об усилении симпатической регуляции, подавляющей активность автономного контура, а также о высоком риске сердечно-сосудистых осложнений и внезапной смерти [23]. При этом в группе 1 (АГ + НАЖБП) по сравнению со группой 2 (АГ) наблюдался более низкий уровень SDNN (34,0 (26,0; 42,0) против 36,0 (25,0; 46,0)) и отмечалось большее количество обследованных с SDNN <50 мс (86,0 против 78,0%), однако эти различия были статистически не значимы (p >0,05).
Активность парасимпатического звена вегетативной регуляции, которая описывается параметрами RMSSD и pNN50, была достоверно ниже у пациентов с НАЖБП (p=0,0075 и p=0,0232 соответственно), что говорит о значимом снижении у них активности автономного контура регуляции [1]. ИН регулирующих систем, который характеризует активность механизмов симпатической регуляции, был достоверно выше у пациентов группы 1 (162,0 против 101,8 у.е. в группе 2; p=0,0497) и превосходил референсные значения. Это свидетельствует о росте напряжения адаптационных механизмов, а значит, об увеличении риска внезапной смерти пациентов с сопутствующей НАЖБП, что подтверждается в работе Kumar M.S. et al. (2016).
Более значимое повышение тонуса симпатического звена вегетативной нервной системы у больных с АГ и НАЖБП выявлено нами при проведении спектрального анализа показателей ВСР. У пациентов группы 1 были достоверно выше значения очень низкочастотного (VLF, %; p=0,0000) и низкочастотного (LF, %; p=0,0424) компонентов спектра и значимо ниже – высокочастотного (HF, %; p=0,0012), что подтверждает смещение системы регуляции работы сердца и тонуса сосудов в сторону симпатикотонии. Индекс вагосимпатического взаимодействия (LF/HF) у больных группы 1 также оказался достоверно выше, чем в группе 2 (p=0,0051).
По результатам анализа фоновых значений можно заключить, что большинство показателей ВСР у пациентов исследованных групп отличались от референсных значений физиологической нормы [23], но у пациентов с АГ и НАЖБП эти изменения более выражены.

При оценке фонового состояния вегетативной нервной системы [24] (табл. 3) в группе 1 было достоверно больше больных с гиперсимпатикотонией (52,0 против 31,8% в группе 2; p=0,0410) и значимо меньше пациентов с эйтонией (10,0 против 26,8% в группе 2; p=0,0342), что подтверждают приведенные выше параметры ВСР. Ваготония чаще наблюдалась у обследованных с изолированной АГ (14,6 против 6,0%), а симпатикотония – при сочетании АГ и НАЖБП (32,0 против 26,8%), но эти различия были статистически не значимы (p >0,05).
Фоновые показатели ВСР имеют большое значение, но еще большее – динамика уровня каждого из них при проведении ортостатической пробы. Как видно из таблицы 4, у пациентов с АГ и НАЖБП по сравнению с больными изолированной АГ наблюдался более низкий уровень SDNN (36,0 (26,0;46,0) против 38,0 (29,0; 54,0)) и большее количество обследованных с SDNN <50 мс (84,0 против 70,7%), что указывает на сохранение симпатикотонии и напряжение состояния регуляторных систем. Параметры RMSSD и pNN50, которые описывают активность парасимпатического звена вегетативной регуляции, также остались на более низком уровне у пациентов с АГ и НАЖБП, но по сравнению с фоновыми показателями это различие было не столь значимо, что говорит о повышении симпатического тонуса у больных группы 2. Также соизмеримым оказался ИН2 (145,8 у.е. в группе 1 против 137,5 у.е. в группе 2; p=0,6465); это подтверждают исследования ряда авторов, в которых отмечалось, что наличие АГ способствует росту напряжения адаптационных механизмов даже в отсутствие сопутствующей патологии [20, 21].

При применении теста Вилкоксона было выявлено достоверное изменение уровней LF (p=0,0496), HF (p=0,0003) и LF/HF (p=0,0000) в группе 1, что позволяет сделать вывод о более выраженной симпатикотонии у пациентов с сочетанной патологией после выполнения ортостатической пробы.
В группе 2 статистически больше стали показатели RMSSD (p=0,0354), VLF (p=0,0000), HF (p=0,0000) и LF/HF (p=0,0000) – увеличение активности как парасимпатического, так и симпатического звена вегетативной регуляции. Это также подтвердилось возрастанием индекса вагосимпатического взаимодействия.
Наиболее полную картину о напряжении регуляторных систем можно получить при анализе ИН2/ИН1 – показателя изменений сердечного ритма при переходе из горизонтального в вертикальное положение [22]. У пациентов с АГ и НАЖБП его значения были статистически значимо выше, чем у больных без коморбидного фона (0,9 (0,4;1,6) против 1,3 (0,7; 2,1); p=0,0387).
Из таблицы 5 видно, что у больных с АГ и НАЖБП значительно чаще определялась вегетативная реактивность по гиперсимпатикотоническому типу (в 64,0% случаев против 43,9% в группе 2; p=0,0387), что также отражает перенапряжение регуляторных систем.
С целью определения роли стеатоза печени в изменении показателей ВРС нами было проведено корреляционное исследование пациентов в группе с АГ и НАЖБП. Было обнаружено, что при повышении FLI достоверно уменьшались фоновые показатели SDNN (r=-0,35; p=0,0001), RMSSD (r=-0,35; p=0,0001) и повышалось значение ИН1 (r=0,23; p=0,0112). Это свидетельствует о значимом снижении активности автономного контура регуляции при усилении симпатического влияния и возрастании напряжения адаптационных механизмов при увеличении степени стеатоза печени.
В обеих группах был произведен расчет 10-летнего фатального риска и 5-летнего риска сердечно-сосудистых осложнений. Установлено, что у пациентов с АГ и НАЖБП по сравнению с больными изолированной АГ достоверно выше как первый (2,4 (1,4; 5,2) против 1,1 (0,5; 2,8); р=0,0006), так и второй из названных показателей (3,0 (1,6; 5,1) против 1,7 (0,9;4,4); р=0,0148). Для определения роли стеатоза печени в увеличении риска кардиоваскулярных осложнений выполнен корреляционный анализ. Установлено, что при повышении FLI достоверно возрастали 10-летний (r=0,25; p=0,0103) и 5-летний риск сердечно-сосудистых осложнений (r=0,20; p=0,0411).
Кроме этого, было выявлено, что при повышении 5-летнего риска сердечно-сосудистых осложнений достоверно уменьшались фоновые показатели SDNN (r=-0,18; p=0,0461). Это указывает на усиление симпатической регуляции у пациентов основной группы при увеличении риска кардиоваскулярных событий.
Выраженный дисбаланс вегетативной нервной системы с гиперактивацией симпатического отдела обусловлен различными механизмами, связанными с развитием и прогрессированием НАЖБП. Большое значение в формировании вегетативной дисфункции многие исследователи отводят инсулинорезистентности и развивающейся гиперинсулинемии. По мнению некоторых авторов, инсулин, проходя через гематоэнцефалический барьер, стимулирует захват глюкозы в регуляторных клетках, связанных с вентромедиальными ядрами гипоталамуса. При этом уменьшается их тормозное влияние на центры симпатической нервной системы ствола мозга, что приводит к увеличению активности симпатического отдела вегетативной нервной системы [25]. В то же время показано наличие прямого воздействия провоспалительных цитокинов (фактор некроза опухоли-альфа, интерлейкин-1β, интерлейкин-6) и маркеров повреждения печени (цитокератин-18) на выраженность вегетативной дисфункции [26, 27]. В других работах отмечено подавляющее влияние печеночного жира при впервые выявленном СД 2 типа на парасимпатический отдел вегетативной нервной системы [28]. Важно подчеркнуть и влияние хронических заболеваний печени на центральную нервную систему и ассоциированное с этим нарушение серотонинергической и допаминергической нейротрансмиттерных систем с последующим развитием астении и дисфункции вегетативной нервной системы [29]. Таким образом, вопрос о патогенезе развития вегетативной дисфункции при НАЖБП достаточно сложен и остается открытым на сегодняшний день.
Полученные данные о вариабельности сердечного ритма у больных АГ и НАЖБП характеризуют прогрессирующее нарушение вегетативного баланса и выраженность автономной кардиальной нейропатии при сопутствующей НАЖБП и свидетельствуют о повышении риска развития кардиоваскулярных осложнений у этой категории больных.
ЗАКЛЮЧЕНИЕ
1. У пациентов с АГ и НАЖБП по сравнению с больными изолированной АГ достоверно ниже активность парасимпатического звена вегетативной регуляции. После проведения ортостатической пробы в основной группе исследования также было достоверно больше пациентов с показателем RMSSD <20 мс, что говорит об усилении влияния симпатической нервной системы и высших нервных центров.
2. При оценке спектрального анализа показателей ВСР у пациентов с АГ и НАЖБП отмечается смещение системы регуляции работы сердца и тонуса сосудов в сторону симпатикотонии, которая увеличивается после проведения ортостатической пробы по сравнению с больными изолированной АГ.
3. ИН регулирующих систем, который характеризует активность механизмов симпатической регуляции, достоверно выше у коморбидных пациентов по сравнению с больными изолированной АГ, что может свидетельствовать об увеличении риска внезапной смерти у этой категории больных.
4. При увеличении степени стеатоза печени отмечается достоверное увеличение 10- и 5-летнего риска сердечно-сосудистых осложнений, а также снижение активности автономного контура регуляции, усиление симпатического влияния и рост напряжения адаптационных механизмов в группе пациентов с АГ и НАЖБП.
5. Увеличение 5-летнего риска сердечно-сосудистых осложнений статистически значимо коррелирует с показателями, характеризующими усиление влияния симпатического отдела вегетативной нервной системы, и ростом напряжения адаптационных механизмов у пациентов с АГ и НАЖБП.


