Хроническая болезнь почек (ХБП) является составной частью кардиоренального континуума и предрасполагает к развитию острого повреждения почек [1, 2]. Наличие ХБП приводит к ухудшению прогноза и качества жизни больных с сердечно-сосудистой патологией [3]. С возрастом увеличивается распространенность коморбидности (сопутствующей патологии), в том числе наличия ХБП и синдрома обструктивного апноэ сна (СОАС).
Распространенность СОАС в популяции лиц старшей возрастной группы достигает 43,2% у мужчин и 27,8% у женщин [4]. По данным исследования ЭССЕ-РФ, жалобы на храп предъявляют более половины опрошенных, причем чаще мужчины (58,2%); апноэ также чаще выявляется у мужчин (9,7%), чем у женщин (8,3%) [5]. СОАС ухудшает не только качество жизни и социальное функционирование пациентов, но и прогноз при сердечно-сосудистой патологии [6, 7]. Учитывая общность причин, определяющих прогноз при кардиоренальном континууме [8], СОАС рассматривается как фактор риска прогрессирования ХБП [9]. Наличие хронической гипоксии и клубочковой гипертензии выступают как основные механизмы, приводящие к снижению функции почек при СОАС [10]. В связи с тем что распространенность СОАС и ХБП увеличивается в популяции больных пожилого и старческого возраста, актуально изучение распространенности, клинических особенностей и качества жизни при СОАС у больных с ХБП.
Цель исследования – изучить коморбидность, клинические особенности и качество жизни больных пожилого и старческого возраста с СОАС и ХБП.
МАТЕРИАЛ И МЕТОДЫ
Работа представляет собой открытое проспективное когортное исследование методом сплошной выборки 80 больных пожилого и старческого возраста со стабильной сердечно-сосудистой патологией (37 женщин и 43 мужчины, средний возраст 67,6±6,1 лет) с периодом наблюдения 12 мес. Критериями исключения из исследования были острый инфаркт миокарда; острое нарушение мозгового кровообращения в течение 6 мес до включения в исследование; психические расстройства, выраженные когнитивные расстройства (деменция умеренной и тяжелой степени выраженности), затрудняющие проведение психологического тестирования, отсутствие информированного добровольного согласия на исследование.
ХБП диагностировали в соответствии с Национальными рекомендациями «Хроническая болезнь почек: основные принципы скрининга, диагностики, профилактики и подходы к лечению» (Научное общество нефрологов России, 2012). При анализе учитывались клинические рекомендации «Хроническая болезнь почек» (Ассоциация нефрологов России, 2019) [8].
Для оценки коморбидности использовали индекс коморбидности (ИК) Чарлсон; коморбидность расценивали как высокую при ИК ≥6 баллов [10]. Характеристика коморбидности больных представлена в таблице 1.

Диагностику СОАС проводили согласно рекомендациям Российского общества сомнологов (2018) [11]. Для скрининга применялись Берлинский опросник [12] и Шкала сонливости Эпворта [13]. Результат ≥11 баллов по Шкале сонливости Эпворта расценивался как значительная дневная сонливость [4].
Кардиореспираторное мониторирование проводилось с использованием комбинированного монитора серии «Кардиотехника-07» («Инкарт», С.-Петербург, Россия). Рассчитывался индекс апноэ/гипопноэ (ИАГ) за час сна: при значении ИАГ 5–14/ч диагностировалась легкая степень, 15–29/ч – средняя, ≥30 – тяжелая степень СОАС.
Оценивалась электрокардиограмма (ЭКГ) в 12 отведениях, спирометрия и регистрация храпа, реопневмограмма (оценка дыхательных усилий), пульсоксиметрия. Анализировался характер апноэ (центральное, обструктивное или смешанное) по наличию/отсутствию дыхательных движений в соответствии с данными реопневмограммы, а также степень гипоксемии (снижение сатурации менее 89%).
Качество жизни больных определяли посредством Европейского опросника оценки качества жизни (European Quality of Life Questionnaire, EQ-5D-5L, Russian, 2009 EuroQol Group), вертикальной визуальной аналоговой шкалы (ВАШ). Также рассчитывался и оценивался интегральный индекс качества жизни EQ-5D-5L: от 0,0 (смерть) до 1,0 (превосходное здоровье) [14].
Для оценки выраженности тревоги и депрессии использовалась Госпитальная шкала тревоги и депрессии (Hospital Anxiety and Depression Scale, HADS) [15]. Механизмы психологической защиты определялись с помощью методики «Индекс жизненного стиля» Плутчика–Келлермана–Конте [16].
Статистический анализ выполнялся с применением программного пакета StatSoft Statistica v.10.0.1011.6 (StatSoft, Inc, США). Характер распределения данных оценивали с помощью W-критерия Шапиро–Уилка. В зависимости от результата анализа данные представлены как M±SD, где M – среднее арифметическое, SD – стандартное отклонение (при нормальном распределении) либо Me (IQR), где Me – медиана, IQR – интерквартильный размах: 25 процентиль – 75 процентиль (при распределении, отличном от нормального). Для сравнения групп использовали t-критерий Стьюдента и U-критерий Манна–Уитни (при распределении, отличном от нормального). Проводился корреляционный анализ (Пирсона или Спирмена в зависимости от распределения признаков). Анализ категориальных данных выполнялся с применением критерия хи-квадрата и точного критерия Фишера (при малой выборке). Различие считали статистически значимыми при р <0,05.
РЕЗУЛЬТАТЫ
ХБП наблюдалась у 48 (60%) участников исследования. Больных с 1 и 2 стадией ХБП не было, 3а стадия встречалась у 35 (43,8%), 3б – у 10 (12,5%), 4 стадия – у 3 (3,8%) человек. Пациенты с ХБП имели более высокий функциональный класс хронической сердечной недостаточности и более высокую коморбидность (ИК Чарлсон), у них чаще отмечалась анемия.
Результаты диагностики СОАС у больных пожилого и старческого возраста со стабильной сердечно-сосудистой патологией в зависимости от наличия ХБП приведены в таблице 2.
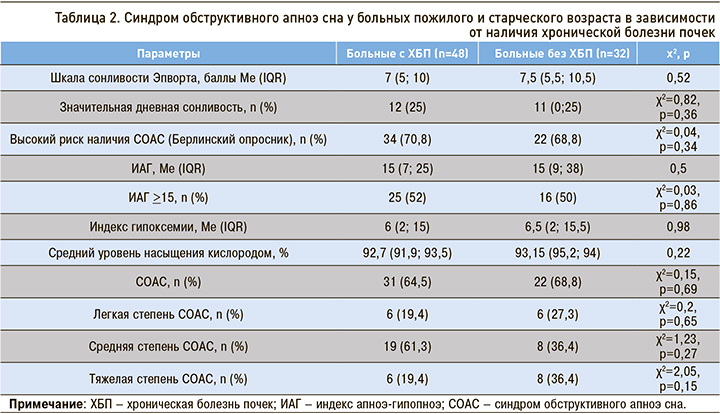
Различий между пациентами пожилого и старческого возраста в зависимости от наличия ХБП при скрининге и диагностике СОАС выявлено не было. Различий в частоте выявления СОАС в зависимости от стадии ХБП также не отмечалось (р=0,61).
 Значительная дневная сонливость отмечалась у каждого четвертого пациента пожилого и старческого возраста, страдающего ХБП (n=12; 25%).
Значительная дневная сонливость отмечалась у каждого четвертого пациента пожилого и старческого возраста, страдающего ХБП (n=12; 25%).
Высокий риск наличия СОАС наблюдался у большинства пациентов с ХБП – 34 (70,8%). СОАС впервые был диагностирован у 31 (64,5%) пациента пожилого и старческого возраста с ХБП. При этом частота его не зависела от пола (р=0,39) и возраста (р=0,48). Более половины имели среднюю степень СОАС (n=19; 61,3%), легкая и тяжелая степень наблюдалась с одинаковой частотой у 6 (19,4%) больных пожилого и старческого возраста с ХБП. При динамическом наблюдении за больными выяснилось, что через 12 мес только 7 (14,6%) пациентов пожилого и старческого возраста с ХБП консультировались у нефролога и всего 2 (6,5%) пациента с СОАС и ХБП обратились к сомнологу.
ИК Чарлсона и общее количество заболеваний у пациентов пожилого и старческого возраста с ХБП не различалось в зависимости от наличия СОАС (рис.).
Пациенты пожилого и старческого возраста с ХБП и СОАС характеризовались высокой коморбидностью: у всех была ХСН, у 30 человек (96,8%) – артериальная гипертензия (табл. 3). При наличии СОАС у больных пожилого и старческого возраста чаще встречалась ишемическая болезнь сердца по сравнению с пациентами с ХБП без СОАС (р=0,01).
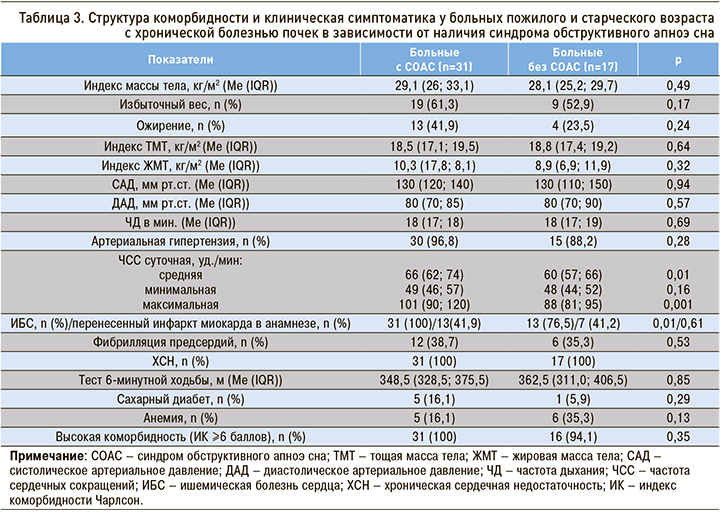
Обращала на себя внимание более высокая суточная частота сердечных сокращений у больных с ХБП и СОАС по сравнению с пациентами без СОАС: 60 (57; 66) против 60 (57; 66) уд./мин (р=0,01).
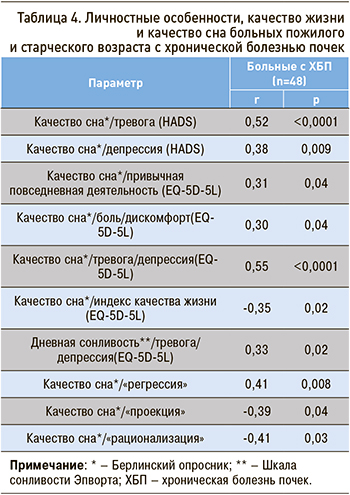 При анализе личностных особенностей и качества жизни пациентов пожилого и старческого возраста с ХБП отмечались выраженность тревожных и депрессивных реакций, нарушение привычной деятельности, усиление боли и дискомфорта, а также снижение индекса качества жизни (EQ-5D-5L) при нарушении качества сна и наличии дневной сонливости (табл. 4).
При анализе личностных особенностей и качества жизни пациентов пожилого и старческого возраста с ХБП отмечались выраженность тревожных и депрессивных реакций, нарушение привычной деятельности, усиление боли и дискомфорта, а также снижение индекса качества жизни (EQ-5D-5L) при нарушении качества сна и наличии дневной сонливости (табл. 4).
При снижении качества сна пациенты пожилого и старческого возраста с ХБП реже использовали зрелые механизмы психологической защиты, такие как «проекция» (r=-0,39; p=0,04) и «рационализация» (r=-0,41; p=0,03). Была обнаружена ассоциация выраженности нарушений сна и напряженности примитивного механизма психологической защиты «регрессия» (r=0,41, p=0,008), что способствует нарушению адаптации больных пожилого и старческого возраста с ХБП.
ОБСУЖДЕНИЕ
В нашей работе высокий риск СОАС наблюдался у большинства (70,8%) пациентов пожилого и старческого возраста с ХБП, при этом данный синдром был диагностирован у более половины больных (64,5%). По данным литературы, распространенность СОАС у больных с ХБП варьируется от 40 до 70% при терминальной ХБП [9, 17]. В нашей работе не было выявлено разницы между частотой СОАС в зависимости от пола, наличия ХБП и ее стадии; вероятно, это объясняется особенностью возрастной группы, высокой сердечно-сосудистой коморбидностью пациентов с ХБП и наличием в структуре ХБП в основном 3а стадии (73% среди больных с этим диагнозом).
Отдельно отметим, что, несмотря на наличие жалоб на нарушение качества сна и высокий риск СОАС при проведении скрининга, только два пациента, участвовавших в нашем исследовании, обратились за помощью к сомнологу в течение года. Это отражает общий низкий уровень медицинской информированности пациентов и доступности качественной сомнологической помощи [18]. Зачастую СОАС остается недиагностированным даже при тяжелой степени [19].
У участников нашего исследования была высокая сердечно-сосудистая коморбидность – более 78% имели три и более сердечно-сосудистых патологии. У больных СОАС вследствие гипоксемии, гиперактивации симпатической нервной системы и оксидативного стресса развивается эндотелиальная дисфункция, что также обусловливает развитие «порочного круга» при ХБП на фоне сердечно-сосудистой коморбидности [18, 20]. Средний уровень насыщения кислородом у больных пожилого и старческого возраста с ХБП в нашей работе составил 92,7% (91,9; 93,5) при норме >93%. По данным Marrone O. et al. (2016), минимальное насыщение кислородом выступает фактором развития ХБП с увеличением на 2% на каждую единицу снижения минимальной сатурации [21]. Наличие гипоксии при СОАС увеличивает риск снижения функции почек в 2,89 раз (доверительный интервал (ДИ): 1,25–6,67) в течение двух лет [22].
Вероятность развития ХБП у пациентов старшей возрастной группы с СОАС, по данным Lin Y.S. et al. (2017), составляет 1,37 (95% ДИ: 1,05–1,77; p <0,019) и не зависит от пола [23]. Согласно выводам ряда исследований, высокая распространенность СОАС при ХБП не объясняется только возрастом, избыточной массой тела/ожирением и коморбидностью; предполагается, что наличие ХБП само по себе служит основной причиной СОАС, особенно у пациентов с терминальной стадией почечной недостаточности [24]. В то же время, если проанализировать результаты нашей работы, то с учетом старшей возрастной группы, высокой коморбидности пациентов и преобладания 3а стадии ХБП высокую распространенность СОАС в исследовании можно объяснить не наличием ХБП, а совокупностью факторов риска и ассоциированных состояний, свойственных высокой коморбидности [25].
В исследовании наблюдалась ассоциация тревожных и депрессивных реакций и снижения индекса качества жизни на фоне нарушения качества сна. При оценке механизмов адаптации наличие СОАС приводило к дезадаптивным механизмам психологической защиты («регрессия»). Последние ассоциируются со слабым эмоционально-волевым контролем, приводят к нарушению социального функционирования, что крайне важно для качества жизни пациентов старшей возрастной группы [26]. По данным литературы, СОАС приводит к снижению качества жизни, прежде всего за счет повышения уровня депрессии [27].
ЗАКЛЮЧЕНИЕ
У больных пожилого и старческого возраста с ХБП наблюдается высокая распространенность СОАС и значительная дневная сонливость. СОАС был впервые диагностирован у 31 (64,5%) пациента пожилого и старческого возраста с ХБП, несмотря на высокий риск и клиническую симптоматику. Пациенты пожилого и старческого возраста с ХБП и СОАС имеют высокую коморбидность, в том числе сердечно-сосудистую, что может объяснить высокую частоту СОАС. Нарушение качества сна, дневная сонливость ассоциируются с выраженностью тревоги, депрессией, снижением качества жизни и дезадаптацией.


