Клещевой энцефалит (КЭ) является наиболее распространенной вирусной инфекцией нервной системы в Европе и нескольких регионах Азии. Прошло уже более 85 лет, когда впервые в 1934 г. выпускник Государственного института медицинских знаний (Ленинград), молодой невролог, военврач Александр Гаврилович Панов обратил внимание на значительный рост загадочной тяжелой инфекции в весенне-летний период среди лиц, посещающих лес, особенно среди работников лесозаготовительных пунктов на Дальнем Востоке [1]. В течение нескольких лет он провел большую исследовательскую работу в плане изучения неизвестной болезни: предложил название, доказал весенне-летнюю сезонность ее обострений среди жителей таежных районов, описал клинические проявления, течение и исходы. В 1937 г. во время первой научной экспедиции по изучению летнего энцефалита на Дальнем Востоке два отечественных вирусолога, Лев Александрович Зильбер и Михаил Петрович Чумаков, открыли новый нейротропный вирус, который представляет собой сферическую липид-обернутую рибонуклеиновую кислоту семейства флавивирусов (Flaviviridae), переносимых клещами, т.е. относящихся к группе арбовирусов («рожденных членистоногими»).
При анализе генома установлено существование трех подтипов вируса КЭ: европейский, сибирский и дальневосточный [2, 3]. Они генетически очень тесно связаны между собой: вариация аминокислотных последовательностей между подтипами составляет 5–6% [2]. Несмотря на ярко выраженное генетическое сходство подтипов, клинические проявления и течение инфекции, вызываемые разными подтипами вируса КЭ, имеют отличия [2].
В связи с тяжестью клинических проявлений, отсутствием этиологического лечения, значительной долей больных с неполным выздоровлением после перенесенного острого периода инфекции, а также устойчиво высоким уровнем заболеваемости (более того, в некоторых странах наблюдается ее возрастание) КЭ представляет собой серьезную проблему общественного здравоохранения, которая может быть существенно уменьшена с помощью современных профилактических мер [2].
Цель исследования – охарактеризовать эпидемиологические особенности КЭ на территории Томской области в 2000–2020 гг. и проанализировать мероприятия по профилактике заболеваемости этой инфекцией.
МАТЕРИАЛЫ И МЕТОДЫ
Использованы данные формы федерального статистического наблюдения № 1, 2 «Сведения об инфекционной и паразитарной заболеваемости» и № 5 «Сведения о профилактических прививках» за эпидемиологические сезоны 2000–2020 гг., результаты клинических осмотров госпитализированных пациентов и амбулаторные карты лиц, переболевших КЭ с 2000 по 2020 г., в Томской области.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Территория Томской области уже многие годы является природным очагом инфекций, передаваемых иксодовыми клещами. Так, в эпидемиологические сезоны 2000–2020 гг. в лечебно-профилактических учреждениях Томской области было зарегистрировано 392 528 человек, пострадавших от присасывания клещей (в среднем 18 692 человека в год). Среди лиц с присасыванием клеща добровольным медицинским страхованием (ДМС) было охвачено 205 786 человек, что составило 52,4% от числа обратившихся в пункты профилактики (в среднем застрахованных по системе ДМС – 9800 человек в год). За 2000–2020 гг. в Томской области зарегистрировано 4726 случаев КЭ. При этом интенсивный показатель заболеваемости КЭ населения Томской области на протяжении последних десятилетий в 16 раз превышал федеративные данные: например, в 2001 г. он составил 72,8 (по России в целом – 4,5) на 100 тыс. населения. В последние годы (2016–2020) наблюдается устойчивое снижение встречаемости КЭ. Так, в указанный период показатель заболеваемости КЭ в пересчете на 100 тыс. человек снизился в 2,3 раза (с 6,87 в 2016 г. до 2,96 в 2020 г.). В 2020 г. было зарегистрировано наименьшее количество заболевших КЭ – 32 человека.
КЭ занимает особое место среди природно-очаговых заболеваний: он характеризуется разнообразием как клинических проявлений острого периода, так и исходов с нередкой хронизацией заболевания (до 20%) и вероятностью летальных случаев (1,4–9%), частота которых зависит от дозы попавшего в организм вируса и его серотипа, характера иммунного ответа, адекватности лечения, а также эффективности экстренной профилактики [4–6]. При современных методах лечения исходы КЭ значительно улучшились. Однако до сих пор сохраняются летальные случаи, связанные с этой инфекцией, наиболее частой причиной которых служит остановка дыхания в результате вовлечения в воспалительный процесс наиболее важных отделов ретикулярной формации ствола головного мозга («дыхательного и сердечно-сосудистого центра»). К клиническим признакам неблагоприятного течения заболевания можно отнести повышение температуры тела постоянного типа до 39–40 °С в течение 3–4 дней с последующим ее снижением по типу кризиса; гиперемию кожи, «пылающее лицо» с инъекцией сосудов склер и особенно периодическую смену гиперемии бледностью кожи; гипергидроз, гиперсаливацию; раннее помрачение сознания, развитие инфекционного делирия; повышение артериального давления или его колебания; выраженную тахи- или брадикардию либо их смену; учащение дыхания и его аритмичность; повышение в ликворе уровня белка, нарастающий плеоцитоз и особенно появление нейтрофилов [7].
В Томской области за последние 20 лет было зарегистрировано 30 летальных случаев КЭ: 22 у мужчин и 8 у женщин (рис.).
Распределение летальных случаев, связанных с КЭ, в зависимости от пола и возраста заболевших за тот же период отражено в таблице.
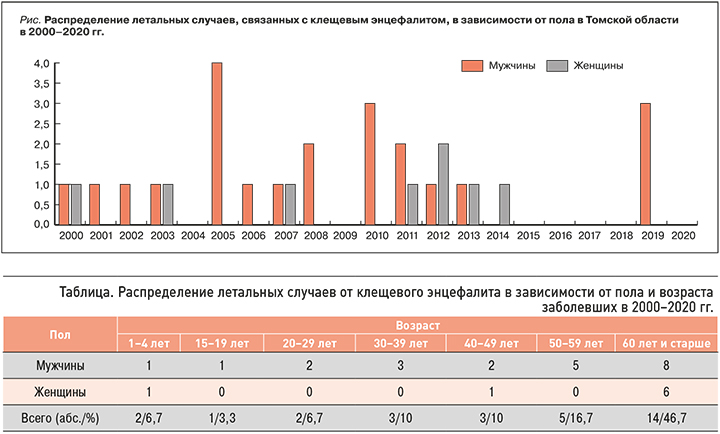
На протяжении многих лет среди тех, кто скончался от вируса КЭ, наблюдается преобладание лиц мужского пола. В возрастном отношении летальные исходы наиболее часто регистрировались у пациентов 50–59 лет (16,7 %) и ≥60 лет (46,7 %). Среди лиц активного и продуктивного возраста отмечено 8 летальных случаев: 6,7% – в группе 20–29 лет, 10% – 30–39 лет, 10% – 40–49 лет. К сожалению, они были также зарегистрированы у двоих детей в возрасте от 1 года до 4 лет (6,7 %) и у одного подростка 18 лет (3,3 %).
Эти данные подтверждают тенденции последних десятилетий – «омоложение» заболеваемости КЭ и ее возрастание среди инфицированных старших возрастных групп.
Анализ факта инфицирования погибших показал, что только 20 человек смогли достоверно указать на его вероятную причину: присасывание клещей (n=19) и обнаружение ползающих клещей (n=1). В 6 случаях пострадавшие факт присасывания клещей отрицали. Возможно, у них имело место кратковременное присасывание клещей-самцов, что могло остаться незамеченным. У остальных 4 пострадавших обстоятельства заражения установить не удалось, так как в связи с тяжестью состояния этих больных в момент госпитализации сбор эпидемиологического анамнеза у них был невозможен.
Манифестация инфекции в 8 случаях, завершившихся летальным исходом, была зарегистрирована в первые 10 дней от момента присасывания клеща, еще в 8 случаях – через 12–18 сут, а в 1 случае клинические признаки заболевания появились только через 7 мес после присасывания клеща. Считается, что на распространение и реализацию жизненного цикла вируса КЭ в организме человека, а также на развитие инфекционного заболевания оказывают влияние индивидуальные особенности как неспецифического, так и специфического иммунитета [8].
В процессе исследования выяснилось, что только 5 человек обратились в медицинские организации в первые 10 дней от момента инфицирования КЭ. 11 пациентов сделали это на 12–30-й день, еще один лишь через 7 мес после контакта с клещом. Поздние обращения были связаны с отсутствием клинических симптомов у пострадавших в течение длительного времени. У остальных 13 погибших сроки обращения в лечебные учреждения от момента присасывания клеща установлены не были (6 отрицали факт присасывания, 4 находились в тяжелом состоянии, 3 не смогли назвать точной даты возможного инфицирования).
Среди всех погибших только 6 пациентов обратились в пункты серопрофилактики в первые 3 дня после присасывания клеща: 4 из них получили иммуноглобулин человека против КЭ в стандартной дозировке, еще двоим препаратам введен не был, так как лабораторные исследования клеща (1 случай) и крови (1 случай) были отрицательными. Остальные 24 пострадавших не получили экстренную профилактику, так как не обращались в пункт серопрофилактики.
У 10 пациентов диагноз КЭ был верифицирован серологическим тестом с помощью иммуноферментного анализа уже в первый день госпитализации, у 12 – на 2–4-е сутки, у 2 – на 7-й день. В 22 случаях были обнаружены ранние антитела (IgM), в 2 – только поздние (IgG). Наличие поздних антител в одном случае было связано с поздним обращением за медицинской помощью (пациент заболел в мае, обратился в октябре), в другом, возможно, с курсами вакцинации (уточнить этот факт не удалось, так как больной был доставлен в состоянии комы). У 6 пациентов отсутствовало лабораторное подтверждение КЭ на момент госпитализации; у одного из них результаты лабораторного исследования были отрицательные, у 5 оно не проводилось.
Обнаружение антигенов возбудителя КЭ в крови у 10 пострадавших свидетельствовало об инфицированности вирусом; у 6 из них также были выявлены ранние антитела (IgM), у 3 не были найдены ни ранние, ни поздние антитела (IgM и IgG), у 1 были зафиксированы только поздние антитела (IgG), что может указывать на вакцинальный иммунитет. Дополнительно у 5 больных применяли прямой метод диагностики вируса КЭ в крови – полимеразную цепную реакцию (ПЦР). У двух из этих пациентов была выявлена РНК вируса КЭ. Кроме того, исследование спинномозговой жидкости методом ПЦР у трех человек позволило обнаружить РНК вируса КЭ в двух случаях.
У 28 погибших была верифицирована менингоэнцефалитическая форма КЭ, в двух случаях – менингоэнцефалополиомиелитическая.
Патологоанатомическое вскрытие было выполнено в 19 случаях. Полное совпадение патологоанатомического диагноза с клинически верифицированным прижизненным диагнозом имело место у 14 погибших, в 5 случаях не было ни серологического, ни вирусологического доказательства клинического диагноза, но было получено патологоанатомическое подтверждение КЭ по результатам вскрытия. В 11 случаях вскрытие не проводилось по разным причинам.
У 0,3–15% больных тяжелыми очаговыми формами КЭ в течение 1 года после острого периода отмечается развитие хронического (прогредиентного) течения заболевания, однако такой переход возможен и через несколько лет. Характерно прогрессирование очаговой неврологической симптоматики. Продолжительность хронического течения КЭ варьируется от 1–2 до 10–20 лет. Летальность составляет 7–10%, остальные пациенты остаются инвалидами [9].
Гиперкинетическая форма КЭ по типу эпилепсии Кожевникова сопровождается развитием в определенной группе мышц, чаще плечевого пояса, односторонней амиотрофии в сочетании с умеренным гомолатеральным центральным гемипарезом. На этом фоне в этой группе мышц при сохраненном сознании появляются локальные неритмичные клонические гиперкинезы постоянного характера с периодическим появлением вторичных генерализованных судорожных приступов. Нарушения психики и интеллекта бывают редко. Другой вариант гиперкинетической формы КЭ представлен миоклониями, хореей и атетозом как без эпиприпадков, так и с развитием генерализованных судорожных приступов [7].
К тяжелым формам КЭ относится амиотрофическая форма в виде полиомиелитического синдрома (асимметричный вялый периферический парез верхних конечностей с преимущественным вовлечением проксимальных отделов) чаще на шейном уровне спинного мозга. При вовлечении в патологический процесс двигательных бульбарных ядер ствола головного мозга наблюдается бульбарный синдром в рамках полиоэнцефалитического синдрома. При поражении центрального верхнего и периферического мотонейрона развивается синдром бокового амиотрофического склероза, преимущественно на уровне шейно-грудного утолщения спинного мозга или продолговатого мозга с характерным верхним смешанным (центральным и периферическим) парапарезом [7].
К резидуальным явлениям у переболевших можно отнести постинфекционную церебрастению, которая может сопровождаться головными болями (диффузными, чаще в утренние часы и во второй половине дня, после утомления и физической работы) и головокружениями, повышенной утомляемостью, раздражительностью, снижением памяти и бессонницей, плохой переносимостью жары и душных помещений, парестезиями. Кроме того, возможно развитие стойкой артериальной гипотонии, снижение слуха и зрения, а также половой потенции у мужчин [7].
В настоящее время система профилактики КЭ, а также предупреждение развития тяжелых клинических форм болезни включает следующие основные направления [10]:
- своевременную вакцинацию населения;
- проведение экстренной (постэкспозиционной) профилактики лицам, пострадавшим от присасывания вируссодержащих клещей и не вакцинированным ранее, с помощью введения иммуноглобулина человека против КЭ;
- обращение за медицинской помощью, проведение адекватного лечения и диспансерного наблюдения за реконвалесцентами клещевых инфекций.
На сегодняшний день общепризнано, что наиболее эффективной основой борьбы с КЭ служит вакцинопрофилактика, которая позволяет в большинстве случаев предупредить развитие заболевания.
В Томской области в эпидемиологические сезоны 2000–2020 гг. вакцинопрофилактикой было охвачено 1 143 922 человека, из которых впоследствии заболели только 360 (0,03%). Ежегодно в среднем вакцинируется 54 тыс. человек. Привитость населения Томской области в 2000–2020 гг. варьировала от 14,5 до 23,9%. Иммунная прослойка населения за анализируемый период составила в среднем лишь 19,2±4,7%. Таким образом, большую часть (80,8±4,7%) населения составляли невакцинированные жители области. Увеличение охвата вакцинированных лиц не всегда возможно, так как активная иммунизация может быть противопоказана по состоянию здоровья. К таким лицам относятся больные туберкулезом, хроническими заболеваниями сердечно-сосудистой системы, почек и печени, пациенты со злокачественными новообразованиями и болезнью крови.
Несмотря на разнообразие вирусов КЭ, на территории России доминирует сибирский подтип вируса. Как показали исследования, применяемые в настоящее время вакцины «Клещ-Э-Вак» (Россия) и ФСМЕ-ИММУН (Австрия) индуцируют антитела ко всем трем подтипам вируса в защитных титрах [11].
В последнее время в литературе сообщается о наличии разных штаммов вирусов КЭ и их постоянной мутации [12, 13]. Это означает, что в будущем, возможно, потребуется мониторировать циркулирующие серотипы вируса КЭ, и на основании результатов мониторинга обновлять вакцины.
Настороженность населения в отношении КЭ и уровень охвата вакцинированных лиц значительно колеблется в зависимости от эндемичности региона. В то же время вне зависимости от этого критерия незыблемым остается постулат о необходимости проведения экстренной профилактики после присасывания клеща [4, 14]. Для этой цели применяется пассивная иммунизация гомологичным противоклещевым иммуноглобулином [15].
В Томской области иммуноглобулин используется для экстренной профилактики КЭ уже более 70 лет. В эпидемиологические сезоны 2000–2020 гг. противоклещевой иммуноглобулин получили 82 066 пострадавших от присасывания иксодовых клещей только после положительного результата исследования клеща или крови, из них заболели 926 (1,1%) пациентов.
Противоклещевой иммуноглобулин отечественного производства представляет собой фракцию белка, выделенную из сыворотки или плазмы иммунизированных доноров, которая содержит антитела к вирусу КЭ в титре 1/80–1/160. Введение препарата рекомендуется непривитым детям и взрослым в течение 72 ч после присасывания клеща в дозе 0,1 мл на 1 кг массы тела внутримышечно (максимально 8,0 мл). Австрийский противоклещевой иммуноглобулин (ФСМЕ-БУЛИН), содержащий антитела к вирусу КЭ в дозе 1/640, назначается в дозе 0,05 мл на 1 кг массы тела до посещения леса, в дозе 0,1 мл на 1 кг массы тела после присасывания клеща в течение 48 ч и в дозе 0,2 мл на 1 кг массы тела в течение 96 ч [6].
Вирус КЭ распространяется гематогенным и невральным путем, в связи с чем быстро попадает в центральную нервную систему, куда антитела введенного противоклещевого иммуноглобулина не проникают [16]. Следовательно, введение иммуноглобулина целесообразно проводить не позднее первых 72 ч после присасывания (для применения отечественного иммуноглобулина) или 96 ч (для австрийского иммуноглобулина). В противном случае применение иммуноглобулина будет недостаточно эффективным вследствие иммуносупрессорного действия и подавления синтеза собственных антител.
Введение иммуноглобулина противопоказано лицам с предшествующими аллергическими реакциями на введение белковых препаратов крови. Кроме того, в настоящее время общепризнано, что препарат имеет высокую себестоимость [17]. Учитывая ограничения применения противоклещевого иммуноглобулина, возникает ряд вопросов. Какой должна быть профилактика непривитых в случае противопоказаний к введению противоклещевого иммуноглобулина? Какой алгоритм профилактики нужно использовать в случае обращения при многократных присасываниях клещей за один эпидемический сезон, если известно, что специфические иммуноглобулины обладают иммунодепрессивным действием, в силу чего их введение нецелесообразно более 2–3 раз одному и тому же человеку на протяжении всей жизни [10]?
В настоящее время остается актуальным поиск и расширение дополнительных мер для экстренной профилактики КЭ, которые предупреждали бы репликацию вируса в клетке и его персистенцию, способствуя снижению заболеваемости. Все это послужило основанием для разработки профилактических подходов, которые предполагают применение препаратов с комплексным механизмом действия, направленным как на борьбу с вирусом, так и повышение неспецифической резистентности организма.
В последние годы одним из перспективных направлений экстренной профилактики КЭ стало использование препаратов интерферонов и их индукторов [18]. Среди индукторов интерферонов с этой целью наиболее широко применяют йодофеназон (Йодантипирин®) – перспективный препарат с доказанной эффективностью, который зарегистрирован в Минздраве России (РУ ЛС002505 от 16.09.2011) как лекарственное средство для лечения и профилактики КЭ у взрослых пациентов.
Йодофеназон является индуктором эндогенного интерферона, относящимся к группе противовирусных и противовоспалительных средств. Он обладает противовирусной, иммуностимулирующей и интерфероногенной активностью (индуцирует выработку альфа- и бета-интерферонов), стимулирует как клеточный, так и гуморальный иммунитет, снижает проницаемость мембран, тормозя проникновение вируса в клетку и подавляет репродукцию РНК- и ДНК-содержащих вирусов, стабилизирует биологические мембраны и является эффективным средством коррекции иммунитета при разных вирусных инфекциях и иммунодефицитных состояниях [10].
Йодофеназон – химический препарат, который может быть произведен в достаточном количестве для оказания помощи лицам, не имеющим возможности получить с профилактической целью иммуноглобулин человека против КЭ. Таблетированная форма и условия хранения препарата (при комнатной температуре) позволяют иметь его в аптечке в течение всего сезона и применять сразу после обнаружения присосавшегося клеща, что особенно актуально в медицинских учреждениях отдаленных районов, в условиях экспедиций и в других сходных ситуациях.
За годы применения йодофеназона были получены обширные данные об эффективности и безопасности его использования на эндемичных территориях России, а в 2008 г. препарат был включен в территориальный список жизненно необходимых лекарственных средств для лечения населения Томской области [10, 19].
В Томской области в 2000–2020 гг. профилактика йодофеназоном была проведена 19 734 обратившимся, из которых заболели 108 человек (0,5%).
Преимущества йодофеназона:
1. Экстренная профилактика препаратом может проводиться до получения результатов исследования клеща или крови, при невозможности провести лабораторное исследование клеща и крови, при позднем обращении пациента в пункт профилактики (после 3–4 сут от момента присасывания клеща), лицам, имеющим противопоказания к введению специфического иммуноглобулина или вакцинации.
2. Препарат может использоваться в качестве дополнительной меры профилактики у лиц, прошедших как полный, так и неполный курс вакцинации против КЭ.
3. Препарат малотоксичен: не обладает мутагенным, эмбриотоксическим, иммунотоксическим и аллергенным действием.
4. Препарат имеет пероральный путь введения.
ЗАКЛЮЧЕНИЕ
В Томской области за последние годы на фоне устойчивой тенденции к снижению общей распространенности КЭ отмечается омоложение болезни и рост заболеваемости среди инфицированных лиц старших возрастных групп. Летальные исходы, связанные с вирусом КЭ, чаще наблюдались у лиц мужского пола. При этом у погибших преобладала менингоэнцефалитическая форма КЭ.
В настоящее время система профилактики заболевания КЭ включает вакцинацию, экстренную (иммуноглобулин) и химиопрофилактику. За анализируемый период большую часть (80,8±4,7%) населения составляли невакцинированные жители области. Неспецифическая химиопрофилактика позволяет упростить систему организации и проведения экстренной профилактики пострадавшим от присасывания клещей, предотвратить риск осложнений, связанных с парентеральным введением донорского противоклещевого иммуноглобулина.


