Системная склеродермия (ССД), или прогрессирующий системный склероз (код по МКБ-10 М34.0), – хроническое аутоиммунное заболевание, характеризующееся генерализованной микроангиопатией, иммунной дисрегуляцией и активацией процессов фиброзообразования, приводящих к фиброзу кожи и внутренних органов [1]. Распространенность заболевания составляет 20–50 случаев на миллион в странах Азии, 100–200 – в странах Европы, 200–260 – в США. ССД чаще встречается у пациенток женского пола (соотношение женщин и мужчин 3–8:1) [2].
Клиническая картина ССД отличается значительным полиморфизмом. Спектр его проявлений включает как фатальные, быстро прогрессирующие, так и длительно текущие, относительно доброкачественные варианты болезни, протекающие субклинически. По выраженности вовлечения кожи выделяют две основные клинические формы ССД: а) диффузную, с обширным поражением кожи и внутренних органов; б) лимитированную, когда поражение кожи ограничено дистальными отделами конечностей и лицом [1]. В 1–2% болезнь протекает без поражения кожи [3]. Такую форму называют висцеральной (scleroderma sine scleroderma). Диагноз висцеральной формы ССД, как правило, устанавливается поздно, так как клинические признаки поражения внутренних органов в этом случае неспецифичны. Классификационные критерии диагностики ССД позволяют выявить его висцеральную форму по совокупности признаков, включающих, наряду с клиническими симптомами, специфичные для заболевания аутоантитела и характерные микроциркуляторные изменения, выявляемые с помощью видеокапилляроскопии ногтевого ложа [4]. Поздняя диагностика ССД при висцеральной форме, часто протекающей хронически, может быть связана с медленным (в течение многих лет) формированием полисистемной картины и длительным периодом моноорганного поражения (легких, сердца, желудочно-кишечного тракта).
У 70–80% пациентов с ССД, чаще при диффузной и висцеральной формах, развивается интерстициальный легочный фиброз, нередко осложняющийся вторичной артериальной гипертензией. Это приводит к хронической дыхательной недостаточности и/или легочно-сердечной недостаточности, которые становятся частой причиной смерти при этом заболевании [5–9]. Интерстициальное поражение легких – самое неблагоприятное проявление болезни в плане прогноза течения и исхода. Интерстициальный легочный фиброз у пациентов с ССД является результатом сложного взаимодействия между повреждением альвеолоцитов, эндотелиальной дисфункцией, активацией иммунных клеток, выработкой профибротических цитокинов и аутоантител, нарушением обмена межклеточного матрикса, способствующего накоплению коллагена и развитию фиброза [8, 10, 11].
При ССД могут встречаться все известные морфологические типы интерстициальных пневмоний (десквамативная интерстициальная пневмония, криптогенная организующаяся пневмония, респираторный бронхиолит с другим интерстициальным заболеванием легких, легочный фиброз), но наиболее часто выявляется неспецифическая интерстициальная пневмония. В части наблюдений может иметь место сочетание нескольких форм интерстициального поражения легких. При наличии выраженного интерстициального фиброза легких на поздних стадиях течения ССД очень сложно дифференцировать с идиопатическим легочным фиброзом [9,12, 13].
Учитывая, что средний возраст дебюта ССД приходится на 30–40 лет, по мере прогрессирования основного заболевания к нему присоединяются коморбидные состояния, ассоциированные с возрастом, что также затрудняет своевременную диагностику.
В связи с редкостью висцеральной формы ССД, трудностями ее диагностики, недостаточно изученным течением и исходом нам представилось целесообразным поделиться собственным клиническим наблюдением.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациентка, 78 лет, в течение последних 3 лет лечилась в НИИ ревматологии им. В.А. Насоновой, умерла дома.
Анамнез заболевания: в 2006 г. появилась одышка и снижение толерантности к физической нагрузке; по результатам компьютерной томографии (КТ) легких были обнаружены диффузные интерстициальные фиброзные изменения в легких. В конце 2011 г. пациентка перенесла бактериальную пневмонию. С декабря 2012 г. усилилась и стала прогрессировать одышка при физической нагрузке, по поводу чего больной был назначены системные глюкокортикостероиды (ГКС) – метилпреднизолон в дозе 24 мг/сут; на фоне приема препарата развился грибковый эзофагит.
В мае 2013 г. пациентка была обследована в пульмонологическом отделении Федерального научно-клинического центра ФМБА России, где у нее был выявлен синдром Рейно и поставлен диагноз интерстициального заболевания легких с исходом в сотовое легкое неуточненного генеза. Больная продолжала получать ГКС; в сентябре 2015 г. на фоне снижения их дозы значительно усилилась одышка, появился приступообразный кашель, повысилась температура. Больная была госпитализирована в ФГБУ «Клиническая больница» Минздрава России (г. Москва), где у нее при бодиплетизмографии было обнаружено значительное нарушение функции внешнего дыхания по рестриктивному типу c бронхообструктивным компонентом (общая емкость легких (ОЕЛ) 77%, жизненная емкость легких (ЖЕЛ) 69%, форсированная жизненная емкость легких (ФЖЕЛ) 69%, сопротивление дыхательных путей (RAW) 278%).
В январе 2018 г. в связи с ухудшением состояния пациентка впервые была госпитализирована в НИИ ревматологии им. В.А. Насоновой, где ей был установлен следующий диагноз: «системная склеродермия, висцеральная форма (без поражения кожи), хроническое течение: синдром Рейно, телеангиэктазии, интерстициальное поражение легких, легочная гипертензия, кардиопатия (адгезивный перикардит)». При капилляроскопии был выявлен переходный неактивный склеродермический тип изменений. Диагноз висцеральной склеродермии расценивался как достоверный, соответствовал критериями ACR/EULAR 2013 г. (сумма значений признаков 9 баллов). Значение С-реактивного белка (СРБ) составило 12,6 мг/л. В ходе исследования функции внешнего дыхания было установлено снижение диффузной способности легких тяжелой степени (DLCO 55,3%) при ФЖЕЛ (FVC) 93,9%. По данным эхокардиографии систолическое давление в легочной артерии (СДЛА) составило 52 мм рт.ст., что свидетельствовало о вторичной артериальной легочной гипертензии.
Результаты консультации кардиолога: хроническое легочное сердце. Легочная гипертензия. Ишемическая болезнь сердца (ИБС). Стенокардия напряжения II функционального класса (ФК). Атеросклероз аорты, коронарных артерий. Адгезивный перикардит. Артериальная гипертензия. Нарушения ритма сердца: пароксизмальная мерцательная аритмия (СНА2DS2-VASc = 6, HAS-BLED = 2), пробежки наджелудочковой тахикардии, частая наджелудочковая экстрасистолия. Хроническая сердечная недостаточность 2А ФК II. Дислипидемия.
Пациентка продолжила прием ГКС, также ей были рекомендован иммуносупрессант гидроксихлорохин (не принимала).
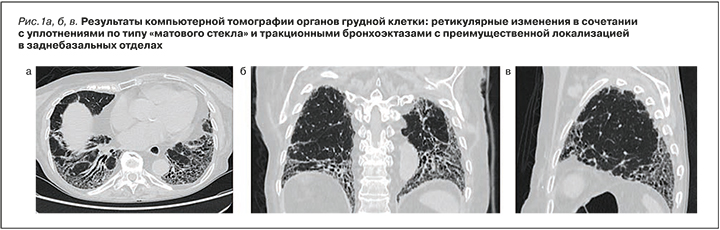
Повторная госпитализация в НИИ ревматологии им. В.А. Насоновой произошла в мае 2019 г. в связи с усилением болей в суставах, нарастанием одышки, слабости. При обследовании отмечена отрицательная динамика легочной функции: ФЖЕЛ 59%, диффузионная способность легких 50%, некоторая тенденция к увеличению СДЛА (с 52 до 56 мм рт.ст.). Больная продолжала получать ГКС, ей вновь был рекомендован иммуносупрессант (микофенолата мофетил). При повторной КТ грудной клетки 23 октября 2019 г. были обнаружены диффузное усиление легочного рисунка, деформированного за счет интерстициального компонента, выраженные диффузные субплевральные фиброзные уплотнения тяжисто-сетчатого характера, больше выраженные в нижнелатеральных отделах легких, с наличием двусторонних симметричных тракционных бронхоэктазов (рис. 1, а, б, в). Свежие очаговые и инфильтративные изменения на этом фоне выявлены не были. Расширение ствола легочной артерии составило до 3,6 см, правой легочной артерии – 2,5 см, левой – 2,6 см. В последующем пациентка наблюдалась в поликлинике по месту жительства, умерла дома.
Заключительный поликлинический диагноз:
- основное заболевание: системная склеродермия (леченная ГКС), висцеральная форма, хроническое течение: синдром Рейно, телеангиэктазии, интерстициальное заболевание легких со снижением диффузионной способности тяжелой степени;
- осложнения: легочная гипертензия. Кардиопатия: адгезивный перикардит, пароксизмальная форма мерцательной аритмии, частая наджелудочковая экстрасистолия.
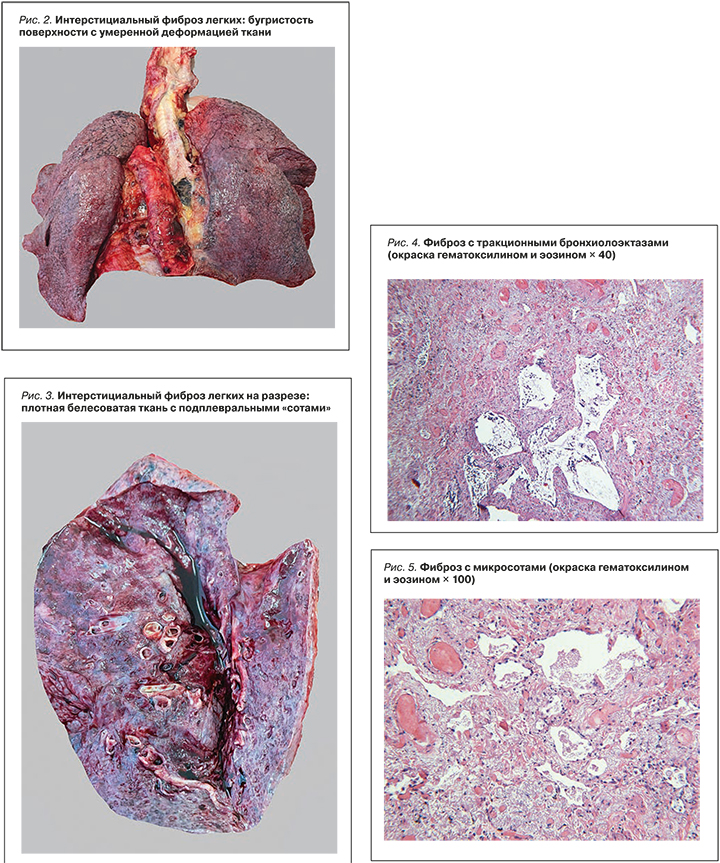
Данные аутопсии: масса легких 1200 г, нижние доли легких резиновой плотности, поверхность бугристая (рис. 2), серо-красного цвета, на разрезе темно-красного и сероватого цвета под висцеральной плеврой в нижних долях на глубину до 2 см, с множественными субплевральными тонкостенными полостями («сотами») диаметром от 0,2 до 0,4 см (рис. 3). С поверхностей разрезов стекает умеренное количество розовой пенистой жидкости, что свидетельствует об умеренно выраженном отеке легких.
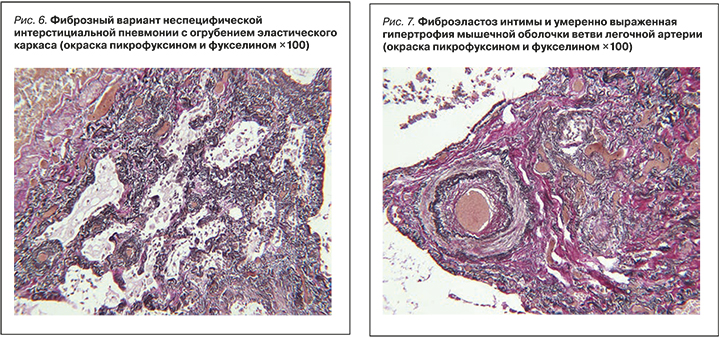
При гистологическом исследовании в легких выявлены обширные поля рыхлого фиброза со множеством полостей причудливой формы и размеров, выстланных однорядным кубическим эпителием (рис. 4, 5), местами с очаговой плоскоклеточной метаплазией. В стенках полостей встречались единичные фибробластические фокусы, в части просветов полостей наблюдалось скопление слизи с единичными гигантскими многоядерными клетками с игольчатыми структурами, в участках фиброза отмечались деформированные терминальные бронхиолы (часть из них с гипертрофией мышечного слоя) и единичные тракционные бронхиолоэктазы. При окраске пикрофуксином и фукселином в участках фиброза преобладали эластические волокна.
В других участках легких наблюдалось утолщение межальвеолярных перегородок за счет выраженного фиброэластоза – неспецифическая интерстициальная пневмония (рис. 6). В ветвях легочной артерии был обнаружен фиброэластоз интимы и гипертрофия мышечного слоя с сужением части просветов (см. рис. 6, 7). В миокарде левого желудочка имелась гипертрофия значительной части кардиомиоцитов с перинуклеарными скоплениями зерен липофусцина, преимущественно периваскулярные прослойки фиброзной ткани.
На основании макро- и микроскопического исследования, изучения медицинской документации был сформулирован заключительный патологоанатомический диагноз:
- основное заболевание: системная склеродермия (леченная ГКС), висцеральная форма; хроническое течение: интерстициальный фиброз легких с сотовой дегенерацией; кардиомиопатия: диффузный кардиосклероз, пароксизмальная форма мерцательной аритмии, частая наджелудочковая экстрасистолия;
- осложнения: вторичная артериальная легочная гипертензия с легочным сердцем: СДЛА 52–56 мм рт.ст., атеросклероз легочной артерии (2 стадия, 1 степень), толщина миокарда правого желудочка 0,4 см, масса миокарда правого желудочка с частью межжелудочковой перегородки 75 г, желудочковый индекс 0,75. Венозное полнокровие и дистрофия внутренних органов: цианотическая индурация селезенки, мускатная печень. Отек головного мозга. Отек легких;
- сопутствующие заболевания: артериальная гипертензия (масса сердца 390 г, толщина миокарда левого желудочка 1,6 см, артериолонефросклероз). Атеросклероз аорты (4 стадия, 3 степень), венечных артерий сердца (4 стадия, 2 степень, стеноз просветов всех артерий на 25%), артерий основания головного мозга (2 стадия, 1 степень).
Непосредственная причина смерти – хроническая дыхательная и легочно-сердечная недостаточность.
ЗАКЛЮЧЕНИЕ
В представленном наблюдении заболевание дебютировало в пожилом возрасте (62 года) с признаков интерстициального заболевания легких. В течении заболевания пациентки можно выделить два этапа. На первом этапе (2006–2012) превалировала одышка, послужившая поводом обращения к врачу. После выявления фиброзных изменений в легких пациентка наблюдалась пульмонологами, получала ГКС-терапию большими дозами (до 6 таблеток в сутки) с определенным положительным эффектом, хотя, по данным КТ органов грудной клетки, проявления легочного фиброза прогрессировали. Второй этап болезни (2013–2020) начался с появления первого признака системности патологии – синдрома Рейно. В это же время в период обострения возникли симптомы поражения сердца в виде частой наджелудочковой тахикардии и пароксизмов фибрилляции предсердий, обнаружилось давление в легочной артерии до 52–55 мм рт.ст., рестриктивные нарушения легочной функции. В 2018–2019 гг. выявлялся позитивный антинуклеарный фактор (1/320, цитоплазматический тип свечения), что свидетельствовало о наличии аутоиммунных реакций, а также отмечались типичные для ССД признаки микроангиопатии по данным капилляроскопии. Сочетание признаков интерстициального поражения легких, сердца, микроангиопатия, телеангиэктазии на коже, аутоиммунные нарушения позволили установить диагноз висцеральной формы ССД через 13 лет от появления одышки. Течение болезни осложнилось развитием сахарного диабета 2 типа, артериальной гипертензии, атеросклерозом аорты, коронарных артерий с постепенным развитием дыхательной и хронической легочно-сердечной недостаточности.
К особенностям представленного случая висцеральной формы ССД следует отнести моноорганное начало заболевания с поражения легких по типу неспецифической интерстициальной пневмонии, большой интервал между поражением легких и появлением других признаков системного заболевания, позднюю нозологическую диагностику и относительно медленное прогрессирование, возможно, связанное с длительным лечением системными ГКС. При этом стандартной терапии иммуносупрессантами пациентка не получала. Второй особенностью представленного наблюдения можно считать наличие коморибидных заболеваний – артериальной гипертензии, сахарного диабета 2 типа, атеросклероза аорты и венечных артерий сердца с развитием хронической дыхательной и легочно-сердечной недостаточности.


