1. КРАТКАЯ ИНФОРМАЦИЯ
1.1. Определение
Неалкогольная жировая болезнь печени (НАЖБП) – хроническое заболевание печени метаболического генеза у лиц с отсутствием экзогенных факторов токсического поражения печени (например, этанолом), обусловленное накоплением липидов в составляющих печеночную дольку клеточных элементах, которое морфологически подтверждается стеатозом, стеатогепатитом, фиброзом, циррозом или аденокрациномой. Диагноз НАЖБП верифицируется при накоплении липидов в виде триглицеридов (ТГ) в количестве более 5–10% массы гепатоцитов или наличии более 5% печеночных клеток, содержащих депозиты липидов [1].
Согласно представлениям последних лет, НАЖБП включает два различных патологических состояния с различными прогнозами – стеатоз и неалкогольный стеатогепатит (НАСГ), причем последний может сопровождаться развитием фиброза. Стеатоз, вероятно, может выступать начальной стадией с последующим развитием НАСГ, но у большинства пациентов не происходит трансформации одной формы заболевания в другую. В соответствии с определением, предложенным ВОЗ (2018), НАСГ является клинически прогрессирующей формой НАЖБП с исходами, включающими сердечно-сосудистые события, цирроз или гепатоцеллюлярную карциному [2, 3].
В 2020 г. было опубликовано международное экспертное консенсусное заявление, предлагающее новое адаптивное понятие – МАЖБП: метаболически ассоциированная жировая болезнь печени (Metabolic (dysfunction) associated fatty liver disease). По мнению авторов консенсуса, предложенная трактовка заболевания позволяет не только подчеркнуть системность и многофакторность патогенеза унифицированного поражения печеночной паренхимы (например, взаимосочетание дисметаболических и алиментарно-токсических факторов), но и персонализировать объемы и направления лечебно-диагностической помощи при различных клинических вариантах МАЖБП-ассоциированной коморбидности [4–6].
Это предложение основывается в том числе на результатах эпидемиологического исследования многотысячной китайской популяции, продемонстрировавшего, что нарушения «циркадного ритма» (CircS) в виде диссомнии, депрессии, когнитивной дисфункции связаны с ключевыми компонентами метаболического синдрома (MetS) – стеатогепатитом, сахарным диабетом (СД) 2-го типа и сердечно-сосудистыми заболеваниями (ССЗ). Показано, что «циркадный синдром» служит более сильным предиктором сердечно-сосудистого риска, нежели непосредственно «метаболический синдром» [7].
Эксперты ‒ составители настоящих клинических рекомендаций, выражая полное согласие с представляемой авторами «Консенсуса» концепцией МАЖБП, тем не менее рекомендуют в повседневной практической деятельности использовать утвержденные ВОЗ соответствующие коды нозологических форм, указанные как в ныне действующей МКБ-10, так и во вступающей в силу через некоторое время МКБ-11.
Использование критериев МАЖБП может быть полезно для персонализации лечебно-диагностических мероприятий у пациентов с различными метаболическими факторами риска, а также в случаях, когда необходимо установить иную, не «метаболичекую» этиологию стеатоза и стеатогепатита.
1.2. Этиология и патогенез
Этиопатогенез НАЖБП подразумевает сложные взаимодействия между генетическими предпосылками, факторами внешней среды (характер питания и величина физической активности), гормональными расстройствами и др. [1].
Эндогенные факторы риска развития НАЖБП включают несбалансированное питание с пере- или недоеданием, низкую физическую активность, синдром избыточного бактериального роста с гиперэндотоксинемией, обусловливающий повышенную проницаемость кишечного слизисто-тканевого барьера, нарушение энтерогепатической циркуляции желчных кислот и т.д.
Нарушение целостности кишечного барьера является причиной транслокации в печень бактерий, вирусов и патоген-ассоциированных фрагментов молекул (pathogen-associated molecular patterns, PAMPs), к которым относятся липополисахариды (эндотоксины), бактериальные и вирусные РНК, избыточного количества сигнальных молекул газов (NH3–NH4+, H2S, NO) и т.п. Указанные образования активируют иммунную систему защиты печени – клетки Купфера, клетки ITO и другие, являющиеся триггерным механизмом не только для «печеночных» (цирроз, гепатокарцинома), но и в большей степени сердечно-сосудистых рисков [8].
Одним из ключевых механизмов развития НАЖБП и метаболического синдрома (МС) выступает нарушение чувствительности и количества рецепторов к инсулину – инсулинорезистентность (ИР), приводящее к нарушению липидного, углеводного и жирового обменов, результатом которого становится избыток производства свободных жирных кислот (СЖК).
В основе накопления триглицеридов в виде жировых вакуолей в гепатоците лежит дисбаланс между их поступлением/синтезом и утилизацией. Накопление жира в клетках печени (собственно стеатоз) является следствием повышения поступления СЖК в печень, снижения скорости бета-окисления СЖК в митохондриях, избыточного их синтеза, снижения синтеза или секреции липопротеидов очень низкой плотности (ЛОНП).
Понимание трансформации стеатоза в стеатогепатит многие годы основывалась на предложенной Day C.P. и James O.F. концепции «двойного удара». Первым этапом поражения печеночной дольки является переполнение ее элементов жировыми каплями, вторым – развитие воспаления в силу цитокиновой или токсической перегрузки постоянно проникающими в печень через нарушенный слизисто-тканевой барьер («дырявую кишку») продуктами провоспаления [9, 10].
Пришедшая на смену теория «множественных ударов» рассматривает многофакторные синергетические воздействия на генетически и эпигенетически предрасположенных к НАЖБП лиц. Это и резистентность к инсулину, и выработка адипокинов, и факторы питания, и микробиом кишечника и т.д. [11, 12].
Механизмами трансформации стеатоза в стеатогепатит служат повышение продукции жировой тканью фактора некроза опухоли-α (ФНО-α); увеличение концентрации СЖК, которые оказывают прямой повреждающий эффект на мембраны гепатоцитов; активация цитохрома Р450; повышение перекисного окисления липидов (ПОЛ); накопление реактивных форм кислорода (оксидативный стресс). Результатом этих патологических реакций становится хроническое воспаление (НАСГ). Предполагается, что одну из ключевых ролей в переходе стеатоза в стеатогепатит играют изменения кишечного микробиома и хроническое воспаление в жировой ткани. Постоянная перегрузка защитного барьера печени (клеток Купфера, клеток Ито, pit (пестрых)-клеток) стимулирует коллагенообразование и прогрессирование фиброза в печени, делая процесс необратимым.
Фиброз печени развивается у 15–20% больных НАЖБП стеатозом и может трансформироваться в цирроз, а при более длительном течении или воздействии повреждающих факторов – в гепатоцеллюлярную карциному (ГЦК).
Признаки НАЖБП также обнаруживают у 10–15% людей без клинических проявлений МС.
Коморбидность при НАЖБП обусловлена множественными метаболическими нарушениями, такими как инсулинорезистентность, атерогенная дислипидемия, артериальная гипертония (АГ), метаболический синдром, СД 2-го типа, висцеральное ожирение, поликистоз яичников, метаболические заболевания опорно-двигательного аппарата, фибромиалгии, полинейропатии и др.
Доказано, что НАЖБП – независимый предиктор высоких сердечно-сосудистых рисков, ГЦК, злокачественных новообразований различной локализации [13–15].
Одним из важных патогенетических механизмов развития и прогрессирования НАЖБП и ассоциированных состояний является «кишечно-печеночная ось», представляющая собой функционально тесную двустороннюю связь между кишечной микробиотой и печенью. Повышенная кишечная проницаемость, бактериальная транслокация и изменения состава микробиоты кишечника выступают важными патогенетическими элементами развития гепатита, инициации фиброзных изменений, формирования цирроза печени и его осложнений [16].
Метаанализ 10 исследований показал высокую связь между синдромом избыточного бактериального роста в тонкой кишке и НАЖБП [17].
Специфические дисбиотические изменения при НАЖБП показывают преобладание эндотоксин-продуцирующих грамотрицательных микроорганизмов, преимущественно семейства Enterobacteriaceae родов Escherichia (Proteobacteria) и Bacteroides (Bacteroidetes) [18, 19]. Вместе с тем количество таких грамотрицательных бактерий, как Prevotella (Bacteroidetes), при НАЖБП возрастает, что заставляет предположить их протективное действие [20, 21]. При этом некоторые грампозитивные микроорганизмы, например род Ruminococcus, показывают тесную положительную связь со степенью фиброза при НАЖБП [22].
Роль генетического полиморфизма в патогенезе НАЖБП
В ходе полномасштабных генетических исследований был выявлен ряд генов, ассоциированных с развитием НАЖБП и НАСГ. Наиболее значимые ассоциации были установлены между наличием НАЖБП и/или НАСГ и наличием однонуклеотидных полиморфизмов в следующих генах:
- PNPLA3 (пататин-подобный домен, содержащий 3 фосфолипазу, ген адипонутрина);
- TM6SF2 (трансмембранный белок 6 суперсемейства-2);
- HSD17B13 (17β-гидроксистероиддегидрогеназа 13);
- GCKR (ген-регулятор глюкокиназы);
- PPAR (рецептор, активируемый пролифераторами пероксисом);
- MBOAT7 (мембраносвязывающий О-ацетилтрансферазу домен, содержащий протеин 7);
- ENPP1 (эктонуклеотид пирофосфатазы-1);
- NCAN (нейрокан);
- LYPLAL1 (лизофосфолипазоподобный белок 1).
Следует отметить, что мутации в данных генах имеют разнонаправленное влияние на метаболический профиль пациентов [23, 24].
Наиболее убедительные данные в различных популяциях получены об ассоциации полиморфизма rs738409 в PNPLA3 и rs58542926 TM6SF2 с прогрессирующим течением НАСГ (развитием стеатоза, фиброза и ГЦК). Так, пациенты с аллелью TM6SF2 rs 58542926 T, предрасполагающей к развитию НАЖБП/ НАСГ, имели более высокий уровень липополисахарид-связывающего белка (LBP – маркер эндотоксемии) [25].
У больных с НАЖБП уровни LBP и эндотоксина коррелировали со степенью долькового воспаления и фиброза, также с фрагментами цитокератина-18 и уровнем жесткости печени. Предполагается, что в отдельных регионах России выявленные мутации имеют определенное значение для отечественной популяции [26–29].
Исследования последних лет у детей с избыточной массой тела или инсулинорезистентностью указывают на возрастающую роль эпигенетических факторов в развитии «наследуемой» НАЖБП: уровень убедительности рекомендаций (УУР) – В, уровень достоверности доказательств (УДД) – 1.
1.3. Эпидемиология
Распространенность НАЖБП в общей популяции в мире колеблется в пределах 6,3–33,0%; она выявляется во всех возрастных категориях, но значительно чаще у лиц с ожирением (до 62–93%).
Такую стадию НАЖБП, как стеатогепатит, выявляют в 18,5–26% случаев, фиброз – в 20–37%, цирроза печени – в 9–10%. 22% пациентов с НАЖБП не имеют избыточного веса и СД, 64% не соответствуют минимальным критериям МС, в 12% случаев не было выявлено ни одного критерия МС.
Chang Y. et al. (2006) показали, что стеатоз печени может развиваться при повышении массы тела, не сопровождающемся повышением индекса массы тела (ИМТ). Предполагается, что даже незначительное увеличение массы тела способствует перераспределению содержания липидов в тканях и нарушению их нормального метаболизма.
В России в настоящее время НАЖБП занимает лидирующее место в структуре заболеваний внутренних органов: УУР – В, УДД – 1.
Комментарии: в России 30% трудоспособного населения имеет избыточную массу тела и 25% страдает ожирением. По результатам российского исследования DIREG 1 (2007), распространенность НАЖБП у пациентов амбулаторных ЛПУ составляла 27%, при этом у 80,3% был диагностирован стеатоз, у 16,8% – стеатогепатит, у 2,9% – цирроз печени. Исследование DIREG 2 (2015) установило, что распространенность НАЖБП среди лиц, обращающихся за амбулаторной помощью, равнялась уже 37,3%, показав при этом рост на 10% за 7 лет в сравнении с данными DIREG 1. Число больных с ГЦК увеличилось до 5%. У 90% пациентов с НАЖБП выявляется один компонент МС и более, а у 30% – все составляющие МС. Отмечено, что НАЖБП служит фактором риска развития ССЗ и определяет их исход даже в большей степени, чем исход заболевания печени. Частота НАЖБП у больных СД 2-го типа и ожирением, по данным различных исследований, варьирует от 70 до 100%. При этом СД 2-го типа или нарушение толерантности к глюкозе (НТГ) выявляют у 10–75%, ожирение – у 30–100%, гипертриглицеридемию – у 20–92%.
НАЖБП рассматривается как независимый фактор риска развития и прогрессирования заболеваний печени и ССЗ: УУР – В, УДД – 1.
Комментарии: НАЖБП повышает риск смертности от ССЗ в 2 раза. При этом жировая дегенерация печени у больных НАЖБП может возникнуть задолго до развития МС и создавать существенные предпосылки для развития возможных метаболических нарушений.
1.4. Кодирование по МКБ-10
Согласно кодам МКБ-10, диагноз выставляется по ведущему клиническому заболеванию, синдрому и/ или симптому, как то:
К 76.0 – жировая дегенерация печени, не классифицированная в других рубриках;
К 73.0 – хронический персистирующий гепатит, не классифицированный в других рубриках;
К 73.9 – хронический гепатит неуточненный;
К 74.6 – другой и неуточненный цирроз печени (ЦП).
Комментарии: при диагностированной НАЖБП рекомендуется пользоваться кодом К 76.0. При доказанном НАСГ или циррозе рекомендуется устанавливать код К74.6.
В планируемой к утверждению в России МКБ-11 НАЖБП будет иметь коды, соответствующие ее общепризнанному международному наименованию.
1.5. Морфологическая классификация НАЖБП
По гистологическим признакам выделяют стеатоз, НАСГ и ЦП в исходе НАЖБП. Стеатоз печени определяется при накоплении жира в печени без признаков гепатоцеллюлярного повреждения в виде баллонной дистрофии гепатоцитов. НАСГ характеризуется наличием воспалительной инфильтрации на фоне стеатоза с фиброзом или без фиброза. На стадии ЦП наблюдаются морфологические признаки цирроза в сочетании с жировой инфильтрацией печени. На поздних стадиях НАЖБП (НАСГ – ЦП) гистологические признаки стеатоза могут исчезать.
Основные морфологические критерии НАЖБП:
- крупнокапельный стеатоз, преимущественно в 3-й зоне ацинуса, характеризующийся наличием крупных липидных капель в цитоплазме со смещением ядра к периферии дольки;
- баллонная дистрофия гепатоцитов;
- преобладание лобулярного воспаления, представленного полиморфноядерными лейкоцитами и мононуклеарами;
- перисинусоидальный фиброз в 3-й зоне ацинуса – месте наихудшего кровоснабжения.
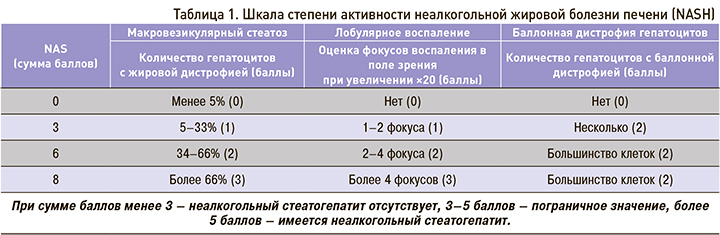
Для определения активности заболевания рекомендуется использовать шкалу для определения активности НАЖБП (NAFLD activity score, NAS), которая представляет собой комплексную оценку морфологических изменений в баллах и объединяет такие критерии, как стеатоз, лобулярное воспаление и баллонную дистрофию гепатоцитов (табл. 1). Аналогичная шкала разработана и рекомендована для определения стадии фиброза при НАЖБП (табл. 2) [30].

1.6. Клиническая картина НАЖБП
В целом для НАЖБП на стадиях стеатоза, НАСГ и фиброза характерно бессимптомное течение, поэтому наиболее часто в практике врач сталкивается со случайно обнаруженным при биохимическом исследовании синдромом цитолиза или признаками изменения структуры паренхимы печени при ультразвуковом ее обследовании. Зачастую пациенты обращаются к врачу по поводу жалоб, обусловленных коморбидными НАЖБП-ассоциируемыми заболеваниями – АГ, ишемической болезнью сердца (ИБС), заболеваниями периферических сосудов, ожирением, СД 2-го типа, полиартралгиями, фибромиалгиями и т.п., и тогда НАЖБП становится диагностической находкой.
Основные клинические симптомы у больных НАЖБП:
- астенический синдром: слабость, повышенная утомляемость, нарушение сна;
- диспепсический синдром: метеоризм, тошнота, нарушения стула;
- болевой синдром: тупые боли и/или тяжесть в правом подреберье;
- гепато- и/или спленомегалия.
Необходимо учитывать, что интенсивность предъявляемых жалоб и данные лабораторно-инструментального обследования зачастую не коррелируют со степенью поражения печеночной паренхимы.
Показатели биохимического анализа крови у пациентов на стадии стеатоза печени обычно не превышают границ нормы.
На стадии стеатогепатита выявляют изменения биохимических показателей: отмечается повышение активности аланиновой (АЛТ) и аспарагиновой (АСТ) трансаминаз до уровня 4–5 верхних пределов норм (ВПН), возможно повышение активности щелочной фосфатазы (ЩФ) и гамма-глутамилтрансферазы (ГГТ), гиперхолестеринемия, гипергликемия (НТГ или СД 2-го типа).
Соотношение АСТ/АЛТ (коэффициент де Ритиса) при НАСГ в среднем составляет 0,9 и не превышает 1,3 [31].
Частым спутником НАЖБП выступает дислипидемия (проатерогенный сывороточный липидный профиль, включающий низкий уровень холестерина липопротеинов высокой плотности (ЛПВП), высокий уровень ТГ, холестерина липопротеинов низкой плотности (ЛПНП) и аполипопротеина В100), развивающаяся независимо от стадии и степени выраженности заболевания и способствующая прогрессированию поражения печени и развитию ССЗ: УУР – В, УДД – 1.
Комментарии: в основе механизма развития ССЗ при НАЖБП лежит системное воспаление вследствие нарушенного печеночного метаболизма, абдоминального ожирения как генератора провоспалительных цитокинов и инсулинорезистентности. Возрастает продукция проатерогенных липопротеидов, системное высвобождение медиаторов воспаления – провоспалительных цитокинов, прокоагулирующих и профибриногенных факторов, прооксидантных молекул, способствующих формированию атеросклероза и атеротромбоза. При НАЖБП происходит избирательное накопление жировой ткани в почках, миокарде и перикардиальном пространстве. Последнее непосредственно способствует развитию гипертрофии миокарда даже без АГ как одного из ее патогенетических факторов.
При трансформации фиброза в ЦП фиксируется преобладание значений АСТ над АЛТ, а также ослабление белково-синтетической функции печени в виде снижения уровней общего белка, альбумина, холестерина, холинэстеразы и протромбина, повышение уровня билирубина, а также и тромбоцитопения, повышение международного нормализованного отношения (МНО), удлинение активированного частичного тромбопластинового времени (АЧТВ).
Наличие фиброза характеризуется изменением сывороточных маркеров: гиалуроновой кислоты, проколлагена III типа, N-терминального пептида проколлагена III, ламинина и др. На этом фоне постепенно формируется портальная гипертензия (расширение воротной и селезеночной вен, варикозное расширение вен пищевода, асцит).
Отсутствие изменений лабораторных показателей, характеризующих состояние печени, не исключает наличия воспалительно-деструктивного процесса и фиброза.
2. ДИАГНОСТИКА НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ
Сводный алгоритм диагностики НАЖБП в группах риска приведен в приложении Б1.
Критерии установления диагноза:
а) наличие избыточного количества жировых отложений в печени (определенное гистологическим исследованием или визуализирующими методами);
b) отрицание в анамнезе хронического употребления алкоголя в токсичных дозах;
c) исключение других причин жировой инфильтрации печени (гепатотропные вирусы, генетически детерминированные заболевания, лекарственное поражение печени).
2.1. Жалобы и анамнез
Сбор жалоб и анамнеза – необходимый метод для выявления клинических симптомов и наличия факторов риска развития НАЖБП, а также наличия ассоциированных метаболических заболеваний: УУР – А, УДД – 2.
Комментарии: при опросе пациента уточняется наличие и выраженность жалоб, их взаимосвязь с приемом пищи, режимом труда и отдыха, пищевыми привычками, физическими нагрузками. Уточняется наличие сопутствующей патологии, в том числе коморбидной (СД 2-го типа, атерогенная дислипидемия, атеросклероз, АГ, ИБС и др.), а также отягощение наследственного анамнеза. В большинстве случаев НАЖБП протекает бессимптомно, иногда больные жалуются на слабость, повышенную утомляемость, тяжесть или ноющие боли в правом подреберье. У врача пациент чаще всего оказывается по поводу сопутствующей патологии: ожирения, АГ, ИБС, СД 2-го типа, желчнокаменной болезни (ЖКБ).
Сбор жалоб и анамнеза необходим для исключения вторичных факторов развития НАЖБП: УУР – А, УДД – 2.
Комментарии: при опросе пациента в обязательном порядке уточняются предшествующий данному обращению прием лекарственных препаратов (амиодарона, ацетилсалициловой кислоты, глюкокортикоидов, дилтиазема, нифедипина, тамоксифена, метотрексата и др.), а также наличие эпизодов парентерального питания, голодания, быстрого снижения массы тела, воспалительных и иммуноопосредованных заболеваний кишечника, любых хирургических вмешательств (особенно проведенных на органах пищеварения – гастропластики, еюноилеального шунтирования, обширной резекции тонкой кишки и т.п.).
Исключение алкогольной этиологии является одной из первых задач при выявлении признаков стеатоза печени. Приемлемой дозой употребления алкоголя у пациентов, которым диагностируется НАЖБП, следует считать не более 210 мл этанола в неделю для мужчин и не более 140 мл в неделю для женщин: УУР – В, УДД – 2.
Комментарии: для исключения алкогольной этиологии и дифференциации между алкогольной и неалкогольной жировой болезнью печени могут быть использованы:
- опрос пациента и его ближайших родственников пациента;
- апробированные опросники для количественной оценки потребления алкоголя;
- определение лабораторных маркеров злоупотребления алкоголем: уровня сывороточной ГГТ, АСТ, соотношения АСТ/АЛТ, среднего объема эритроцитов, углевододефицитного трансферрина и их интерпретация в совокупности с данными анамнеза и других исследований. Отметим, что ГГТ может быть повышена у лиц с НАЖБП, не злоупотребляющих алкоголем;
- непатентованные расчетные формулы, такие как ALD/NAFLD index (ANI), включающий следующие показатели: ИМТ, пол, MCV, АСТ, АЛТ (онлайн-калькулятор для расчета – https://www.mdapp.co/ald-nafld-index-ani-calculator-355);
- патентованные расчетные формулы, такие как диагностическая панель «ФиброМакс» («АшТест») [32, 33].
2.2. Физикальное обследование
Проведение физикального обследования у пациента с подозрением на НАЖБП должно включать оценку антропометрических данных: УУР – А, УДД – 2.
Комментарии: необходимо провести измерения периметра талии (ОТ) и бедер (ОБ), рассчитать индекс ОТ/ОБ, ИМТ. Увеличение периметров талии и бедер в сочетании с повышенным ИМТ служит фактором риска развития МС и НАЖБП.
Значимыми факторами риска следует считать у лиц европеоидной расы ИМТ ≥25 кг/м2, периметр талии ≥102 см для мужчин и ≥88 см для женщин; у лиц азиатской расы ИМТ ≥23 кг/м2, периметр талии ≥90 см для мужчин и ≥80 см для женщин. С целью уточнения значимости каждого фактора НАЖБП-ассоциированной коморбидности возможно использование критериев диагностики МАЖБП (приложение Б2).
Для выявления групп риска стеатоза печени рекомендуется рассчитать индекс стеатоза (St-index – неинвазивный скрининговый метод оценки риска стеатоза печени): УУР – В, УДД – 2.
Комментарии: St-index разработан российскими учеными на основе данных исследования DIREG2. Для расчета величины индекса необходимы следующие данные о больном:
- возраст (кол-во полных лет);
- СД 2-го типа – есть (1)/нет (0);
- соотношение талии (см) к росту (см) (Т/Р=…).
Расчетная формула: Y (Индекс стеатоза или St-index) = -3,5856 + 0,0141 × возраст + 0,4711 × СД2 + 4,4373 × Т/Р.
Значения: Y >0,405 – риск стеатоза высокий (специфичность=91,4%); Y <-0,847 – риск стеатоза низкий (чувствительность=93,8%) [34].
Проведение физикального обследования у пациента с подозрением на НАЖБП должно быть направлено на выявление малых печеночных знаков, оценку размеров и консистенции печени, размеров селезенки, выявление желтухи и признаков портальной гипертензии: УУР – А, УДД – 2.
Комментарии: у больных с хроническим заболеванием печени (ХЗП) могут быть выявлены характерные «малые печеночные знаки» – телеангиэктазии, пальмарная эритема. Признаком ХЗП также является изменение размеров печени (увеличение на доцирротической стадии и уменьшение на стадии цирроза), заострение края, уплотнение паренхимы. У части больных увеличивается селезенка. Физикальное обследование может выявить наличие расширенных подкожных вен, асцита, отечности нижних конечностей вследствие формирования портальной гипертензии. На доцирротических стадиях и начальных этапах цирроза печени НАЖБП физикальные изменения со стороны печени могут не выявляться или ограничиваться незначительной гепатомегалией.
2.3. Лабораторная диагностика
При подозрении на НАЖБП наряду с выполнением общеклинических анализов крови, кала и мочи целесообразно определение уровней АЛТ, АСТ, ГГТ, ЩФ, общего билирубина – сывороточных показателей, отражающих наличие повреждения печени: УУР – А, УДД – 2.
Комментарии: у больных с НАЖБП примерно в 90% случаев уже на стадии стеатоза выявляется повышение уровня ГГТ в среднем до уровня 3–4 ВПН. При развитии воспаления в печени (НАСГ) выявляются признаки цитолиза с повышением АЛТ и АСТ различной степени выраженности, но чаще всего не превышающие 5–7 уровня ВПН при соотношении АСТ/АЛТ <1,3. Уровень билирубина повышен, как правило, на стадии ЦП. Отсутствие изменений в лабораторных маркерах состояния печени не исключает наличие НАЖБП [35, 36].
При подозрении на НАЖБП рекомендуется определение уровня показателей, отражающих функциональное состояние печени: количество тромбоцитов, общего белка, альбумина, билирубина, характер коагулограммы: УУР – А, УДД – 2.
Комментарии: лабораторным признаком формирования стадии ЦП и печеночно-клеточной недостаточности служит снижение белково-синтетической функции печени, что проявляется тромбоцитопенией, гипербилирубинемией, снижением сывороточных уровней общего белка, альбумина, протромбина (ПТИ), а также факторов свертывания крови, синтезирующихся в печени. При выраженных нарушениях в коагулограмме (снижение ПТИ, удлинение АЧТВ и МНО) диагностируется геморрагический синдром. Ранние стадии ЦП не сопровождаются подобными изменениями, поэтому отсутствие изменений в лабораторных параметрах не исключает ЦП.
При подозрении на наличие НАЖБП рекомендуется определение показателей липидного спектра: ТГ, общего холестерина (ОХС), ХС ЛПВП и ХС ЛПНП), апо-В липопротеидов: УУР – А, УДД – 2.
Комментарии: около 40–50% больных с НАЖБП имеют нарушения липидного профиля по типу атерогенной дислипидемии: повышение уровня ТГ, ОХС и ЛПНП с синхронным снижением ЛПВП. Атерогенная липидемия требует коррекции для снижения рисков ССЗ и смертности от них.
При подозрении на НАЖБП рекомендуется определение показателей углеводного обмена: измерение уровня глюкозы натощак, инсулина крови натощак, глюкозотолерантный тест по показаниям: УУР – А, УДД – 2.
Комментарии: не менее 20% больных НАЖБП имеют нарушения углеводного обмена, свидетельствующие о нарушении толерантности к глюкозе, наличии предиабета или СД 2-го типа. Наличие СД 2-го типа у больных НАЖБП повышает риск ССЗ.
При подозрении на НАЖБП рекомендуется оценка наличия и выраженности инсулинорезистентности: УУР – А, УДД – 2.
Комментарии: наиболее часто применяемым методом оценки инсулинорезистентности служит расчет индекса HOMA-IR (HOmeostasis Model Assesment) по формуле: HOMA-IR = I0 × G0/22,5, где I0 – уровень инсулина натощак (мкМЕ/мл), G0 – уровень глюкозы натощак (ммоль/л). Значение HOMA-IR у здоровых лиц составляет менее 2,7, при нарушении толерантности к глюкозе, СД 2-го типа – более 4. Значимую диагностическую ценность при НАЖБП имеет увеличение индекса HOMA-IR более 5.
При обнаружении у пациентов с НАЖБП в сыворотке крови высоких титров аутоантител (антинуклеарный фактор, антигладкомышечные антитела) в сочетании с другими признаками иммунного воспаления необходимо провести полное обследование для исключения аутоиммунного заболевания: УУР – В, УДД – 1.
Комментарии: у 1/5 пациентов с НАЖБП обнаруживается антинуклеарный фактор (АНФ) и антигладкомышечные антитела, чаще в низких титрах (менее 1:320); при этом гистологические признаки аутоиммуного гепатита не наблюдаются. Однако выявление аутоантител требует тщательного обследования пациента для исключения аутоиммунного заболевания печени. Для исключения аутоиммунного гепатита рекомендованы упрощенные критерии Международной рабочей группы по аутоиммунному гепатиту (Hennes E.M. et al.; International Autoimmune Hepatitis Group, 2008), использование которых требует определения аутоантител, исключения вирусных гепатитов, определения IgG, гистологического исследования ткани печени [37, 38].
2.4. Инструментальная диагностика
Основное условие диагностики НАЖБП – установление наличия избыточного содержания жира в печени по данным инструментальных и/или морфологических исследований.
У пациента со случайно выявленными при инструментальном обследовании признаками стеатоза печени (при отсутствии признаков или симптомов печеночного заболевания и нормальных биохимических показателях) целесообразно провести оценку метаболических факторов и альтернативных причин возникновения стеатоза: УУР – А, УДД – 1.
Случайно выявленные при инструментальном обследовании признаки или симптомы либо изменения биохимических показателей сыворотки крови, характерные для НАЖБП, дают основание предполагать наличие этого заболевания и проводить дальнейшее исследование: УУР – А, УДД – 1.
Комментарии: с целью верификации наличия и степени выраженности жировой инфильтрации печени и портальной гипертензии рекомендовано инструментальное обследование: ультразвуковое исследование (УЗИ), а при его недостаточной информативности – выполнение других инструментальных методик, перечисленных ниже.
Скриниговым методом выявления стеатоза печени при подозрении на НАЖБП является УЗИ. Наличие признаков стеатоза печени по данным УЗИ после исключения других причин его развития позволяет установить диагноз НАЖБП: УУР – А, УДД – 2.
Комментарии: среди визуальных методов диагностики НАЖБП наибольшее распространение в виду своей доступности получило УЗИ, дающее возможность с высокой чувствительностью и специфичностью выявить стеатоз в печени и оценивать изменения в динамике.
Основные ультразвуковые признаки стеатоза печени:
- дистальное затухание эхосигнала;
- диффузная гиперэхогенность печени («яркая белая печень»);
- увеличение эхогенности печени по сравнению с почками;
- нечеткость и обеднение сосудистого рисунка.
Наличие признаков стеатоза по данным УЗИ при неизменных лабораторных тестах и исключении других этиологий стеатоза служит достаточным критерием для постановки диагноза НАЖБП, поскольку результаты биохимического анализа крови не всегда отражают наличие или отсутствие стеатоза печени и/или НАСГ.
При необходимости дополнительного подтверждения наличия избытка жира в печени и наличия материально-технической базы рекомендуется использование современной высокопольной магнитно-резонансной томографии (МРТ) или МР-спектроскопии: УУР – А, УДД – 2.
Комментарии: к преимуществам МРТ относятся высокая тканевая контрастность изображения за счет выгодного соотношения «сигнал–шум», возможность получения целостного изображения органа в любой проекции, большие ресурсы программного обеспечения, используемые для дифференциальной диагностики. МР-спектроскопия – единственный метод, позволяющий количественно неинвазивно точно оценить количество ТГ в печени. Ограничения применения этого метода обусловлены малой его доступностью и дороговизной.
Компьютерная томография (КТ) печени имеет малую специфичность в отношении жировой инфильтрации печени, поэтому не рекомендуется для широкого использования именно в целях диагностики НАЖБП, но показана при подозрении на новообразование печени: УУР – А, УДД – 2.
Комментарии: исследования последних лет показали низкую специфичность визуализации избытка жировых отложений в печени. Метод может применяться в случае недоступности МРТ и необходимости дополнительного обследования в неясных случаях. Основные признаки стеатоза печени по данным КТ:
- снижение рентгеноплотности печени до 3–5 единиц (норма 50–75 единиц);
- рентгеноплотность печени при стеатозе меньше рентгеноплотности селезенки;
- внутрипеченочные сосуды (воротная, нижняя полая вена) визуализируются как более плотные структуры по сравнению с печеночной тканью;
- для очаговой жировой инфильтрации характерно пересечение нормальными кровеносными сосудами печени зон пониженной рентгеноконтрастности.
Оценка контролируемого параметра затухания ультразвука (КПЗУ) может быть дополнительно использована как метод, позволяющий оценить наличие и ориентировочную выраженность стеатоза печени: УУР – А, УДД – 2.
Комментарий: согласно данным метаанализа 9 крупных рандомизированных контролируемых исследований (РКИ), КПЗУ обладает хорошей чувствительностью и специфичностью для выявления стеатоза печени различной выраженности [39].
Наличие и стадия фиброза печени при НАЖБП – основной фактор, определяющий прогноз пациента. Поэтому при установлении диагноза НАЖБП дальнейшее обследование должно быть направлено на выявление наличия фиброза: УУР – А, УДД – 2.
Комментарии: показано, что наличие и стадия фиброза является определяющий для прогноза больного: продолжительности жизни, развития печеночных осложнений и ССС. Риск неблагоприятных исходов возрастает соответственно стадии фиброза [40].
Наличие у пациента признаков МС и/или ожирения предполагает высокий риск НАЖБП и требует планового скринингового обследования для выявления этого заболевания: УУР – А, УДД – 2.
Комментарии: ассоциация выявленных признаков НАЖБП с МС и системным ожирением предполагает высокий риск наличия у пациента НАЖБП и повышенного риска ее прогрессирующего течения. В связи с этим всем пациентам с ожирением/и или МС следует в плановом порядке проводить скрининговые обследования, направленные на выявление НАЖБП: УЗИ, биохимические анализы крови, включающие определение АЛТ, АСТ. При обнаружении изменений показано дальнейшее обследование. При отсутствии изменений желательно повторить скрининговое обследование через 3–5 лет в связи с возможностью последующего развития НАЖБП [2].
Для выявления групп риска пациентов с прогрессирующим течением НАЖБП (наличием фиброза) могут быть использованы сывороточные биомаркеры фиброза – расчетные индексы. Это касается как непатентованных (FIB-4, NAFLD, fibrosis score, ВАRD и др.), так и патентованных (Фибротест и др.) формул. Наибольшую диагностическую точность из непатентованных методов имеет FIB-4: УУР – А, УДД – 2.
Комментарии: для выявления групп высокого риска прогрессирования НАСГ с фиброзом используется ряд формул, основанных на простейших и доступных для определениях в рутинной практике показателей (ИМТ, пол, наличие толерантности к глюкозе или СД, скрининговые сывороточные показатели). Наибольшую популярность в мире получили:
• шкала NFS (Nonalcoholic Fatty Liver Disease Fibrosis Score). Метод разработан в 2007 г. группой ученых во главе с Angulo P. и основан на анализе возраста, уровня глюкозы в крови, ИМТ, количества тромбоцитов, уровня альбумина и соотношения АСТ/АЛТ. Расчет проводят по формуле:
–1,675 + 0,037 × возраст (годы) + 0,094 × ИМТ (кг/м2) + 1,13 × гипергликемия или СД (да=1, нет=0) + 0,99 × АСТ/АЛТ – 0,013 × тромбоциты (109/л) – 0,66 × альбумин (г/дл).
Значение индекса менее -1,455 с чувствительностью 90% и специфичностью 60% свидетельствует о минимальной вероятности фиброза F3 и F4, тогда как значение более 0,676 (чувствительность 67% и специфичность 97%) указывает на выраженный фиброз печени. Значения в интервале от -1,455 до 0,675 являются неопределенными (так называемая серая зона). Рекомендации по лечению и диагностике НАЖБП под эгидой Американской гастроэнтерологической ассоциации, Американской ассоциации по изучению заболеваний печени и Американской коллегии гастроэнтерологов подтверждают клиническую значимость шкалы NFS для скрининга фиброза среди пациентов с НАЖБП. Основным недостатком этого показателя является то, что большая доля пациентов попадает в «серую зону», и они не могут быть классифицированы как имеющие высокую или низкую вероятность фиброза.
Для определения значений шкалы NFS можно использовать онлайн-калькулятор (http://nafldscore.com);
• индекс FIB-4. Изначально этот показатель использовался для установления стадии фиброза у пациентов с хроническим вирусным гепатитом C, позже его стали применять и при НАЖБП. При расчете FIB-4 оцениваются возраст, количество тромбоцитов, уровень АЛТ и АСТ. При значении индекса FIB-4 ≥2,67 с достоверностью 80% можно утверждать о наличии выраженного фиброза, при уровне ≤1,30 с достоверностью 90% – о его отсутствии. Интервал значений индекса FIB-4 от 1,3 до 2,67 попадает в «слепую зону», что не позволяет отнести его к универсальным методам оценки фиброза при НАЖБП. Таким образом, наибольшую диагностическую точность при НАЖБП имеет формула FIB-4 с порогом выявления 1,30, что особенно важно при динамическом наблюдении [41, 42].
Для определения значений индекса FIB-4 можно использовать онлайн-калькулятор (https://www.hepatitisc.uw.edu/page/clinical-calculators/fib-4);
• шкала HAIR (англ. Hypertension, ALT and Insulin Resistance) позволяет прогнозировать НАЖБП у пациентов с морбидным ожирением (ИМТ ≥35 кг/ м2). Метод основан на оценке трех показателей: АГ – 1 балл; АЛТ >40 Ед/л – 1 балл; индекс резистентности к инсулину >5,0 – 1 балл. Наличие минимум двух параметров имеет высокую диагностическую чувствительность (80%) и специфичность (89%) для НАЖБП. Наличие всех трех факторов позволяет говорить о наличии НАЖБП у пациента;
• шкала NICE. Основана на анализе компонентов МС, уровней АСТ и цитокератина-18 [16]. Диагноз МС устанавливался на основе критериев, разработанных Международной федерацией по сахарному диабету при наличии ожирения абдоминального типа (ОТ ≥94 см у мужчин, ≥80 см у женщин) и наличии ≥2 факторов из нижеперечисленных: повышенный уровень ТГ ≥1,7 ммоль/л; пониженный уровень ХС ЛПВП (<1,03 ммоль/л у мужчин и < 1,29 ммоль/л у женщин); АГ (уровень систолического артериального давления >130 мм рт.ст., диастолического артериального давления >85 мм рт.ст.; повышенный уровень глюкозы в плазме крови натощак (>более 5,6 ммоль/л (100 мг/дл)) или ранее диагностированный СД 2-го типа. Показатель рассчитывают по формуле:
5,654 + 3,78E-02 уровень АСТ (Ед/л) + 2,215E-03 ·уровень цитокератина-18 (Ед/л) + 1,825 (1 – МС есть; 0 – МС нет).
Результат по шкале NICE ≥5 позволяет достоверно диагностировать НАЖБП у пациентов с ожирением;
• индекс стеатоза печени FLI (англ. Fatty Liver Index). Признан суррогатным маркером НАЖБП и включает оценку уровня ТГ и ГГТ в плазме крови, ИМТ и ОТ. Формула для расчета индекса включает сложные логарифмические вычисления, поэтому для удобства можно использовать компьютерные калькуляторы (например, https://www.mdapp.co/fatty-liver-index-fli-calculator-356). Значение FLI <30 исключает (чувствительность метода 87%), а показатель ≥60 свидетельствует (специфичность 86%) о наличии стеатоза печени. Кроме того, у больных с МС выявлены корреляции между значением FLI и толщиной эпикардиального жира (r=0,52; p=0,0001), а также показателями ремоделирования миокарда – толщиной задней стенки левого желудочка (ЛЖ) (r=0,34; p=0,004), толщиной межжелудочковой перегородки (r=0,28; p=0,017), массой миокарда ЛЖ (r=0,48; p=0,0001);
• Nash Test. В рамках этого теста анализируются следующие показатели: возраст, пол, рост, масса тела, уровень ТГ, ОХС, альфа-2-макроглобулина, аполипопротеина-А1, гаптоглобина, ГГТ, АЛТ, АСТ и общего билирубина в сыворотке крови. При расчете алгоритма, включающего вышеперечисленные показатели, можно говорить об отсутствии НАСГ, вероятном присутствии и достоверном стеатогепатите.
К неинвазивным методам скрининга стадии фиброза печени при НАЖБП относятся:
• соотношение АСТ/АЛТ. Как правило, у пациентов с НАЖБП уровень АЛТ в плазме крови выше, чем АСТ, однако при выраженном фиброзе соотношение АСТ/АЛТ превышает единицу. Оценка этого показателя служит простейшей моделью анализа выраженности фиброза. Несмотря на свою простоту, это соотношение имеет хорошую отрицательную прогностическую ценность и может применяться для исключения наличия фиброза. Соотношение АСТ/АЛТ используется в ряде многокомпонентных моделей прогнозирования НАЖБП;
• шкала BARD (англ. BMI, AST/ALT Ratio, and Diabetes Score). Включает анализ суммы баллов трех показателей: соотношение АСТ/АЛТ ≥0,8 – 2 балла; ИМТ ≥28 кг/м2 – 1 балл; наличие СД 2 типа – 1 балл. Количество баллов 0–1 с высокой вероятностью свидетельствует об отсутствии выраженного фиброза печени (прогностическая ценность отрицательного результата 96%). Наличие ≥2 баллов свидетельствует о минимальной (отношение шансов=17) вероятности III–IV стадии фиброза;
• шкала BAAT. Включает анализ четырех компонентов, выраженных в баллах, и позволяет исключить наличие фиброза при НАЖБП: ИМТ ≥28 кг/ м2 – 1 балл; возраст не моложе 50 лет – 1 балл; уровень АЛТ в 2 раза и более превышает ВПН– 1 балл; ТГ ≥1,7 ммоль/л (150 мг/дл) – 1 балл. Значения 0–1 свидетельствуют о минимальной вероятности фиброза F3 и F4, ≥2 – о фиброзе F3 и F4. Метод имеет 100% отрицательное прогностическое значение в отношении септального фиброза или ЦП (100% чувствительность и 46% специфичность);
• индекс APRI рассчитывается по формуле:
APRI = АСТ (Ед/л)/(ВПН АСТ в Ед/л) × 100/тромбоциты (109/л) [29].
Если показатель ≤0,5, то вероятность фиброза печени низка (отрицательное прогностическое значение 83%), если >1,5, то с высокой вероятностью можно говорить о фиброзе печени (положительное прогностическое значение 68,4%). Промежуточный результат (от 0,5 до 1,5) соответствует «серой зоне». Достоверность указанного метода не очень высока, но тест позволяет предположить выраженный фиброз печени и ЦП, не прибегая к биопсии печени;
• шкала CDS (англ.: Cirrhosis Discriminant Score). Построена на анализе уровня тромбоцитов в крови, отношения АЛТ/АСТ и показателя свертываемости крови (МНО). Значения полученных показателей выражаются в баллах:
- уровень тромбоцитов ≥340·× 109/л – 0 баллов; 280–339·× 109/л – 1 балл; 220–279·× 109/л – 2 балла; 160–219·× 109/л – 3 балла; 100–159·× 109/л – 4 балла; 40–99·× 109/л – 5 баллов; менее 40·109/л – 6 баллов;
- соотношение АЛТ/АСТ более 1,7 – 0 баллов; 1,2–1,7 – 1 балл; 0,6–1,19 – 2 балла; <0,6 – 3 балла;
- МНО <1,1 – 0 баллов; 1,1–1,4 – 1 балл; >1,4 – 2 балла.
Итоговая величина варьирует от 0 до 11 баллов. При общем балле CDS ≥8 можно говорить о выраженном фиброзе (чувствительность 46% и специфичность 98%). Лица, у которых количество баллов по CDS ≤7, попадают в «серую зону»;
• шкала ELF (англ. European Liver Fibrosis Test). В формулу для ее расчета входят значения уровней гиалуроновой кислоты, тканевого ингибитора металлопротеиназ-1 (TIMP-1) и аминоконцевого пропептида проколлагена типа III (P3NP):
ELF= -7,412+(ln[гиалуроновая кислота]·0,681)+ (ln[P3NP]·0,775) (ln[TIMP-1]·0,494) [24].
Значение AUROC для обнаружения прогрессирующего фиброза с помощью этого теста равнялось 0,90, чувствительность и специфичность составили 89 и 96% соответственно. С высокой точностью фиброз печени можно исключить при ELF=-1,455 (отрицательное прогностическое значение 98%). ELF ≥0,676 свидетельствует о выраженном фиброзе (положительное прогностическое значение 80%).
В России преимущественно применяется панель Фибротест, дающая возможность определения сывороточных маркеров фиброза (α2-макроглобулин, гаптоглобин, аполипопротеин А1, ГГТ, общий билирубин) с последующим расчетом индекса фиброза по специальной формуле. Тест имеет высокую надежность при выраженных стадиях фиброза: прогностическая ценность отрицательного (NPV – negative predictive value) и положительного (PPV – positive predictive value) результатов составляет 90 и 70% соответственно. Фибротест не эффективен при синдроме Жильбера, высоких цифрах цитолиза, высокой концентрации ЛПВП.
Комплексный тест «ФиброМакс» включает определение активности процесса – «АктиТест», стадию фиброза – «ФиброТест», степень выраженности стеатоза – «СтеатоТест», степень выраженности воспаления (стеатогепатита) – «НэшТест». По ряду биохимических показателей с учетом пола, возраста, роста и веса пациента на основании математического анализа производится расчет индекса, соответствующего той или иной шкале.
Другой патентованный метод – Fibro Original European Liver Fibrosis (OELF) test (чувствительность 90%) – включает такие показатели, как возраст, уровень тканевого ингибитора металлопротеиназы-1, концентрацию гиалуроновой кислоты, N-терминального пропептида коллагена III типа.
Важно учитывать, что все сывороточные биомаркеры более надежны для выявления ЦП и выраженного фиброза, нежели ранних стадий НАЖБП [43].
Для исключения поздних стадий заболевания у больных НАЖБП и установления ориентировочной стадии фиброза печени и рекомендуется измерение эластичности печеночной ткани методами эластометрии, основанными на оценке жесткости нормальной и патологически измененной ткани органа: УУР – В, УДД – 2.
Комментарии: транзиентная эластография (ТЭ) – неинвазивный стандарт для измерения эластичности ткани печени, используемый для выявления и косвенной оценки степени фиброза. Наиболее высокая диагностическая точность метода наблюдается при выраженных стадиях фиброза. Недостатками метода являются отсутствие возможности оценки выраженности некровоспалительного процесса, неинформативность у пациентов с избыточной массой тела (требует применение XL датчика), искажение значения результатов у пациентов с активным воспалением, невозможность оценки состояния печени на стадиях стеатоза, стеатогепатита и ранних стадиях фиброза. ТЭ лучше выявляет цирротические изменения печени, менее информативна при фиброзе, и поэтому ее скорее применяют с целью исключения ЦП (прогностическая ценность отрицательного результата более 90 %) [43–48].
Эластография сдвиговой волны также может быть рекомендована для определения выраженности фиброза и исключения ЦП: УУР – В, УДД – 2.
Комментарии: альтернативой методу ТЭ служит метод ультразвуковой эластографии сдвиговой волной (ЭСВ) с эластометрией. Использование метода ЭСВ с эластометрией объясняется возможностью измерения деформации в тканях по скорости сдвиговой волны, возбуждаемой фокусированным ультразвуком. ТЭ и ЭСВ с эластометрией должны рассматриваться и как универсальный способ оценки фиброза печени, и как инструмент динамического мониторинга за состоянием печени. Информативность показателей, полученных при ЭСВ с эластометрией, сопоставима с морфологической стадией фиброза печени (по шкале Метавир с чувствительностью и специфичностью ЭСВ в определении стадий: ≥F2 – 97,1%, 77,4%; ≥F3 – 88,3%, 92,5%; F4 – 95,6%, 89,1%) [49–53].
Комбинация неинвазивных биомаркеров и методов эластометрии повышает достоверность получаемых результатов: УУР – В, УДД – 2.
Магнитно-резонансная эластография в связи с высокой стоимостью для рутинного использования в клинической практике не рекомендуется: УУР – В, УДД – 2.
Наличие признаков метаболического синдрома, положительные результаты неинвазивных методов (расчетные индексы, методы эластографии) могут быть использованы для выявления лиц с высоким риском развития НАЖБП с прогрессирующим фиброзом печени: УУР – В, УДД – 1.
При отсутствии признаков прогрессирующего течения НАЖБП динамическая оценка неинвазивных маркеров (сывороточные биомаркеры или эластография) для исключения формирования фиброза печени должна быть выполнена у пациентов с НАЖБП с интервалом в 2-3 года: УУР – В, УДД – 1.
В случаях, когда другие методы диагностики не дают возможности убедительно верифицировать заболевание либо его прогрессирующее течение, рекомендуется проведение пункционной биопсии печени с последующим изучением гепатобиоптата: УУР – А, УДД – 1.
Комментарии: биопсия печени служит «золотым стандартом» диагностики НАЖБП и единственным достоверным методом выявления стеатогепатита, позволяющим оценить визуально и количественно степень выраженности стеатоза, воспаления и фиброза, а также в ряде случаев выявить специфические признаки патологии печени, связанной с другими причинами (лекарственные поражения печени, гемохроматоз, гепатоцеребральная дистрофия и т.п.) [35].
Биопсия с целью дифференциальной диагностики рекомендуется в случае невозможности другими методами исключить наличие конкурирующих этиологических факторов и сопутствующих хронических заболеваний печени: УУР – В, УДД – 1.
Комментарии: биопсия с целью дифференциальной диагностики показана при подозрении на НАЖБП в сочетании с устойчивым выраженным увеличением содержания железа и сывороточного ферритина на фоне гомозиготной или гетерозиготной мутации С282У в гене НFE.
Биопсия печени не рекомендуется лицам с НАЖБП со стеатозом, выявленным при инструментальном обследовании, при отсутствии признаков или симптомов печеночного заболевания, нормальных биохимических показателях и отсутствии признаков прогрессирующего течения (фиброза) по данным неинвазивных методов (биомаркеры, эластография): УУР – В, УДД – 1.
Биопсия печени не рекомендуется пациентам с установленным НАЖБП в рутинном обследовании для динамического наблюдения: УУР – В, УДД – 1.
2.5. Другие методы диагностики
При НАЖБП в стадии ЦП рекомендуется регулярное обследование, направленное на выявление основных проявлений портальной гипертензии (портальной гастропатии, варикозного расширения вен пищевода и желудка) 1 раз в 1–2 года: УУР – В, УДД – 1.
Комментарии: с целью уточнения наличия и степени выраженности портальной гипертензии верхних отделов желудочно-кишечного тракта рекомендуется регулярное проведение эзофагогастродуоденоскопии (ЭГДС).
При НАЖБП в стадии цирроза печени и выраженного фиброза (F2 и более) рекомендован скрининг на гепатоцеллюлярную карциному – выполнение УЗИ печени 1 раз в 6 мес: УУР – А, УДД – 1.
Комментарии: риск развития ГЦК повышен на всех стадиях НАЖБП, но наиболее высок при выраженном фиброзе и формировании ЦП: однолетняя кумулятивная частота составляет 2,6%. Необходимость наблюдения за пациентами с НАЖБП без ЦП и выраженного фиброза пока не определена [54–56]. Метаанализ показывает, что эффективность УЗИ в выявлении ГЦК составляет 94%, ранней ГЦК – 63%; согласно его результатам, оптимальный срок выполнения исследования – 1 раз в 6 мес. Дополнительное определение альфа-фетопротеина не повышает эффективность выявления ГЦК; он может скринингово определяться в случаях, когда невозможно выполнение УЗИ [57, 58].
У всех больных НАЖБП рекомендуется оценивать предикторы высокого риска ССЗ: УУР – А, УДД – 2.
Комментарии: оценку предикторов высокого риска ССЗ следует проводить в соответствии с действующими отечественными рекомендациями. У больных НАЖБП к предикторы высокого риска ССЗ относятся:
- индекс стеатоза печени FLI = (е0,953 × loge (ТГ) + 0,139 × (ИМТ) + 0,718 × loge (ГГТП) + 0,053 × (ОТ) – 15,745) / (1 + е0,953×loge (ТГ) + 0,139 × (ИМТ) + 0,718 × loge (ГГТП) + 0,053 × (ОТ) – 15,745) × 100. При значении 30–60 риск считается высоким [59];
- увеличение толщины эпикардиального жира, изменение показателей ремоделирования миокарда (увеличение толщины задней стенки ЛЖ, межжелудочковой перегородки, массы миокарда ЛЖ);
- увеличение толщины комплекса интима-медиа;
- удлинение комплекса QT;
- повышение уровней АЛТ, ГГТ, ФНО-альфа, интерлейкина-1b, интерлейкина-6, С-реактивного белка, снижение уровня адипонектина.
2.6. План обследования пациентов с метаболическими нарушениями, обращающихся к врачу по поводу ишемической болезни сердца, сахарного диабета 2-го типа, артериальной гипертензии, гипотиреоза, холелитиаза и т.д.
1. Сбор анамнеза (наследственность, образ жизни, пищевые привычки, физические нагрузки).
2. Антропометрические измерения (ИМТ, ОТ, ОБ, индекс ОТ/ОБ).
3. Объективный осмотр (выявление малых печеночных знаков: телеангиэктазий, пальмарной эритемы, оценка размеров и консистенции печени, размеров селезенки).
4. Мониторинг артериального давления.
5. Оценка липидограммы: ТГ, ОХС, ХС ЛПВП и ЛПНП, апо-В липопротеидов.
6. Определение уровня глюкозы натощак, глюкозотолерантный тест по показаниям.
7. Инсулин крови натощак.
8. Оценка наличия и выраженности инсулинорезистентности – определение индекса HOMA-IR по формуле HOMA-IR = I0 х G0/22,5, где I0 – уровень инсулина натощак (мкМЕ/мл), G0 – уровень глюкозы натощак (ммоль/л). Значение HOMA-IR у здоровых лиц составляет <2,7, при нарушении толерантности к глюкозе, СД 2-го типа – >4. Значимую диагностическую ценность при НАЖБП имеет увеличение индекса HOMA-IR более 5.
9. Клинический анализ крови (наличие тромбоцитопении, анемии).
10. Оценка биохимических показателей, отражающих функциональное состояние печени (АЛТ, АСТ, ГГТ, ЩФ, общий билирубин, протромбин/МНО, общий белок, альбумин).
11. УЗИ органов брюшной полости (размеры и ультразвуковые характеристики печени и селезенки, наличие и выраженность признаков портальной гипертензии).
12. При выявлении УЗИ признаков стеатоза печени – оценка риска фиброза неинвазивными методами (расчетный индекс FIB-4).
13. ЭГДС при предполагаемом ЦП (скрининг на наличие варикозно расширенных вен пищевода).
14. Пункционная биопсия печени (при наличии показаний).
3. ЛЕЧЕНИЕ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ
Сводный алгоритм лечения НАЖБП приведен в приложении Б3.
Для предупреждения развития потенциально летальных осложнений (в том числе со стороны сердечно-сосудистой системы) необходимо следующее.
1. Скрининг на НАЖБП для пациентов группы риска.
2. Своевременная постановка диагноза.
3. Своевременное проведение эффективной терапии препаратами с высоким профилем безопасности, воздействующими не только на гепатоцит, но и на патогенез развития сердечно-сосудистых осложнений.
Основной целью терапии является уменьшение выраженности стеатоза и предотвращение прогрессирования заболевания в стадии стеатогепатита, фиброза или цирроза, а также снижение риска сердечно-сосудистых осложнений.
Доказано, что у пациентов с НАЖБП комплексные меры по изменению образа жизни, приводящие к разрешению заболевания, способствуют снижению риска смерти от сердечно-сосудистых осложнений на 40%, что сопоставимо с эффективностью медикаментозной коррекции.
Основные принципы лечения НАЖБП
1. Снижение массы тела (диета и физические нагрузки).
2. Обязательная отмена потенциально гепатотоксичных препаратов, кроме случаев, когда польза от их назначения превышает риск.
3. Коррекция метаболических нарушений:
а. повышение чувствительности клеточных рецепторов к инсулину (метформин, тиазолидиндионы);
b. коррекция нарушений липидного обмена;
c. гипотензивная терапия.
4. Лечение окислительного стресса.
Комментарий: представленный в Приложении Б3 «Полиэдр (многоугольник) коморбидности при НАЖБП» представляет собой векторную схему лечебных мероприятий с указанием основных рекомендованных в настоящее время лекарственных средств и может быть использован врачом для принятия решения о целях комбинированной терапии.
3.1. Снижение веса и физическая активность
У пациентов с НАЖБП следует оценивать состав рациона и физическую активность: УУР – А, УДД – 1.
Комментарии: факторами риска развития НАЖБП являются нерациональное питание и низкая физическая активность [2, 60]. Выявление дефектов в образе жизни позволяет провести их персонализированную коррекцию.
Постепенное снижение веса и увеличение физической нагрузки – ведущие факторы в лечении НАЖБП; потеря веса при использовании гипокалорийной диеты или ее сочетание с повышенной физической активностью способствует уменьшению проявлений стеатоза: УУР – А, УДД – 1.
Комментарии: диетотерапия должна быть направлена на постепенное снижение массы тела при ее исходно повышенных показателях. При нормальной массе тела должна проводится коррекция состава рациона. Диетические рекомендации включают ограничение энергии и исключение компонентов, способствующих развитию НАЖБП (простые углеводы, напитки с высоким содержанием фруктозы, готовые блюда, например фастфуд). Показано, что диета с ограничением углеводов (так называемая средиземноморская диета или диета FODMAP), по сравнению с диетой с ограничением жиров, лучше способствует разрешению стеатоза [61, 62]. Установлено, что для уменьшения выраженности стеатоза при НАЖБП требуется снижение веса тела не менее чем на 3–5%, а для устранения некротических и воспалительных изменений в печени при стеатогепатите необходимо снижение веса не менее чем на 10% (УУР – Б, УДД – 1) [63].
Подбор диеты и выбор типа и объема физической нагрузки должен быть адаптирован к индивидуальным предпочтениям пациента: УУР – В, УДД – 1.
Комментарии: не существует унифицированного немедикаментозного подхода к лечению НАЖБП. Целесообразно приспособление диеты, снижения веса и увеличение физической нагрузки к индивидуальным потребностям пациента, поскольку важным является сохранение достигнутого изменения в образе жизни на длительный период [64–70].
У взрослых пациентов физическая нагрузка уменьшает выраженность стеатоза даже при отсутствии дополнительных медикаментозных воздействий, однако ее влияние на нормализацию других гистологических изменений в печени остается неясной: УУР – В, УДД – 1.
Пациентам с НАЖБП противопоказано злоупотребление алкоголем, на стадии ЦП следует рекомендовать воздерживаться от употребления алкоголя и табакокурения: УУР – В, УДД – 1.
Комментарии: в настоящее время нет единой точки зрения на роль умеренных количеств потребления алкоголя и характера алкогольных напитков при НАЖБП (например, средиземноморская диета включает обязательное потребление красного вина до 50 мл в день). Однозначно негативным фактором признается злоупотребление алкоголем. Показано, что употребление алкоголя и табакокурение повышают риск развития ГЦК, поэтому требуется исключить их потребление пациентами с НАЖБП на стадии ЦП [71–75].
3.2. Фармакологическая коррекция инсулинорезистентности
Для лечения сопутствующего нарушения толерантности к углеводам и профилактики развития СД 2-го типа пациентам с НАЖБП рекомендуется метформин в дозе 20 мг/кг/сут (дозу наращивают постепенно, начиная с 500–850 мг/сут) курсами не менее года: УУР – В, УДД – 1.
Комментарии: в клинических исследованиях по изучению эффективности метформина показано снижение резистентности к инсулину при его приеме, уменьшение активности трансаминаз и выраженное снижение веса (более 10 кг) у 19% больных НАЖБП. Однако улучшение гистологической картины печени было незначительным: уменьшения выраженности стеатоза удается достигнуть только 30% пациентам.
Метформин не рекомендуется в качестве специфического средства для лечения НАЖБП с синдромом инсулинорезистентности, поскольку не оказывает существенного влияния на гистологическую структуру печени: УУР – В, УДД – 1.
Комментарии: данные метаанализа показали, что применение метформина в течение 6–12 мес на фоне изменения образа жизни не снижает выраженности цитолиза, но улучшает гистологическую структуру печени аналогично контрольной группе, не принимавшей препарат, но изменявшей образ жизни [35].
3.3. Фармакологическая коррекция гиперлипидемии
Гиполипидемическую терапию следует проводить с учетом стадии НАЖБП, при необходимости в комбинации с гепатопротекторами. Наиболее распространенными и изученными гиполипидемическими препаратами являются ингибиторы ГМК-КоА редуктазы (статины).
У больных НАЖБП статины могут быть рекомендованы для коррекции дислипидемии, но с учетом их повышенного гепатотоксического риска. Однако для специфического лечения НАСГ применять статины не рекомендуется: УУР – В, УДД – 1.
Комментарии: на фоне лечения статинами рекомендуется активный мониторинг каждые 3–4 нед в течение первых месяцев терапии:
- определение сывороточных печеночных тестов (билирубин, трансаминазы, ГГТ, ЩФ);
- определение показателей углеводного и липидного обменов (глюкоза, ТГ, ОХС, ХС ЛПНП, ХС ЛПВП, инсулин).
Прием статинов в комбинации с урсодезоксихолевой кислотой (УДХК) в дозе 10–15 мг/кг/сут сопровождается более выраженным снижением уровня ХС ЛПНП и рекомендуется для применения в реальной клинической практике: УУР – В, УДД – 2.
Комментарии: комбинация статинов с УДХК предупреждает развитие цитолиза и способствует снижению повышенного уровня трансаминаз [76].
Кроме статинов, при нарушении липидного обмена у больных НАЖБП рекомендованы производные фиброевой кислоты (фибраты), никотиновая кислота (ниацин), секвестранты желчных кислот (в настоящее время не зарегистрированы в России). Однако в настоящее время отсутствуют РКИ по их использованию у больных НАЖБП [35].
3.4. Медикаментозная терапия НАЖБП
3.4.1. Гепатопротекторы
Для снижения выраженности повреждения печени (окислительного стресса, воспаления, фиброзообразования) применяются гепатопротекторные средства различных фармакологических групп, способные воздействовать на звенья патогенеза НАЖБП. Гепатопротектор – лекарственное вещество, предотвращающее или ослабляющее клинико-функциональные и морфологические последствия токсико-метаболических повреждений печени.
Клинические эффекты гепатопротекторов делятся на локальные и плейотропные (табл. 3).

Витамин Е в суточной дозе 800 МЕ у пациентов с НАЖБП, не имеющих СД, улучшает гистологическую картину печени и может быть рекомендован как средство терапии первой линии в качестве антиоксиданта при лечении больных с доказанным НАСГ и прогрессирующим фиброзом (F2 и более): УУР – В, УДД – 1.
Комментарии: витамин Е (токоферол) является универсальным протектором клеточных мембран от окислительного повреждения (перекисной деструкции). Мембраностабилизирующее действие витамина проявляется и в его свойстве предохранять от окисления SH-группы мембранных белков. Витамин Е выступает антигипоксантом, стабилизирующим митохондриальную мембрану и экономящим потребление клетками кислорода. У пациентов с НАЖБП, не страдающих СД, токоферол в суточной дозе 800 МЕ позволяет снизить выраженность стеатоза и баллонной дистрофии, а также стимулировать регресс НАСГ [77, 78]. В исследовании PIVENS применение витамина Е (800 МЕ/сут) позволило снизить выраженность стеатоза, воспаления и баллонной дистрофии и стимулировать регресс НАСГ у 36% пациентов (21% в группе плацебо) [77]. В долгосрочном исследовании (средний период наблюдения 5,6 лет) прием витамина Е в дозе 800 ME ≥2 лет у пациентов с продвинутыми стадиями НАЖБП снизил риск смерти или потребность в трансплантации, а также риск печеночной декомпенсации без влияния на развитие ГЦК и сердечно-сосудистых событий. 10-летняя кумулятивная вероятность ГЦК, сосудистых событий и непеченочного рака не различалась [79].
Назначение витамина Е нецелесообразно при сочетании НАЖБП и СД, при НАЖБП без НАСГ и фиброза, при подозрении на НАСГ, но без гистологического подтверждения, а также при исходе НАЖБП в ЦП: УУР – А, УДД – 3.
Комментарии: высокие дозы витамина Е (более 800 мг/сут) при длительном приеме могут оказывать проканцерогенный эффект в отношении рака предстательной железы и увеличивают риск смерти от всех причин [77], поэтому вопрос об их использовании должен решаться в качестве персонализированного решения. Токоферол в больших количествах содержится в растительных маслах из пшеничных зародышей, подсолнуха, оливок, кукурузы, тыквы, хлопка, льна и сои. Для сохранения полезных качеств продукта в кулинарных целях лучше применять эти масла в качестве составляющей салатов. Витамин Е находится также в семечках, орехах, горохе, фасоли, семенах льна, овсе, печени, желтках, молоке, зеленых листовых овощах.
Урсодезоксихолевая кислота (УДХК) может быть применена при всех формах НАЖБП, особенно с признаками вне- и внутрипеченочного холестаза: УУР – В, УДД – 2.
УДХК может быть рекомендована для лечения пациентов с признаками НАСГ: УУР – С, УДД – 3.
Комментарии: УДХК – желчная кислота, оказывающая прямое гепатопротекторное действие и уменьшающая гепатотоксичность гидрофобных солей желчи. Ее молекула обладает метаболическим и плейотропным действием, оказывает влияние на энтерогепатическую циркуляцию желчных солей, уменьшая реабсорбцию в кишечнике эндогенных более гидрофобных и потенциально токсичных соединений, а также воздействует на фарнезиодные рецепторы (антифибротические действие) [80]. УДХК уменьшает выраженность стеатоза печени по данным неинвазивных методов исследования [81–84], в высоких дозах уменьшает выраженность баллонной дистрофии [85]. УДХК снижает содержание холестерина в желчи преимущественно путем дисперсии этого вещества и формирования жидкокристаллической фазы [86]. Также она снижает литогенный индекс желчи, увеличивая содержание в ней желчных кислот, способствует частичному или полному растворению холестериновых желчных камней при пероральном применении, оказывает холеретическое действие [87]. Помимо этого, желчные кислоты (ЖК) действуют как метаболически активные сигнальные молекулы, контролирующие печеночный липогенез de novo, экспорт липопротеидов очень низкой плотности, участвуют в регуляции глюконеогенеза в печени, синтеза гликогена и чувствительности к инсулину [76, 88, 89]. УДХК назначается в дозе 10–15 мг/кг/сут в 2 приема не менее года, иногда до 2 лет и более.
УДХК рекомендована пациентам с НАЖБП, сердечно-сосудистой патологией и синдромом холестаза: УУР – А, УДД – 1.
Комментарии: результаты отечественного многоцентрового исследования «УСПЕХ» показали, что УДХК улучшает показатели липидного обмена и обладает потенциальными антиатерогенными свойствами. У женщин также достоверно снижался показатель толщины комплекса интима-медиа (ТКИМ) каротидных артерий и 10-летний риск сердечно-сосудистых осложнений по калькулятору ASCVD 2013 [84].
Эссенциальные фосфолипиды (ЭФЛ) рекомендуются для лечения пациентов с признаками стеатоза печени вне зависимости от стадии заболевания (НАЖБП/НАСГ): УУР – А, УДД – 1.
Комментарии: эффективность ЭФЛ в терапии заболеваний печени реализуется за счет способности 3-sn-фосфатидилхолина (основное действующее вещество) включаться в поврежденные участки мембран гепатоцитов. ЭФЛ также способны конкурентно замещать эндогенные фосфолипиды с меньшим количеством полиненасыщенных жирных кислот, что увеличивает пластичность мембран и улучшает их функционирование, стабилизировать мембраны, обладают антиоксидантным, цитопротективным и противовоспалительным действием [90]. Пероральная форма ЭФЛ приводила к значимому регрессу стеатоза у больных НАЖБП/НАСГ по данным биопсии печени, УЗИ и КТ в 7 РКИ: в них отмечалась стабильно высокая амплитуда и гомогенность эффекта [91–97]. Также в этих исследованиях показано значимое снижение трансаминаз (АЛТ, АСТ, ГГТ) и липидного профиля. Имеются данные в отношении замедления процесса фиброзирования при длительном применении препарата у больных НАЖБП [96]. Систематический обзор и метаанализ, подтвердил регресс стеатоза на фоне терапии ЭФЛ в РКИ, а также положительное влияние на трансаминазы и липидный профиль у больных с НАЖБП/НАСГ [98]. В наблюдательном исследовании MANPOWER 2018 (2843 пациента со стеатозом печени и кардиометаболической коморбидностью) продемонстрировано улучшение УЗИ-картины у 69,6% пациентов после 3-месячного приема ЭФЛ и у 81,4% пациентов через 6 мес терапии [99]. Прием ЭФЛ осуществляется в дозе 1800 мг/сут, курсами по 3–6 мес, 2–3 раза в год.
ЭФЛ могут быть рекомендованы у пациентов с НАЖБП и сопутствующей сердечно-сосудистой и метаболической патологией (АГ, СД 2-го типа, дислипидемия, ожирение): УУР – В, УДД – 2.
Комментарии: в зависимости от соотношения количеств линолевой и линоленовой кислот у препаратов ЭФЛ могут отмечаться дополнительные гиполипидемические свойства. Пост-хок-анализ исследования MANPOWER продемонстрировал дополнительные гиполипидемические возможности терапии при назначении ЭФЛ на 12 и 24 нед пациентам с НАЖБП [99].
S-аденозил-L-метионин показан для лечения пациентов с НАЖБП: УУР – С, УДД – 3.
Комментарии: S-адеметионин-L-метионин участвует в трех основных типах биохимических реакций: трансметилирование, транссульфирирование и аминопропилирование [104, 105]. Эта молекула выступает основным донором метильных групп в реакциях синтеза аминокислот, фосфолипидов, гистонов, биогенных аминов и белков [106]. S-адеметионин – универсальный антиоксидант, кроме того, он служит предшественником синтеза глютатиона [107, 108]. Убедительных данных о клинически значимом долгосрочном положительном влиянии S-аденозил-L-метионина на биохимическую и гистологическую картину при НАСГ не получено. Мультицентровое наблюдательное исследование 250 пациентов с НАЖБП и проявлениями внутрипеченочного холестаза продемонстрировало, что 6-недельный прием S-адеметионин-L-метионина сопровождался значимым снижением симптомов внутрипеченочного холестаза (желтухи, зуда кожи, лабораторных маркеров холестаза), а также снижением количества дней нетрудоспособности и посещений врачей [109]. S-аденозил-L-метионин назначается в дозе 800–1600 мг/сут в таблетированной форме или 400–800 мг/сут в форме для внутримышечного или внутривенного введения. Для лечения госпитальных пациентов рекомендуют использовать ступенчатую терапию: внутривенное введение препарата в стандартных дозах продолжительностью до 2 нед с последующим переходом на пероральную терапию в амбулаторных условиях. Данные об адекватной продолжительности терапии отсутствуют.
Плейотропные эффекты S-аденозил- L-метионина могут быть использованы у пациентов с НАЖБП при астеническом синдроме (гепатогенной слабости) и при депрессии в качестве антидепрессанта: УУР – А, УДД – 1.
Комментарии: у пациентов с хроническими заболеваниями печени S-адеметионин-L-метионин оказывает дополнительное противоастеническое действие [110–115]. Метаанализ, включающий 25 контролируемых исследований, свидетельствует, что эффективность S-адеметионина как антидепрессанта существенно превышает эффект плацебо и сопоставим с трициклическими антидепрессантами [116].
Плейотропные эффекты S-аденозил-L-метионина могут быть использованы у пациентов с НАЖБП при наличии повышенной утомляемости (так называемого циркадного синдрома) или депрессии, а также при сочетании НАЖБП и алкогольного поражения печени: УУР С, УДД – 3.
L-орнитин-L-аспартат рекомендован для лечения пациентов с НАЖБП и гипераммониемией: УУР – С, УДД – 3.
Комментарии: L-орнитин-L-аспартат представляет собой смесь эндогенных аминокислот с доказанной способностью усиливать выведение аммиака при паренхиматозных повреждениях печени [117]. Показана возможность дозозависимого влияния препарата на выраженность стеатоза печени у пациентов с НАЖБП [118]; у пациентов с НАСГ на фоне его приема значительно улучшались КТ-показатели соотношения «печень‒селезенка» [119]. Продемонстрирована возможность L-орнитин-L-аспартата воздействовать на печеночную микроциркуляцию: улучшение зарегистрировано в том числе и при наличии фиброза 0–1 стадий [120]. Главный механизм действия L-орнитина-L- аспартата, который лежит в основе его свойств как детоксиканта аммиака при хроническом заболевании печени, включает выведение NH3 двумя различными путями, а именно через интенсификацию синтеза мочевины перипортальными гепатоцитами (L-орнитин служит промежуточным продуктом метаболизма в цикле образования мочевины) и синтез глутамина с помощью фермента глутаминсинтетазы (GS), локализованного в перивенозных гепатоцитах и скелетных мышцах. Обеспечение благоприятного действия L-орнитина-L-аспартата при НАЖБП осуществляется через механизмы его метаболической трансформации в L-глутамин, L-аргинин и глутатион. Эффект заключается в предотвращении перекисного окисления липидов, улучшении печеночной микроциркуляции, противовоспалительном и антиоксидантном действии [121]. Российский консенсус «Гипераммониемии у взрослых» рекомендует использовать этот препарат в парентеральной и энтеральной формах у больных с гепатогенной гипераммониемией и различными стадиями печеночной энцефалопатии, а также для снижения рисков прогрессирования патологии печени на фоне гипераммониемии [122]. Прием L-орнитин-L-аспартата осуществляется перорально в дозе 6–9 г/сут.
L-орнитин-L-аспартат может быть использован для лечения пациентов с НАЖБП и гипераммониемией до нормализации показателей уровней аммиака–аммония, а также регрессии проявлений печеночной энцефалопатии в соответствии с тестом связи чисел (ТСЧ): УУР В, УДД – 3.
Силимарин может быть рекомендован для лечения пациентов с признаками НАЖБП (стеатоза печени и стеатогепатита), особенно при сопутствующих токсических и лекарственных поражениях печени: УУР – С, УДД – 3.
Комментарии: силимарин (наиболее активный компонент – силибинин) является основным действующим началом экстракта расторопши. Данные о влиянии силимарина на пациентов с НАЖБП ограниченны. Однако некоторые исследования продемонстрировали, что лечение этим препаратом было связано с улучшением окислительного профиля из-за его способности подавлять выработку провоспалительных цитокинов [123]. Показано снижение выраженности стеатоза печени при использовании комбинации диеты, препарата расторопши пятнистой и витамина Е [124]. По сравнению с плацебо, лечение силимарином в дозе 700 мг 3 раза/сут в течение 48 нед, по данными биопсии, значительно улучшало признаки фиброза у 99 пациентов с НАСГ и неалкогольным стеатозом ≥4 [125]. В многоцентровом двойном слепом плацебо-контролируемом исследовании пациенты (n=72) с НАСГ, без ЦП и с неалкогольным стеатозом ≥4 получали 420 или 700 мг силимарина либо плацебо 3 раза/сут в течение 48 нед. Гистологическое улучшение между группами существенно не различалось. Однако улучшение стеатоза и лобулярного воспаления в группе силимарина было больше, чем в группе плацебо, но статистически значимого гистологического улучшения не наблюдалось [126]. Прием препарата осуществляется в дозе 420 мг/сут. Курсы лечения силимарином не стандартизованы и рассчитаны на длительный временной период.
Доказана эффективность силимарина при лекарственных поражениях печени, связанных с приемом диаммония глицирризината, винкристина, преднизолона, метотрексата, меркаптопурина, тиогуанина, такрина, психотропных и противотуберкулезных препаратов: УУР – В, УДД – 3.
Комментарии: при лекарственных поражениях печени, связанных с приемом диаммония глицирризината, винкристина, преднизолона, метотрексата, меркаптопурина, тиогуанина, такрина (при болезни Альцгеймера), психотропных и противотуберкулезных препаратов в среднем было достигнуто достоверное снижение (р <0,001) всех зарегистрированных лабораторных показателей [127–129].
Таурин может быть рекомендован для лечения пациентов с НАЖБП при сердечно-сосудистой коморбидности: УУР В, УДД – 2.
Таурин может быть рекомендован для лечения пациентов с признаками НАСГ: УУР С, УДД – 3.
Таурин может быть использован в лечении пациентов с НАЖБП и СД 1-го и 2-го типа, МС, ИБС: УУР – А, УДД – 1.
Комментарии: таурин (2-аминоэтансульфоновая кислота) – наиболее распространенная свободная аминокислота в организме человека, образующаяся в гепатоцитах в результате обмена веществ из метионина и цистеина через гипотаурин. В печени таурин играет важную роль в метаболизме желчи, модулируя уровни холестерина в крови, и образует конъюгаты с желчными кислотами (главным образом холевой и дезоксихолевой) с образованием желчной соли таурохолата – главной соли желчи, которая составляет основной путь выведения холестерина из плазмы. Таурин также активирует ХС-7a-гидроксилазу, ограничивающую скорость фермента, участвующего в синтезе желчной кислоты из холестерина [130, 131]. Оказывает антиоксидантное, антиапоптотическое и противовоспалительное действие [132]. Дефицит таурина – один из важных патогенетических механизмов, участвующих в формировании дисфункции висцерального жира, прогрессирования НАЖБП. Продемонстрировано достоверное влияние таурина на выраженность стеатоза и фиброза печени у пациентов с НАЖБП [133–136]. Помимо гепатопротективного действия, таурин выступает физиологическим ингибитором ренин-ангиотензин-альдостероновой системы (РААС), что обусловливает его положительные кардиотропные эффекты [137, 138]. Дополнительные гипогликемизирующие и гиполипидемические возможности таурина определяют включение в показания к его применению СД 1-го и 2-го типа, гиперхолестеринемии [139–141]. Прием препарата осуществляется в дозе 1000 мг/сут, курсами по 3 мес, 2–3 раза в год.
Гидролизат человеческой плаценты показан для лечения пациентов с НАЖБП/НАСГ и гиперферритинемией: УУР – С, УДД – 3.
Комментарии: гидролизат человеческой плаценты для парентерального введения имеет выраженные иммуномодулирующие и гепатопротекторные свойства. Биологически активные вещества гидролизата (факторы роста гепатоцитов, инсулиноподобный и другие факторы роста, противовоспалительные интерлейкины) стимулируют регенерацию гепатоцитов, проявляют дезинтоксикационные свойства, активируют обмен веществ в печени, уменьшают отложение холестерина и липидов в печеночных клетках, повышают активность тканевого дыхания, снижают интенсивность развития соединительной ткани в печени. У больных с НАЖБП гидролизат человеческой плаценты оказывает противовоспалительное, антиоксидантное действие, уменьшает проявления инсулинорезистентности, способствует нормализации функции печени, показателей липидного обмена и таким образом нормализует дистрофические, воспалительно-некротические, фибротические процессы в печени. Курсовая терапия гидролизатом плаценты человека показана при повышении уровня ферритина [142]. Препарат вводится парентерально, по 4,0 мл внутривенно в 250 мл физиологического раствора либо при невозможности внутривенного введения внутримышечно по 4,0 мл через день (курс 20 процедур). Между курсами назначается поддерживающая терапия: 1 раз в 10 дней по 6,0 мл от 3 до 7 мес.
Морфолиниевая соль тиазотовой кислоты может быть рекомендована для лечения пациентов с НАЖБП и сердечно-сосудистой коморбидностью: УУР – С, УДД – 3.
Комментарии: морфолиниевая соль тиазотовой кислоты оказывает антиоксидантное действие: в ее структуре присутствует тиольная группа, за счет которой препарат имеет выраженную восстанавливающую способность и является акцептором электронов от нестойкой активной формы кислорода, обладает мембраностабилизирующим эффектом, который обусловлен его антиоксидантными свойствами. Препарат активирует лактатдегидрогеназу и пируваткиназу, ферменты малат-аспартатного челночного механизма, что активизирует аэробный и анаэробный пути окисления глюкозы, вследствие чего восстанавливается макроэргический пул и снижается лактатацидоз в гепатоцитах даже при развитии гипоксии [143, 144]. Оказывает дополнительное антиангинальное действие, что может быть использовано у пациентов с НАЖБП и ИБС [145–147]. В исследовании программы ТРИГОН -1 «Терапевтическая эффективность монотерапии тиотриазолином у пациентов с НАЖБП и сердечно-сосудистыми рисками», целью которого стало изучение механизмов формирования коморбидности у пациентов с неалкогольными стеатогепатозами и предикторами ССЗ и влияния на них полиорганной терапии, было показано, что прием препарата морфолиниевой соли тиазотовой кислоты с полиотропным действием у больных НАЖБП улучшает состояние печени и снижает риски ССЗ [148]. Лечение проводится в два этапа: на первом этапе препарат вводится внутривенно капельно по 100 мг (4 мл) курсом 5 дней, затем в таблетированной форме 300 мг/сут в течение 2 нед.
Принципы назначения гепатопротекторов у пациентов с НАЖБП отражены в Приложении Б3.
3.4.2. Коррекция нарушений функции желчевыводящих путей при НАЖБП
У больных с МС и хроническим бескаменным холециститом выявлена прямая корреляционная взаимосвязь между уровнями лептина, фактора роста фибробластов и васкулоэндотелиального фактора роста с уровнями АЛТ и АСТ, ТГ и значением HOMA-IR, что подтверждает наличие нарушений функции печени [149]. В другом исследовании показатели трансаминаз не выходили за пределы референсных показателей, но были достоверно выше, чем у больных без хронического холецистита. Наряду с этим уровни ЩФ, ГГТ, холестерина были достоверно выше у пациентов группы наблюдения и превышали референсные значения. При многофракционном дуоденальном зондировании (МФДЗ) выявлено увеличение V фракции желчи, а при динамической гепатосцинтиграфии (ДГС) – замедление экскреции радиофармпрепарата [150].
Длительность заболевания калькулезным холециститом определяет выраженность поражений печеночной ткани. Так, при наличии заболевания менее года структурные изменения не выявляются ни до, ни после холецистэктомии, однако у больных с длительностью заболевания более трех лет холецистэктомия не предотвращает развития и прогрессирования патологических изменений печеночной ткани [151]. Таким образом, холецистэктомия при ЖКБ и НАЖБП должна быть проведена по показаниям, которые сформулированы в российских и зарубежных рекомендациях [152–154].
Флавоноид цинарин в составе экстракта из листьев артишока рекомендован больным с НАЖБП при наличии патологии желчевыводящих путей: УУР – С, УДД – 3.
Комментарии: флавоноид цинарин – основной компонент препарата растительного происхождения из листьев артишока полевого. Экстракт из листьев артишока полевого содержит различные растительные компоненты, оказывающие противовоспалительное действие и уменьшающие литогенность желчи. Цинарин в сочетании с фенолокислотами обладает желчегонным, а также гепатопротекторным эффектом. При курсовом лечении экстракт артишока улучшает холерез и холекинез, улучшает реологические свойства желчи, способствует раскрытию сфинктера Одди и устраняет билиарный сладж [155–158].
Экстракт артишока может быть применен для достижения целевых уровней холестерина и триглицеридов на фоне лечения низкими дозами статинов у пациентов с НАЖБП: УУР – С, УДД – 3.
Комментарии: имеются указания о положительном воздействии экстракта артишока на показатели липидного спектра крови [159].
3.4.2 НАЖБП-ассоциированный сахарный диабет 2-го типа
Пиоглитазон показан для лечения морфологически подтвержденного НАСГ, однако его безопасность и эффективность при длительной терапии не доказана [35]: УУР – В, УДД – 1.
Комментарии: пиоглитазон – пероральное гипогликемическое средство, селективный агонист гамма-рецепторов (PPAR-гамма), обнаруживаемых в жировой, мышечной тканях и в печени. Активация ядерных рецепторов PPAR-гамма модулирует транскрипцию ряда генов, чувствительных к инсулину, участвующих в контроле уровня глюкозы и в метаболизме липидов. Пиоглитазон снижает инсулинорезистентность в периферических тканях и в печени, в результате чего происходит увеличение расхода инсулинозависимой глюкозы и уменьшение продукции глюкозы в печени. При НАЖБ-ассоциированном СД 2-го типа уменьшение инсулинорезистентности под действием пиоглитазона приводит к снижению концентрации глюкозы в крови, уменьшению в плазме уровней инсулина, гликированного гемоглобина, ТГ и увеличению уровня ЛПВП. Однако уровень ЛПНП и ОХС у таких пациентов не изменяется.
3.4.3. Лечение полинейропатии при НАЖБП и сахарном диабете 2-го типа
В регуляции метаболических процессов в печени существенная роль принадлежит а-липоевой (тиоктовой) кислоте, которая в качестве кофермента участвует в углеводном и белковом обмене и является одной из важных составляющих антиоксидантной системы. В реакциях окислительного декарбоксилирования альфа-кетокислот тиоктовая кислота способствует превращению пировиноградной кислоты в ацетил-КоА (исходное соединение в цикле Кребса), что существенно увеличивает энергетический потенциал клетки. Как стимулятор окисления жирных кислот тиоктовая кислота способствует предупреждению стеатоза, так как обеспечивает стимуляцию глюконеогенеза, способствует накоплению гликогена, тормозит отложение липидов в гепатоцитах, действует как мощный антиоксидант, стимулируя при этом эндогенный синтез глутатиона. Будучи плейотропной молекулой, она способствует коррекции эндотелиальной дисфункции и сосудистых нарушений [160, 161].
Комментарий: доказан очевидный системный положительный нейротропный и гепатопротекторный эффект тиоктовой кислоты при лечении полинейропатий у больных СД, что позволило включить ее в официальные документы Минздрава России [162].
3.4.4. Комбинированное применение гепатопротекторов
Для достижения максимальной эффективности и безопасности в процессе лечении больных с НАЖБП-коморбидностью при принятии решения о назначении комбинаций гепатопротекторов экспертный совет рекомендует:
- руководствоваться положениями Приложения Б3;
- четко сформулировать целевые промежуточные и конечные точки результатов лечения;
- использовать принципы многоцелевой (мультитаргентной) монотерапии и рационального комбинирования;
- исключить нерациональные комбинации, полипрагмазию и возможность развития нежелательных (побочных) эффектов.
Официнальные комбинации
ЭФЛ + глицирризиновая кислота: УУР – С, УДД – 4.
Комментарии: теоретическим обоснованием эффективности фиксированной комбинации ЭФЛ и глицирризиновой кислоты является способность последней защищать фосфолипиды от окисления и, напротив, способность ЭФЛ повышать липофильность глицирризиновой кислоты, способствуя увеличению ее биодоступности. Клиническая эффективность комбинации показана в небольшом количестве отечественных исследований [100, 101]. 45 больных с НАСГ и АГ, СД и дислипидемией в первые 10 дней получали препарат внутривенно по 400 мг/ сут в пересчете на глицирризиновую кислоту, затем перорально по 70 мг 3 раза/сут в течение 60 дней. Нормализация активности АЛТ, АСТ, ГГТ и статистически более значимое уменьшение размеров печени по данным УЗИ отмечалась у достоверно большего числа больных, нежели в контрольной группе. На фоне введения комбинированного препарата глицирризиновой кислоты наблюдались единичные обратимые, слабо выраженные побочные явления – кожная сыпь, зуд, диспепсические явления. При внутривенном введении было отмечено 2 случая умеренного повышения артериального давления [102].
В двойное слепое плацебо-контролируемое исследование были включены 180 больных с НАЖБП. Комбинированный препарат глицирризиновой кислоты в дозе 400 мг/сут (в пересчете на этот компонент) вводился внутривенно в течение 10 дней, далее в течение 10 нед больные принимали таблетки в дозе по 70 мг 3 раза/сут перорально. Контрольная группа получала плацебо по той же схеме в аналогичных лекарственных формах. После завершения лечебного курса уровень адипонектина у больных основной группы повышался статистически более значимо по сравнению с плацебо, одновременно отмечалась отрицательная динамика индекса фиброза печени (по шкале NAFLD Fibrosis Score). Профиль безопасности двух режимов терапии оказался сопоставимыми [103].
Вместе с тем явно недостаточное количество исследований, проведенных по стандартам GCP, диктует необходимость подробного углубленного изучения комбинации ЭФЛ + глицирризиновая кислота у больных НАЖБП.
УДХК+ глицирризиновая кислота: этот лекарственный препарат имеет теоретически и экспериментально обоснованную базу по вероятной эффективности, однако серьезных клинических исследований его эффективности и безопасности пока не проводилось.
Инозин + меглюмин + метионин + никотинамид + янтарная кислота в растворе в виде фиксированной комбинации используется в основном при острых поражениях печени (лекарственных, алкогольных) или как средство инициальной терапии: УУР – С, УДД – 3.
Комментарии: включение в схему лечения больных с НАЖБП (стеатогепатитом) этого препарата достоверно повышало эффективность лечения, что проявлялось более быстрым купированием астеновегетативного и диспепсического синдромов, уменьшением выраженности биохимических признаков цитолитического и холестатического синдромов [163].
Эмпирические комбинации
До настоящего времени отсутствуют окончательные суждения о границах применения, эффективности и безопасности комбинаций гепатопротекторов, так как по ним нет клинических исследований, отвечающих современным принципам доказательной медицины.
Комбинированное применение гепатопротекторов может преследовать целью либо расширение спектра гепатотропного действия терапии, либо однонаправленное увеличение (аддитивность, суммация, потенцирование) того или иного фармакологического эффекта.
Наиболее эффективными с точки зрения влияния на гистологическую картину печени или потенцирования основного фармакологического эффекта представляются комбинации глицирризиновая кислота + ЭФЛ, силибинин + ЭФЛ + альфа-токоферол, УДХК + альфа-токоферол, а также совместное применение УДХК и адеметионина как антихолестатического средства [164].
В практическом здравоохранении широко используется комбинированное применение парентерального введения растворов S-аденозил-L-метионина и L-орнитин- L-аспарагина, особенно у больных с алкогольным поражением печени.
Комментарии: доказательная база по всем перечисленным комбинациям отсутствует, поэтому на практике при лечении НАЖБП при необходимости представляется целесообразным прибегать к обоснованным комбинациям, например, используя ЭФЛ и/ или УДХК как базисные препараты. При этом включение в комбинированное лечение УДХК оправдано при наличии холестаза или при назначении статинов, экстракта артишока – при нарушении внепеченочного холекинеза, адеметионина – при сочетании НАЖБП и алкогольной болезни печени, депрессиях, слабости, L-орнитин-L-аспартат – при гипераммониемии, гидролизат плаценты человека – при гиперферритинемии, тиоктовая кислота – при полинейропатии, силимарин – при лекарственных поражениях печени, таурин или морфолиниевая соль тиазотовой кислоты – при сердечно-сосудистой коморбидности, янтарной кислоты в виде комбинированного препарата – при печеночной недостаточности и т.д.
Необходимо также учитывать возможность развития нежелательных эффектов, для чего целесообразно внимательно изучать инструкцию по применению каждого препарата. Например, глицирризиновую кислоту следует применять с осторожностью при АГ и гиперкортицизме, препараты УДХК не показаны при наличии желчных камней с большим содержанием кальция, остром холецистите, почечной недостаточности, печеночной недостаточности и обтурации желчевыводящих путей и т.д.
3.5. Хирургическое лечение НАЖБП
В отсутствие эффекта от немедикаментозных мероприятий и адекватной медикаментозной терапии у лиц с ожирением при наличии показаний возможно рассмотрение вопроса о целесообразности проведения хирургического бариатрического лечения: УУР – В, УДД – 4.
Комментарии: кандидатами для хирургического вмешательства являются пациенты с выраженным морбидным ожирением при отсутствии возможности других способов снижения веса.
У пациентов с НАЖБП и декомпенсированным циррозом печени либо формированием ГЦК следует обсуждать показания к трансплантации печени: УУР – А, УДД – 1.
Комментарии: трансплантация печени – наиболее эффективный и зачастую единственный радикальный метод лечения больных с терминальной стадией НАЖБП и злокачественными опухолями печени, позволяющий увеличить продолжительность жизни пациентам с декомпенсированным ЦП и ГЦК. Вопрос о показаниях к ее проведению и постановке пациентов в лист ожидания трансплантации печени должен решаться в соответствии с действующими национальными клиническими рекомендациями.
3.6. Другие методы лечения
3.6.1. Коррекция дисбиоза
Подавление уреазопродуцирующей кишечной микрофлоры является одним из способов устранения причин гипераммониемии и соответственно печеночной энцефалопатии, в том числе латентной. Патогенетическая терапия этого вида гипераммониемии включает назначение кишечных невсасывающихся антибиотиков (рифаксимина) в рекомендуемой дозе 400 мг 3 раза/сут: УУР – А, УДД – 1.
Комментарии: снижение выраженности печеночной энцефалопатии у больных с ЦП на фоне применения рифаксимина доказано в РКИ и метаанализе [165–169].
При принятии решения о выборе биотической терапии больным с НАЖБП и признаками дисбиоза следует руководствоваться рекомендациями Всемирной гастроэнтерологической организации (ВГО): УУР – В, УДД – 4.
Комментарии: ВГО рекомендует при НАЖБП/НАСГ следующие мультиштаммовые пробиотические продукты:
- при НАЖБП:
- йогурт (с Lactobacillus bulgaricus и Streptococcus thermophilus) обогащенный L. acidophilus La5 и Bifidobacterium lactis Bb12 300 г ежедневно; показатель эффективности – снижение уровня трансаминаз;
- смесь L. casei, L. rhamnosus, Streptococcus thermophilus, Bifidobacterium breve, L. acidophilus, B. longum и L. bulgaricus + фруктоолигосахариды, минимум 107 КОЕ дважды в день; показатели эффективности – снижение уровня трансаминаз, улучшение индекса HOMA IR и данных транзиентной эластрографии;
- при НАСГ:
- L. bulgaricus и Streptococcus thermophiles (таблетка 5 × 108, 1 раз/сут); показатель эффективности – снижение уровня трансаминаз;
- Bifidobacterium longum W11 + FOS (5 × 109 живых бактерий) 1 раз/сут; показатели эффективности – снижение уровня трансаминаз и выраженности воспаления показателей по шкале гистологической активности НАСГ [170].
3.6.2. Восстановление слизисто-бактериального кишечного барьера и снижение эндотоксинемии
У больных с НАЖБП/ НАСГ уровни липополисахарид-связывающего белка (LBP, маркер эндотоксемии) и эндотоксина коррелировали со степенью долькового воспаления и фиброза, а также с фрагментами цитокератина-18 и уровнем жесткости печени. Пациенты с аллелью TM6SF2 rs 58542926 T, как известно, предрасполагающей, к НАЖБП /НАСГ, имели более высокий уровень LBP. У больных с НАЖБП и СД 2-го типа было отмечено значительное повышение уровня эндотоксина уже на ранней стадии фиброза. Поскольку эндотоксин может способствовать развитию инсулинорезистентности и воспаления, мероприятия, направленные на снижение его уровня у пациентов с НАЖБП, могут быть полезными в снижении воспалительного процесса [25, 171].
С целью снижения эндотоксинемии и восстановления слизисто-бактериального кишечного барьера может быть рекомендован ребамипид в дозе 100 мг 3 раза/сут курсом 2–4 нед: УУР – С, УДД – 5.
Комментарии: в эксперименте ребамипид оказывал выраженное защитное действие в отношении эндотоксин-индуцированного повреждения печени за счет ингибирования активации нейтрофилов и ФНО-альфа [172]. Кроме этого, ребамипид замедляет развитие CCl4-индуцированного фиброза печени у крыс, способствуя возрастанию уровня простагландина E2 (повышающего синтез коллагеназы и вызывающего деградацию коллагена) и подавляя уровень главного супрессора клеточного иммунитета – интерлейкина-10 [173].
4. МЕДИЦИНСКАЯ РЕАБИЛИТАЦИЯ
В качестве методов реабилитации пациентов с хроническими заболеваниями печени могут быть использованы санаторно-курортное лечение в санаториях гастроэнтерологического профиля (санатории Кисловодска, Железноводска, Ессентуки и др.), физиотерапевтические методы лечения.
5. ПРОФИЛАКТИКА И ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ
Профилактика НАЖБП предполагает мероприятия, направленные на формирование здорового образа жизни, коррекцию пищевых привычек, физическую активность. Диспансерное наблюдение должно осуществляться мультидисциплинарно, с привлечением всех необходимых специалистов (гастроэнтеролога, эндокринолога, кардиолога, диетолога).
6. ОРГАНИЗАЦИЯ ОКАЗАНИЯ МЕДИЦИНСКОЙ ПОМОЩИ
Организация оказания медицинской помощи проводится на основании Приказа Минздрава России от 12.11.2012 № 906н «Об утверждении порядка оказания медицинской помощи населению по профилю “Гастроэнтерология”» (зарегистрирован в Минюсте России 21 января 2013 г., № 2664). Госпитализация показана при необходимости стационарного обследования в неясных случаях.
7. КРИТЕРИИ ОЦЕНКИ КАЧЕСТВА МЕДИЦИНСКОЙ ПОМОЩИ
Критерии оценки качества медицинской помощи должны соответствовать Приказу Минздрава России от 10.05.2017 № 203н «Об утверждении критериев оценки качества медицинской помощи» (табл. 4).
8. ПРИЛОЖЕНИЯ
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Координатор проекта:
Л.Б. Лазебник, вице-президент РНМОТ, президент НОГР, д.м.н., профессор кафедры поликлинической терапии ФГБОУ ВО «Московский государственный медицинский стоматологический университет им. А.И. Евдокимова» Минздрава России (Москва)
Состав рабочей группы:
Е.В. Голованова, д.м.н., профессор кафедры поликлинической терапии ФГБОУ ВО «Московский государственный медицинский стоматологический университет им. А.И. Евдокимова» Минздрава России (Москва)
С.В. Туркина, д.м.н., профессор кафедры внутренних болезней педиатрического и стоматологического факультетов ФГБОУ ВО «Волгоградский государственный медицинский университет» Минздрава России (Волгоград)
К.Л. Райхельсон, д.м.н., профессор НК и ОЦ гастроэнтерологии и гепатологии «Санкт-Петербургский государственный университет» (Санкт-Петербург)
С.В. Оковитый, д.м.н., профессор, зав. кафедрой фармакологии и клинической фармакологии Санкт-Петербургской государственной химико-фармацевтической академии (Санкт-Петербург)
О.М. Драпкина, чл.-корр. РАН, д.м.н., профессор, директор ФГБУ «НМИЦ терапии и профилактической медицины» Минздрава России, главный внештатный специалист по терапии и общей врачебной практике Минздрава России (Москва)
И.В. Маев, акад. РАН, д.м.н., профессор, зав. кафедрой пропедевтики внутренних болезней и гастроэнтерологии лечебного факультета ФГБОУ ВО «Московский государственный медицинский стоматологический университет им. А.И. Евдокимова» Минздрава России (Москва)
А.И. Мартынов, акад. РАН, д.м.н., президент РНМОТ, профессор кафедры госпитальной терапии ФГБОУ ВО «Московский государственный медицинский стоматологический университет им. А.И. Евдокимова» Минздрава России (Москва)
Г.Е. Ройтберг, акад. РАН, д.м.н., профессор, зав. кафедрой семейной медицины ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, президент многопрофильной клиники ОАО «Медицина» (Москва)
О.В. Хлынова, чл.-кор. РАН, д.м.н., профессор, зав. кафедрой госпитальной терапии ФГБОУ ВО «Пермский государственный медицинский университет им. академика Е.А. Вагнера» Минздрава России, главный внештатный специалист-гастроэнтеролог Минздрава Пермского края (Пермь)
Д.И. Абдулганиева, д.м.н., профессор, зав. кафедрой госпитальной терапии ФГБОУ ВО «Казанский государственный медицинский университет» Минздрава России, главный внештатный специалист-терапевт Минздрава Республики Татарстан (Казань)
С.А. Алексеенко, д.м.н., профессор, зав. кафедрой госпитальной терапии ФГБОУ ВО «Дальневосточный государственный медицинский университет» Минздрава России, главный внештатный гастроэнтеролог Дальневосточного ФО и Минздрава Хабаровского края (Хабаровск)
М.Д. Ардатская, д.м.н., профессор кафедры гастроэнтерологии ФГБУ ДПО «Центральная государственная медицинская академия» Управления делами Президента Российской Федерации (Москва)
И.Г. Бакулин, д.м.н., профессор, зав. кафедрой пропедевтики внутренних болезней, гастроэнтерологии и диетологии имени С.М. Рысса ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России (Санкт-Петербург)
Н.В. Бакулина, д.м.н., профессор, зав. кафедрой внутренних болезней, клинической фармакологии и нефрологии ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России (Санкт-Петербург)
А.О. Буеверов, д.м.н., профессор, «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского» (Московская область)
Е.В. Виницкая, д.м.н., руководитель научно-исследовательского отдела гепатологии Московского клинического научно-практического центра им. А.С. Логинова (Москва)
В.Б. Гриневич, д.м.н., профессор, зав. кафедрой терапии усовершенствования врачей № 2 ФБГВОУ ВО «Военно-медицинской академии им. С.М. Кирова» Министерства обороны России (Санкт-Петербург)
А.Н. Казюлин, д.м.н., профессор кафедры пропедевтики внутренних болезней и гастроэнтерологии лечебного факультета ФГБОУ ВО «Московский государственный медицинский стоматологический университет им. А.И. Евдокимова» Минздрава России (Москва)
И.В. Козлова, д.м.н., профессор, зав. кафедрой терапии, гастроэнтерологии и пульмонологии ФГБОУ ВО «Саратовский государственный медицинский университет имени В. И. Разумовского» Минздрава России (Саратов)
Ю.В. Конев, д.м.н., профессор кафедры поликлинической терапии ФГБОУ ВО «Московский государственный медицинский стоматологический университет им. А.И. Евдокимова» Минздрава России (Москва)
Н.В. Корочанская, д.м.н., профессор кафедры хирургии № 3 ФПК и ППС ФГБОУ ВО «Кубанский государственный медицинский университет» Минздрава России (Краснодар)
Ю.А. Кравчук, д.м.н., профессор кафедры терапии усовершенствования врачей № 2 ФБГВОУ ВО «Военно-медицинской академии им. С.М. Кирова» Министерства обороны России (Санкт-Петербург)
Е.Д. Ли, д.м.н., консультант-терапевт Многопрофильного медицинского Центр Банка России (Москва)
И.Д. Лоранская, д.м.н., профессор, декан терапевтического факультета и зав. кафедрой гастроэнтерологии ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России (Москва)
В.М. Махов, д.м.н., профессор, научный руководитель гастроэнтерологического отделения клиники факультетской терапии им. В.Н. Виноградова, профессор кафедры факультетской терапии № 1 лечебного факультета ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Москва)
С.Н. Мехтиев, д.м.н., профессор, зав. кафедрой гастроэнтерологии Института профессиональной переподготовки ММЦ «СОГАЗ» (Санкт-Петербург)
О.Д. Остроумова, д.м.н., профессор, зав. кафедрой терапии и полиморбидной патологии ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России (Москва)
Ч.С. Павлов, д.м.н., профессор, зав. кафедрой терапии ИПО, зам.директора по научно-организационной работе Института клинической медицины им. Н.В. Склифосовского ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Москва)
В.Г. Радченко, д.м.н., профессор, заслуженный работник Высшей школы РФ, заслуженный врач РФ, профессор кафедры терапии усовершенствования врачей № 2 ФБГВОУ ВО «Военно-медицинской академии им. С.М. Кирова» Министерства Обороны России (Санкт-Петербург)
А.А. Самсонов, д.м.н., профессор кафедры пропедевтики внутренних болезней и гастроэнтерологии лечебного факультета ФГБОУ ВО «Московский государственный медицинский стоматологический университет им. А.И. Евдокимова» Минздрава России (Москва)
Р.Г. Сайфутдинов, д.м.н., профессор, зав. кафедрой госпитальной и поликлинической терапии Казанской государственной медицинской академии (КГМА) – филиала ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, главный гастроэнтеролог Республики Татарстан (Казань)
П.В. Селиверстов, к.м.н., доцент кафедры внутренних болезней ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России (Санкт-Петербург)
С.И. Ситкин, к.м.н., доцент кафедры пропедевтики внутренних болезней, гастроэнтерологии и диетологии имени С.М. Рысса ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России (Санкт-Петербург)
Л.В. Тарасова, д.м.н., профессор, зав. кафедрой факультетской и госпитальной терапии ФГБОУ ВО «Чувашский государственный университет им. И.Н. Ульянова» (Чебоксары)
Е.И. Ткаченко, д.м.н., профессор, заслуженный деятель науки РФ, заслуженный врач РФ, профессор кафедры терапии усовершенствования врачей № 2 ФБГВОУ ВО «Военно-медицинской академии им. С.М. Кирова» Министерства обороны России (Санкт-Петербург)
Ю.П. Успенский, д.м.н., профессор, зав. кафедрой факультетской терапии им. профессора В.А. Вальдмана ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России, главный внештатный гастроэнтеролог Департамента здравоохранения Санкт-Петербурга (Санкт-Петербург)
Ю.А. Фоминых, к.м.н., доцент кафедры внутренних болезней стоматологического факультета ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. академика И.П. Павлова» Минздрава России (Санкт-Петербург)
Ю.В. Цыганова, к.м.н., ассистент кафедры факультетской и госпитальной терапии ФГБОУ ВО «Чувашский государственный университет им. И.Н. Ульянова» (Чебоксары)
О.О. Шархун, д.м.н., доцент кафедры терапии и семейной медицины ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России (Москва)
Приложение А2. Методология разработки клинических рекомендаций
Данные клинические рекомендации разработаны для врачей первичного звена здравоохранения – врачей общей практики, терапевтов, гастроэнтерологов. Разработка рекомендаций проводилась с учетом следующего нормативного документа: Приказ Минздрава России от 12.11.2012 № 906н «Об утверждении порядка оказания медицинской помощи населению по профилю “Гастроэнтерология”» (зарегистрировано в Минюсте России 21 января 2013 г. № 2664).
При создании данных рекомендаций использовались материалы, полученные в результате поиска по базам данных PubMed и Cochrane за 20 лет до сентября 2020 г. Все данные в рекомендациях приведены с указанием уровней достоверности доказательств (УДД) и уровня убедительности рекомендаций (УУР) для методов диагностики, профилактики, лечения и реабилитации согласно Приложению № 2 к Требованиям к структуре клинических рекомендаций, составу и научной обоснованности включаемой в клинические рекомендации информации, утвержденным приказом Минздрава России от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации» (табл. 5–7).

Приложение А3. Связанные документы
- Федеральный закон «О внесении изменений в статью 40 Федерального закона “Об обязательном медицинском страховании в Российской Федерации“ и Федеральный закон от 25.12.2018 № 489-ФЗ “Об основах охраны здоровья граждан Российской Федерации“ по вопросам клинических рекомендаций», принятый Госдумой 19 декабря 2018 г. и одобренный Советом Федерации 21 декабря 2018 г.
- Приказ Минздрава России от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации» (зарегистрирован в Минюсте России 08.05.2019 № 54588).
- Приказ Минздрава России от 12.11.2012 № 906н «Об утверждении порядка оказания медицинской помощи населению по профилю “Гастроэнтерология”» (зарегистрирован в Минюсте России 02.01.2013 № 2664).
- Приказ Минздрава России от 10.05.2017 № 203н «Об утверждении критериев оценки качества медицинской помощи».
Приложение Б1. Алгоритм диагностики неалкогольной жировой болезни печени в группах риска*
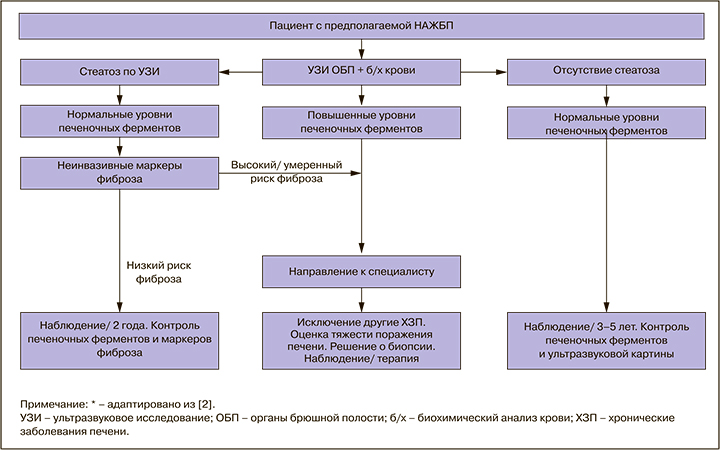
Приложение Б2. Критерии диагностики метаболически ассоциированной жировой болезни печени
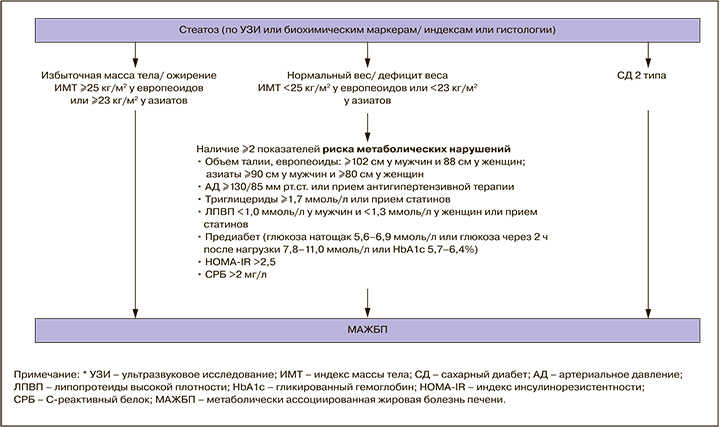
Приложение Б3. Алгоритм дифференцированного назначения гепатопротекторов при неалкогольной (метаболически ассоциированной) жировой болезни печени
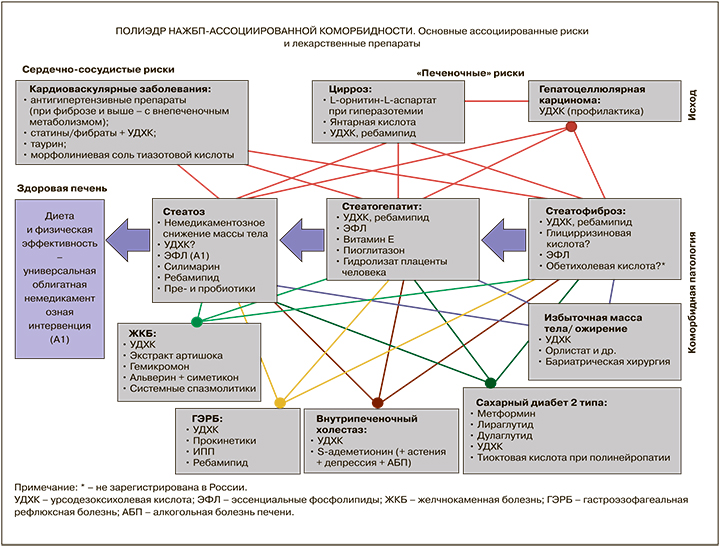
Комментарии: разработанный полиэдр (многоугольник) коморбидности НАЖБП (МАЖБП) служит основой для построения алгоритмов таргетной терапии пациентов с различными стадиями НАЖБП, основанной на доказательствах. Поскольку МАЖБП, метаболические нарушения, болезни сердечно-сосудистой, гепатобилиарной системы – взаимозависимые состояния, терапия должна воздействовать на максимальное количество патологических процессов.
1. Борьбу за обратное развитие стадий МАЖБП, а также улучшение функционального состояния печени при необратимых поражениях.
2. Профилактику фатальных осложнений со стороны печени (цирроз, рак).
3. Профилактику сердечно-сосудистых рисков: лечение проявлений МС, дислипидемии, АГ.
Основные цели терапии НАЖБП (МАЖБП)
1) Обеспечение регрессии (движение справа налево) или отсутствия прогрессии заболевания.
2) Профилактика развития необратимых осложнений со стороны печени («печеночных» рисков) – ЦП и рака печени (проводится с момента диагностики стеатоза печени).
3) Профилактика сердечно-сосудистых рисков (проводится с момента диагностики стеатоза печени).
На каждой стадии НАЖБП (МАЖБП) подбор гепатопротекторной терапии проводится с учетом наличия/отсутствия следующих сопутствующих патологий:
- ЖКБ;
- кардиоваскулярых заболеваний;
- внутрипеченочного холестаза;
- избыточной массы тела/ожирения;
- СД 2-го типа;
- гастроэзофагеальной рефлюксной болезни (ГЭРБ).
NB! Гепатопротекторы являются лишь составной частью терапии коморбидного пациента с НАЖБП (МАЖБП), не заменяя/исключая базисную терапию основного заболевания (например, гипотензивную терапию при АГ, гипогликемизирующие средства при СД, ингибиторы протонной помпы при ГЭРБ и т.д.).
Приложение В. Информация для пациента: рекомендации по коррекции образа жизни при НАЖБП
Залог успеха в лечении НАЖБП:
- здоровое питание;
- физическая активность.
Уменьшите размер съедаемых порций, питайтесь по возможности часто, но небольшими порциями. Исключите из регулярного питания продукты, богатые простыми углеводами (сладости, мучное), и старайтесь употреблять их изредка, в небольших количествах
Замените сладкие и газированные напитки водой или несладкими напитками.
Поставьте себе цель ‒ съедать 5 порций фруктов и овощей в день. Ешьте продукты с высоким содержанием клетчатки, в том числе содержащие цельное зерно. Избегайте насыщенных жиров, используйте оливковое масло холодного отжима в качестве основного добавленного в блюда источника жира. Ешьте рыбу 2–3 раза в неделю.
Избегайте обработанных продуктов и фастфуда. Читайте этикетки на пищевых продуктах, чтобы найти скрытые жир, сахар и натрий. Старайтесь заниматься какой-либо физической активностью не менее 60 мин в день. Это не обязательно должно быть одномоментно. Ходите больше, упражняйтесь, по возможности поднимайтесь по лестнице.


