Циррозы печени (ЦП) остаются серьезной медицинской, социальной и экономической проблемой мирового здравоохранения. В последние десятилетия Всемирной организацией здравоохранения (ВОЗ) для количественного изучения общественного здоровья с учетом преждевременной смертности, заболеваемости и инвалидизации населения предложена концепция Global Burden of Disease – глобальное бремя болезни (ГББ). При изучении ГББ проводятся исследования группы показателей, характеризующих смертность и инвалидность населения, финансовые потери от основных заболеваний, травм и факторов их риска. Эти показатели получают в результате комплексных региональных и/или глобальных медицинских статистических исследований [1]. По данным, опубликованным ВОЗ в 2020 г., глобальное бремя ЦП, несмотря на тенденцию к снижению за последние 10 лет, занимало 16 место среди более чем 100 ведущих неинфекционных заболеваний человечества, а в группе мужчин в возрасте 50–74 лет входило в первую десятку [1, 2].
Основной риск для здоровья и жизни пациента представляет декомпенсированный ЦП. Переход от компенсированного к декомпенсированному ЦП представляет собой поворотный момент с точки зрения качества жизни больного, вероятности наступления инвалидности и риска летального исхода [3, 4]. К ведущим причинам декомпенсации ЦП относятся нарастание портальной гипертензии и развитие связанных с ней осложнений: кровотечения из варикозно расширенных вен пищевода, асцита, хронической печеночной энцефалопатии, гепаторенального синдрома, синдрома эндотоксемии и системного воспаления [4–6].
Кишечная микробиота занимает важное место в патофизиологии ЦП [7–9]. Изменения функционального состояния желудочно-кишечного тракта, включая синдромы мальабсорбции и избыточного бактериального роста в тонкой кишке, дисбиоз кишечника, чрезвычайно распространены у больных ЦП, особенно на стадии декомпенсации [5, 9]. Барьерная функция кишечника препятствует проникновению в системный кровоток потенциально патогенных микроорганизмов и их эндотоксинов – липополисахаридов (LPS). В то же время прогрессирование портальной гипертензии у больных ЦП приводит к нарушению проницаемости эндотелиального барьера кишечника, что способствует транслокации микробных LPS в близлежащие лимфоузлы и систему кровообращения [10–12]. В свою очередь, LPS запускают цитокиновый каскад, а также активируют другие медиаторы иммунной системы [12–14].
Центральная роль в обеспечении взаимодействий бактериального LPS с белками-рецепторами клеток врожденного иммунитета принадлежит липополисахарид-связывающему белку – lipopolysaccharide-binding protein (LBP) [15, 16]. LBP участвует в запуске сложного каскада реагирования рецепторного комплекса с LPS, заключающегося в его распознавании, связывании и транспортировке, а также усилении сигнала опасности инфицирования [15, 16]. Связываясь со свободным или извлеченным из мембран грамотрицательных патогенов эндотоксином, LBP доставляет его клеточным мембранным рецепторам мононуклеарных фагоцитов – мембранным кластерам дифференцировки (mCD14) или их растворимой форме (sCD14) [17].
На сегодняшний день LBP относят к острофазовым белкам I класса [15, 18]. В связи с этим ряд авторов рассматривают его как новый многообещающий диагностический маркер синдромов эндотоксемии, системного воспаления, который также может использоваться при проведении мониторинга их терапии, в том числе при ЦП [16, 19, 20]. В то же время клинико-диагностическое значение LBP при ЦП изучено еще недостаточно. Обоснование его роли в качестве предиктора прогрессирования и развития декомпенсированного ЦП имеет существенное значение для медицинской науки и практики.
Целью нашей работы стало установление прогностического и диагностического значения исследования в крови концентрации LBP при ЦП.
МАТЕРИАЛ И МЕТОДЫ
Было обследовано 120 больных ЦП вирусной, алкогольной и смешанной (вирусной + алкогольной) этиологии – 65 мужчин и 55 женщин в возрасте от 20 до 60 лет. Контрольную группу составили 30 практически здоровых пациентов соответствующего пола и возраста. Обследование проводилось при поступлении больного в гастроэнтерологический стационар в фазе обострения заболевания. Диагноз ЦП и его ведущие синдромы устанавливались на основании результатов изучения большого комплекса клинико-лабораторных и инструментальных показателей в соответствии с существующими клиническими рекомендациями [3, 5].
Исследование концентрации LBP в плазме крови выполнялось методом твердофазного иммуноферментного анализа (ИФА) с использованием коммерческих тест-систем компании HyCult Biotechnology (Нидерланды).
Статистическая обработка материала осуществлялась общепринятыми методами вариационной статистики с использованием пакета прикладных программ Statistica 10.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Медиана значений концентрации LBP в контрольной группе здоровых лиц составила 13,5 {7,9; 14,5} нг/мл, что соответствовало референсным показателям, рекомендованным разработчиками тест-системы, и было сопоставимо с данными литературы. В группе больных ЦП, по сравнению с контрольной группой, уровень LBP значительно возрастал до 46,0 {27; 54,6} нг/мл. Различия с контрольной группой имели высокую степень достоверности (р <0,001). Вариабельность величины LBP при ЦП находилась в пределах от 10,4 до 58,3 нг/мл. При этом превышение нормальных значений протеина при ЦП наблюдалось в 88% случаев. Отсутствовали достоверные (р >0,05) гендерные различия средних значений концентраций LBP при ЦП и в группе контроля.
Было показано, что повышение концентрации LBP не имело достоверных различий (р >0,05) в зависимости этиологии ЦП. Медиана значений LBP в подгруппе больных вирусными ЦП (n=32) составила 48,0 {21; 56} нг/мл, алкогольными ЦП (n=43) – 42,0 {26; 53} нг/мл, смешанными (вирусно-алкогольными) ЦП (n=45) – 50,0 {28; 56}.
В то же время уровень LBP при ЦП с высокой активностью мезенхимально-воспалительного синдрома (n=33) был достоверно (р <0,05) выше по сравнению с ЦП умеренной активности (n=87): 49,0 {35; 56} против 42,0 {23; 51} нг/мл соответственно.
Ведущим синдромом при ЦП является портальная гипертензия, обусловливающая возникновение большинства осложнений и развитие декомпенсации заболевания [5, 22]. Это послужило основанием для поиска связи изменений концентрации LBP с выраженностью ряда наиболее часто встречающихся синдромов, ассоциированных с портальной гипертензией. Были сопоставлены уровни LBP у обследованных пациентов с такими проявлениями ЦП, как варикозное расширение вен пищевода, асцит, гиперспленизм, хроническая печеночная энцефалопатия. Полученные результаты представлены в таблице 1.
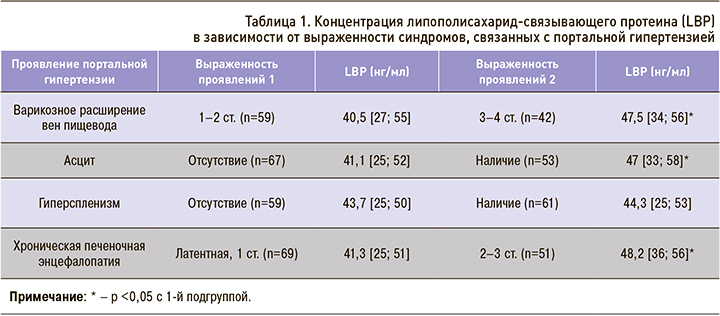
В связи с тем что варикозное расширение вен пищевода по данным эзофагогастрофиброскопии было выявлено у 84% больных ЦП, концентрация LBP была сопоставлена со степенью его выраженности. Было выделено две подгруппы: 1-я – пациенты с 1–2 ст. варикозного расширения вен пищевода (n=59), 2-я – с 3–4 ст. (n=42). Полученные данные свидетельствуют о достоверном (р <0,05) повышении средних значений LBP (р <0,05) в подгруппе с более высокой степенью варикозного расширения вен пищевода (см. табл. 1).
Учитывая, что увеличение степени варикозного расширения вен пищевода свидетельствует о нарастании портальной гипертензии, наблюдавшемся у больных из 2-й подгруппы, существенное увеличение концентрации LBP может объясняться реакцией, обусловленной взаимодействием протеина с микробными LPS. Их повышенное количество при высокой портальной гипертензии может поступать в кровоток через портокавальные анастомозы и путем транслокации вследствие нарушения проницаемости стенки кишечника [11, 22].
Наличие асцита также характеризовалось достоверным (р <0,05) ростом средних значений LBP относительно подгруппы больных ЦП с его отсутствием (см. табл. 1). В связи с этим выявление у пациента с асцитом высоких концентраций LВP, особенно при появлении у него резистентности к диуретикам, необходимо учитывать в качестве предиктора развития асцита-перитонита.
В то же время у больных ЦП не отмечалось достоверных различий показателей LBP в зависимости от наличия или отсутствия синдрома гиперспленизма (см. табл. 1). Даже после выделения подгрупп больных с гиперспленизмом 1 ст. (n=42) и 2–3 ст. (n=17) статистически достоверных различий между ними по LВP установлено не было (р >0,05).
Одним из самых неблагоприятных клинических проявлений ЦП выступает хроническая печеночная энцефалопатия, развивающаяся вследствие снижения детоксикационной функции печени, гипераммониемии и наличия коллатерального кровообращения [3, 5]. Учитывая, что признаки хронической печеночной энцефалопатии различной степени выраженности имелись у большинства больных с ЦП, было выделено две подгруппы пациентов: 1-я (n=69) – больные с латентной хронической печеночной энцефалопатией или с энцефалопатией 1 ст., 2-я (n=51) – пациенты с проявлениями хронической печеночной энцефалопатии 2–3 ст.
При проведении диагностики хронической печеночной энцефалопатии учитывались такие ее симптомы, как изменение поведения, нарушение сна, дезориентация в пространстве и времени, раздражительность, возбуждение, заторможенность, замедление движений и речи, частая смена настроения, хлопающий тремор рук, результаты выполнения психометрического теста (связи чисел). Кроме того, были исследованы биохимические показатели крови, свидетельствующие о развитии печеночно-клеточной недостаточности, в первую очередь гипоальбуминемия, снижение уровня факторов протромбинового комплекса, нарастание значений билирубина.
Результаты изучения концентрации LBP у больных ЦП в зависимости от выраженности у них ХПЭ также представлены в таблице 1. Как следует из нее, средние значения LBP достоверно (р <0,05) повышались по мере нарастания степени хронической печеночной энцефалопатии.
Принимая во внимание вышеприведенные литературные данные о LBP как маркере нарушений кишечного микробиоценоза, транслокации микробных LPS и эндотоксемии при ЦП, выявленное значительное повышение значений протеина у больных с хронической печеночной энцефалопатией 2–3 ст. позволяет прогнозировать у них быстрое нарастание декомпенсации ЦП и требует назначения соответствующей медикаментозной терапии, включая деконтаминацию кишечника.
Тяжесть поражения печени у больных ЦП в значительной степени обусловлена нарушением ее функционального состояния. В связи с этим было важно установить возможную взаимосвязь изменений показателей LBP со степенью недостаточности печени, для оценки которой в гепатологии используется такой интегративный показатель, как класс тяжести ЦП по Child–Pugh. Согласно этой классификации, было обследовано 29 больных ЦП класса А, 67 – класса В, 24 – класса С. Результаты исследования концентрации LBP у больных ЦП в зависимости от градации по Child–Pugh представлены в таблице 2.
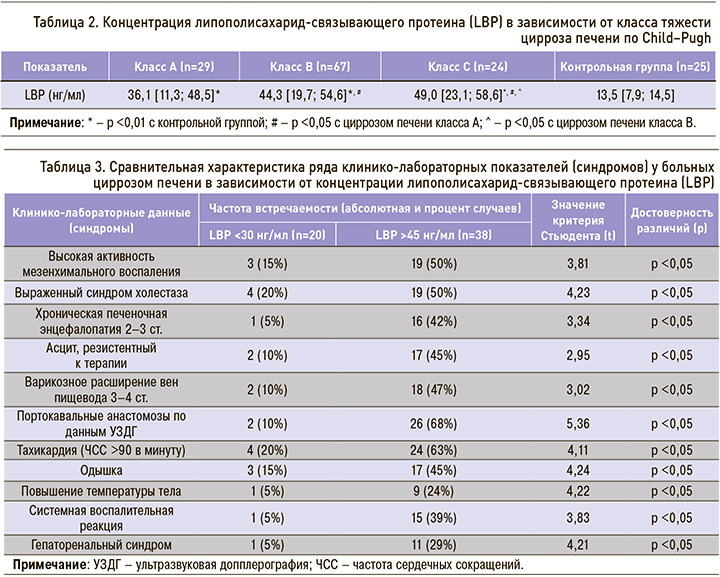
Было установлено, что, независимо от класса тяжести ЦП, значения LBP были существенно (р <0,01) повышены по сравнению с нормой. При этом по мере возрастания класса тяжести ЦП отмечено увеличение медианы значений LBP. Наиболее высокий уровень исследуемого показателя наблюдался у больных ЦП класса С. Выявлены достоверные (р <0,05) различия между концентрациями LBP у больных ЦП класса А и С по Child–Pugh.
Учитывая, что в соответствии с классификацией по Child–Pugh к классу С относятся больные с декомпенсированным ЦП, полученные данные, в свою очередь, характеризуют LBP как предиктор декомпенсации заболевания. Следовательно, выявление высоких значений этого протеина, в несколько раз превышающих норму, служит не только важным маркером эндотоксемии и системной воспалительной реакции, но и показателем, который может быть использован в качестве предиктора декомпенсации ЦП.
Для выяснения возможной связи динамики значений LBP с продолжительностью ЦП пациенты были распределены на три подгруппы: 1-я – больные ЦП c продолжительностью заболевания до 1 года с момента постановки диагноза, 2-я – от 1 года до 5 лет, 3-я подгруппа – более 5 лет.
Концентрация LBP у больных из 1-й подгруппы (n=25) составила 42 {21; 50} нг/мл, из 2-й (n=59) – 44 {22; 55} нг/мл, из 3-й (n=36) – 47 {24; 56} нг/мл. Достоверные различия были установлены между значениями в подгруппах больных со стажем ЦП до года и более 5 лет (р <0,05). Следовательно, при ЦП наблюдается четкая тенденция к росту значений LBP по мере увеличения длительности заболевания.
С учетом вариабельности полученных значений концентраций LBP при ЦП было проведено сравнительное исследование клинико-лабораторных особенностей заболевания у обследованных пациентов с наименьшим и наибольшим повышением концентрации протеина. Было выделено две подгруппы: 1-я – больные ЦП с LBP <30 нг/ мл (n=20) c медианой 21,0 {15; 26} нг/мл, 2-я – с LBP >45 нг/ мл (n=38) с медианой 54,0 {45; 57} нг/мл. Различия при сравнении этих подгрупп имели высокую степень статистической достоверности (р <0,01).
Сравнительная характеристика анализируемых клинико-лабораторных показателей и синдромов у больных ЦП в зависимости от концентрации LBP приведена в таблице 3.
Результаты сравнительного исследования показали, что имеются достоверные (р <0,05) различия между частотой (абсолютные значения и процент случаев) выявления анализируемых клинико-лабораторных показателей (синдромов) у больных из 1-й и 2-й подгрупп. Как следует из таблицы 3, у больных ЦП с высокими концентрациями LBP значительно преобладала частота высоко активных форм заболевания, выраженной портальной гипертензии и ее осложнений (более высокий процент больных с варикозным расширением вен пищевода 3–4 ст., наличием портокавальных анастомозов по данным ультразвуковой допплерографии, резистентным асцитом, хронической печеночной энцефалопатией 2–3 ст. и т.д.).
Повышение температуры тела наблюдалось у 5% больных из 1-й подгруппы и у 24% из 2-й. При отсутствии у больных каких-либо сопутствующих воспалительных заболеваний причиной субфебрилитета, по-видимому, выступали избыточный бактериальный рост в кишечнике и синдромом эндотоксемии. Об этом свидетельствует и значительно более частое обнаружение у лиц из 2-й подгруппы данных в пользу системной воспалительной реакции и гепаторенального синдрома.
Обращало на себя внимание распределение больных ЦП классов А, В и С по Child–Pugh в зависимости от концентрации LBP. Как следует из рисунка, в подгруппе больных ЦП с нормальными значениями или незначительным повышением концентрации LBP <30 нг/мл 50% пациентов относилось к классу А по Child–Pugh, тогда как в подгруппе с высокими цифрами LBP >45 нг/мл лишь в 13% случаев. При этом ЦП класса В встречался примерно с одинаковой частотой в обеих подгруппах (45%), а декомпенсированный ЦП класса С в 42% случаев у лиц с высокими значениями протеина и лишь в 5% у пациентов с показателями LBP <30 нг/мл.
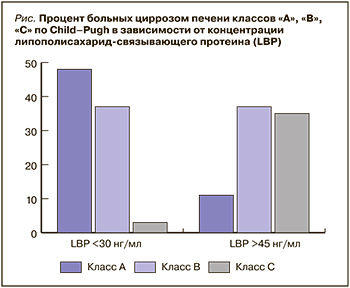
Следовательно, результаты проведенного сравнительного анализа свидетельствуют, что у больных ЦП значительный (трехкратный и выше относительно нормы) рост уровня LBP связан с более тяжелым течением заболевания, высоким риском развития декомпенсированного ЦП по сравнению с пациентами, у которых имелось менее существенное (до двух норм) повышение концентрации данного показателя.
ЗАКЛЮЧЕНИЕ
ЦП характеризуются существенным повышением концентрации в крови LBP по сравнению с контрольной группой здоровых лиц (доноров). Установлена связь значений этого протеина с выраженностью портальной гипертензии, хронической печеночной энцефалопатии, развитием асцита, в том числе резистентного к диуретикам, классом тяжести ЦП по Child–Pugh. При этом наиболее высокие концентрации LBP (трехкратные и выше по сравнению с нормой) встречались преимущественно у больных ЦП класса С по Child–Pugh. У пациентов с высоким уровнем этого протеина достоверно чаще наблюдалась высокая активность синдромов мезенхимального воспаления и холестаза, чаще развивались гепаторенальный синдром и синдром системного воспаления.
Учитывая, что LBP многими авторами признается как острофазовый белок I класса, маркер синдромов эндотоксемии и избыточного бактериального роста, на основе полученных данных можно сделать следующее заключение: значительное повышение концентрации LBP в крови при ЦП служит предиктором тяжелого течения заболевания и развития декомпенсированного ЦП.
Анализ результатов исследования позволяет высказать мнение, что исследование концентрации LBP при ЦП является перспективным для медицинской практики как для углубленной клинической оценки состояния больного и прогнозирования дальнейшего течения заболевания, так и назначения соответствующей патогенетической терапии.


