ВВЕДЕНИЕ
Обструктивное апноэ сна (ОАС) – распространенное хроническое заболевание группы расстройств сна, характеризующееся регулярными глоточными коллапсами с фрагментацией сна, снижением насыщения артериальной крови кислородом (десатурации), избыточной дневной сонливостью. ОАС напрямую связано с повышенной смертностью от всех причин [1]. К другим неблагоприятным для здоровья последствиями ОАС у нелеченых пациентов относятся высокие риски сердечно-сосудистых заболеваний, цереброваскулярные события, диабет и когнитивные нарушения. Более того, ОАС оказывает отрицательное воздействие на качество жизни пациента и многократно повышает риски травм в результате дорожно-транспортных происшествий [2].
Висконсинское когортное исследование сна (WSCS) показало, что 17,4% женщин и 33,9% мужчин в возрасте от 30 до 70 лет имеют легкое ОАС с индексом апноэ–гипопноэ сна (ИАГ) 5–14,9/ч, в то время как у 5,6% женщин и 13,0% мужчин обнаруживается среднетяжелая форма заболевания (ИАГ 15–29,9/ч) [3]. Кроме того, в период с 1990 по 2018 г. распространенность ОАС увеличилась на 30%; в настоящее время оно выявляется у каждого пятого (20%) урбанизированного жителя Европы и Северной Америки, причем 15% лиц уже имеют среднетяжелое течение заболевания [4, 5]. К сожалению, низкая осведомленность населения об ОАС и его последствиях приводит к верификации и лечению болезни лишь в 20% случаев, что способствует сохранению высоких рисков смерти от всех причин, возрастающих пропорционально тяжести ОАС [6]. Именно поэтому эффективная лечебная доктрина, основанная на рациональных методах коррекции ОАС, имеет важное практическое значение [7].
Целью настоящего обзора стал анализ клинически важных стратегий терапии у коморбидных пациентов ОАС и обобщение опыта их применения в реальной клинической практике с позиций современной прецизионной медицины.
ДИАГНОСТИКА
Наличие у пациента ОАС и его тяжесть принято определять методом полисомнографии (ПСГ) – мультимодальной методики из группы неинвазивной функциональной диагностики, позволяющей регистрировать и анализировать неврологические (электроэнцефалограмма), кардиологические, респираторные сигналы в период сна. При проведении ПСГ респираторные датчики обнаруживают уменьшение/отсутствие воздушного потока, что классифицируется как:
1) «гипопноэ» при частичном уменьшении/снижении воздушного потока на 10 с;
2) «апноэ» при полном прекращении воздушного потока на 10 с;
3) «респираторная активация/ароузал» при нарушении воздушного потока и повышении сопротивления дыхательных путей ко вдоху.
Главным показателем, отражающим границу патологического «порога» и наличие дыхательных расстройств, принято считать ИАГ – общее количество всех респираторных нарушений к первому часу времени сна. У лиц без расстройств дыхания в период сна ИАГ <5/ч [8]. Американская академия медицины сна (AASM) классифицирует ОАС по степени тяжести в зависимости от уровня ИАГ: легкому ОАС соответствует ИАГ 5–15/ч, среднетяжелому – >15–30/ч, тяжелому – >30/ч [9].
Каково же реальное клиническое значение ИАГ как показателя тяжести ОАС? Сосредотачиваясь исключительно на ИАГ как основном «маркере» патологии, клиницисты упускают возможность стратификации сердечно-сосудистых рисков, особенно у пациентов с тяжелым течением и выраженной коморбидностью [6]. Необходимо помнить, что ИАГ – достаточно грубый и приблизительный показатель, плохо отражающий патофизиологическое разнообразие процессов и фенотипы хронического заболевания. Он не позволяет достоверно прогнозировать неблагоприятные исходы и фатальные осложнения заболевания. Именно поэтому для гармоничной оценки заболевания опытные специалисты, наряду с ИАГ, всегда учитывают другие демографические и прогностические факторы, клинические характеристики пациента, показатели работы сердечно-сосудистой системы и общего газообмена, регистрируемых в период ПСГ [10]. Основное клиническое значение ИАГ сводится к определению «серьезности последствий» патологического респираторного события в той мере, в которой оно коррелирует с частотой (т.е. чем чаще событие, тем более выражены патологические изменения). Однако существуют другие клинически важные и независимые от ИАГ «оси тяжести» заболевания, связанные с глубиной, быстротой и продолжительностью ночной гипоксии, степенью и продолжительностью «мозговых активаций» (ароузалов), выраженностью активации центральной нервной системы (ЦНС), принципиально влияющие на картину заболевания, особенно у коморбидных пациентов. Несмотря на то что на сегодняшний день нет единого мнения об истинной клинической пользе указанных показателей по причине отсутствия масштабных рандомизированных контролируемых исследований (РКИ), принятие ИАГ 5–15/ч в качестве «линии порога» болезненного состояния, «точки отсчета» заболевания со значимыми клиническими исходами открывает клиницисту возможность раннего терапевтического вмешательства и профилактики кардиоваскулярных осложнений. Это делает ИАГ крайне полезным диагностическим инструментом [11]. Многие специалисты в области медицины сна следуют нашим рассуждениям относительно пользы/вреда ИАГ и не используют его в качестве линейного показателя тяжести заболевания. Более того, важно не отказываться от ИАГ полностью, а понизить его статус с уровня «золотого стандарта» тяжести ОАС до уровня «прогностической значимости» заболевания, что рационализирует его использование [12].
Несмотря на то что до настоящего времени ПСГ, выполняемая в «лабораториях сна», т.е. с посещением пациентом специальных стационаров (уровень-1), или проводимая на дому (уровень-2), признается «золотым стандартом» исследований сна, для ранней диагностики ОАС возможно предложить более простые и экономичные методы. В этом контексте интерес представляет диагностическое устройство WatchPAT® (WatchPAT® 300, Itamar Medical, Caesarea, Израиль) – портативный амбулаторный аппарат для проведения «компьютерной сомнографии» (рис. 1) [13].
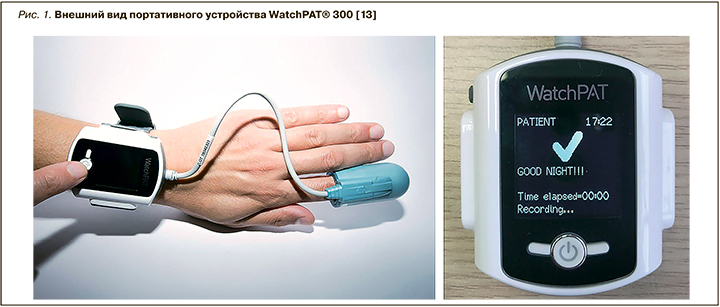
Уникальная особенность WatchPAT® – сочетание возможности регистрации периферического артериального тонуса (PAT) с одновременной пульсоксиметрией и актиграфией для оценки кардиореспираторных событий в период сна. Принцип регистрации патологического респираторного события основан на резком повышении тонуса симпатической нервной системы (СНС) в конце эпизода апноэ/гипопноэ, закономерном изменении артериального тонуса сосудов фаланги пальца с развитием пальцевой вазоконстрикции, достоверно распознаваемое плетизмографическим датчиком. Определяемый PAT-показатель сопоставляется с данными пульсоксиметрии (степенью гипоксемии, частотой сердечных сокращений) и актиграфии (ночная моторика) в патентованном программном продукте (Zzz PAT® version 4.3.62; Itamar Medical). В ходе алгоритма ступенчатого автоматического анализа можно с высокой точностью и достоверностью определить основные сомнографические (например, стадии сна, латенция ко сну) и кардиореспираторные показатели (например, ИАГ, частота сердечных сокращений, SpO2), что позволяет типировать сон и верифицировать сопровождающие сон состояния. Эта методика получила название «компьютерная сомнография». Именно она является точной, воспроизводимой и простой альтернативой ПСГ.
Проведенные многочисленные исследования данной технологии (WatchPAT®) демонстрируют ее высокую сопоставимость с ПСГ по обнаружению респираторных событий, типированию сна, выявлению ночных гипоксемии и нарушений ритма сердца; в настоящее время это позволяет считать ее приоритетной диагностической методикой обнаружения ОАС у амбулаторных пациентов [14]. Учитывая современную эпидемиологическую обстановку (пандемия COVID-19), существенно ограничивающую любые амбулаторные диагностические возможности, создание одноразовых устройств WatchPat® ONE (рис. 2), высылаемых почтовым отправлением в адрес пациента вместе с видеоинструкцией, служит уникальной и зачастую единственной возможностью амбулаторной диагностики ОАС. После диагностической ночи полученные результаты отправляются пациентом самостоятельно через мобильное приложение в телефоне в «облако», где в дальнейшем анализируются специалистами в области медицины сна с постановкой необходимого диагноза [15].

Важно отметить, что широкое внедрение инновационных технологий телемедицины для диагностики в амбулаторной практике пациентов с ОАС открывает новые возможности для верификации этого заболевания, приводящего к значимым, а зачастую фатальным кардиоваскулярным осложнениям, оказывающего выраженное негативное воздействие на качество жизни пациента [14].
ОБЩИЕ ПРИНЦИПЫ ТЕРАПИИ ВЗРОСЛЫХ ПАЦИЕНТОВ С ОБСТРУКТИВНЫМ АПНОЭ СНА
Общая концепция терапии пациентов с ОАС включает модификацию поведения, снижение массы тела, изменение характера лекарственной терапии, респираторную поддержку положительным давлением (СРАР-терапию), терапию внутриротовыми аппликаторами (MADs-терапия), быстрое расширение верхней челюсти мини-имплантатом (MARME-терапия), а также хирургические процедуры – увулопалатофарингопластику, трахеостомию, челюстно-нижнечелюстное смещение (MMA-терапию), стимуляцию подъязычного нерва.
Поведенческие методы коррекции направлены на устранение факторов, усиливающих тяжесть ОАС. Так, всем пациентам ОАС рекомендуется избегать употребления алкоголя и седативных средств. У ряда больных потеря веса и избегание положения «сон на спине» благоприятно влияет на проходимость дыхательных путей, сводя к минимуму эпизоды апноэ/гипопноэ и храпа. В то же время роль фармакотерапии, как и эффективность многих лекарственных субстанций в терапии пациентов ОАС, остается малоизученной и плохо понимаемой.
НЕХИРУРГИЧЕСКИЕ МЕТОДЫ ТЕРАПИИ
Терапией первой линией (или патогенетической терапией) у пациентов ОАС признается СРАР-терапия, надежно стабилизирующая воздухоносный просвет при любой степени тяжести заболевания. Регулярное использование CPAP-терапии эффективно уменьшает симптомы сонливости и улучшает показатели качества сна и жизни (рис. 3) [16].
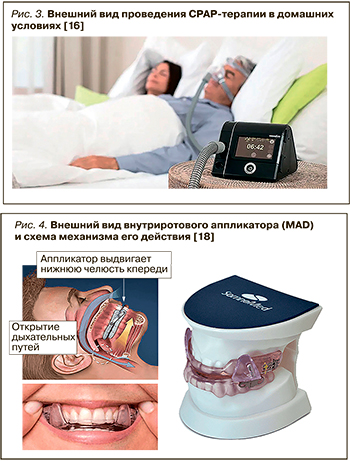
CPAP-терапия имеет прямые показания к применению у пациентов со среднетяжелым и тяжелым течением ОАС; ее эффективность превышает 90%. Однако оценка данных домашнего использования респираторной поддержки в эффективном режиме СРАР >4/ч в ночь показывает приверженность к такой терапии лишь у 64% больных, что зачастую обусловлено необходимостью использования лицевых гарнитур. Тем не менее для пациентов с низким комплаенсом в отношении СРАР-терапии необходимо как можно раньше рассмотреть альтернативные варианты лечения [17].
Терапия внутриротовыми аппликаторами (MADs-терапия) хорошо переносится большинством пациентов ОАС. Более того, подавляющее большинство больных с легким течением заболевания предпочитает MADs-терапию хирургическому вмешательству или даже СРАР-терапии; при этом эффективность коррекции заболевания в случае использования этого метода находится в диапазоне 80% (рис. 4) [18].
Однако в нормативных документах AASM именно СРАР-терапия рекомендована как приоритетный метод лечения для таких пациентов, поскольку она обладает гарантированной коррекцией апноэ/гипопноэ [1]. И только в случае некомплаентности или неприемлемости для пациентов СРАР-терапии приоритетной стратегией становится применение индивидуально изготавливаемых внутриротовых аппликаторов, особенно у пациентов с аномалиями черепно-челюстно-лицевой зоны и протрузией нижней челюсти [19].
Быстрое расширение верхней челюсти (RME-терапия) служит эффективным методом терапии апноэ сна как у детей, так и взрослых. Особого вида скелетный расширитель верхней челюсти (MSE) может существенно увеличить размер носовой полости и значительно повысить прохождение потока воздуха через носовые ходы. Однако такие инвазивные хирургические процедуры увеличивают риск заболеваемости и повышают стоимость лечения. В связи с этим у возрастных пациентов с ОАС используют процедуру MARME-терапии, которая в настоящее время является стандартным подходом, уменьшающим риски нежелательных побочных эффектов [20]. В ряде исследований показана ее высокая эффективность среди пациентов молодого возраста с легким течением ОАС. Вместе с тем, чтобы подтвердить эффективность RME-терапии у широкого круга пациентов, необходимы масштабные РКИ, сравнивающие различные подходы малоинвазивной терапии у взрослых пациентов с ОАС [21].
ХИРУРГИЧЕСКИЕ МЕТОДЫ ТЕРАПИИ
Одним из наиболее распространенных хирургических методов лечения пациентов ОАС длительное время была увулопалатофарингопластика (UPPP-терапия), заключающаяся в удалении миндалин, нёбного язычка и задней занавески. Описано несколько вариантов проведения UPPP-терапии, способствующих нормализации ИАГ у пациентов с ОАС, однако AASM официально не рекомендует этот метод в качестве вмешательства первой линии у больных со среднетяжелым и тяжелым течением ОАС [22]. В метаанализе Choi J.H. et al. (2016), посвященном оценке предикторов успешности UPPP-терапии, было обнаружено, что гипертрофия миндалин в стадии «Фридман-I» (большие миндалины и нормальное положение мягкого нёба) была предиктором успеха, тогда стадия «Фридман-III» и низкое положение подъязычной кости выступали предиктором хирургической неудачи [23].
Трахеостомия была единственным и основным хирургическим методом лечения пациентов с ОАС с конца 1960-х до начала 1980-х гг., когда прочие методы лечения не давали должного эффекта. Несмотря на то что трахеостомия имеет «идеальное» преимущество, а именно надежно обходит зону обструкции и, следовательно, «вылечивает» пациентов с ОАС, она признается «крайней/вынужденной хирургической процедурой» [24]. Наиболее подходящими кандидатами для трахеостомии считаются больные, у которых другие методы терапии, включая хирургические вмешательства на черепно-челюстно-лицевой зоне, оказались безрезультатными [25].
Согласно данным научной литературы, уровень успешности челюстно-нижнечелюстного смещения MMA-терапии (ортогнатической хирургии) варьирует от 75 до 100%, что делает его наиболее эффективным хирургическим методом коррекции ОАС [26]. Основное действие MMA-терапии связано с увеличением просвета верхних дыхательных путей в переднезаднем и латеральном направлениях с приподниманием подъязычной кости. Подавляющее большинство стоматологов признают ММА-терапию «золотым стандартом» ортодонтической хирургической помощи пациентам с легкой степенью тяжести ОАС. Однако для подтверждения эффективности ММА-терапии среди больных со среднетяжелым и тяжелым течением ОАС необходимы репрезентативные РКИ, оценивающие отсроченные последствия процедуры и ее сторонние эффекты [27].
В рамках стадийного или поэтапного хирургического протокола при ОАС принято выделять основные зоны обструкции верхних дыхательных путей, а именно мягкое нёбо, боковую стенку глотки, основание языка и гортань. Хирургическое лечение фазы 1 основывается как раз на верификации зоны обструкции в ходе до операционного осмотра/оценки. Поэтому хирургия фазы 1 включает три процедуры: 1) UPPP-терапию при обструкции ротоглотки; 2) продвижение гениоглосса с подъязычной миотомией; 3) устранения обструкции, вызванной корнем языка [28]. Через 6 мес после операции проводится повторная компьютерная сомнография, оценивающая коррекцию ИАГ.
Пациенты, у которых не достигнут планируемый эффект в фазе 1, подвергаются хирургическому лечению фазы 2 – остеотомии с выполнением ММА-терапии [29]. Позднее был предложен одномоментный протокол хирургического вмешательства, предусматривающий расширенную MMA-терапию с воздействием на корень языка. Он показал 95,8% эффективность через 3 и 6 мес у пациентов со среднетяжелым и тяжелым течением ОАС. При этом до настоящего времени не существует единого мнения о пользе/вреде разделения протокола хирургического лечения на фазы, поскольку отсутствуют соответствующие репрезентативные РКИ [30].
Добавим, что в 2014 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило использование для лечения пациентов ОАС стимулятора подъязычного нерва (СПЯ-терапии; рис. 5) [31]. Целевой группой этой методики были пациенты с ОАС, не переносящие СРАР-терапию, которым хирургическим путем имплантировались устройства для стимуляции верхних дыхательных путей. Такая нейростимуляция для стабилизации верхних дыхательных путей в период сна признается менее инвазивной и более эффективной терапией лишь для отдельных больных. Вероятность успеха СПЯ-терапии наиболее высока у пациентов ОАС, имеющих: 1) низкий индекс массы тела; 2) ИАГ <50/ч; 3) переднезадний паттерн нёбных коллапсов [32].

ФЕНОТИПЫ ПАЦИЕНТОВ С ОБСТРУКТИВНЫМ АПНОЭ СНА
Взгляды на патогенез ОАС за последние 20 лет существенно изменились. В настоящее время считается, что существует несколько основных фенотипических маркеров, описывающих патоморфологические и клинические различия в прогрессировании и исходах этого хронического заболевания. Они включают анатомические нарушения (узость глотки и прилежащих тканей), функциональные несоответствия (низкий порог респираторной активации), мышечные дисфункции (снижение тонуса мышц дилаторов), нарушения ЦНС-регуляции (нестабильный вентиляционный контроль) [33]. В ранних стратегиях терапии пациентов с ОАС подчеркивалась жизнесберегающая необходимость респираторной поддержки в виде СРАР-терапии. В настоящее время все чаще ставится вопрос о правильном фенотипировании больного. Это обусловлено возрастающей потребностью рационализировать многообразие лечебных стратегий в отношении конкретного пациента исходя из его индивидуальных анатомических, метаболических, респираторных особенностей (персонализированная медицина). Фактически такая стратегия ведения пациента с ОАС полностью согласуется с принципами прецизионной (точной) медицины, постулирующей правило выбора подходящего и оптимального лечения на основании точных диагностических и лечебных алгоритмов [34].
ЗАКЛЮЧЕНИЕ
В настоящее время наиболее остро стоит вопрос о смене диагностической и лечебной парадигмы у пациентов с ОАС в сторону концепта прецизионной (точной) медицины. Такое изменение потребует большого акцента на ранее обнаружение заболевания, совершенствование мер профилактики, предупреждения болезненного состояния, назначения персонализированных и эффективных методик фармакологических и немедикаментозных вмешательств с предсказуемыми побочными эффектами, сокращения затрат на здравоохранение и уход за пациентом [34]. По нашему мнению, наиболее разумным и оправданным решением станет формирование многопрофильных бригад, состоящих из терапевтов, пульмонологов, кардиологов, функциональных диагностов, стоматологов-ортодонтов, черепно-челюстно-лицевых хирургов, задействованных в диагностике, лечении, профилактике и амбулаторном ведении пациентов с различной степенью тяжести ОАС.


