ВВЕДЕНИЕ
В течение 1,5 лет новая коронавирусная инфекция (COVID-19) продолжает распространяться во всем мире, приводя к новым массовым жертвам в различных странах. Низкая эффективность терапевтических стратегий против COVID-19 инициировала изучение особенностей инфекционного процесса в различных областях медицинской науки, в том числе и в ревматологии.
Несмотря на все большее и большее понимание механизмов патогенеза новой коронавирусной инфекции, до сих пор остаются нерешенными проблемы эффективного лечения ее раннего периода, предупреждения «цитокинового шторма», последующей профилактики постковидного синдрома, а также предотвращения развития аутоиммунных заболеваний (у генетически детерминированных групп пациентов).
Как известно, инфекционный процесс может быть обусловлен не только бактериальными, но и вирусными агентами. Так, по оценкам специалистов, инфекционные заболевания у человека способны вызывать около 600 различных вирусов [1]. Впервые они были открыты в 1892 г. русским ученым Д.И. Ивановским, но лишь к 30–40 гг. прошлого столетия была сформулирована концепция о вирусах как организмах.
Коронавирусы – это положительные крупные оболочечные РНК-содержащие вирусы, впервые описанные в 1966 г. Tyrell D.A. и Bynoe M.L. как возбудители острых респираторных инфекций [2].
Для понимания возможных мишеней терапии необходимы знания о реакции иммунной системы на тот или иной инфекционный агент и понимание особенностей этого процесса при конкретном возбудителе.
ИММУННЫЙ ОТВЕТ ПРИ ВИРУСНОЙ ИНФЕКЦИИ
Механизмы врожденного иммунитета не всегда могут сдержать развитие инфекции. В таких случаях запускается адаптивный иммунный ответ. В отличие от врожденного иммунитета, который реализуется клетками, сформировавшимися в процессе онтогенеза независимо от контакта с патогенными микроорганизмами, адаптивный иммунный ответ развивается только в ответ на контакт с конкретным антигеном. При этом в иммунный ответ вовлекаются только те клоны лимфоцитов, которые распознают проникшие в организм чужеродные антигены. Эта специфическая адресная реакция и называется иммунным ответом.
Таким образом, иммунный ответ – многоэтапный процесс с обязательным участием лимфоцитов и других клеток иммунной системы. В нем выделяют индуктивную и эффекторную (продуктивную) фазы. В индуктивную фазу происходит презентация антигена, т.е. передача информации об антигене от клеток врожденного иммунитета (антигенпрезентирующих клеток) к инициаторам адаптивного иммунитета – Т-хелперам. Затем выбирается путь дальнейшего развития иммунного ответа по клеточному или гуморальному пути – через индукцию дифференцировки разновидностей Т-хелперов (Th1, Th2, Th17 и др.) [3].
СУБПОПУЛЯЦИИ Т-ХЕЛПЕРОВ
С конца 80-х гг. XX в. было принято выделять 2 субпопуляции Т-хелперов (в зависимости от того, какой набор цитокинов они продуцируют) – Th1 и Th2. В последние годы спектр субпопуляций СD 4+ Т-клеток продолжает расширяться. Обнаружены такие субпопуляции, как Th17, Т-регуляторы, Tr1, Th3, Tfh и др. К основным субпопуляциям CD4+ Т-клеток относят:
- Th0 – CD4+ Т-лимфоциты на ранних стадиях развития иммунного ответа, которые продуцируют только интелейкин-2 (митоген для всех лимфоцитов);
- Т-лимфоциты Th1 – дифференцированная субпопуляция CD4+ Т-лимфоцитов, специализирующаяся на продукции интерферона гамма (ИФН- γ), фактора некроза опухоли-альфа (ФНО- α) и интерлейкина-2 (ИЛ-2). Эта субпопуляция регулирует многие реакции клеточного иммунитета, включая гиперчувствительность замедленного типа и активацию цитотоксических Т-лимфоцитов (ЦТЛ). Кроме того, Th1 стимулируют продукцию В-лимфоцитами опсонизирующих антител класса IgG, запускающих каскад активации комплемента;
- Th2 – дифференцированная субпопуляция CD4+ Т-лимфоцитов, специализирующаяся на выработке ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10 и ИЛ-13. Эта субпопуляция участвует в активации В-лимфоцитов и способствует секреции ими больших количеств антител разных классов;
- Th17 – субпопуляция CD4+ Т-лимфоцитов, специализирующаяся на образовании ИЛ-17. Эти клетки осуществляют противогрибковую и антимикробную защиту эпителиальных и слизистых барьеров, а также играют ключевую роль в патогенезе аутоиммунных заболеваний;
- Т-регуляторы – CD4+ Т-лимфоциты, подавляющие активность других клеток иммунной системы через секрецию иммуносупрессорных цитокинов – ИЛ-10 (ингибитора активности макрофагов и Th1-клеток) и трансформирующего фактора роста бета (ингибитора пролиферации лимфоцитов). Ингибиторный эффект может также достигаться при непосредственном межклеточном взаимодействии, поскольку на мембране некоторых Т-регуляторов экспрессированы индукторы апоптоза активированных и «отработавших» лимфоцитов – FasL (Fas-лиганд);
- Tfh (от англ. follicular helper – фолликулярный хелпер) – одна из важнейших популяций CD4+ Т-лимфоцитов. Эта популяция преимущественно расположена в лимфоидных фолликулах и осуществляет хелперную функцию для B-лимфоцитов посредством продукции ИЛ-21, вызывая их созревание и терминальную дифференцировку в плазматические клетки. Кроме ИЛ-21, Tfh могут также вырабатывать ИЛ-6 и ИЛ-10, необходимые для дифференцировки В-лимфоцитов. Нарушение функций этой популяции приводит к развитию аутоиммунных заболеваний и иммунодефицитов;
- Th9 – еще одна «новоявленная» популяция, выступающая продуцентом ИЛ-9. По-видимому, это Th2, переключившиеся на секрецию ИЛ-9, который способен вызывать пролиферацию Т-хелперных клеток в отсутствие антигенной стимуляции [3].
УСЛОВИЯ РАЗВИТИЯ ИММУННОГО ОТВЕТА ThI ТИПА
Зрелые дендритные клетки (ДК) осуществляют контроль за Т-клеточной дифференцировкой в зависимости от типа патогена, пути заражения, наличия сигналов от клеток врожденного иммунитета и тканевых факторов. В случае контакта с внутриклеточными бактериями и вирусами или паразитами миелоидные ДК, вступив в контакт с Т-лимфоцитами лимфатических узлов, начинают продуцировать ИЛ-12 и ФНО-α, стимулируя Т-лимфоциты к выработке ИФН-γ, ИЛ-12, которые также продуцируются макрофагами и нейтрофилами. На Т-лимфоците, Т-клеточные рецепторы (TCR) которого связал антиген с высокой авидностью, устойчиво экспрессируется рецептор для ИЛ-12, содержащий р2-субъединицу (экспрессия этой субъединицы специфична именно для Th1). Антигенпрезентирующие клетки (преимущественно плазмоцитоидные ДК) сразу после распознавания патогена (еще до попадания в лимфатический узел) начинают активно продуцировать ИФН I типа (ИФН-α и ИФН-β), которые, с одной стороны, аутокринно стимулируют созревание ДК, а с другой – индуцируют образование Т-лимфоцитами ИФН-γ и ИЛ-10. В то же время активированные миелоидные ДК продуцируют ИЛ-12, индуцирующий выработку одного только ИФН-γ. ИЛ-10 подавляет дифференцировку и активность Th1-лимфоцитов, возможно, не напрямую, а через угнетение активности макрофагов и возникающий при этом недостаток ИЛ-12. ИФН-γ и ИФН-α – кофакторы для дифференцировки Th1-лимфоцитов, индуцируемой ИЛ-12. Их источником, помимо Th1-клеток, служат активированные CD8+ Т-клетки, т.е. CD8+ Т-лимфоциты вносят свой вклад в дифференцировку CD4+ Т-клеток по пути Th1. В свою очередь, Th1-хелперы, стимулированные ДК, активируют цитотоксические CD8+ Т-лимфоциты и макрофаги, которые «расправляются» с клетками организма, зараженными внутриклеточными патогенами.
Таким образом, большая нагрузка антигеном и достаточные количества ИЛ-12 – необходимые и, возможно, достаточные условия для индукции дифференцировки Т-лимфоцитов в продуценты ИФН-γ, т.е. CD4+ Th1-лимфоциты [3].
Тh2-ОПОСРЕДОВАННЫЙ ИЛИ ГУМОРАЛЬНЫЙ ИММУННЫЙ ОТВЕТ
Иммунный ответ Тh2 типа, в отличие от Th1-ответа, контролируется другими цитокинами – в основном ИЛ-4. Продуцентами ИЛ-4 выступают CD4+ Тh2-клетки. Этот тип ответа направлен на стимуляцию B-лимфоцитов к образованию антител, нейтрализующих бактерии, токсины, паразитов и реализующих другие эффекты гуморального иммунитета. Тh2-лимфоциты поддерживают переключение синтеза изотипов иммуноглобулинов в B-лимфоцитах на IgE, IgG4 и IgA [3].
Давно известно, что лимфоцитарный иммунный ответ начинает проявлять себя не раньше, чем через 7–8 сут от момента проникновения патогена в организм. В этот период распространению и размножению патогенов (репликации при вирусной инфекции) противостоят механизмы доиммунной защиты [3].
МАКРОФАГИ КАК ОДИН ИЗ ВАЖНЫХ КОМПОНЕНТОВ ДОИММУННОЙ ЗАЩИТЫ
Моноциты являются «промежуточной формой» развития макрофагов, в крови их 5–10% от общего числа лейкоцитов. Макрофаги локализуются в определенных участках лимфоидной ткани – медуллярных тяжах лимфатических узлов, красной и белой пульпы селезенки. Клетки – производные моноцитов присутствуют практически во всех нелимфоидных органах: в клетках Купфера в печени, микроглии нервной системы, альвеолярных макрофагах, клетках Лангерганса кожи, остеокластах, макрофагах слизистых оболочек и серозных полостей, интерстициальной ткани сердца, поджелудочной железы, мезангиальных клетках почек. Макрофаги слизистых оболочек играют ведущую роль в противоинфекционной защите организма. Для реализации этой функции они имеют набор распознающих рецепторов, кислородозависимые и кислородонезависимые механизмы киллинга микроорганизмов. Большое значение в защите организма от инфекции имеют альвеолярные макрофаги и макрофаги слизистой оболочки кишечника. Первые «работают» в относительно бедной опсонинами среде, поэтому экспрессируют большое количество паттерн-распознающих рецепторов, включая скавенджер-рецепторы, маннозные рецепторы, β-глюканспецифические рецепторы, дектин-1 и др. При микробной инфекции в очаг проникновения микроорганизмов дополнительно мигрирует большое число воспалительных моноцитов, способных дифференцироваться в различные клеточные линии в зависимости от цитокинового окружения. Рецепторы макрофагов способствуют поддержанию гомеостаза, очищая организм от стареющих и апоптотических клеток, восстанавливая ткани после инфекции и травмы [3].
Макрофаги – первые и ключевые клетки противовирусной защиты, инициирующие формирование адаптивного иммунитета. Они активируют Th1-лимфоциты, тем самым стимулируя клеточный иммунный ответ. К важным функциям макрофагов относятся фагоцитоз, процессинг антигена и антигенпрезентация.
Фагоцитоз – особый процесс поглощения клеткой крупных макромолекулярных комплексов или корпускулярных структур. «Профессиональные» фагоциты у человека представлены двумя типами дифференцированных клеток – нейтрофилами и макрофагами. Макрофаги и нейтрофилы, активированные продуктами микроорганизмов, начинают продуцировать цитокины и другие биологически активные медиаторы, инициирующие воспалительные реакции в очаге проникновения чужеродных агентов, подготавливая возможность развития адаптивного иммунного ответа [3].
NK-КИЛЛЕРЫ
Еще один важный компонент противовирусной защиты – естественные киллеры (NK-клетки, натуральные киллеры). Они дифференцируются из общей лимфоидной клетки-предшественника и in vitro способны спонтанно, т.е. без предварительной иммунизации, убивать некоторые опухолевые, а также инфицированные вирусами клетки. NK-клетки являются большими гранулярными лимфоцитами, не экспрессирующими линейные маркеры Т- и В-клеток (CD 3, CD19). В циркулирующей крови нормальные киллеры составляют около 15% всех мононуклеарных клеток, а в тканях они локализованы в печени (большинство), красной пульпе селезенки, слизистых оболочках (особенно репродуктивных органов). Большинство NK-клеток содержит в цитоплазме азурофильные гранулы, где депонированы цитотоксические белки – перфорин, гранзимы и гранулизин. Главные функции NK-клеток включают распознавание и элиминацию клеток, инфицированных микроорганизмами, измененных в результате злокачественного роста, либо опсонизированных IgG-антителами, а также синтез цитокинов ИФН-γ, ФНО-α, гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), ИЛ-8 [3].
Таким образом, исходя из вышеперечисленного, мы можем сказать, что в борьбе с внутриклеточными патогенами (вирусами и некоторыми бактериями) основное место принадлежит врожденному иммунитету и клеточно-опосредованному иммунному ответу.
КЛЮЧЕВЫЕ ЦИТОКИНЫ И ИХ РОЛЬ В ВОСПАЛЕНИИ
Основными цитокинами, играющими существенную роль в направлении развития типа доиммунного и иммунного ответа, являются:
- цитокины доиммуного ответа: ИЛ-1, ИЛ-6, ИЛ-12, ФНО-α, основными продуцентами которых служат тканевые макрофаги;
- цитокины регуляторы иммунного воспаления:
- ИФН-γ, продуцируемый Th1-клетками, NK-клетками, CD8+ Т-лимфоцитами. Являясь ИФН II типа с противовирусным и противоопухолевым эффектом, он активирует макрофаги, стимулирует антигенпрезентирующие клетки (АПК), усиливая экспрессию главного комплекса гистосовместимости I и II классов (МНС-I и MHC- II), стимулирует переключение классов антител на IgG2a, подавляет активность Тh2-лимфоцитов, угнетает ангиогенез;
- ИЛ-12, продуцируемый В-лимфоцитами, макрофагами, дендритными клетками. Он вызывает дифференцировку Th1-клеток, ингибирует развитие Тh2-лимфоцитов, стимулирует секрецию ИФН-γ Th1-лимфоцитами и NK-клетками, усиливает цитотоксическую активность NK-клеток и ЦТЛ, участвует в аутоиммунном воспалении;
- ИЛ-10, вырабатываемый CD4+ Т-лимфоцитами и В-лимфоцитами, цитотоксическими Т-лимфоцитами, моноцитами/макрофагами. Стимулирует дифференцировку В-лимфоцитов и экспрессию ими МНС II, пролиферацию и дифференцировку цитотоксических Т-лимфоцитов, снижает экспрессию МНС-II и продукцию цитокинов макрофагами, моноцитами и дендритными клетками, ингибирует секрецию Th1-цитокинов.
Системное действие выявлено в основном для четырех цитокинов: ФНО-α, ИЛ-1, ИЛ-6 и колониестимулирующего фактора макрофагов (M-CSF) [3].
ОСОБЕННОСТИ ПАТОГЕНЕЗА НОВОЙ КОРОНАВИРУСНОЙ ИНФЕКЦИИ
Особенности патогенеза новой коронавирусной инфекции ассоциированы с асинхронным иммунным ответом. Недавние клинические исследования показали, что пациенты с тяжелым COVID-19 имели более низкие уровни CD4+ и CD8+ Т-клеток и более высокие уровни ИЛ-6 и ИЛ-10 в плазме крови по сравнению с пациентами с легким течением заболевания [4, 5].
Так, Zhao Y. et al. проанализировали в общей сложности 71 пациента с лабораторно подтвержденным COVID-19, поступившими в Пекинскую больницу в Китае с легким (53 пациента) или тяжелым (18 пациентов) заболеванием. В своем исследовании авторы выявили, что ингибирующие цитокины ИЛ-1RA и ИЛ-10 значительно повышены при тяжелом течении на ранней стадии инфекции. В свою очередь, повышенные уровни ИЛ-6, ИЛ-17, ИЛ-12, ИЛ-1β, ИФН-γ и ИЛ-27 наблюдались только на поздних стадиях заболевания в тяжелых случаях (рис. 1).
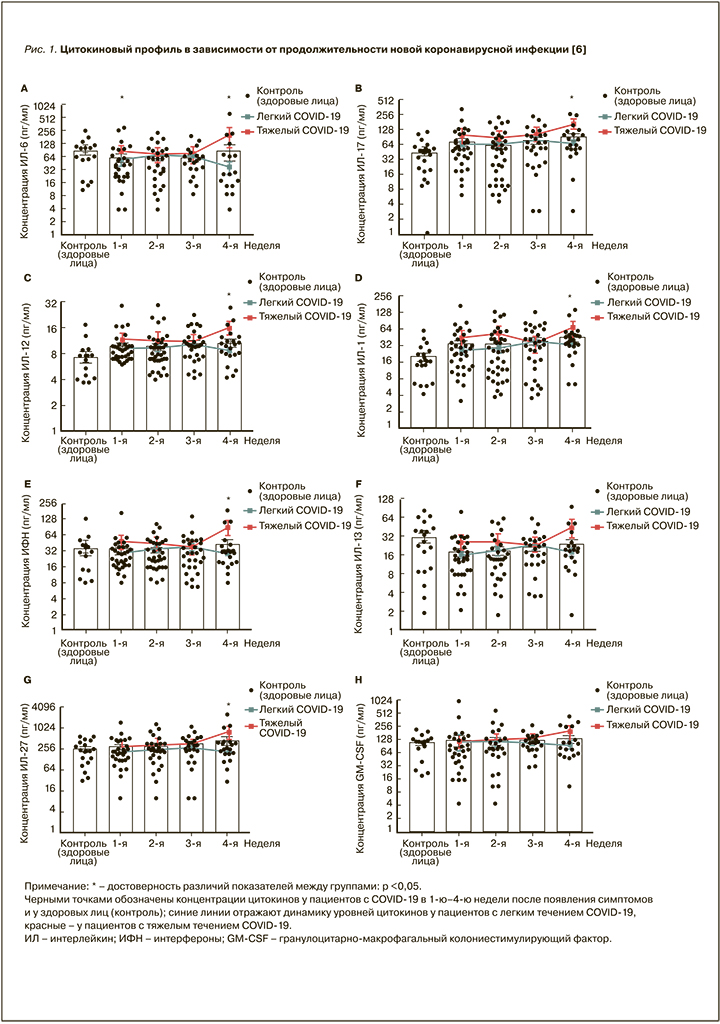
Также в данном исследовании авторы показали, что тяжелое течение новой коронавирусной инфекции было выше среди пожилых пациентов (средний возраст 66 лет), имеющих хронические заболевания, такие как артериальная гипертензия, сердечно-сосудистые заболевания, сахарный диабет, болезни легких, почек и ожирение [6]. В связи с этим о них следует сказать отдельно.
Изменения, происходящие в организме в результате ожирения, носят сложный характер. Повышенное накопление липидов приводит к гипертрофии адипоцитов, гипоксии и повышенной гибели клеток. Эта дисфункция жировой ткани способствует формированию микроокружения, в котором адипоциты начинают секретировать провоспалительные цитокины, включая ФНО-α, ИЛ-6, ИЛ-8 и моноцитарный хемотаксический фактор-1 (MCP-1). MCP-1 и другие хемокины, продуцируемые адипоцитами и иммунными клетками, способствуют повышенному проникновению циркулирующих моноцитов и других врожденных и адаптивных иммунных клеток в жировую ткань [7–9].
В основе ишемической болезни сердца, гипертонической болезни и сердечной недостаточности лежит системный атеросклероз, который тесно связан с хроническим воспалительным процессом с участием основных цитокинов – ИЛ-6, ИЛ-1β и ФНО. Как хроническое воспалительное заболевание атеросклероз ассоциирован с высоким уровнем проатерогенного воспалительного цитокина – ИЛ-1β. При этом недостаток IL-1β замедлял развитие атеросклероза [10, 11].
Проатерогенный воспалительный цитокин ИЛ-6 является биомаркером воспаления кровеносных сосудов и значимым фактором риска развития сердечно-сосудистых заболеваний. ИЛ-6 играл ключевую роль в развитии воспалительной реакции и атеросклероза [12].
ИЛ-1β и ИЛ-6 стимулируют в паравентрикулярном ядре гипоталамуса секрецию кортикотропин-рилизинг фактора, который, в свою очередь, повышает продукцию гипофизом адренокортикотропного гормона (АКТГ). АКТГ инициирует выброс из клеток коры надпочечников в кровь глюкокортикоидных гормонов, что в конечном итоге приводит к ингибированию экспрессии в клетках генов ИЛ. Также кортикостероиды способны вызывать изменение баланса между Th1- и Th2-субпопуляциями в сторону преобладания Th2-клеток, и это способствует более выраженному гуморальному ответу [13].
Исследование Zhao Y. et al. показывает, что вирус SARS-CoV-2 способен инвертировать иммунный ответ с Th1 на Th2 путь у предрасположенных групп пациентов (пожилых людей, пациентов с сопутствующими заболеваниями) через увеличение продукции ИЛ-10, что позволяет ему беспрепятственно реплицироваться в месте внедрения.
Другим немаловажным фактом тяжелого течения COVID-19 является лимфопения [14]. Tan L. et al. случайным образом отобрали пять случаев смерти и отслеживали динамические изменения в анализах крови каждого пациента от начала заболевания до летального исхода. Среди всех показателей процент лимфоцитов крови показал наиболее значимую и последовательную тенденцию; это позволяет предположить, что этот показатель может отражать прогрессирование заболевания. Для дальнейшего подтверждения связи между уровнем лимфоцитов крови и состоянием пациента авторы увеличили объем выборки до 12 случаев смерти (средний возраст пациентов 76 лет, среднее время лечения 20 дней). В большинстве случаев лимфоциты были снижены до менее чем 5% в течение 2 нед после начала заболевания. Также произвольно были оценены 7 случаев с тяжелыми симптомами и исходами лечения (средний возраст пациентов 35 лет, среднее время лечения 35 дней) и 11 случаев с умеренными симптомами и исходами лечения (средний возраст пациентов 49 лет, среднее время лечения 26 дней). Уровень лимфоцитов у тяжелых больных исходно снижался, а затем увеличивался до более чем 10% до момента выписки. Напротив, уровень лимфоцитов у пациентов со среднетяжелым течением колебался очень мало после начала заболевания и был выше 20% при выписке (рис. 2) [15].

Таким образом, развившаяся лимфоцитопения в условиях отсутствия клеточно-опосредованного иммунного ответа способствует распространению вируса по органам и системам. В дальнейшем при репликации вируса во многих тканях и органах приводит к активации тканевых макрофагов с продукцией большого количества провоспалительных цитокинов (ИЛ-6, ИЛ-12, ИЛ-1β), активации NK-клеток и клеточно-опосредованного иммунного ответа с развитием синдрома гиперпродукции цитокинов. Так, активация клеточно-опосредованного иммунного ответа на поздних стадиях влечет за собой альтерацию большого количества тканей и органов и чрезмерному развитию выраженных системных эффектов таких цитокинов, как ИЛ-6, ИЛ-1β и ФНО-α.
ОБСУЖДЕНИЕ
Асинхронный иммунный ответ при новой коронавирусной инфекции, связанный с активацией Th2 в начале заболевания через продукцию ИЛ-10, приводит к развитию гуморального иммунного ответа, что недостаточно для элиминации вируса и способствует его внутриклеточной репликации. В то же время подавление доиммунного воспаления и клеточно-опосредованного иммунного ответа в начале заболевания, его активация на более поздних стадиях и развивающаяся лимфоцитопения вызывают неконтролируемое распространение вируса по организму и индукцию гипервоспалительной реакции. Подавление данной реакции, в том числе и с помощь ингибиторов ИЛ-6, глюкокортикостероидов, вероятнее всего, способствует лишь длительной персистенции вируса и хронизации инфекционного процесса в дальнейшем. Кроме того, длительная персистенция вируса, по-видимому, создает условия для развития постковидного синдрома и к индукции аутоиммунитета у генетически детерминированных групп пациентов, что ведет к развитию аутоиммунных заболеваний.
Исходя из этого мы предлагаем активировать доиммунные и клеточно-опосредованные иммунные реакции в начале заболевания. Один из возможных вариантов активации этих процессов – использование препаратов рекомбинантного ИФН-γ в первые сутки от начала заболевания в течение 5 дней.
В отличие от ИФН I типа, ИФН-γ вызывает изменение баланса между Th1- и Th2-субпопуляциями в сторону преобладания Th1-клеток, способствует усилению фагоцитарной активности макрофагов, активности NK-клеток, цитотоксичности Т-клеток. Он повышает активность окислительных ферментов в фаголизосомах макрофагов, тем самым способствуя расщеплению крупных белковых молекул антигена до пептидов размером 12–25 аминокислотных остатков, что усиливает синтез и экспрессию молекул HLA II класса на АПК. Наряду с этим ИФН-γ блокирует синтез трансформирующего фактора роста бета, ответственного за развитие фиброза легких. К сожалению, количество научных работ по применению ИФН-γ при новой коронавирусной инфекции ограничивается небольшим количеством исследований и небольшим объемом выборки.
Так, в работе А.Л. Мясникова с соавт. показан положительный эффект при применении ИФН-γ у пациентов со среднетяжелым течением COVID-19 в начале заболевания.
В данное рандомизированное исследование были включены пациенты старше 18 лет обоих полов с новой коронавирусной инфекцией среднетяжелого течения. Все участники были рандомизированы в 2 группы: основную, в которой назначался рекомбинантный ИФН‑γ на фоне базовой антибактериальной и симптоматической терапии, и контрольную с использованием только базового (антибактериального, симптоматического) лечения. По основным показателям обе группы были сопоставимы между собой (p >0,05); между ними отсутствовали различия по статусу курения, особенностям эпидемиологического анамнеза, сопутствующим заболеваниям и остальным клинически значимым параметрам. В ходе проведенного исследования была выявлена более благоприятная динамика стабилизации жизненно важных показателей в сочетании с сокращением длительности лихорадки и продолжительности госпитализации на 2-е сутки при применении ИФН-γ в дополнение к комплексной терапии. Особого внимания заслуживает тот факт, что получавшие рекомбинантный ИФН-γ не имели прогрессирования дыхательной недостаточности и не требовали перевода в отделение интенсивной терапии (ОРИТ). В то же время в группе контроля 3 человека из 18 в последующем были переведены в отделение интенсивной терапии [16].
Полученные данные демонстрируют важность активации клеточно-опосредованных иммунных механизмов в начале заболевания.
Таким образом, применение препаратов ИФН-γ может приводить к устранению асинхронности иммунного ответа, стимуляции доиммунных и клеточно-опосредованных механизмов противовирусной защиты организма в начале заболевания. Это может способствовать развитию полноценного клеточно-опосредованного иммунного ответа в месте внедрения вируса, предотвращению развития гиперпродукции цитокинов, предотвращению длительной персистенции вируса и хронизации инфекционного процесса. В последующем такой подход, вероятно, позволит снизить частоту развития постковидных синдромов и предотвратить индукцию аутоиммунитета с формированием конкретных аутоиммунных заболеваний.
ЗАКЛЮЧЕНИЕ
Использование препаратов рекомбинантного ИФН-γ короткими курсами в начале заболевания при новой коронавирусной инфекции является патогенетически обоснованным методом лечения с хорошим потенциалом в борьбе с вирусной инфекцией в начальном периоде заболевания. Вместе с тем влияние определенных цитокинов на эффекторные функции клеток еще недостаточно изучены, в том числе и в экспериментальных исследованиях, что требует более осторожного использования различных препаратов из группы цитокинов и антител к этим цитокинам. Нами предлагается использование рекомбинантного ИФН-γ у следующих групп пациентов: пожилые (возраст 60+), больные с артериальной гипертензией, атеросклерозом, сахарным диабетом и заболеваниями аутоиммунной природы.


