ВВЕДЕНИЕ
Пандемия новой коронавирусной инфекции (COVID-19), вызываемая коронавирусом тяжелого острого респираторного синдрома 2 (SARS-CoV-2), поразила уже более 274 млн больных по всему миру и привела, только по официальным данным, к гибели более 5,3 млн человек [1]. Одними из основных причин смерти пациентов с COVID-19 являются тромбозы и тромбоэмболии, что подтверждается данными аутопсий [2]. При COVID-19 наблюдается ряд гемостатических и воспалительных изменений, вызывающих увеличение риска тромбообразования. Повышение уровня D-димера в крови, обусловленное тромбозом микрососудов, может наблюдаться в том числе при легком и среднетяжелом течении заболевания. Имеются сообщения о развитии тромботической микроангиопатии у детей даже при относительно бессимптомном течении COVID-19 [3]. Прогрессирование тромбоза микрососудов легких приводит к несоответствию вентиляции и перфузии и развитию гипоксии, а поражение сосудистого русла сердца и почек вызывает их ишемическое реперфузионное повреждение, дисфункцию и органную недостаточность [4].
Тромбоциты выступают ключевыми эффекторными клетками в патогенезе тромбо-воспалительного процесса, о чем свидетельствует повышение их количества, агрегационной и адгезивной активности, а также увеличение экспрессии Р-селектина на поверхности тромбоцитов и их циркулирующих агрегатах с моноцитами, нейтрофилами и Т-лимфоцитамиц [5]. Активация тромбоцитов при COVID-19 индуцируется повреждением эндотелия. Важную роль в этом процессе играет тромбоксан (Tx) А2, который модулирует функции тромбоцитов и эндотелиальных клеток паракринным путем через простаноидный рецептор тромбоксана. ТхА2 также увеличивает экспрессию Р-селектина в тромбоцитах, стимулируя адгезию и миграцию тромбоцитов и лейкоцитов к участкам повреждения и воспаления [6]. У пациентов с COVID-19 наблюдается существенное повышение концентрации ТхА2 в плазме крови и содержимом бронхоальвеолярного лаважа [5].
Таким образом, существуют предпосылки к тому, что профилактика тромбообразования с помощью препаратов, обладающих антитромбоцитарным действием, может позволить предотвратить прогрессирование заболевания у амбулаторных пациентов с легкой или средней степенью тяжести COVID-19, а также улучшить прогноз у госпитализированных больных с тяжелым течением заболевания.
ВОЗМОЖНЫЕ МЕХАНИЗМЫ ДЕЙСТВИЯ АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ У ПАЦИЕНТОВ С COVID-19
Ацетилсалициловая кислота (АСК) является антитромбоцитарным препаратом, подавляющим агрегацию тромбоцитов путем необратимой инактивации фермента циклооксигеназы 1 (ЦОГ-1). Ацетильная группа АСК присоединяется к активному локусу ЦОГ-1, ингибируя синтез простагландина H2, служащего субстратом тромбоксан-А-синтазы, которая катализирует образование TхA2. Доказано, что это антиагрегантное лекарственное средство ингибирует гликопротеин Р-селектин, способствующий адгезии лейкоцитов и тромбоцитов и прикреплению лейкоцитов к эндотелию сосудов. Другой антитромботический механизм действия АСК – усиление продукции оксида азота (NO) эндотелиальными клетками путем ингибирования синтеза простациклина, что приводит к инактивации тромбоцитов. Кроме того, АСК предотвращает образование фермента сериновой протеазы тромбина, который катализирует превращение фибриногена в фибрин. АСК также ингибирует тканевой фактор – комплекс фактора VIIa, участвующего в образовании тромбина и, следовательно, опосредованные им пути свертывания крови [3]. Возможный механизм предупреждающего влияния АСК на развитие тромбозов у больных COVID-19 представлен на рисунке.

В дополнение к антитромботической активности АСК хорошо известна своими жаропонижающим, обезболивающим и противовирусным эффектами. Она подавляет репликацию ряда вирусов, таких как вирус гриппа, гепатита С и флавивирус. К описанным механизмам противовирусного действия АСК относят активацию митоген-активируемой протеинкиназы р38 и ингибирование провоспалительного ядерного фактора транскрипции каппа-би (NF-κB), участвующего в экспрессии вирусных генов [7].
В настоящее время АСК рекомендована для вторичной профилактики инсульта, острого коронарного синдрома и заболеваний периферических артерий. Многоцентровое двойное слепое плацебо-контролируемое исследование WARFASA (варфарин и АСК для профилактики рецидивирующей венозной тромбоэмболии), в которое вошли 403 пациента, показало более низкую частоту венозных тромбоэмболий (ВТЭ) у пациентов, получавших АСК, по сравнению с пациентами, не принимавшими ее (6,6 против 11,2%) [8]. В клиническом исследовании с участием 1224 пациентов, проведенном Международным сообществом по изучению АСК при рецидивирующей ВТЭ (INSPIRE), было выявлено, что прием АСК позволяет снизить риск рецидива тромбоза глубоких вен на 34% без значительного увеличения риска кровотечений [9].
Данные китайских авторов показали, что при тяжелом течении COVID-19 часто развивается острый респираторный дистресс-синдром (ОРДС), признаки которого наблюдали у 74% умерших больных [10]. Имеются данные о том, что назначение АСК снижает смертность пациентов с ОРДС без COVID-19 [11]. ОРДС вызывает неконтролируемое нарушение свертываемости крови у тяжелобольных пациентов, поэтому эффективность АСК в таких случаях может объясняться антитромботическими свойствами препарата.
Целесообразность включения АСК в схемы лечения пациентов с COVID-19 с ранних сроков заболевания обсуждается многими отечественными и зарубежными авторами [12–19]. Для выявления пациентов с SARS-CoV-2, которым следует применять профилактические дозы АСК в сочетании или без антикоагулянтов, предложен подход со стратификацией пациентов по риску осложнений и «критериям безвредности» приема АСК на основе пороговых значений тропонина и D-димера [20]. Другие авторы рекомендуют прием АСК в низких дозах для первичной профилактики артериальной тромбоэмболии у пациентов с COVID-19 в возрасте 40–70 лет, которые подвержены высокому риску сердечно-сосудистых заболеваний (ССЗ), связанных с атеросклерозом, или пациентам промежуточного кардиоваскулярного риска, имеющим низкую вероятность кровотечения [21].
Целью данной работы стал обзор опубликованных оригинальных исследований по приему АСК у амбулаторных и госпитализированных пациентов с COVID-19.
МЕТОДОЛОГИЯ ПОИСКА
Был проведен поиск в базах данных РИНЦ и PubMed по ключевым словам «аспирин», «ацетилсалициловая кислота», COVID-19 и SARS-CoV-2 за период с марта 2020 г. по ноябрь 2021 г. После отсеивания обзоров и дублирующихся публикаций для последующего анализа были отобраны 28 работ, 18 из которых являлись ретроспективными наблюдениями (в 9 из них использовали метод псевдорандомизации), 2 – проспективными наблюдениями, 2 – рандомизированными исследованиями, 4 – метаанализами и 2 – небольшими сериями наблюдений.
ИССЛЕДОВАНИЯ ПО ОЦЕНКЕ ВЛИЯНИЯ ПРИЕМА АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ НА РИСК РАЗВИТИЯ COVID-19
Риск развития COVID-19 в зависимости от предшествующего приема АСК был изучен в трех ретроспективных исследованиях.
По данным израильского популяционного поперечного исследования, прием АСК с целью первичной профилактики ССЗ у пациентов старше 40 лет был ассоциирован с меньшей вероятностью заражения COVID-19, по сравнению с лицами, не принимавшими это лекарственное средство (отношение шансов (ОШ) 0,71; 95% доверительный интервал (ДИ): 0,52–0,99; р=0,041). Более того, продолжительность заболевания, оцениваемая как время между первым положительным и вторым отрицательным ПЦР-тестом на COVID-19, в группе АСК была значительно короче по сравнению с теми, кто не принимал ее (19,8±7,8 против 21,9±7,9 суток; р=0,045) [22].
Противоположный результат получен в двух южнокорейских исследованиях. Анализ Корейской национальной базы данных, включавший сведения о 662 пациентах, использовавших АСК в течение 2 нед до постановки диагноза COVID-19 (n=136), и аналогичного числа больных, не принимавших АСК, показал, что частота заболеваемости COVID- 19 (подтвержденной положительным результатом ПЦР-теста) существенно не отличалась в зависимости от исходного статуса приема АСК; при этом ее применение было ассоциировано с тяжелым течением заболевания [23]. В другом популяционном исследовании модели «случай–контроль» прием АСК в течение как минимум 14 предшествующих дней не был связан с частотой развития инфекции SARS-CoV-2 или ее осложнений [24].
ИССЛЕДОВАНИЯ ПО ПРИМЕНЕНИЮ АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ НА АМБУЛАТОРНОМ ЭТАПЕ ЛЕЧЕНИЯ COVID-19
Изучению влияния приема АСК в амбулаторных условиях на течение COVID-19 (в том числе у пациентов, которые были в последующем госпитализированы) посвящены 8 ретроспективных и 1 проспективное рандомизированное исследование.
Анализ данных Национальной электронной базы медицинских записей Управления здравоохранения ветеранов (США) показал, что у пациентов, инфицированных COVID-19, предшествующий прием АСК был связан со значимым снижением общей смертности более чем в 2 раза в течение как 14 дней (ОШ 0,38; 95% ДИ: 0,32–0,46), так и 30 дней (отношение рисков (ОР) 0,38; 95% ДИ: 0,33–0,45) [25].
Наблюдательное когортное исследование взрослых пациентов, госпитализированных с COVID-19 в США (n=412), продемонстрировало, что применение АСК в дозе 81 мг/сут в течение 7 дней до или в первые сутки после госпитализации независимо ассоциируется со снижением риска искусственной вентиляции легких (ОШ 0,56; 95% ДИ: 0,37–0,85; р=0,007), госпитализаций в отделение интенсивной терапии (ОШ 0,57; 95% ДИ: 0,38–0,85; р=0,005) и смерти в стационаре (ОШ 0,53; 95% ДИ: 0,31–0,90; р=0,02). Различий в частоте крупных кровотечений (р=0,69) и тромбозов (р=0,82) между группами, принимающими и не принимающими АСК, выявлено не было [26].
Связь предшествующей антитромбоцитарной терапии с выживаемостью у пациентов, госпитализированных с COVID-19, была изучена в наблюдательном когортном исследовании, включившем 34 675 пациентов старше 50 лет. В группе антитромбоцитарной терапии (n=6781) АСК принимали 83,9%. Внутрибольничная смертность была значительно ниже у пациентов, получавших догоспитальную антитромбоцитарную терапию (18,9 против 21,5%; р <0,001), что привело к абсолютному снижению смертности на 2,6% (ОШ 0,81; 95% ДИ: 0,76–0,87; р <0,005). В группе антитромбоцитарной терапии наблюдалась значительно меньшая частота тромбоэмболии легочной артерии (2,2 против 3,0%; р=0,002) и более высокая частота носовых кровотечений (0,9 против 0,4%; р <0,001). В частоте других геморрагических или тромботических осложнений различий отмечено не было [27].
Иранское когортное исследование установило наличие достоверной независимой связи между приемом АСК и снижением риска госпитальной смертности у пациентов с подтвержденным диагнозом тяжелого COVID-19 (ОШ 0,746; 95% ДИ: 0,560–0,994; р=0,046). В 202 случаях (60%) пациенты получали АСК до госпитализации, остальным препарат был назначен в первый день госпитализации [28].
В итальянском когортном исследовании ASA-CARE участвовали 984 пациента с COVID-19, стратифицированные в соответствии с приемом АСК в дозе 75–100 мг/сут, как минимум в течение 7 дней до госпитализации. При многофакторном анализе прием АСК был независимо связан с более низкой вероятностью достижения первичной конечной точки, включавшей смерть в стационаре и/или необходимость эскалации респираторной поддержки (ОШ 0,697; 95% ДИ: 0,525–0,924; p=0,012) [29].
К сожалению, не все исследования принесли позитивные результаты. По данным американских авторов, при скорректированном многофакторном анализе между пациентами, принимавшими и не принимавшими антитромбоцитарные препараты на догоспитальном этапе (в 229 из 239 случаев – АСК), значимых различий в максимальном балле по 6-балльной модифицированной порядковой шкале (MOS) обнаружено не было, несмотря на то что пациенты, получавшие антиагреганты, были достоверно старше и имели больше сопутствующих заболеваний [30].
В итальянском многоцентровом наблюдательном исследовании как нескорректированный, так и скорректированный регрессионный анализ не выявил различий в частоте развития ОРДС или смерти во время госпитализации между группами пациентов, получавшими или не получавшими на момент поступления антитромбоцитарную или антикоагулянтную терапию [31].
Отдельный интерес представляет исследование китайских авторов, показавшее, что применение до госпитализации низких доз (75–150 мг/сут) АСК у пациентов с COVID-19, страдавших ишемической болезнью сердца, не связано с частотой летальности в период последующего стационарного лечения (21,2 против 22,1%; p=0,885) [32].
Рандомизированное двойное слепое плацебо-контролируемое исследование для сравнения антикоагулянтной и антитромбоцитарной терапии у клинически стабильных симптомных амбулаторных пациентов с COVID- 19 (ACTIV-4B), проводившееся в 52 центрах в США, было преждевременно остановлено после включения всего 9% пациентов из-за более низкой, чем ожидалось, частоты возникновения конечных точек. У 657 рандомизированных пациентов прием АСК в дозе 81 мг/сут (как и апиксабана) не снижал по сравнению с плацебо частоту комбинированной конечной точки, включавшей смертность от всех причин, венозную или артериальную тромбоэмболию, инфаркт миокарда (ИМ), инсульт или госпитализацию по сердечно-сосудистой или легочной причине [33].
ИССЛЕДОВАНИЯ ПО ПРИМЕНЕНИЮ АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ У ГОСПИТАЛИЗИРОВАННЫХ ПАЦИЕНТОВ С COVID-19
Эффективность применения АСК у госпитализированных пациентов с COVID-19 изучена в 6 работах.
В ретроспективном исследовании китайских авторов установлено, что 30 и 60-дневная смертность в группе пациентов, принимавших АСК в дозе 100 мг/сут в течение госпитализации, была значительно ниже, чем в группе, не принимавшей препарат (р=0,021 и р=0,030 соответственно). Продолжительность инфекции между группами существенно не различалась (р=0,942) [34].
В другом наблюдательном исследовании (США), охватившем 1956 пациентов с COVID- 19, прием АСК во время госпитализации также был связан с более низкой совокупной частотой смерти в стационаре по сравнению с отсутствием терапии антиагрегантами (ОШ 0,52; 95% ДИ: 0,34–0,81) [35].
Ретроспективное когортное исследование с участием пациентов с COVID-19, госпитализированных в отделения интенсивной терапии шести больниц Нью Хейвена (США), показало, что среди 23 проанализированных препаратов прием АСК был связан с более низкой внутрибольничной летальностью (ОШ 0,72; 95% ДИ: 0,60–0,87; р <0,001) наряду с апиксабаном и эноксапарином. Применение метода псевдорандомизации подтвердило более низкую смертность у пациентов, получавших АСК, по сравнению с соответствующей контрольной группой (25,6 против 29,6%). В исследовании был выявлен дозозависимый эффект АСК: низкие дозы препарата (100 мг/сут) были ассоциированы с более низкой смертностью (24,6 против 30,6%; ОШ 0,53; 95% ДИ: 0,375–0,74; р <0,001), в то время как при приеме более высоких доз (300–325 мг/сут) такая связь отсутствовала (33,3 против 21,6%; ОШ 1,14; 95% ДИ: 0,41–3,15; р=0,796) [36].
В многоцентровой международный проспективный регистр Health Outcome Predictive Evaluation (HOPE-COVID-19) были включены 7824 пациента, 730 (9%) из которых с первых суток госпитализации получали антитромбоцитарные препараты, в том числе 695 (95,2%) – АСК. Пациенты, принимавшие антиагреганты, были старше (74±12 против 63±17 лет; р <0,01), чаще мужского пола (68% против 57%; р <0,01) и чаще страдали сахарным диабетом (39 против 16%; р <0,01). Тем не менее значимых различий между группами пациентов, принимавшими и не принимавшими антиагреганты, по показателям госпитальной летальности (18% против 19%; р=0,64), потребности в инвазивной вентиляции легких (8,7 против 8,5%; р=0,88), эмболических осложнений (2,9 против 2,5%; р=0,34) и кровотечений (2,1 против 2,4%; р=0,43) отмечено не было. В то же время пациенты, получавшие антиагреганты, имели меньшую продолжительность искусственной вентиляции легких (8±5 против 11±7 дней; р=0,01) в случае потребности в ней. Прием антиагрегантов у пациентов, не получавших антикоагулянтную терапию, был связан с более низким показателем смертности (ОР 0,79; 95% ДИ: 0,70–0,94). При многофакторном анализе прием антиагрегантов в стационаре также был ассоциирован с более низким риском смертности (ОР 0,39: 95% ДИ: 0,32–0,48; р <0,01) [37].
Результаты наблюдения в США за 1994 пациентами с подтвержденным COVID-19, как амбулаторными, так и госпитализированными, показали, что АСК в дозе 81 мг/сут, назначенная до или в ранние сроки заболевания, не влияла на летальность (13,3 против 15,3% у пациентов, не принимавших АСК; p=0,53), однако повышала риск комбинированной тромботической конечной точки, включавшей ИМ, инсульт/транзиторную ишемическую атаку или ВТЭ (9,3 против 2,8%; p=0,005). Аналогичный эффект наблюдался и при приеме других нестероидных противовоспалительных препаратов [38].
В рандомизированном, контролируемом, открытом исследовании RECOVERY, выполнявшемся в Великобритании, Индонезии и Непале, изучалась эффективность и безопасность АСК (в суточной дозе 150 мг) у пациентов, госпитализированных с COVID-19, по сравнению со стандартной терапией. Прием АСК не приводил к снижению 28-дневной смертности или риска прогрессирования инвазивной искусственной вентиляции легких (ИВЛ) или смерти, однако был ассоциирован с небольшим увеличением частоты выписки живыми в течение 28 дней (75 против 74%; ОР 1,06; 95% ДИ: 1,02–1,10; p=0,0062), снижением продолжительности госпитализации (медиана 8 [5–>28] против 9 дней [5–>28]) и частоты тромботических событий (4,6 против 5,3%; абсолютное снижение риска 0,6%). Время начала приема и дозировка АСК, исходный сердечно-сосудистый риск и тяжесть заболевания пациентов, возможно, способствовали нейтральному влиянию АСК на выживаемость госпитализированных пациентов с COVID-19 [39].
МЕТААНАЛИЗЫ ИССЛЕДОВАНИЙ ПО ПРИМЕНЕНИЮ АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ У ПАЦИЕНТОВ С COVID-19
Четырьмя коллективами авторов были проведены метаанализы исследований, объединившие данные по назначению АСК пациентам с COVID- 19 как в амбулаторных условиях, так и в период госпитализации. Следует отметить, что метаанализы выполнены на материале одних и тех же исследований в различных комбинациях, что частично объясняет схожесть полученных результатов.
Данные самого раннего из проведенных метаанализов, включившего результаты только 3 ретроспективных исследований (n=1054, из которых АСК принимали 19,2% больных), свидетельствовали об отсутствии связи между применением АСК и летальностью у госпитализированных пациентов с COVID-19 [40].
Более поздние метаанализы, объединившее данные большего количества исследований, принесли более обнадеживающие результаты. Так, метаанализ 6 исследований, охвативших 13 993 пациента, показал, что применение низких доз АСК (75–325 мг/сут) независимо ассоциировалось со снижением летальности (ОШ 0,46; 95% ДИ: 0,35–0,61; p <0,001). В подгруппе пациентов, принимавших АСК в низких дозах только во время госпитализации, также наблюдалось значительное снижение летальности (ОШ 0,39; 95% ДИ: 0,16–0,96; p <0,001) [41].
В систематический обзор и метаанализ, проведенный Wijaya I. et al., вошли 7 исследований, в которых приняли участие 34 415 пациентов. Применение АСК было связано со снижением риска смерти (ОШ 0,56; 95% ДИ: 0,38–0,81; р=0,002). Связь между использованием АСК и частотой тромбозов была противоречивой [42].
Наиболее полный метаанализ (Srivastava R. et al.) объединил данные 10 обсервационных исследований с участием 56 696 пациентов с COVID-19. Было установлено, что пациенты, принимавшие АСК (n=13705), имели меньшую вероятность смерти по сравнению с группой без АСК (ОШ 0,70; 95% ДИ: 0,63–0,77). Однако после исключения из анализа исследований с максимальной и минимальной выборками больных летальность в группах оказалась практически одинаковой [43].
ИССЛЕДОВАНИЯ ПО ИЗУЧЕНИЮ ПРИМЕНЕНИЯ АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ В КОМБИНАЦИИ С ДРУГИМИ ПРЕПАРАТАМИ У ПАЦИЕНТОВ С COVID-19
Ряд исследований был посвящен изучению эффективности и безопасности терапии АСК в сочетании с другими препаратами, в том числе применяющимися при лечении COVID-19.
В исследовании Pavoni V. et al. была изучена эффективность комбинированной терапии АСК в комбинации с низкомолекулярным гепарином в различных дозировках в зависимости от уровня D-димера [44].
Влияние комбинированной антитромбоцитарной терапии (АСК + клопидогрел и тирофибан) на артериальную оксигенацию и клинические результаты у пациентов с тяжелым течением COVID-19 и гиперкоагуляцией было изучено итальянскими авторами в небольшой серии наблюдений (n=5). Антитромбоцитарная терапия оказалась эффективной в улучшении соотношения вентиляции и перфузии у пациентов с COVID-19 и тяжелой дыхательной недостаточностью [45].
Бразильскими авторами была предложена гипотеза потенцирования эффекта АСК при назначении ее в сочетании со статинами. Ими была представлена серия из 14 наблюдений госпитализированных пациентов с лабораторно подтвержденным диагнозом COVID-19. Все пациенты получали терапию АСК в нагрузочной дозе 200–300 мг с последующим ее приемом 100 мг/сут в течение 15–21 дней; в случае наличия факторов риска ССЗ также назначался аторвастатин в дозе 10–20 мг/ сут. Ни один из случаев не прогрессировал до тяжелой степени тяжести, у всех пациентов наблюдалась ремиссия симптомов со 100% выживаемостью при отсутствии геморрагических осложнений или других побочных эффектов лечения [46].
В американо-немецком сетевом анализе было выявлено, что комбинация АСК и блокатора H₂-гистаминовых рецепторов фамотидина (n=344) продемонстрировала значительное преимущество в выживаемости (ОШ 0,55; 95% ДИ: 0,39–0,78) у пациентов с тяжелым течением новой коронавирусной инфекции, находящихся на оксигенотерапии [47].
Во французском проспективном когортном обсервационном исследовании COCAA-COLA показана эффективность и безопасность раннего 5-дневного курса лечения, сочетающего пероральный прием преднизолона, колхицина, АСК, прямого ингибитора Ха фактора (апиксабана или ривароксабана) и фуросемида, в снижении риска высокопоточной оксигенотерапии, необходимости ИВЛ и/или 28-дневной смертности у госпитализированных пациентов с COVID-19, не находящихся в критическом состоянии (ОР 0,097; 95% ДИ: 0,001–0,48; p=0,0009) [48].
Исследование египетских авторов показало, что монотерапия АСК в низких дозах (81–162 мг/сут) снижает частоту артериальных тромбозов и тромбоэмболий, связанных с COVID- 19, но уступает в эффективности назначению эноксапарина или комбинации АСК с эноксапарином. Одновременное назначение АСК и эноксапарина продемонстрировало многообещающие результаты в плане снижения риска тромботических событий и потребности в ИВЛ [49].
Следует подчеркнуть, что как отечественные, так и международные рекомендации подтверждают отсутствие межлекарственных взаимодействий АСК с препаратами, применяемыми для этиотропного и патогенетического лечения COVID-19, и подчеркивают необходимость продолжения приема АСК, используемого с целью вторичной профилактики ССЗ [50, 51].
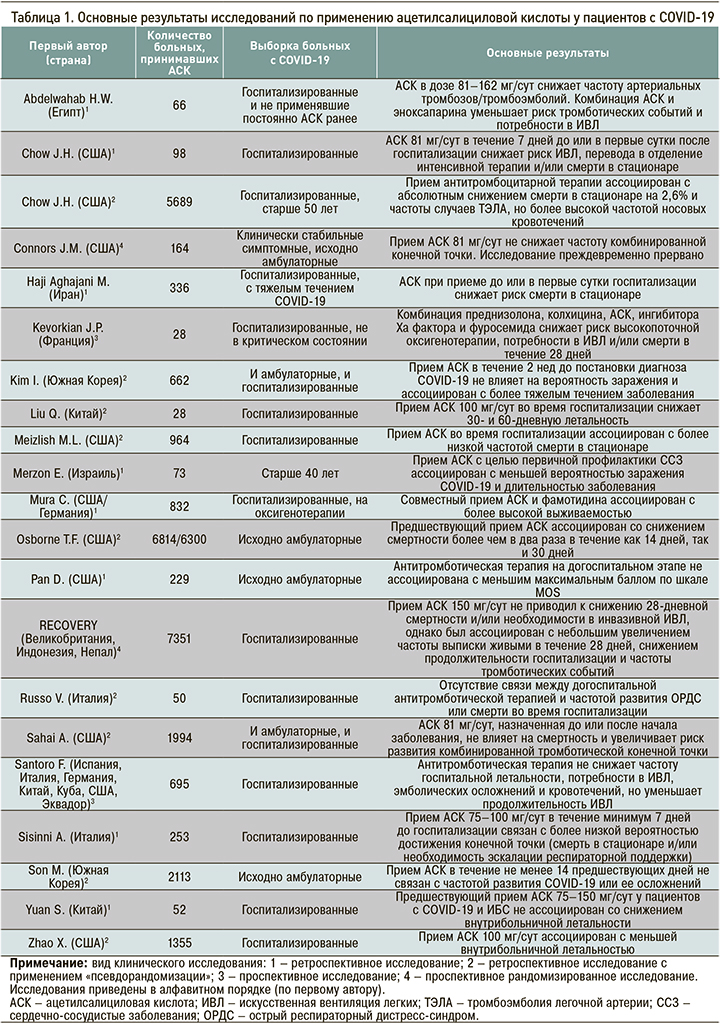
Ключевые данные проведенных исследований по применению АСК у пациентов с COVID-19 в сжатом виде представлены в таблице.
ЗАКЛЮЧЕНИЕ
Анализ публикаций, посвященных изучению приема АСК у пациентов с COVID-19, показал, что из 18 оригинальных исследований в 10 был отмечен положительный эффект этого антиагреганта в снижении летальности и/или частоты тромботических осложнений, в 6 работах получен нейтральный результат и лишь в 2 исследованиях применение АСК было ассоциировано с тяжелым течением заболевания. 3 из 4 метаанализов также продемонстрировали преимущества включения АСК в схемы лечения пациентов с COVID-19. Еще в 5 работах получены данные об эффективности назначения АСК в комбинации с другими средствами, применяемыми для лечения больных новой коронавирусной инфекцией. Неоднозначные результаты проведенных исследований частично могут быть обусловлены временем начала приема АСК (до заболевания, в ранние его сроки или в ходе госпитализации в стационар), использовавшимися дозировками, исходным сердечно-сосудистым риском и тяжестью заболевания.
В настоящее время прием АСК не рекомендован для первичной профилактики тромбозов и тромбоэмболических осложнений у пациентов с COVID-19. Тем не менее научные сообщества и регулирующие органы здравоохранения рекомендуют продолжать проводимую антитромбоцитарную терапию низкими дозами АСК с целью вторичной профилактики ССЗ в случае развития инфекции. Предложенные более селективные подходы к назначению АСК больным COVID-19 в зависимости от риска тромботических и геморрагических осложнений или уровня биомаркеров требуют дальнейшего изучения в рамках крупномасштабных исследований.


