ВВЕДЕНИЕ
Целиакия является хроническим аутоиммунно-воспалительным заболеванием кишечника, развивающимся при участии иммунологических, генетических механизмов и факторов окружающей среды [1]. Распространенность этого заболевания составляет 1–3% и продолжает расти [2]. Примерно 75% впервые диагностированных случаев целиакии с яркими клиническими проявлениями у взрослых встречаются у женщин [3].
Желудочно-кишечные симптомы – наиболее характерные проявления целиакии. Вместе с тем у части пациентов на первый план выступают внекишечные симптомы болезни с поражением многих органов и систем, включая нервную систему, кожу, репродуктивную систему, опорно-двигательный аппарат.
Поражение опорно-двигательного аппарата не относится к частым проявлениям целиакии, тем не менее в рамках этого заболевания, особенно в случае его дебюта в позднем возрасте, возможно развитие артрита и/или спондилоартрита [1–3].
Цель представленной работы – описание случая целиакии, протекавшей с поздним дебютом и сопровождавшейся поражением опорно-двигательного аппарата и нервной системы.
Описание клинического случая выполнено на основании данных медицинской документации. Представленный случай не позволяет идентифицировать пациента как личность, описание представлено с соблюдением Федерального закона о персональных данных и положения о врачебной тайне. Получено информированное согласие пациента на публикацию деперсонифицированных данных.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациентка С., 1978 г.р., обратилась на амбулаторный прием в Клиническую ревматологическую больницу № 25 (г. Санкт-Петербург) в 2020 г. с жалобами на выраженную общую слабость, утомляемость, раздражительность, мигрирующие боли в разных частях скелета (позвоночник, суставы конечностей), миалгии, нарушение координации движений, диарею с частотой стула до 10 раз в сутки (стул без примеси слизи и крови).
Данные анамнеза: в 2015 г. (в возрасте 36 лет), после первых родов, у пациентки впервые появилась боль и скованность в лучезапястных суставах, припухлости суставов она не отмечала. При осмотре врачом по месту жительства было установлено наличие гипермобильности суставов, данных в пользу артрита или другого аутоиммунного заболевания выявлено не было. В дальнейшем пациентка к врачам не обращалась, медикаментозного лечения не получала, у нее сохранялись артралгии.
В 2018 г. (40 лет), через полгода после вторых родов, у пациентки появились ноющая боль в правом тазобедренном суставе, диарея с частотой стула до 3–4 раз/сут, масса тела снизилась на 7 кг при сохраненном аппетите и режиме питания. Пациентка обратилась к ревматологу по месту жительства; по результатам обследования изменений в общем анализе крови и общем анализе мочи выявлено не было, биохимический профиль крови был без отклонений, уровень С-реактивного белка составлял 0,3 мг/л (норма), ревматоидного фактора (РФ) – 10 ед./л (норма), антител к цитруллинированному циклическому виментину – 40 ед./л (норма).
При молекулярно-генетическом исследовании носительство HLA-В27 и HLA-B51 антигенов обнаружено не было.
На рентгенограмме кистей было выявлено незначительное сужение суставных щелей, субхондральный склероз 3, 4, 5-го пястно-фаланговых суставов, на рентгенограмме крестцово-подвздошных сочленений – сакроилеит справа первой стадии, подтвержденный данными магнитно-резонансной томографии (МРТ) крестцово-подвздошных сочленений (небольшая зона субхондрального отека в подвздошной кости справа).
Пациентке был поставлен диагноз «аксиальный спондилоартрит», рекомендован ибупрофен (применяла препарат производства компании «Татхимфармпрепараты», Россия) внутрь по 600 мг/сут в 3 приема, фонофорез с гидрокортизоном на сустав. На фоне лечения пациентка отмечала улучшение самочувствия, уменьшение выраженности болевого синдрома.
Весной 2019 г. (41 год) к клиническим проявлениям спондилоартрита и диареи у пациентки присоединились жалобы на сухость глаз, ощущение песка в глазах, что потребовало исключения болезни Шегрена (по данным сиалометрии и пробы Ширмера, слезо- и слюнопродукция нарушены не были), рекомендовано использовать увлажняющие глазные капли. Эти рекомендации пациентка выполняла, с положительным эффектом.
В июле 2019 г. (41 год) пациентка стала отмечать сильную раздражительность, боль в эпигастрии, усиление болей в позвоночнике и суставах. При осмотре ревматологом суставы внешне не были изменены, пальпаторно безболезненны, объем движений полный. По результатам общего анализа крови все показатели были в пределах нормы, скорость оседания эритроцитов (СОЭ), ревматоидный фактор (РФ), C-реактивный белок (СРБ) также в норме. По данным выполненной эзофагогастродуоденоскопии (ЭГДС) наблюдались эндоскопическая картина обострения хронического рефлюкс-гастрита, дуоденальный рефлюкс. В связи с этим пациентке был рекомендован прием ингибитора протонной помпы омепразол (препарат производства компании «Др. Реддис», Индия) по 20 мг 2 раза/сут и гастропротекторного средства ребамипида (препарат производства компании «ПРОМЕД СS», Чехия) по 100 мг 3 раза/сут.
В августе 2019 г. (41 год) у пациентки произошло ухудшение общего состояния, отмечались выраженная слабость, расстройство сна, раздражительность, головные боли, головокружение, нарушение координации, сухость слизистых полости рта, выраженная боль в большом пальце правой стопы, а также пульсирующая, мигрирующая боль в нижнечелюстных, плечевых, локтевых, тазобедренных, голеностопных и коленных суставах, скованность в суставах кистей рук. Было нарушено самообслуживание: пациентка не могла самостоятельно подниматься по лестнице, из-за шаткости походки неоднократно падала, из-за слабости и нарушений координации не могла брать ребенка на руки.
После осмотра неврологом пациентке была проведена МРТ головного мозга, исключившая его органическую патологию. Диагностирована мозжечковая атаксия и сенсорная дистальная полинейропатия.
На МРТ правого и левого коленных суставов (с подавлением сигнала от жировой ткани) выявлены признаки умеренного синовита, на МРТ тазобедренных суставов (с подавлением сигнала от жировой ткани) – признак дегенеративных изменений суставной губы левого тазобедренного сустава.
Выполнено ультразвуковое дуплексное сканирование брахиоцефальных артерий (экстракраниальный отдел). Результат: правая позвоночная артерия малого диаметра, изменения сосудистой геометрии обеих позвоночных артерий в сегменте V2 могут быть вызваны шейным остеохондрозом, S-образная деформация левой позвоночной артерии в сегменте V1. Признаков васкулита не выявлено.
После повторного обращения к ревматологу пациентке были выполнены следующие исследования: антитела к циклическому цитруллинированному пептиду (АЦЦП), РФ, СОЭ. Ревматоидный фактор находился в пределах нормы, ревматоидный артрит был исключен. Был установлен диагноз «дегенеративно-дистрофическое заболевание позвоночника, дорсопатия распространенной локализации, осложненная многоуровневым грыжеобразованием, мышечно-тоническим синдромом, цервикалгия, любмалгия. Фибромиалгия».
Пациентке были рекомендованы тофизопам (препарат производства компании «ЭГИС», Венгрия) по 1 таблетке 2 раза/сут в течение 3 нед, хондроитина сульфат натрия (производства компании «ДИАМЕД-фарма», Россия) инъекционно по 2 мл в день, лечебная физкультура, йодобромные ванны, грязелечебница, солевые ванны в санатории. После лечения в санатории самочувствие пациентки незначительно улучшилось – уменьшились боль и скованность.
К октябрю 2019 г. (42 года) имевшиеся симптомы поражения опорно-двигательного аппарата, нервной системы и желудочно-кишечного тракта (ЖКТ) усилились, пациентка отметила снижение массы тела на 10 кг за 4 мес. Выполнено исследование крови на антинуклеарные антитела IgG (иммуноблот) и антинуклеарный фактор на HEp-2клетках IgG – указанные маркеры обнаружены не были. По результатам МРТ крестцово-подвздошных сочленений выявлены признаки умеренно выраженного околосуставного отека костного мозга левого крестцово-подвздошного сочленения.
Для исключения воспалительного заболевания кишечника ревматолог направил пациентку к гастроэнтерологу. При выполнении фиброколоноскопии кишечника была найдена лимфофолликулярная гиперплазия терминального отдела подвздошной кишки, комбинированный геморрой вне обострения. Данных в пользу язвенного колита или болезни Крона выявлено не было.
При обращении к ревматологу Клинической ревматологической больницы № 25 в 2019 г. в дополнение к вышеперечисленным жалобам у пациентки появились жалобы на жар в теле, суставах, постоянный жидкий стул. Были исключены болезнь Шегрена, системная красная волчанка, рассеянный склероз, аксиальный спондилоартрит. Ответ на нестероидные противовоспалительные препараты (НПВП) был слабым. При более детальном сборе анамнеза обнаружено, что старшему ребенку пациентки установлен диагноз целиакия, у младшего ребенка имеются схожие симптомы.
Объективно на момент осмотра: состояние удовлетворительное, температура тела 36,6 °С, масса тела 65 кг (исходно – 75 кг), рост 175 см. Кожные покровы чистые, периферические лимфоузлы не пальпируются. Щитовидная железа без патологии. Частота сердечных сокращений (пульс) 61/ мин, артериального давление 110/70 мм рт. ст. Тоны сердца ясные, ритмичные. Дыхание везикулярное, хрипов нет. Частота дыхательных движений 16/мин. Живот мягкий, безболезненный. Физиологические отправления в норме. Периферических отеков нет. Суставы не изменены визуально, пальпаторно безболезненны, припухлости нет. Подвижность позвоночника сохранена в полном объеме во всех отделах. Экскурсия грудной клетки в норме.
В 2020 г. пациентке была повторно выполнена фиброколоноскопия кишечника с исследованием биопсийного материала: эндоскопических признаков воспалительных заболеваний кишечника не выявлено, в объеме исследованного материала достоверных признаков воспалительных заболеваний кишечника и микроскопического колита не обнаружено.
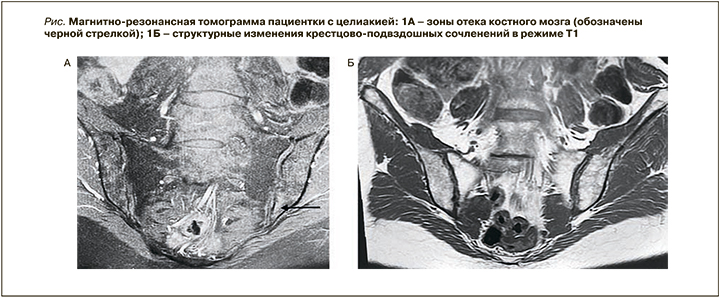
По данным МРТ крестцово-подвздошных сочленений с контрастированием определялись слабо выраженные участи отека костного мозга в проекции передненижнего отдела боковой массы крестца и подвздошной кости слева (рис. 1А, Б).
При сцинтиграфии скелета выявлено типичное для умеренной выраженности воспаления накопление контраста в позвоночнике, крестцово-подвздошных сочленениях и суставах конечностей.
При обследовании у гастроэнтеролога установлено минимальное повышение фекального кальпротектина до 85 мкг/г (референсные значения <50 мкг/г).
В марте 2020 г. в связи с семейным анамнезом целиакии (наличие заболевания у детей), наличием множества жалоб при отсутствии объективных признаков воспаления, жалоб на жидкий стул и снижение массы тела пациентке было проведено генетическое исследование на целиакию. В результате него обнаружен гаплотип HLA-DQ2.2, включающий аллели HLA-DQA1*02:01 и HLA-DQВ1*02, а также HLA-DQ8, включающий HLA-DQA1*03:01 и HLA-DQВ1*03:02.
С учетом наличия целиакии у детей, выявленного гаплотипа HLA-DQ2.2 и клинической картины пациентке установлен диагноз: целиакия, ассоциированная с комплексом гистосовместимости DQ2.2, с внекишечными проявлениями (вторичный синдром Шегрена, полиартрит, спондилоартрит с двусторонним МРТ-активным сакроилеитом, поражением нервной системы в виде статокоординационных расстройств и дистальной сенсорной полинейропатии).
На фоне полной отмены НПВП и строгой безглютеновой диеты у пациентки нормализовалась частота дефекации, восстановилась масса тела, купировалась боль в суставах и позвоночнике, исчезла неврологическая симптоматика. Клиническая и лабораторная ремиссия сохраняется без лекарственной поддержки.
ОБСУЖДЕНИЕ
Целиакия – одно из наиболее часто встречающихся заболеваний ЖКТ как у взрослых, так и детей. Около 97% пациентов с целиакией имею генетические маркеры с носительством на хромосоме 6p21. У 90–95% пациентов выявляется аллель HLA-DQ2, у остальных – HLADQ8 [1–4].
Хотя носительство HLA-DQ2 или HLA-DQ8 аллелей необходимо для развития болезни, риск ее клинической манифестации составляет около 36–53% [4]. Отсутствие обоих типов HLA исключает диагноз целиакии с вероятностью практически 99%. К группе высокого риска развития целиакии относятся родственники первой степени родства пациентов с целиакией, люди с аутоиммунными заболеваниями, синдромом Дауна. Этих пациентов необходимо рассматривать как кандидатов для генетического тестирования [4].
Внекишечные клинические проявления целиакии могут затрагивать многие органы и системы организма. Из мышечно-скелетных проявлений наиболее часто выделяют остеопению и остеопороз (1–34% случаев). В основе указанных изменений лежит мальабсорбция кальция и витамина D с развитием вторичного гиперпаратиреоза и, как следствие, остеопороза [2].
Суставные симптомы целиакии встречаются в 2–9% случаев [2]. Они представлены преимущественно артралгиями, без синовита, хотя существуют единичные сообщения о субклиническом синовиальном выпоте при целиакии и сакроилеите. Чаще всего пациенты предъявляют жалобы на болевой синдром в плечевых, тазобедренных и коленных суставах, поясничном отделе позвоночника; боли при этом преимущественно симметричные. [5]
Описано сочетание целиакии с такими аутоиммунными заболеваниями, как синдром Шегрена, системна красная волчанка, ювенильный ревматоидный артрит. В настоящее время патогенез поражения суставов при целиакии остается неясным [2].
К неврологическим проявлениям целиакии, частота которых варьирует от 10 до 22%, можно отнести атаксию, эпилепсию, головные боли, деменцию, церебральный васкулит, энцефалит, полимиозит, периферическую нейропатию [3, 6].
Другими внекишечными проявлениями целиакии выступают анемия (10–15%), неврологические расстройства (8–14%), кожные проявления (10– 20%), репродуктивная дисфункция [7]. Наиболее распространенные неврологические нарушения при целиакии – глютеновая (мозжечковая) атаксия и периферическая нейропатия, при этом у пациентов могут отсутствовать жалобы со стороны ЖКТ [2, 8]. У пациентов с глютеновой атаксией могут наблюдаться трудности с контролем рук и ног, потеря мелкой моторики, нарушения зрения, нестабильность походки, плохая координация [8]. Также возможны снижение памяти, дизартрия, дисфония, нарушение координации движения глазных яблок [7]. Патогенез этих нарушений до сих пор не ясен [2].
При глютеновой нейропатии происходит повреждение нервов периферической нервной системы, нарушение связи головного и спинного мозга с остальными частыми тела [8]. Клинически это может проявляться симметричной сенсомоторной аксональной периферической нейропатией, ассиметричной нейропатией, сенсорной ганглионопатией и нейропатией мелких волокон [3]. Большую часть пациентов с ассоциированной с целиакией нейропатией беспокоят болезненные парестезии в конечностях, часть больных отмечает неустойчивость походки [8]. Эти заболевания являются медленно прогрессирующими, средний возраст их начала – 53–55 лет [8]. Взрослые пациенты часто предъявляют жалобы на проблемы с концентрацией, вниманием, трудности с подбором слов, эпизоды нарушения памяти и спутанности сознания, снижения остроты зрения и дезориентации, описывают свое состояние как «затуманенная голова» [2, 8]. Также возможны депрессия, апатия, биполярное расстройство, тревога, расстройства пищевого поведения, синдром дефицита внимания, нарушения сна и другие психиатрические расстройства [2].
При целиакии возможно развитие герпетиформного дерматита, чаще всего в зрелом возрасте, у мужчин [2]. Для него характерно папуловезикулярное поражение кожи на разгибательных поверхностях конечностей, туловища, ягодиц, волосистой части головы и шеи с кожным зудом [7, 9].
В представленном клиническом случае мы наблюдали пациентку старше 40 лет с наличием выраженных внекишечных симптомов в виде слабости, раздражительности, нарушения координации движений, полинейропатии, укладывающихся в клиническую картину глютеновой атаксии и полинейропатии, а также артрталгий, синовита, спондилита и сакроилеита, которые могут выступать проявлением ассоциированного с целиакией поражения опорно-двигательного аппарата. Этот случай интересен не только поздним дебютом клинических симптомов, но и возникновением кишечной симптоматики через несколько лет после появления внекишечных проявлений. Синхронное течение патологических симптомов со стороны опорно-двигательного аппарата, нервной системы и ЖКТ с их одновременным полным регрессом на фоне строгой безглютеновой диеты может свидетельствовать о патогенетической общности имеющихся изменений и их взаимосвязи с целиакией.
Представленный клинический пример демонстрирует, что, несмотря на доступность высокочувствительных специфических молекулярно-генетических тестов и инструментальных методов обследования, многие случаи целиакии с внекишечными симптомами остаются не идентифицированными в связи с вариабельностью клинических проявлений и атипичным течением [1, 2].
Строгая и пожизненная безглютеновая диета остается единственной безопасной и эффективной терапией у пациентов с целиакией на сегодняшний день, предотвращающей большую часть возможных осложнений [1, 2]. Однако необходимо иметь в виду, что возможна также резистентная форма целиакии, когда отсутствует ответ на безглютеновую диету, и эта форма характеризуется неблагоприятным прогнозом.
Вследствие того что атипичные проявления целиакии становятся все более распространенными (по последним данным, они встречаются у 50% всех диагностированных пациентов), значительная доля пациентов длительно остается с не диагностированной целиакией и без лечения. В долгосрочной перспективе это ведет к таким осложнениям, как бесплодие, остеопороз, онкологические заболевания (новообразования тонкой кишки, аденокарцинома и ассоциированная с энтеропатией Т-клеточной лимфомы) [1].
ЗАКЛЮЧЕНИЕ
Диагностика и лечение целиакии могут быть сопряжены с большими трудностями при позднем дебюте заболевания и преобладании внекишечной симптоматики (поражении нервной системы и/или опорно-двигательного аппарата). Единственным способом лечения кишечных и внекишечных симптомов целиакии в настоящий момент служит безглютеновая диета, которая может приводить в ремиссии заболевания даже при самом тяжелом его течении.


