Длительная персистенция SARS-CoV-2 в организме человека
Длительный период персистенции и выделения описан для целого ряда респираторных вирусов, включая SARS-CoV [1] и MERS-CoV [2]. Для SARS-CoV-2 также с самого начала пандемии описаны случаи персистенции вируса в дыхательных путях, что подтверждалось положительными результатами теста на РНК вируса методом амплификации нуклеиновых кислот [3, 4]. В одном из ранних исследований, проведенных Zhou F. et al. (2020), средняя продолжительность выделения вируса составила 20 дней у выживших пациентов, однако у умерших в стационаре больных вирус выделялся вплоть до летального исхода. Максимальный период выделения SARS-CoV-2 в этом исследовании составил 37 дней [5].
В более поздних исследованиях медиана продолжительности выделения вируса достигла 31 дня от начала заболевания, при минимальной продолжительности 18 дней и максимальной – 48 [6]. В работе Carmo А. et al. (2020) в группе из 94 пациентов с положительным ПЦР-тестом среднее число дней между первым и последним положительным тестом составило 32,55±9,6 [7]. Vibholm L.K. et al. (2021) показали, что РНК SARS-CoV-2 может обнаруживаться в мазках со слизистой рото- и носоглотки вплоть до 105 дней после клинического выздоровления. Одновременно у пациентов обнаруживался более высокий уровень активности специфических CD8 T-лимфоцитов, что позволяет предположить продолжающуюся стимуляцию иммунного ответа в условиях персистенции вируса [8].
Li N. et al. (2020) проанализировали данные 22 пациентов с лабораторно подтвержденной коронавирусной инфекцией COVID-19. У всех отмечалось клиническое выздоровление, положительная динамика по данным компьютерной томографии (КТ) органов грудной клетки, отсутствие необходимости в продолжении терапии. В то же время во всех случаях было выявлено длительное, в течение более чем 50 дней после выздоровления, обнаружение РНК SARS-CoV-2 в мазках из верхних дыхательных путей. Средний период выделения вируса составил 76, максимальный – 112 дней [9].
Опубликованы результаты исследований, в которых описаны случаи длительного, вплоть до 4 мес, обнаружения SARS-CoV-2 в материале из верхних дыхательных путей в количественном ПЦР-тесте [10]. В исследовании Salmon-Ceron D. et al. (2020) ПЦР-тест мазков из носоглотки на SARS-CoV-2 RT-PCR через 2 мес после начала заболевания был положительным у 11 из 43 пациентов и у 3 пациентов оставался положительным через 3 мес от начала заболевания [11].
Хотя SARS-CoV-2 преимущественно передается воздушно-капельным путем и клинически проявляется поражением органов дыхания, следует помнить о том, что ввиду широкого распространения рецепторов АПФ2 в организме новая коронавирусная инфекция COVID-19 является системной инфекцией. Вовлечение ЖКТ в патологический процесс определяет значимость передачи вируса через фекалии. В систематическом обзоре 55 исследований (1348 пациентов) получены данные об обнаружении вируса почти в половине образцов кала. Более того, положительный результат ПЦР-теста образцов кала (медиана 19 дней) определялся достоверно дольше, чем положительный ПЦР-тест респираторных образцов [12]. В другом метаанализе более чем в половине образцов фекалий вирус обнаруживался в течение периода до 70 дней от начала заболевания и в течение 33 дней после того, как он уже не определялся в респираторных образцах [13].
В исследованиях Park S.K. et al. (2020), Wu Y. et al. (2020) продемонстрировано, что SARS-CoV-2 может выделяться с фекалиями в течение периода до 4 мес независимо от наличия или отсутствия у пациента ЖКТ-симптомов [14, 15]. Выявлено присутствие РНК и белков SARS-CoV-2 в течение 4 мес после начала заболевания в тонком кишечнике 50% пациентов с COVID-19 при отсутствии каких-либо симптомов [16]. Инфекционность вируса, выделяемого с фекалиями, к настоящему времени до конца не определена, однако присутствие вируса в фекалиях пациентов с COVID-19 свидетельствует о значимости фекально-орального пути его передачи [17].
Таким образом, к настоящему времени в ряде исследований показана возможность длительной персистенции SARS-CoV-2 в организме человека, что может быть причиной ряда иммунных реакций, способствующих развитию лонг-ковида.
Факторы, способствующие персистенции вируса
Предположительно длительному выделению вируса могут способствовать несколько факторов. Одним из них ряд авторов считает тяжесть заболевания в остром периоде. Так, в одном из исследований было показано, что медиана продолжительности обнаружения вируса в образцах из дыхательных путей у больных с тяжелым течением острого периода COVID-19 (21 (14–30) день) была значимо дольше, чем у пациентов с легким течением болезни (14 (10–21) дней; p=0,04) [18]. Эти результаты коррелируют с данными о более длительном выделении вируса у пациентов, находившихся в отделении реанимации и интенсивной терапии (ОРИТ), в сравнении с пациентами, госпитализированными в инфекционные отделения [19]. Кроме того, вирусная нагрузка у пациентов с тяжелым течением заболевания была значимо выше (по данным одного из исследований, в 60 раз), чем у пациентов с легким течением заболевания; это позволяет предположить прямую корреляцию между степенью вирусной нагрузки и тяжестью течения болезни [20].
По данным ряда исследований, предполагаемыми предикторами длительного выделения SARS-CoV-2 с сохраненной активностью из респираторного тракта являются высокая вирусная нагрузка, длительность заболевания менее 7 дней, отсутствие нейтрализующих антител и снижение иммунного ответа организма-хозяина, однако в качестве значимых независимых факторов риска определены только высокая вирусная нагрузка (>7 Log10 копий РНК/мл в образцах из дыхательных путей) и отсутствие SARS-CoV-2-нейтрализующих антител [21, 22]. Эти результаты получены в группе госпитализированных пациентов с тяжелым течением COVID-19, что ограничивает их экстраполяцию на популяцию в целом. В недавнем ретроспективном анализе Marks М. et al. (2021) изучены данные негоспитализированных пациентов [23] и установлено, что основным предиктором инфекционности служит высокая вирусная нагрузка.
Другие потенциальные факторы риска включают лихорадку (t >38,5 °C), применение кортикостероидов и сроки госпитализации. В частности, в одной из работ продемонстрировано, что тяжелое течение болезни, прогрессирование инфильтративных изменений в легких по данным КТ более чем на 50% в течение 24–28 ч прямо коррелировало с длительным выделением вируса. Вместе с тем при проведении многофакторного регрессионного анализа эта зависимость не была столь очевидной [24]. В другом исследовании с участием 113 госпитализированных пациентов медиана выделения РНК SARS-CoV-2 составила 17 (от 13 до 22) дней. Длительное выделение вируса (>15 дней) наблюдалось у 76 пациентов (67,3%), прямая корреляция отмечалась с мужским полом, нахождением на искусственной вентиляции легких (ИВЛ) и сроками госпитализации (p=0,002) [25].
Инфекционность персистирующего SARS-COV-2
Длительное выделение вируса, однако, не является свидетельством сохранения его инфекционности. Средний период инфекционности дикого штамма вируса составляет примерно 8 дней от начала заболевания [22, 26, 27]. Van Kampen J.J.A. et al. (2021) показали, что вероятность выделения живого вируса из дыхательных путей в период более 2 нед от начала заболевания составляет ≤5% [22]. В настоящее время имеется лишь одно сообщение о выделении живого вируса в мазке из носоглотки через 18 дней от начала заболевания, что подтверждает резкое снижение инфекционности вируса после второй недели заболевания [28]. Скорее всего, выделение вирусной РНК не относится к значимым предикторам инфекционности, и такая длительная персистенция может быть связана с субоптимальным иммунологическим клиренсом SARS-CoV-2 [22, 26, 27].
Становится все более очевидным, что для окружающих риск, обусловленный контактами с реконвалесцентами COVID-19, является незначительным. В одном из исследований у медицинских работников, имевших положительный тест в течение периода до 55 дней после появления симптомов, живой вирус в мазках из носо- и ротоглотки выделен не был [29]. В другом исследовании у 48 пациентов с положительным тестом на РНК SARS-CoV-2 более 14 дней от начала заболевания также не был обнаружен живой вирус [30]. Однако в работе Jeong H.W. et al. (2020) выявлено, что живой вирус может обнаруживаться в период более 15 дней в слюне, моче и кале [31].
Таким образом, очевидно, что период инфекционности SARS-CoV-2, скорее всего, варьирует в зависимости от целого ряда факторов. Один из наиболее значимых факторов длительной персистенции и сохранения инфекционности вируса – состояние иммунной системы пациента.
Персистенция вируса у иммунокомпроментированных пациентов
Анализ данных исходов COVID-19 у пациентов с различными сопутствующими заболеваниями продемонстрировал, что онкологические заболевания легких и крови, трансплантация органов, первичные иммунодефициты служат факторами риска тяжелого течения COVID-19, внутрибольничных инфекций, летальных исходов, связанных с COVID-19 [32]. В ряде работ сообщается о высокой вероятности персистенции, реактивации или реинфекции SARS-CoV-2 у иммунокомпроментированных пациентов. И хотя длительное выделение вирусной РНК в ПЦР-тесте у симптомных и бессимптомных пациентов описано уже в достаточно большом числе исследований, выделить вирус с подтвержденной инфекционностью у пациентов с сохранной иммунной системой в период более 2 нед после начала заболевания пока не удалось [33]. При этом имеется несколько сообщений о выделении активного вируса иммунокомпроментированными пациентами в течение недель и даже месяцев после начала заболевания. В ряде случаев у этих пациентов отмечался даже рецидив симптомов, проводились повторные курсы лечения ремдесивиром (противовирусное средство класса нуклеотидных аналогов), что в конечном итоге приводило к элиминации вируса [34–40]. Самый длительный период выделения жизнеспособного вируса в мазке из носоглотки (≈8 мес) был зафиксирован у пациента с неходжкинской лимфомой [41]. Объяснением подобных фактов может быть то, что вирусная нагрузка у иммунокомпроментированных пациентов может отличаться от таковой у пациентов с сохранным иммунитетом.
Существующие к настоящему времени данные о длительной персистенции и выделении инфекционного вируса сложно экстраполировать на популяцию в целом и обобщать по следующим причинам: эти исследования не были тщательно спланированы для изучения факторов риска персистенции и реинфекции SARS-CoV-2; во всех описанных случаях имело место атипичное течение заболевания, обычно протекающего в острой форме; SARS-CoV-2 эволюционирует медленно [42], что является дополнительной возможностью для диверсификации квазивидов SARS-CoV-2.
Однако, учитывая, что SARS-CoV-2 является пандемической инфекцией, вполне возможно влияние иммунного ответа организма-хозяина на эволюцию вируса и селекцию штаммов с измененными свойствами, вызывающих хроническую персистирующую инфекцию. Этот аспект инфекции SARS-CoV-2 требует выполнения крупномасштабных исследований, которые будут направлены на понимание механизма, лежащего в основе персистенции вируса, с целью разработки методов лечения и профилактики. Учитывая накапливающиеся данные о появлении новых вариантов SARS-CoV-2, их заразности, влиянии на эффективность вакцин и тяжесть заболевания, было бы также интересно исследовать взаимосвязь между эволюцией вируса внутри хозяина и механизмами ухода от иммунного ответа у разных групп пациентов в контексте персистенции вируса, инфекционности и реинфекции.
Персистенция вируса и возможность рецидива или реинфекции
Имеются сообщения об обнаружении вируса SARS-CoV-2 в респираторных образцах у пациентов, перенесших COVID-19, после получения одного или двух отрицательных результатов ПЦР-теста [43–46]. В связи с этим возникают вопросы, связано ли это с погрешностями забора материала, ограниченной чувствительностью теста, персистенцией вируса, рецидивом или реинфекцией. Хотя существующие данные ограниченны, есть ряд исследований, в которых таких пациентов наблюдали в течение определенного времени после выписки из стационара и при этом не было выявлено заражения членов их семей, что позволило предположить выделение неактивного вируса [46]. В то же время имеются несколько сообщений о выделении у выздоровевших пациентов другого штамма вируса, что может говорить о реинфекции или мутации исходного штамма [47, 48].
Невозможно дать окончательный ответ на вопрос, насколько обнаружение положительного теста после отрицательного свидетельствует о реинфекции. Однако в одном из исследований среди 87 пациентов с повторным положительным тестом после отрицательного живой вирус или вирус, генетически отличный от исходного, был получен только в 14% случаев, а у большинства пациентов выделялся неактивный вирус [49]. Суммируя результаты проведенных исследований можно предположить, что длительное выделение вируса у большинства пациентов, скорее всего, не связано с реинфекцией. Одно из возможных объяснений этого факта – предположение о том, что вирус SARS-CoV-2 может изолироваться в организме (например, в экзосомах) и затем периодически выделяться, как это описано для вирусов ВИЧ или Эпштейна–Барр [50, 51]. Наконец, сохраняется возможность реактивации латентного вируса, как в случае с вирусами герпеса. Этот феномен был описан у пациента с COVID-19, который одновременно получал лечение по поводу острого лимфолейкоза [52].
Исходя из вышеизложенного, для разработки адекватных мероприятий по контролю пандемии COVID-19 представляется крайне важным изучение причин, по которым у ряда пациентов вирус персистирует и выделяется в течение длительного времени.
С учетом высокой вероятности персистенции вируса при Long-COVID-19 представляется вполне обоснованным использование уже за пределами острого периода препаратов прямого противовирусного действия, таких как РНК-зависимый ингибитор РНК-полимеразы фавипиравир. В выполненных в нескольких странах клинических исследованиях доказано угнетение репликации вируса COVID-19 и последовательный регресс клинической симптоматики в остром периоде. В некоторых клиниках России успешно используется повторное назначение фавипиравира при затянувшемся COVID-19 [53, 54].
Альтернативный подход может быть основан на применении в таких ситуациях иммуномодулирующих средств. В этом плане представляется перспективным использование имидазолилэтанамида пентандиовой кислоты (Ингавирин®). В доклинических и клинических исследованиях показана эффективность этого препарата в отношении вирусов гриппа типа A и В, аденовируса, вируса парагриппа, респираторно-синцитиального вируса, коронавируса, метапневмовируса, энтеровирусов и риновируса. Механизм действия Ингавирина® реализуется на уровне инфицированных клеток за счет активации факторов врожденного иммунитета, подавляемых вирусными белками. Препарат повышает экспрессию рецептора интерферона-α первого типа на поверхности эпителиальных и иммунокомпетентных клеток, активирует синтез антивирусного эффекторного белка МхА (раннего фактора противовирусного ответа, ингибирующего внутриклеточный транспорт рибонуклеопротеиновых комплексов вирусов) и фосфорилированной формы протеинкиназы R, подавляющей трансляцию вирусных белков. Помимо противовирусного действия, Ингавирин® оказывает противовоспалительный эффект, обусловленный подавлением продукции ФНО-α, ИЛ, снижением активности миелопероксидазы, и проявляет регенеративное действие. Проведенное клиническое исследование подтвердило эффективность препарата в острый период COVID-19 [55]. Исходя из механизма его действия, включающего снижение вирусной нагрузки, логично предположить целесообразность назначения Ингавирина® при Long-COVID-19. Однако требуются дальнейшие исследования в этом направлении.
Хроническое воспаление
Ввиду того что в достаточно большом числе исследований показана возможность длительной персистенции SARS-CoV-2 в организме человека, возникло предположение о возможной роли активации иммунной системы в патогенезе долгого COVID-19. В частности, опубликован обзор данных, согласно которым Т-клеточная дисфункция может способствовать развитию лонг-ковида, чья патофизиология очень сходна с аутоиммунными заболеваниями [56]. Это подтверждается результатами аутопсии пациентов, умерших от COVID-19, у которых в легких и других органах были обнаружены инфильтраты с высокой концентрацией CD8+ T-лимфоцитов, которые выступают одними из важнейших медиаторов аутоиммунных реакций [57].
Достаточно неожиданно у 15–20% пациентов с COVID-19 были выявлены нарушения функции щитовидной железы [58, 59]. Принимая во внимание тесную связь щитовидной железы и Т-клеточно-опосредованных аутоиммунных реакций, необходимо иметь в виду возможную роль патологии щитовидной железы в патогенезе лонг-ковида [58, 60].
B-лимфоциты также могут играть определенную роль в иммунопатогенезе долгого COVID-19. Так, при анализе образцов крови пациентов, госпитализированных с новой коронавирусной инфекцией COVID-19, антифосфолипидные антитела были обнаружены в 52% случаев. В дальнейшем в ходе исследования была подтверждена роль этих антител в гиперактивации нейтрофилов и более тяжелом течении заболевания [61]. В других работах у 10–50% пациентов с COVID-19 были найдены аутоантитела против интерферонов, нейтрофилов, соединительной ткани и др. [62–65]. Кроме того, уже очевидно, что при тяжелом течении COVID-19 развивается лимфопения (т.е. снижение уровня B- и T-лимфоцитов), что приводит к избыточной воспалительной реакции [66, 67]. Это обусловлено, что именно лимфоциты, особенно Т-лимфоциты, играют важную роль в разрешении воспаления, связанного с инфекцией [68, 69]. В подтверждение этого имеются результаты метаанализа, в соответствии с которыми лимфопения и повышенное содержание провоспалительных нейтрофилов служат независимыми факторами риска тяжелого течения COVID-19 и летальности [70–72]. Таким образом, неразрешенная избыточная воспалительная реакция может иметь определенное значение в развитии лонг-ковида. Показано также, что при низких уровнях T- и B-лимфоцитов создаются благоприятные условия для персистенции SARS-CoV-2, что, в свою очередь, может поддерживать активацию иммунной системы при долгом COVID-19 [73].
Кроме того, к настоящему времени описано достаточно большое число случаев мультисистемного воспалительного синдрома (MIS), развивающегося у детей и взрослых через 2–6 нед после острого периода инфекции. Интересно, что у этих пациентов в остром периоде могло быть достаточно легкое или даже бессимптомное течение заболевания, а впоследствии наблюдался рост уровней маркеров воспаления (С-реактивного белка, ИЛ-6, ферритина, Д-димера), лимфопения и тяжелые нарушения со стороны сердечно-сосудистой, нервной систем, ЖКТ [74–76]. Отсроченное развитие мультисистемного воспалительного синдрома подтверждает значимость дисрегуляции адаптивного иммунитета [77]. Таким образом, возможно, не разрешившееся воспаление может быть одним из факторов развития лонг-ковида как у взрослых, так и детей, и объясняет такие характерные его симптомы, как миалгия, артралгия, утомляемость. При этом необходимо помнить, что хроническая усталость выступает не только признаком воспаления, но и нарушений мозгового кровообращения, дисфункции вегетативной нервной системы, что также может иметь значение в патогенезе долгого ковида [78, 79].
Другой причиной длительного воспалительного процесса может быть патология ЖКТ. Известна способность SARS-CoV-2 эффективно размножаться в клетках желудка и кишечника ввиду высокой экспрессии рецепторов АПФ2, что у 10–20% пациентов приводит к гастроинтестинальной форме клинической манифестации COVID-19 [80, 81]. Важно понимать, что те же симптомы со стороны органов пищеварения (тошнота, рвота, диарея и др.) наблюдаются у пациентов с лонг-ковидом [82]. Нарушение микробиоты ЖКТ наблюдается при новой коронавирусной инфекции в течение периода до 30 дней от начала заболевания и коррелирует с тяжестью заболевания и уровнями воспалительных маркеров [83, 84]. Учитывая тесную взаимосвязь между ЖКТ и иммунной системой, это также вносит определенный вклад в поддержание хронического воспаления [85].
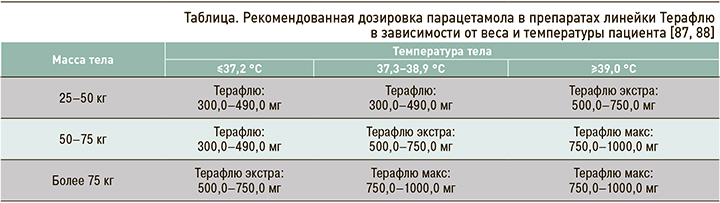
Для подавления клинических проявлений хронического воспаления, существенно влияющих на качество жизни пациентов, можно использовать нестероидные противовоспалительные препараты (НПВП) и парацетамол. При этом представляется приоритетным использование фиксированных комбинаций парацетамола с адреномиметиками и антигистаминными препаратами, например парацетамол + фенилэфрин + фенирамин (Терафлю), поскольку в этом случае наблюдается синергизм действия активных компонентов и достигается возможность комплексного действия сразу на несколько симптомов (слабость, озноб, лихорадку, миалгию, артралгию, кашель, заложенность носа, ринорею, чихание) [86, 87].
Комментарии: при простуде и гриппе парацетамол можно использовать у пациентов с температурой тела ниже 37,2 °С с целью достижения обезболивающего, противовоспалительного, противоотечного эффектов (табл.) [87].
У пациентов с COVID-19, как правило, развивается эндотелиальная дисфункция в результате прямого вирусного поражения эндотелиоцитов. Эндотелиальная дисфункция приводит к нарушению микроциркуляции и способствует формированию гипоксии в различных органах и тканях. Со стороны центральной нервной системы (ЦНС) обычно отмечается усугубление симптоматики уже имеющейся хронической ишемии мозга либо возникновение когнитивных нарушений и астенического синдрома de novo. Пациентам с признаками когнитивных нарушений и сопутствующего астенического синдрома рекомендуется применять терапию, направленную на устранение эндотелиальной дисфункции и улучшение микроциркуляции. С этой целью целесообразно применять депротеинизированный гемодериват крови телят, который обладает подтвержденным эндотелиопротективным действием, способствует улучшению реологии эритроцитов и увеличению количества функционирующих капилляров. Согласно последним клиническим данным, прием соответствующего препарата по 2 таблетки 3 раза/сут не менее 45 дней способствует регрессу когнитивных нарушений и сопутствующего астенического синдрома.
Показано влияние комбинированного лекарственного препарата Цитофлавин (инозин + никотинамид + рибофлавин + янтарная кислота) на ключевые патофизиологические звенья полиорганной недостаточности при CОVID-19. Обладая противовоспалительным, антиоксидантным и антигипоксантным действием, Цитофлавин оказывает положительное влияние на энергообразование в клетке, уменьшает продукцию свободных радикалов и восстанавливает активность ферментов антиоксидантной защиты, активирует окислительно-восстановительные ферменты дыхательной цепи митохондрий, ресинтез макроэргов, способствуя утилизации глюкозы и жирных кислот. Это позволяет сделать вывод о целесообразности его использования при реабилитации пациентов с постковидным синдромом.
По данным рандомизированного проспективного исследования ЦИТАДЕЛЬ с участием 100 пациентов (средний возраст 40,4±11,7 года, давность перенесенного CОVID-19 от 30 до 90 дней с момента выздоровления), назначение препарата Цитофлавин по 2 таблетки 2 раза/сут в течение 25 дней позволило добиться выраженного выраженного регресса астенических симптомов и коррекции когнитивных нарушений. Оценка состояния проводилась по шкале оценки астении (MFI-20), краткой шкале оценки психического статуса (опросник MMSE), опроснику качества жизни (EQ-5D), шкале оценки общего состояния здоровья, Питтсбургскому опроснику качества сна (PSQI). Ретроспективно выполнялся анализ лабораторных показателей. Был выявлен дополнительный положительный эффект Цитофлавина – уменьшение выраженности тромбоцитопении. Преимущества этого лекарственного препарата заключаются в синергичных механизмах действия его активных компонентов [89].



