В настоящее время не вызывает сомнения тот факт, что COVID-19 и иммуновоспалительные ревматические заболевания (ИВРЗ) имеют определенную общность, обусловленную системностью поражения различных органов и систем. Инфекция SARS-CoV-2 потенциально может вызывать запуск системного иммуновоспалительного процесса и локальных иммунологических нарушений у пациентов, имеющих генетические предпосылки в формировании процессов аутореактивности. При этом «тромбовоспаление» рассматривается в качестве универсального механизма как для COVID-19 (так называемая СOVID-19-ассоциированная коагулопатия), так и ИВРЗ, который связан с гиперпродукцией провоспалительных цитокинов и образованием нейтрофильных внеклеточных ловушек (neutrophil extracellular traps – NETs), индуцирующих активацию/повреждение эндотелиальных клеток, тромбоцитов (тромбопатия), а также с активацией системы комплемента и др. Предполагается, что одним из механизмов, инициирующих активацию воспалительного процесса, выступает молекулярная мимикрия. Установлено, что коронавирусы имеют общие молекулярные эпитопы с белками человека (например, с гликопротеином S), которые играют ключевую роль в инвазии клеток хозяина. Имитирующие эпитопы также могут присутствовать в синовиальной мембране и вызывать локальное воспаление [1–3].
SARS-CoV-2 ведет не только к развитию острых интерстициальных поражений легких, васкулопатий с вовлечением в патологический процесс сердечно-сосудистой системы, ЦНС, ЖКТ, почек и другому, но и сохранению/формированию различных патологических состояний после выздоровления от этого инфекционного заболевания. В перечень постковидных синдромов входят артралгии, артриты, миалгии, васкулиты с поражением сосудов различного калибра, системная красная волчанка (СКВ), антифосфолипидный синдром, болезнь Кавасаки, а также целый ряд иммунологических маркеров (антифосфолипидных антител, антинуклеарных факторов и др.), характерных для широкого круга ревматических заболеваний [4–8].
Один из вариантов клинических проявлений лонг-ковида – формирование суставного синдрома, который может быть связан с развитием поствирусного артрита (ПВА), характеризующегося полной обратной динамикой его развития на фоне элиминации вируса [9–11]. Однако следует отметить, что суставной синдром, разившийся после перенесенного COVID-19, может выступать дебютом системных аутоиммунных заболеваний (ревматоидного артрита, спондилоартритов, СКВ, болезни Шегрена, системных васкулитов, воспалительных миопатий и др.), что требует расширения дифференциально-диагностического поиска и динамического наблюдения за этой группой пациентов [12–14].
В рамках постковидного суставного синдрома следует учитывать возможность формирования асептического некроза головок крупных суставов (коленных, тазобедренных), развившегося на фоне вирусной инфекции и применения ГКС для ее терапии [15].
Перенесенный COVID-19 может стать причиной развития или обострения фибромиалгии и синдрома хронической усталости (доброкачественный миалгический энцефаломиелит) – патологии, связанной с дисфункцией ноцицептивной и вегетативной нервной системы, для которой типично наличие выраженной утомляемости, психоэмоциональных нарушений и хронической боли [10, 11].
Формированию хронической боли в рамках постковидного синдрома могут способствовать депрессия, тревожность и психоэмоциональный стресс [16–17].
Скелетно-мышечные проявления лонг-ковида
Миалгии и артралгии относятся к числу характерных проявлений вирусной инфекции. Эти симптомы возникают у 50–90% больных в остром периоде COVID-19 и имеют прямые взаимосвязи с тяжестью течения заболевания и наличием стойкой фебрильной лихорадки [18–19]. В настоящее время отсутствует точная статистика частоты развития постковидного скелетно-мышечного синдрома у лиц, ранее не имевших каких-либо ревматических заболеваний. Отмечается существенный «разброс» данных в зависимости от популяции и тяжести перенесенного COVID-19. В среднем через 6 мес наблюдения боли в суставах фиксируются у 9%, а миалгии – у 5–43% реконвалесцентов. У пациентов с легким течением COVID-19 в острой фазе отмечается более высокая частота и спектр «постковидных» симптомов, в том числе болей в суставах, по сравнению с тяжелым течением инфекции [20–22].
Особенности течения скелетно-мышечных проявлений лонг-ковида представлены в наблюдательном проспективном одноцентровом исследовании [6]. В изучаемую группу вошли 121 пациент с недифференцированным артритом (воспалительным артритом, который не соответствовал критериям ни одного иммуновоспалительного заболевания суставов) и 324 пациента с ИВРЗ, перенесших новую коронавирусную инфекцию с марта 2020 г. по май 2021 г. различной степени тяжести: бессимптомное (15,1%), легкое течение (41,9%), средней тяжести (39,5%), тяжелое (3,39%). В 43,5% случаев пациенты были госпитализированы в стационар инфекционного профиля для лечения новой коронавирусной игфнекции в связи с тяжестью состояния. Средний возраст пациентов (76,8% женщин и 23,2% мужчин) составил 57,3±13,5 лет. Положительный мазок из рото-, носоглотки на ПЦР SARS-CoV2 выявлялся у 88,8% пациентов.
Среди пациентов с недифференцированным артритом (НДА) у 80,0% наблюдалась средняя степень тяжести течения COVID-19. Продолжительность периода от перенесенного COVID-19 до манифестации суставного синдрома составила от 1 до 6 мес. Были выявлены следующие клинические проявления суставного синдрома: артралгии, артриты, синовиты, моноартрит и полиартрит. Наиболее часто поражались коленный, голеностопный и лучезапястный суставы. Все случаи полиартрита включали вовлечение в патологический процесс мелких суставов кистей и стоп.
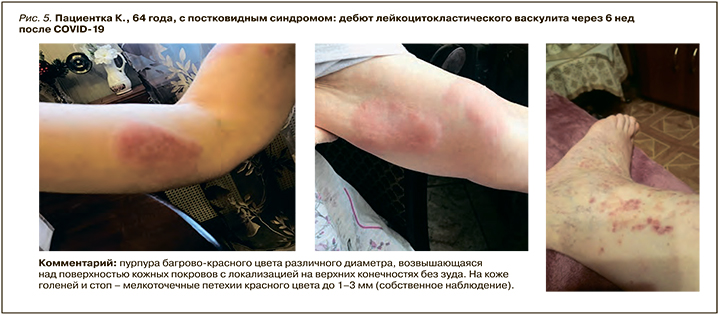
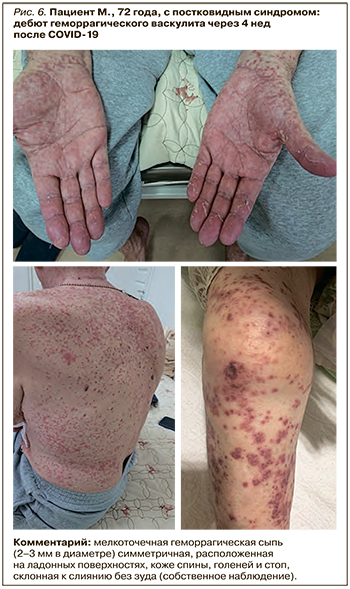
Развитие поствирусного артрита (ПВА) было выявлено у 22,6% пациентов с быстрой обратной динамикой суставного синдрома на фоне применения НПВП (рис. 1–4).
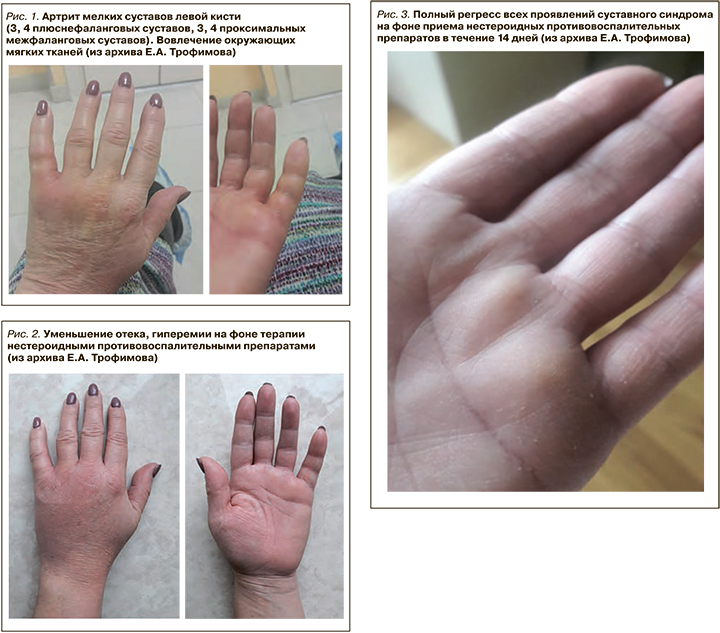
ПВА выявлялся на фоне COVID-19 или в ближайшее время после перенесенной вирусной инфекции (1–4 нед). Данный вариант артрита характеризовался моно-/олигоартритом коленных, голеностопных, проксимальных и дистальных межфаланговых суставов, а также припухлостью периартикулярных мягких тканей, отсутствием деструктивных изменений в суставах и хорошим клиническим ответом на лечение НПВП или ГКС.
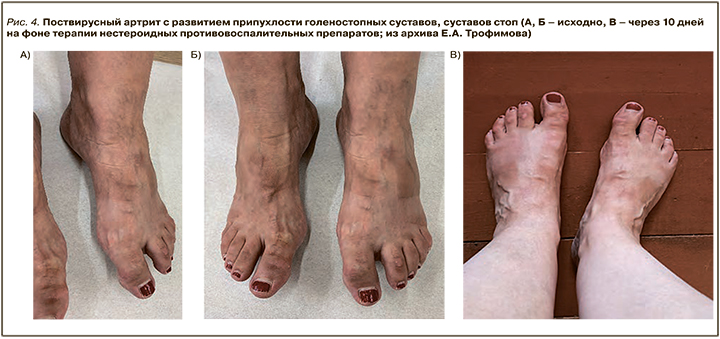
Следует отметить, что ПВА в большинстве случаев остается диагнозом исключения. Дифференциальная диагностика проводится с септическими, микрокристаллическими артритами, реактивными артритами, дебютом ИВРЗ (ревматоидного артрита, аксиальных спондилитов, диффузных болезней соединительной ткани). Подтверждением этиологической роли SARS-CoV-2 служит отсутствие признаков других ревматических заболеваний, включая повышение уровня мочевой кислоты, ревматоидного фактора (РФ), антител к циклическому цитруллинированному пептиду (АЦЦП), антинуклеарного фактора (АНФ), наличие HLA B-27 [24].
Среди пациентов с НДА определенный диагноз ревматического заболевания был верифицирован в 49% случаев в течение 3–6 мес. В этой группе обследованных чаще выявлялся ранний ревматоидный артрит (РРА). Формирование РРА из НДА включало симметричный артрит, быстрое увеличение числа болезненных и припухших суставов (преимущественно коленных), лучезапястных, проксимальных межфаланговых суставов кистей и плюснефаланговых суставах стоп, серопозитивность по РФ и АЦЦП. При ультразвуковом исследовании (УЗИ) суставов выявлялись теносиновиты и костно-хрящевые эрозии.
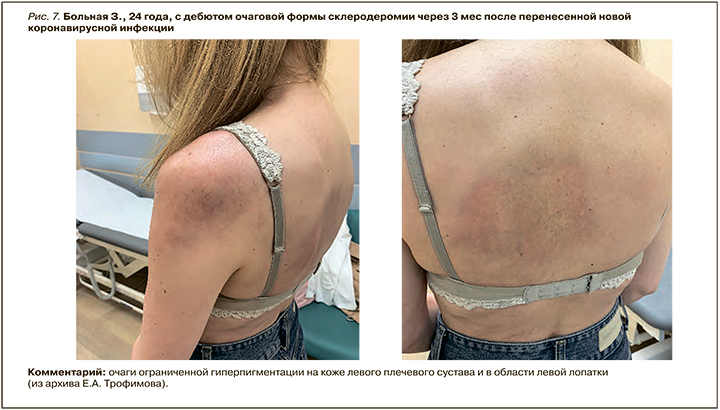
Наряду с этим через 3–6 мес после перенесенного COVID-19 у пациентов с НДА были диагностированы аксиальный спондилоартрит, болезнь Шегрена, псориатический артрит, полиостеоартрит, СКВ, лейкоцитокластический васкулит (рис. 5), геморрагический васкулит (рис. 6), очаговая склеродермия (рис. 7) аутоиммунное неуточненное заболевание (АИЗ), артралгии. У 51% больных диагноз НДА был сохранен.
Следует отметить, что НДА может трансформироваться в остеоартрит (ОА). На начальных этапах развития он характеризуется формированием асимметричного синовита, чаще коленных суставов, болью при приседании на корточки и спуске/подъеме по лестнице, а также непродолжительной (10–15 мин) скованностью. Инструментальными диагностическими признаками раннего ОА следует считать наличие синовита, выявляемого с помощью УЗИ, незначительного сужения суставной щели по данным рентгенографии коленных суставов и отсутствие остеофитоза, который служит характерным рентгенологическим признаком развернутой стадии этого заболевания. Дифференциальная диагностика проводится с микрокристаллическими артритами, реактивными артритами, ревматоидным артритом, спондилоартритами. Лабораторным подтверждением диагноза раннего ОА служит отсутствие признаков лабораторной активности, включая повышение уровней СОЭ и СРБ, мочевой кислоты, РФ, АЦЦП, АНФ и HLA B-27.
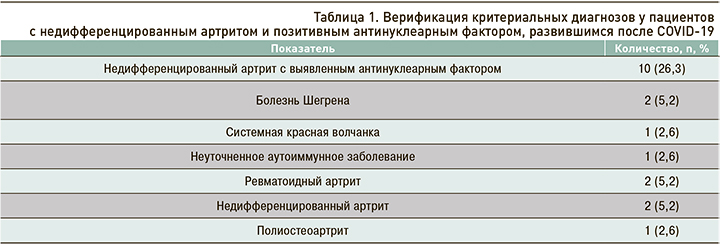
У 10 пациентов с НДА обращали на себя внимание диагностические значения АНФ (от 1:320 до 1:2560). Наибольшие его уровни наблюдались при последующей верификации критериальных диагнозов: болезни Шегрена (1:1280), СКВ (1:2560), АИЗ неуточненного (1:640) и ревматоидного артрита (1:640 и 1:1280). При НДА и полиостеоартрите значения АНФ были ниже и составляли 1:320 и 1:640 соответственно. Верификация критериальных диагнозов у пациентов с НДА и позитивным АНФ, развившимся после COVID-19, представлена в таблице 1.
Определение диагностических значений АНФ (≥1:160 на клеточной линии Hep 2) у пациентов с НДА, перенесших COVID-19, требует проведения клинико-иммунологического обследования для исключения/подтверждения диагноза ИВРЗ. Однако следует учитывать, что позитивность по АНФ и антителам к ДНК может наблюдаться в рамках иммуноопосредованного ответа на вирусную инфекцию у лиц без ИВРЗ и требует наблюдения в динамике.
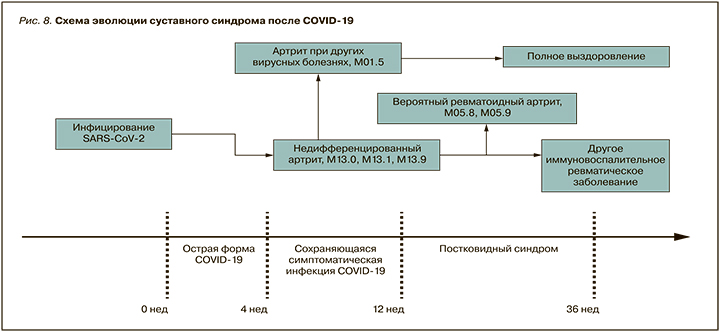
Диагноз НДА может быть сохранен у пациентов с персистирующим суставным синдромом, но при отсутствии критериальных проявлений какого-либо ревматического заболевания, и требует динамического наблюдения. Схема эволюции суставного синдрома после COVID-19 представлена на рисунке 8.
Клинические проявления лонг-ковида у пациентов с иммуновоспалительными ревматическими заболеваниями
В постковидном периоде (4–12 нед) у подавляющего числа пациентов с ИВРЗ отмечается существенное возрастание клинической и иммунологической активности болезни, требующее коррекции противоревматической терапии и динамического наблюдения.
При обследовании 230 пациентов с воспалительными заболеваниями суставов, позвоночника и системными заболеваниями соединительной ткани (СЗСТ) постковидный синдром в виде слабости, одышки, артралгий, миалгии, похудания, снижения памяти, депрессии был выявлен в 25,9% случаев [23]. В ранние сроки (от 4 до 8 нед) после перенесенной новой коронавирусной инфекции наблюдалось обострение основного заболевания, что в большинстве случаев (72%) требовало госпитализации пациентов в стационар ревматического профиля для интенсификации терапии.
Обострение суставного синдрома отмечено у 83,4% пациентов с ревматоидным артритом, перенесших COVID-19. Так, у 38,3% пациентов на момент госпитализации или амбулаторного приема имела место высокая степень активности заболевания (DAS28 ≥5,1). Средняя степень активности ревматоидного артрита (DAS28 ≥3,2) наблюдалась у 41,9% пациентов, тогда как низкая – всего у 19,6%. В среднем через 3±1,2 мес после COVID-19 было зафиксировано нарастание лабораторной активности ревматоидного артрита: увеличение средних значений СРБ относительно исходных (с 26,08±0,92 до 31,28±6,34 мг/л) и РФ (с 29,5±10,12 до 50,1±11,64 ед/мл). У пациентов с СЗСТ в постковидном периоде отмечалось прогрессирование показателей клинической активности и существенное повышение уровня АНФ: при болезни Шегрена – максимум до 1:163 840, при СКВ – максимум до 1:40 960, при системной склеродермии – максимум до 1:5280.
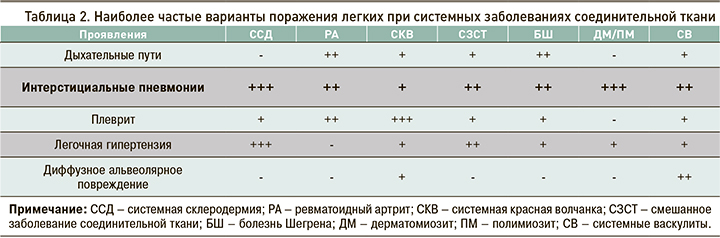
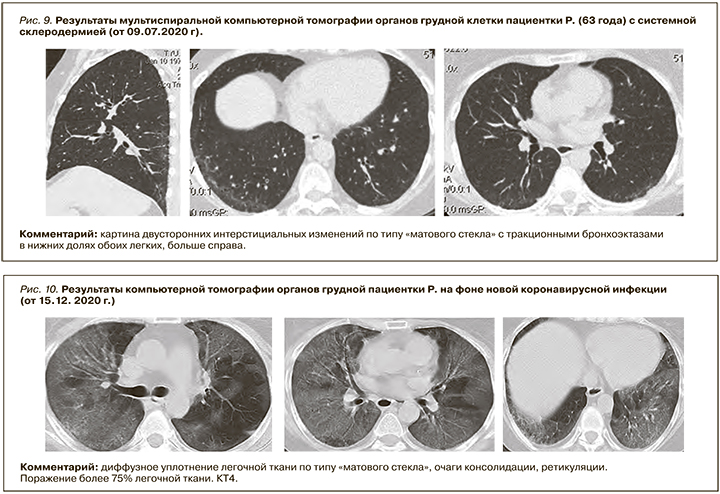
Перенесшие COVID-19 пациенты с интерстициальным поражением легких в рамках СЗСТ имеют высокий риск осложненного течения лонг-ковида (прогрессирующий легочный фиброз, дыхательная недостаточность) и требуют динамического наблюдения и интенсификации лечения [24, 25]. Отметим, что наблюдается сходство клинических признаков интерстициального поражения легких (кашель, одышка, крепитация) и КТ-признаков со стороны легких (матовое стекло, ретикуляция, тракционные бронхоэктазы) у пациентов с СЗСТ и новой коронавирусной инфекцией (табл. 2, рис. 9, 10). Общими клиническими и физикальными признаками являются сухой кашель, одышка на вдохе, крепитация при аускультации, КТ-признаками – двустороннее полисегментарное поражение интерстиция и сосудов легких (табл. 3).

Показания для госпитализации в ревматологический стационар у пациентов с ИВРЗ после перенесенной новой коронавирусной инфекции включают высокую клинико-лабораторную активность основного заболевания, увеличение числа пораженных органов и систем, отсутствие эффекта от проводимой терапии на амбулаторном этапе [26].
Возможные исходы лонг-ковида у пациентов с ревматическими заболеваниями
Вероятными исходами лонг-ковида при ревматических заболеваниях являются полная обратная динамика суставного синдрома у пациентов с поствирусными артритами, дебют либо обострение ИВРЗ, а также ухудшение течения коморбидной патологии (гипертонической болезни, ИБС, ХСН, СД, ХБП) [27].
Рекомендации по ведению пациентов с ревматологическими проявлениями постковидного синдрома
Терапия постковидного синдрома у пациентов с ревматологическими проявлениями должна носить персонифицированный характер и определяться особенностями этого состояния у конкретного пациента – выраженностью висцеральной патологии (дыхательная и сердечная недостаточность, ХБП и др.), наличием признаков системной воспалительной реакции, болей в суставах и мышцах, выраженной утомляемости, проблем в интеллектуально-мнестической и психоэмоциональной сферах [28].
Пациентам с постковидным артритом требуется назначение НПВП, коротких курсов ГКС (преднизолон ≤10 мг/сут в течение 5–7 дней), а при наличии депрессивных расстройств – антидепрессантов и антиконвульсантов [29, 30].
С учетом обострения течения ИВРЗ в посковидном периоде необходимо возобновление иммуносупрессивной терапии при легком течении новой коронавирусной инфекции через 1 нед после отрицательных мазков на SARS-CoV2, при среднем варианте течения – через 2–3 нед, а при тяжелом течении – через 4 нед.
Для пациентов с ревматоидным артритом, развившимся после новой коронавирусной инфекции, необходимо назначение базисной терапии в виде метотрексата (15–25 мг/нед), либо лефлуномида (20 мг/сут), либо сульфасалазина (2000 мг/сут).
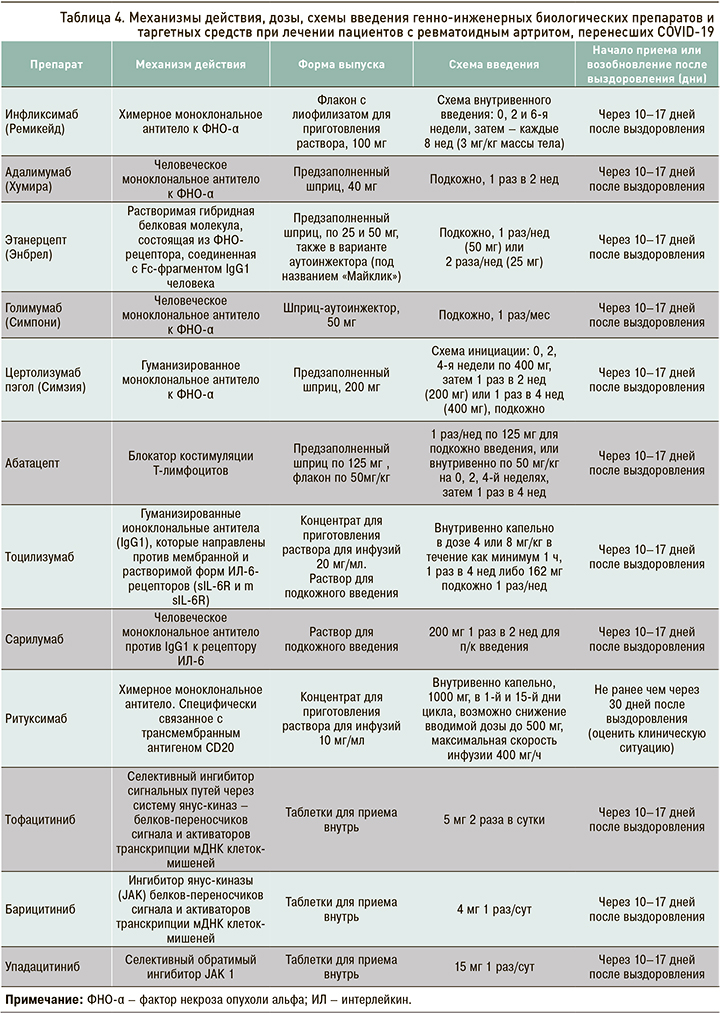
При средней и высокой активности заболевания, несмотря на прием синтетических базисных противоревматических средств, может быть начато применение генно-инженерных биологических препаратов (ГИБП) или таргетных средств (табл. 4).
При наличии воспалительного полиартрита показано применение ГКС (преднизолон ≤10 мг сут) или НПВП [31].
При сохраняющейся активности болезни показано назначение ГИБП – тоцилизумаба (внутривенно капельно в дозе 4 или 8 мг/кг 1 раз в 4 нед либо 162 мг п/к 1 раз в неделю через 10–17 дней после выздоровления) либо ритуксимаба (внутривенно капельно, 1000 мг, в 1-й и 15-й дни цикла, не ранее чем через 30 дней после выздоровления, с учетом клинической ситуации) [28].
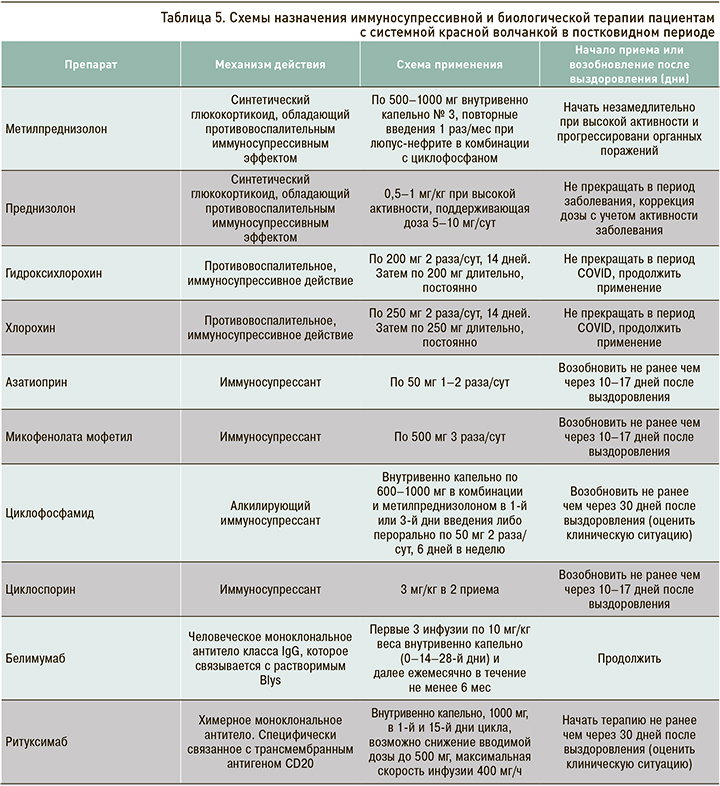
Пациентам с впервые диагностированной СКВ следует назначать аминохинолиновые препараты в полной дозировке: гидроксихлорохин (200 мг 2 раза в сутки) или хлорохин (250 мг 2 раза/сут) в течение 10–14 дней, затем по 1 таблетке длительно, постоянно. У беременных с СКВ использование гидроксихлорохина (200 мг/сут) и хлорохина (250 мг/сут) следует продолжить. Терапия ГКС и иммуносупрессантами проводится в полной дозе с учетом активности и органного поражения. По показаниям может быть начато применение белимумаба (табл. 5) [29].
Следует отметить, что терапия дексаметазоном в дозе 16–32 мг/сут, назначаемая в период лечения новой коронавирусной инфекции, может «смазывать» картину активности ИВРЗ. С учетом этой ситуации требуется обязательное назначение иммуносупрессивной терапии после выздоровления (с учетом представленных выше рекомендаций) и регулярное динамическое наблюдение за такими пациентами для коррекции лечения [32].
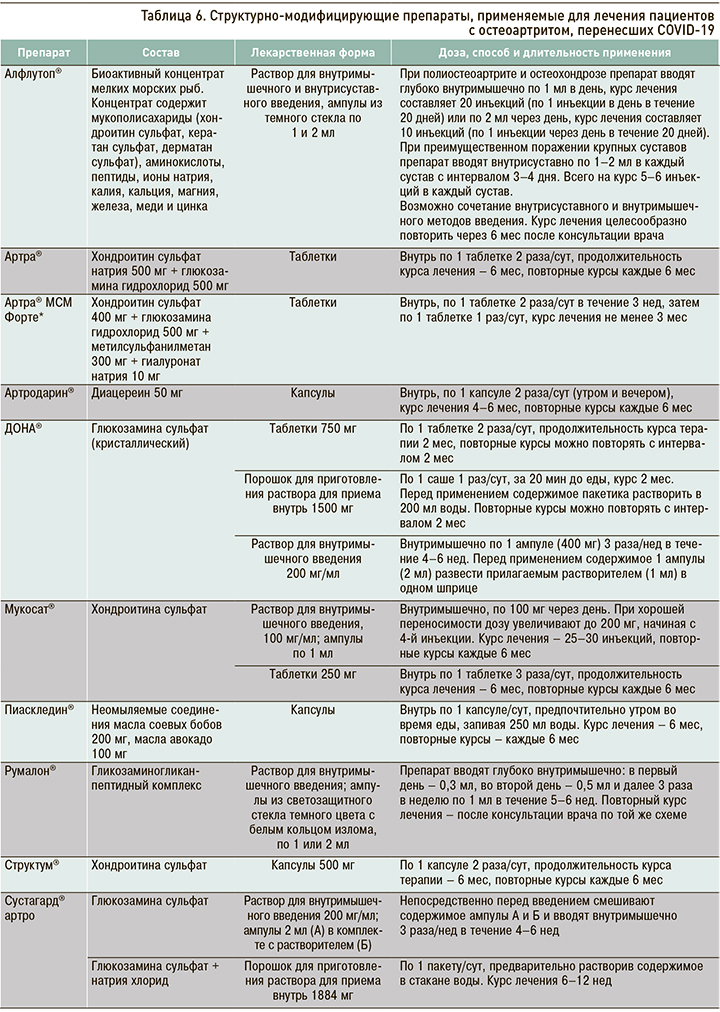
Пациентам с ранним ОА при болевом синдроме показано местное назначение НПВП в форме мазей или гелей (Вольтарен Эмульгель, гель Долобене, крем Долгит, гель Ибупрофен, гель Диклак и др.) или прием парацетамола в дозе до 3 г/сут. Особое место в схеме медикаментозного лечения коморбидных пациентов с ОА в условиях пандемии занимают симптоматические медленно действующие препараты (SYSADOA). С учетом особенностей патогенеза COVID-19 в этой группе лекарственных средств предпочтение следует отдавать парентеральным препаратам, не усиливающим протромбогенные свойства крови. У больных с воспалительным фенотипом ОА, развившегося после новой коронавирусной инфекции, препаратом выбора может служить Алфлутоп, который характеризуется ранним анальгетическим эффектом (на второй неделе терапии), нарастающим эффектом в течение 3 мес по окончании курсового лечения и длительным периодом последействия – до 4–6 мес. Важным практическим преимуществом Алфлутопа следует считать отсутствие влияния на параметры гемокоагуляции и снижение потребности в НПВП, вследствие чего уменьшается риск тромботических осложнений, характерных для лонг-ковида. Короткий курс введения Алфлутопа (10 внутримышечных инъекций по 2,0 мл через день) способствует удобству его применения и повышению приверженности к терапии пациентов с ОА [4].
Применение SYSADOA может быть продолжено в период заболевания COVID-19 и в постковидном периоде (табл. 6) [33]. В настоящее время отсутствуют данные об эффективности внутрисуставного введения гиалуроновой кислоты у пациентов с ранним ОА, развившимся после новой коронавирусной инфекции.

При выраженном болевом синдроме и наличии реактивного синовита показано стартовое назначение НПВП (диклофенак 100 мг/сут, ацеклофенак 100–200 мг/сут, кетопрофен 100 мг 2 раза/сут, напроксен 275 мг 2–3 раза/сут, нимесулид 200 мг/сут, мелоксикам 7,5–15 мг/сут, целекоксиб 200 мг/сут, эторикоксиб 60 мг/сут) с учетом гастроинтестинальных и кардиоваскулярных рисков.
Среди местных НПВП в качестве эффективной альтернативы системным формам обезболивающих средств, которая позволяет снизить лекарственную нагрузку или полностью отказаться от НПВП системного действия, может рассматриваться препарат Вольтарен Эмульгель (1 и 2% диклофенака диэтиламина) [39, 40]. При низком уровне системной абсорбции (меньше 6%) применение препарата Вольтарен Эмульгель позволяет достигать высоких терапевтических концентраций активного компонента в очаге воспаления, уменьшать интенсивность боли на срок до 12 ч после однократного применения и ускорять восстановительные процессы в тканях [41–44].
Таким образом, в настоящее время существуют значимые особенности течения лонг-ковида у пациентов ревматологического профиля, характеризующиеся формированием НДА, связанного с развитием ПВА, который, однако, может выступать дебютом системных аутоиммунных заболеваний. Следовательно, пациенты с постковидным НДА должны быть направлены на консультацию к ревматологу с целью расширения дифференциально-диагностического поиска для постановки критериального диагноза и назначения патогенетической терапии. У пациентов с уже существующими ревматологическими заболеваниями в период лонг-ковида нередко наблюдается обострение их течения, требующее коррекции терапии и интенсификации лечения с применением высокодозных схем ГКС, цитостатиков и ГИБП.



