ВВЕДЕНИЕ
Системная красная волчанка (СКВ) - системное аутоиммунное заболевание неизвестной этиологии, характеризующееся гиперпродукцией органонеспецифических аутоантител к различным компонентам клеточного ядра и цитоплазмы с развитием иммуновоспалительного повреждения внутренних органов [1, 2]. Глобальная распространенность СКВ, по различным данным, составляет от 4 до 250 случаев на 100 тыс. взрослого населения, в России – 9,0–20,6 случаев на 100 тыс. населения в зависимости от региона, а заболеваемость - 0,3–1,6 на 100 тыс. населения [2, 3]. Медико-социальная значимость СКВ обусловлена рядом факторов, к которым относится поражение лиц молодого, трудоспособного возраста, чаще женщин, рецидивирующим и неуклонно прогрессирующим течением с поражением жизненно важных органов, снижением качества жизни, высокой инвалидизацией пациентов, а также частым развитием побочных эффектов проводимой терапии, особенно при применении глюкокортикоидов (сахарный диабет, артериальная гипертензия, интеркуррентные инфекции, остеопороз и др.) [2].
В связи с этим особую актуальность приобретает ранняя диагностика СКВ, так как своевременно назначенная (попадание в «окно возможности») патогенетическая терапия является важным фактором достижения ремиссии заболевания. Согласно точке зрения ряда авторов, дебюту СКВ предшествует доклиническая фаза, характеризующаяся нарушениями иммунологической толерантности с экспрессией аутоантител, признаками иммунной дисрегуляции и неспецифическими клиническими симптомами (лихорадкой, потерей массы тела, утомляемостью, артралгией, миалгией), которая в течение короткого периода потенциально может трансформироваться в раннюю стадию заболевания [4].
ФАКТОРЫ РИСКА И ПАТОГЕНЕЗ
В основе гетерогенности СКВ лежит широкий спектр клинических проявлений и иммунологических нарушений, из-за чего у пациентов может наблюдаться любая комбинация симптомов, претерпевающих динамику в течение болезни и проводимой терапии [5, 6]. К факторам риска заболевания относят генетическую предрасположенность (у кровных родственников пациентов с СКВ риск развития заболевания в 17 раз выше, чем в популяции); полиморфизм генов HLA II класса (наличие ассоциации аллелей HLA-DR2 и HLA-DR3); врожденный дефицит компонентов комплемента C4a, C4b, C1q и др.; повышенный синтез интерферона (ИФН) I типа дендритными клетками; нарушение клиренса апоптотических клеток, что приводит к образованию циркулирующих иммунных комплексов, которые впоследствии откладываются в различных органах и тканях, вызывая их иммунное повреждение; периоды быстрых гормональных изменений (беременность, послеродовой период, стимуляция овуляции во время экстракорпорального оплодотворения, применение эстрогенов и др.); вирусные инфекции, стресс, факторы внешней среды (в особенности ультрафиолетовое облучение), курение, прием некоторых лекарственных препаратов (противосудорожных, противотуберкулезных, антигипертензивных, антибиотиков и др.) [7–12]. Тем не менее окончательных данных, которые бы количественно описывали вклад данных факторов риска в развитие заболевания, на сегодняшний день не представлено.
В основе патогенеза СКВ лежит образование антител к ядрам и отдельным компонентам собственных клеток с формированием циркулирующих иммунных комплексов, которые откладываются в базальной мембране кожи, клубочках почек и других органах, вызывая иммуновоспалительное повреждение тканей [13, 14]. В последние годы большое значение придается изучению гиперпродукции ИФН I типа («ИФН I типа генный автограф») как одного из ведущих элементов патогенеза не только СКВ, но и ряда других иммуновоспалительных ревматических заболеваний. В частности, установлена ассоциация гиперпродукции ИФН I типа с развитием СКВ в группах риска [10, 12].
Сложность верификации СКВ заключается в фенотипическом разнообразии клинической картины, а также учащении случаев стертых и атипичных форм заболевания. С учетом этого одну из ключевых ролей в диагностике СКВ приобретают лабораторные маркеры – антинуклеарные антитела, включающие в первую очередь антитела к двуспиральной ДНК (анти-дсДНК), антигену Смита (анти-Sm), рибонуклеопротеину (анти-РНП), анти-Ro/SSA- и анти-La/SSB-антитела, а также антитела к фосфолипидам (волчаночный антикоагулянт), кардиолипину (IgM, IgG) и ß2-гликопротеиду 1 [1, 4, 15].
ДИАГНОСТИКА
Диагноз СКВ устанавливается на основании клинико-лабораторных данных в соответствии с одними из критериев SLICC 2012 г./EULAR/ACR 2019 г. Чаще в клинической практике используются классификационные критерии Клиники международного сотрудничества по системной красной волчанке (SLICC 2012 г. – The Systemic Lupus International Collaborating Clinics; табл. 1). Диагноз СКВ ставится при наличии 4 критериев, один из которых должен быть клиническим и один – иммунологическим [1, 15–17].

Классификационные критерии СКВ постоянно совершенствуются, последние из них были опубликованы European League Against Rheumatism (EULAR) и American College of Rheumatology (ACR) в 2019 г. (EULAR/ACR 2019 г.). Главным отличием представленных критериев является выявление антинуклеарного фактора (АНФ) в титре ≥1:80 методом непрямой иммунофлюоресценции c использованием эпителиальных клеток человека HEp2 (human epithelial cells type 2) в качестве «входного» критерия, без наличия которого диагноз СКВ маловероятен. Эти критерии сфокусированы на увеличении их значимости (чувствительность – 89%, специфичность – 97%) в отношении ранней диагностики заболевания [2, 15, 17–19]. В последней версии рекомендаций по диагностике СКВ в качестве основного критерия предложено также учитывать часто встречающуюся в клинической практике «необъяснимую лихорадку», которая более типична для ранней стадии СКВ, чем для других заболеваний [20].
Следует подчеркнуть, что положительные результаты определения АНФ имеют не только диагностическую и прогностическую значимость, но также применяются для оценки активности СКВ и характеристики ее клинико-иммунологических субтипов [21]. Однако АНФ может встречаться и при других системных заболеваниях соединительной ткани, аутоиммунных неревматических болезнях (аутоиммунном тиреоидите, вирусном гепатите, рассеянном склерозе), на фоне применения некоторых лекарственных средств (антиконвульсантов, противотуберкулезных препаратов, ингибиторов факторов некроза опухоли альфа и др.). Невысокие титры АНФ могут обнаруживаться и у здоровых людей, при этом частота его выявления увеличивается среди лиц старшей возрастной группы [18, 22]. Важную роль играет титр обнаруживаемого АНФ: в здоровой популяции титр АНФ ≥1:80 встречается в 20%, а АНФ ≥1:160 – лишь в 5%. В связи с этим ряд авторов считает целесообразным увеличить диагностический титр АНФ с ≥1:80 до ≥1:160 для повышения его значимости как основного входящего критерия СКВ [17, 19, 23, 24].
Для правильной интерпретации результата АНФ необходимо оценивать не только выявляемый титр антител, но также характер его свечения и наличие так называемых защитных антител – anti-DFS70 [25, 26]. Положительный результат выявления АНФ может быть связан с anti-DFS70-аутонтителами – особым видом антинуклеарных антител с характерным мелкокрапчатым свечением (dense fine-speckled) [27]. Окончательных данных в отношении того, являются ли аутоантитела против DFS70 дополнительным «антимаркером» системных аутоиммунных ревматических заболеваний или биомаркером наличия какой-либо другой аутоиммунной патологии, на сегодняшний день нет, хотя, по данным ряда авторов, они часто обнаруживаются при синдроме хронической усталости, миалгическом энцефаломиелите, атопическом дерматите, реже при тиреоидите Хошимото, очаговой алопеции, саркоидозе, паранеопластических процессах и др. [25, 27–29]. Согласно Ochs R.L. et al. (2016), по крайней мере 5–10% здоровых людей, у которых не развиваются ревматические заболевания при контролируемом наблюдении, могут быть носителями анти-DFS70 [28]. В свою очередь, по данным Gundin S. et al. (2016), ни у одного из 181 пациента, находившегося под динамическим наблюдением в течение 10 лет без клинических симптомов, но с положительным результатом АНФ только за счет свечения анти-DFS70-аутоантител и без обнаружения других антиядерных антител, системное заболевание соединительной ткани (СЗСТ) не развилось [26]. Таким образом, выявление моноспецифических антител к DFS70 может рассматриваться как потенциальный лабораторный критерий для исключения диагноза СКВ и других СЗСТ у АНФ-позитивных лиц [26]. Недавно Moroni L. et al. (2020) показали, что тест на антитела против DFS70 способен помочь избежать ненужных диагностических процедур у АНФ-позитивных пациентов с неспецифическими признаками системного аутоиммунного заболевания и свести к минимуму использование ресурсов здравоохранения [30].
В качестве дополнительного теста для верификации диагноза «неполной» (вероятной) СКВ можно использовать тест волчаночной полоски (ТВП) – обнаружение иммунореактантов, включающих IgA, IgM, IgG, и компонентов комплемента С3- и С1q методом прямой иммунофлюоресценции в биоптате неповрежденного участка кожи в области верхней трети плеча. Тест определяется положительным у 60,7% больных с достоверной и у 47% с вероятной СКВ, при этом он ассоциирован с активностью заболевания [31,32]. ТВП может служить дополнительным диагностическим инструментом в группе вероятной СКВ, особенно при выявлении иммунореактантов IgM и IgG в характерных для этого заболевания сочетаниях (IgM + IgG и IgM + IgG + C3) [31, 32].
ДОКЛИНИЧЕСКАЯ СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА
Известно, что некоторые лабораторные маркеры могут обнаруживаться за многие месяцы и годы до развития типичных клинических симптомов СКВ, включая антитела, не входящие в классификационные критерии SLICC 2012 г. [33–35, 39]. Доклинический бессимптомный период характеризуется появлением АНФ, общего для аутоимунных заболеваний, а в последующем – высокоспецифичных для СКВ антител, таких как анти-дсДНК и анти-Sm [35–37]. По данным ряда авторов, ретроспективный анализ показателей 132 больных с СКВ свидетельствовал о том, что повышенный титр АНФ (1:120 и выше) определялся за 10 лет (в среднем за 4 года) до верификации диагноза у 78% пациентов с СКВ, антифосфолипидные антитела – за 7,6 года (в среднем за 3 года) у 18%, анти-дсДНК – за 2,5 года у 55%, анти-Sm, анти-U1RNP – за несколько месяцев до диагностированной болезни [33] (рис. 1).
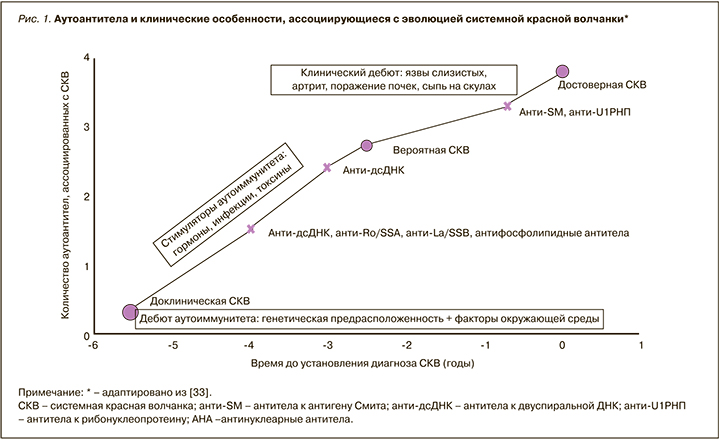
«НЕПОЛНАЯ» СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА
При наличии нескольких критериев СКВ (клинических и иммунологических), но отсутствии достоверных 4 критериев ACR 1997 г. или SLICC 2012 г. диагностируется «неполная» (вероятная) СКВ [4, 31, 36, 42]. В настоящее время нет общепризнанного термина, определяющего это состояние; в научной литературе можно встретить термины «неполная», «латентная», «вероятная», «потенциальная», «ранняя» СКВ. Как уже было отмечено, для постановки достоверного диагноза необходимо наличие 4 критериев, из которых минимум один должен быть клиническим и один иммунологическим [1]. «Неполная» СКВ иногда считается легкой формой заболевания и часто описывается как предшественник клинически очерченного варианта СКВ [36]. Согласно имеющимся данным, «неполная» СКВ в 10–50% прогрессирует до достоверной СКВ, обычно в течение 5 лет после начала заболевания [37–39].
Вместе с тем данные реальной клинической практики указывают на то, что большое количество пациентов без явно выраженных клинических проявлений могут многие месяцы и годы оставаться без диагноза и лечения [4, 36]. Так, согласно результатам, полученным на основании анализа многонациональной когорты LUMINA (631 пациент), только у 15% исследованных имело место типичное начало СКВ с наличием достаточных критериев для постановки диагноза; у остальных средняя длительность развития клинических симптомов варьировала от 39 до 14 мес [40].
У больных СКВ наблюдается системное поражение органов и тканей с многообразием клинической картины, что обусловлено широким спектром продуцируемых органонеспецифических антител. Это и различные кожные поражения (характерная «бабочка» в области скуловых дуг и крыльев носа, дискоидные высыпания, многоформная экссудативная эритема, фотодерматит и другие кожные эквиваленты), часто артрит, язвы на слизистой полости рта, серозит с поражением органов дыхания (плеврит) и сердца (перикардит), асептический эндокардит Либмана–Сакса, поражение почек и центральной нервной системы, гематологические (анемия, лейко- и тромбоцитопения) и иммунологические нарушения (высокие титры АНФ, анти-дсДНК, анти-Sm, антител к кардиолипину и др.), входящих в критерии SLICC 2012 г. При этом болезнь может дебютировать только одним или двумя признаками, что существенно затрудняет ее диагностику на ранних этапах.
Среди первых клинических проявлений, наиболее часто встречающихся при «неполной» СКВ, большинство авторов отмечает острое поражение кожи, лихорадку, фотосенсибилизацию, артралгии, образование язв на слизистой оболочке полости рта, изменения в анализах крови (цитопения, появление антител к ДНК и кардиолипину, гипокомплементемию) [31, 36, 37, 39, 41, 42].
Согласно данным испанского регистра RELESSER, при анализе данных 345 пациентов с «неполной» СКВ наиболее частыми клиническими проявлениями заболевания были артралгии/артрит (44,2%), различные гематологические нарушения (43,7%), фоточувствительность (20,5%), поражение кожи (17,7%), синдром Рейно (19,1%) [37]. Наряду с этим отмечались и лабораторные маркеры: положительный АНФ (94,7% случаев), диагностические титры анти-дсДНК, анти-Sm и антифосфолипидных антител (55,1%).
«Неполная» СКВ часто описывается как легкий вариант СКВ с кожно-слизистыми проявлениями [4, 31, 39]. Вместе с тем имеются наблюдения и о тяжелом течении с необратимым повреждением жизненно важных органов. Так, в исследовании Aberle T. et al. (2017) у 3397 пациентов с клиническим диагнозом СКВ было проанализировано (по данным медицинских карт) соответствие установленного диагноза критериям ACR и SLICC [43]. Оказалось, что у 9% пациентов диагноз не соответствовал ни одному из них, однако у больных уже развились повреждения жизненно важных органов: среди них в 6% случаев был диагностирован серозит, в 5% – поражение почек и в 1% – поражение нервной системы. При этом большинство из этих «неклассифицируемых» пациентов получали гидроксихлорохин и/или глюкокортикоиды, а 10% нуждались в назначении другой иммуносупрессивной терапии [43]. Нам представляется важным, что в последней версии рекомендаций по диагностике СКВ в качестве одного из основных критериев предложено учитывать часто встречающуюся в клинической практике «необъяснимую лихорадку», которая более характерна для ранней стадии СКВ, чем для других заболеваний [20].
ПРЕДИКТОРЫ ПЕРЕХОДА «НЕПОЛНОЙ» СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКИ В ДОСТОВЕРНУЮ
Интересные данные были представлены Al Daabil M. et al. (2014), которые провели ретроспективный анализ (за 20-летний период) медицинской документации 264 пациентов с «неполной» волчанкой [39]. Согласно полученным результатам, достоверная СКВ развилась у 56 (21%) из них, при этом симптомами-предикторами были язвы на слизистой полости рта, стойкая протеинурия или изменения мочевого осадка, а также наличие анти-дсДНК. Другие авторы среди предикторов трансформации выделяют также женский пол, возраст моложе 40 лет, сыпь на коже в области скуловых дуг и крыльев носа («бабочка»), наличие антител к кардиолипину [38, 39, 44, 45].
Одним из лабораторных маркеров трансформации является повышение уровня экспрессии генов ИФН, коррелирующего с образованием антител класса IgG к двуспиральной ДНК, Ro/SSA, La/SSB и РНП [46]. Доказано также, что высокий уровень циркулирующего ИФН альфа может выявляться у пациентов до постановки диагноза СКВ, у родственников первой линии, а также ассоциируется с развитием заболевания в группах риска [10, 46, 47]. Поскольку гиперпродукция ИНФ I типа не всегда коррелирует с активностью СКВ и риском развития обострений, обсуждается вероятность того, что ИНФ I типа может играть важную патогенетическую роль не в развернутой стадии, а в дебюте заболевания, для которого характерен иной цитокиновый профиль [46, 47].
Для улучшения диагностики Lambers W.M. et al. (2019) предложили критерии «неполной» СКВ, в которых входным критерием служит АНФ в титре ≥1:80 в сочетании с одним и более клиническим и/ или иммунологическим критерием (табл. 2) [41].

ТЕРАПЕВТИЧЕСКАЯ ТАКТИКА ПРИ «НЕПОЛНОЙ» СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКЕ
Все пациенты со «случайно» выявленным положительным результатом АНФ в титре ≥1:160 и неспецифическими симптомами (лихорадкой, артралгиями, миалгиями, алопецией, необъяснимой усталостью и др.) должны быть направлены на консультацию к ревматологу, который оценивает анамнестические данные, наличие и выраженность клинических симптомов, результаты лабораторных тестов (общий анализ крови и мочи, C-реактивный белок, титр антител к экстрагируемым ядерным антигенам, скрининг на анти-дсДНК и антифосфолипидные антитела, определение циркулирующих иммунных комплексов, C3-, C4-компонентов комплемента и др.) и инструментальных исследований. С целью проведения дифференциальной диагностики рекомендовано выполнение ТВП, который может служить дополнительным диагностическим методом у пациентов с «неполной» волчанкой, особенно при наличии в биоптатах кожи отложений IgG и/или IgM, а также при выявлении более одного иммунореактанта.
Пациентам должны быть предоставлены рекомендации по модификации факторов риска, а также динамическому наблюдению. Одним из вариантов медикаментозной терапии в этот период является назначение гидроксихлорохина, который продемонстрировал свою эффективность при различных вариантах СКВ в отношении поражений кожи и суставов, а также легкий иммуносупрессивный и антитромботический эффект [18, 48, 49]. Блокируя toll-подобные рецепторы 7 и 9 типа плазмоцитоидных дендритных клеток, гидроксихлорохин ингибирует выработку ИФН альфа, который играет решающую роль в патогенезе СКВ [50]. Препарат обладает хорошей переносимостью и при отсутствии абсолютных противопоказаний назначается в дозе 200–400 мг/сут в соответствии с современными рекомендациями EULAR/ACR 2019 г. [2, 16]. Гидроксихлорохин разрешен к применению при беременности и грудном вскармливании. В связи с возможным риском развития ретинопатии пациентам рекомендуется ежегодное офтальмологическое обследование, однако это осложнение встречается достаточно редко (1:5000) [16].
В Северо-Западном государственном медицинском университете им. И.И. Мечникова в 2013–2019 гг. было проведено исследование, которое включало 38 пациентов с «неполной» СКВ [51]. После установления диагноза «неполной» СКВ при отсутствии противопоказаний всем пациентам был назначен гидроксихлорохин (Плаквенил) в дозе 400 мг/сут с учетом действующих клинических рекомендаций [2, 48–50, 52]. При контрольном обследовании через 6 мес установлено, что у 37% пациентов наблюдалась регрессия клинических симптомов и нормализация лабораторных показателей, у 26% сохранялись положительные иммунологические тесты без каких-либо клинических проявлений, в то время как у 21% пациентов произошла трансформация «неполной» в достоверную СКВ, а у 16% были диагностированы другие заболевания (ревматоидный артрит, болезнь Шегрена и др.).
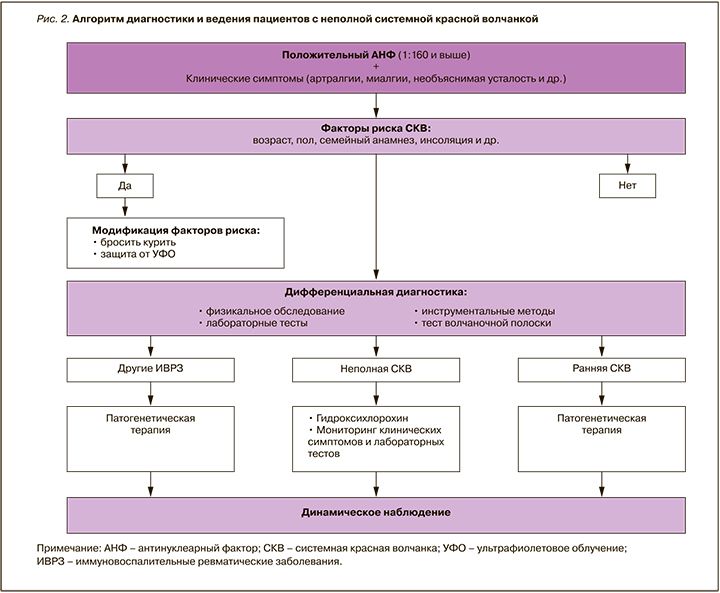
На рисунке 2 представлен разработанный нами алгоритм диагностики и ведения пациентов с «неполной» СКВ, который был апробирован в реальной клинической практике и показал свою информативность. В частности, мониторинг состояния пациентов позволяет определить тех из них, у которых существует высокая вероятность «перехода» «неполной» СКВ в достоверную (развитие артритов, кожных симптомов, нарастание титра АНФ, появление анти-дсДНК, анти-Sm и др.). При этом важно еще раз подчеркнуть, что «неполная» СКВ потенциально может быть «окном возможности» для своевременных терапевтических интервенций с целью уменьшения бремени болезни и, возможно, предотвращения ее трансформации в развернутую волчанку.


