ВВЕДЕНИЕ
В 2020 г. через несколько месяцев после начала пандемии SARS-CoV-2 начали появляться сообщения о длительной персистенции разнообразных симптомов у пациентов после перенесенной коронавирусной инфекции. Термин «долгий COVID» (Long-COVID) был введен пациентами и принят медицинским сообществом. Elisa Perego из Ломбардии весной 2020 г. была первой, кто использовал этот термин в «Твиттере» для описания своих симптомов после перенесенной коронавирусной инфекции. В дальнейшем был опубликован целый ряд проспективных и ретроспективных исследований, которые подтвердили не только персистирование многочисленных симптомов после COVID- 19, но и высокие риски дебюта и прогрессирования сердечно-сосудистой патологии.
В 2021 г. были опубликованы результаты интересного наблюдательного ретроспективного исследования, проведенного в Великобритании. Авторы проанализировали состояние здоровья почти 48 тыс. человек, которые были госпитализированы по поводу COVID-19 в течение 140 дней после выписки из стационара (основная группа). Контрольную группу составили пациенты, госпитализированные в этот же период по другим причинам. Обе группы исследуемых были сопоставимы по демографическим и клиническим характеристикам. За время наблюдения в группе реконвалесцентов COVID- 19 29,4% пациентов были госпитализированы снова, а 12,3% умерли. Риск повторной госпитализации и смерти в течение года после COVID-19 был в 3,5 и 7,7 раз выше, чем в контрольной группе. Согласно подсчетам, на 1000 человек, выписанных из больницы после COVID-19, в течение года диагностируется 66 новых случаев тяжелых осложнений со стороны сердечно-сосудистой системы (острый инфаркт миокарда, инсульт, тяжелая сердечная недостаточность и др.). Среди пациентов после перенесенной коронавирусной инфекции в 3 раза чаще развиваются новые случаи МАСЕ (Major Adverse Cardiovascular Events – сердечная недостаточность, инфаркт миокарда, инсульт, аритмия) в сравнении с контрольной группой [1].
В феврале 2022 г. было опубликовано ретроспективное исследование с использованием национальной базы данных здравоохранения США (Министерство по делам ветеранов). В нем анализу подверглась когорта реконвалесцентов COVID-19 (n=153 760), а также две контрольные когорты – современная (n=5 637 647) и историческая (n= 5 859 411) – для оценки 12-месячных рисков заранее определенных сердечно-сосудистых исходов. Было показано, что после первых 30 дней после заражения люди с COVID-19 подвергаются повышенному риску возникновения сердечно-сосудистых заболеваний (ССЗ), включая нарушения мозгового кровообращения, нарушения ритма, ишемическую и неишемическую болезнь сердца, перикардит, миокардит, сердечную недостаточность и тромбоэмболические заболевания. Эти риски выявлялись даже у пациентов, которые не были госпитализированы во время острой фазы инфекции, и увеличивались в зависимости от условий оказания медицинской помощи во время острой фазы (не госпитализированные, госпитализированные и госпитализированные в отделение интенсивной терапии). Результаты исследования свидетельствуют о том, что риск и бремя ССЗ в течение 1 года у выживших после острого COVID-19 являются значительными. При оказании помощи тем, кто пережил острый эпизод COVID-19, необходимо уделять большое внимание сердечно-сосудистому здоровью и кардиоваскулярным заболеваниям [2].
Исследователями обсуждаются следующие патофизиологические механизмы поражения сердечно-сосудистой системы после перенесенной коронавирусной инфекции COVID-19:
- дисрегуляция иммунной системы (хроническое воспаление, аутоиммунные реакции);
- дисрегуляция ренин-ангиотензин-альдостероновой (РААС), калликреин-кининовой (ККС), симпатоадреналовой (САС) систем;
- сосудистое повреждение, эндотелиопатия;
- гиперкоагуляция с тромбообразованием в микрососудах.
ПРЕДПОЛАГАЕМЫЕ МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ ЭНДОТЕЛИЯ ПРИ COVID-19
Прямое повреждение энтотелиоцитов
SARS-CoV-2 обладает высокой активностью в отношении богатых ангиотензинпревращающим ферментом 2 (АПФ2) эндотелиальных клеток сосудов; это может быть одной из причин большей вероятности тяжелых осложнений, обусловленных повреждением эндотелия, у пациентов с артериальной гипертензией и другими ССЗ, диабетом, у курильщиков и лиц с ожирением, экспрессирующих высокие уровни АПФ2. С проникновением вируса в эндотелиальные клетки связано также прямое повреждение эндотелиоцитов и апоптоз. Отдаленные последствия этого повреждения могут реализовываться в постковидном периоде [3].
Дисбаланс ренин-ангиотензин-альдостероновой и калликреин-кининовой систем
АПФ2 не только является рецептором для проникновения вируса, но и важным компонентом РААС. Потеря АПФ2 приводит к дисбалансу системы РААС и ККС. АПФ2 не может катализировать превращение ангиотензина II (АII) в ангиотензин 1-7, что приводит к накоплению ангиотензина II и патологическому повреждению. AII служит аутокринным вазоконстриктором, его избыток активирует сигнальный путь PI3K-Akt через рецептор AT1, регулируя активацию эндотелия и выработку интерлейкина 6 (ИЛ-6) и активных форм кислорода (АФК). Кроме того, высокие концентрации AII вызывают гибель эндотелиальных клеток и дегенерацию сосудов, разрушая связь между эндотелиоцитами и перицитами [4–7].
ККС регулирует многие физиологические процессы, такие как воспаление, свертывание крови, расширение сосудов и кровяное давление. Гиперактивация ККС вызывает эндотелиальную дисфункцию и в дальнейшем приводит к адгезии лейкоцитов и сосудистому повреждению [8, 9].
Повреждение эндотелия, опосредованное окислительным стрессом и образованием активных форм кислорода
Окислительный стресс определяется как состояние чрезмерного образования оксидантов и/или уменьшения количества антиоксидантов. В эндотелиальной дисфункции, опосредованной окислительным стрессом, может участвовать ряд механизмов, но преобладающий механизм, вероятно, связан с уменьшением биодоступности оксида азота (NO). Последнее, как считается, обусловлено снижением экспрессии эндотелиальной синтазы оксида азота (eNOS), отсутствием субстратов для eNOS, инактивацией eNOS и ускоренной деградацией NO [10]. Избыточная продукция активных форм кислорода может вызывать окисление макромолекул, приводя к апоптозу клеток, индукции молекул адгезии и провоспалительных цитокинов, которые могут повышать проницаемость сосудов и способствовать адгезии лейкоцитов [11, 12]. Результаты недавнего исследования позволяют предположить, что окислительный стресс ассоциирован с тромботическими осложнениями у пациентов с COVID-19 (рис. 1) [13].
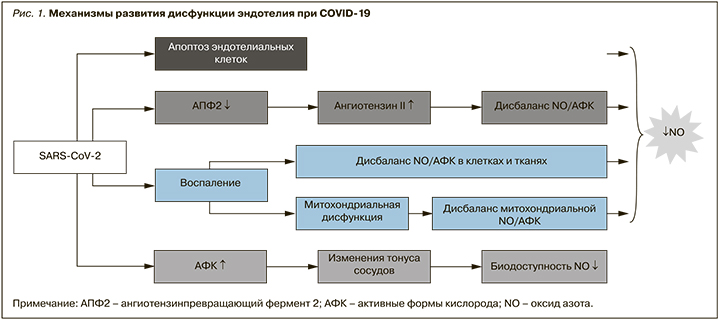
ИЛ-6-опосредованная активация и дисфункция эндотелия
Повышенный уровень циркулирующего ИЛ-6 связан с патогенезом COVID-19. Этот цитокин продуцируется несколькими типами клеток (моноцитами/макрофагами, адипоцитами и эндотелиоцитами) и повышается во время воспалительных состояний.
ИЛ-6 активирует молекулы адгезии (VCAM-1, ICAM-1, селектин) и моноцитарный хемотаксический белок 1 (MCP-1), усиливая адгезию лейкоцитов и экстравазацию в сосудистую стенку, снижает биодоступность NO и увеличивает окислительный стресс. Это приводит к увеличению проницаемости эндотелия, наряду с рекрутингом и инфильтрацией сосудистой стенки циркулирующими лейкоцитами [14].
Активация и дисфункция эндотелия вследствие активации комплемента
Комплемент является неотъемлемой частью врожденного иммунитета и служит первой линией защиты от микроорганизмов. Активация комплемента была подтверждена в патогенезе COVID-19, при этом чрезмерная его активация приводит к острому и хроническому воспалению, эндотелиальной дисфункции и гиперкоагуляции [15, 16].
Роль С-реактивного белка в активации и дисфункции эндотелия
С-реактивный белок (СРБ) – основной белок острой фазы COVID-19, и повышение его уровня коррелирует с плохим прогнозом заболевания [17, 18]. Недавние исследования продемонстрировали, что СРБ играет важную роль в воспалении и повреждении эндотелия in vivo и in vitro [19]. Он эффективно подавляет транскрипцию eNOS в эндотелиоцитах и дестабилизирует мРНК eNOS, что влечет за собой эндотелиальную дисфункцию [20]. Было установлено, что СРБ усиливает регуляцию молекул адгезии, способствует апоптозу эндотелиальных клеток и ингибирует ангиогенез, одновременно усиливая CD14-индуцированную активацию эндотелия. СРБ также мощно усиливает регуляцию NF-κB, ключевого ядерного фактора, который может способствовать транскрипции воспалительных генов [21].
Таким образом, SARS-CoV-2 непосредственно проникает в эндотелиальные клетки сосудов и вызывает системные воспалительные микрососудистые эндотелиальные нарушения, такие как утечка компонентов плазмы из микрососудов, внутрисосудистое свертывание крови и образование тромбов, а также чрезмерное высвобождение воспалительных цитокинов [22]. Это может играть центральную роль в патогенезе острого респираторного дистресс-синдрома (ОРДС) и полиорганной недостаточности, а также в патофизиологии Long-ковида (рис. 2) [23–26].
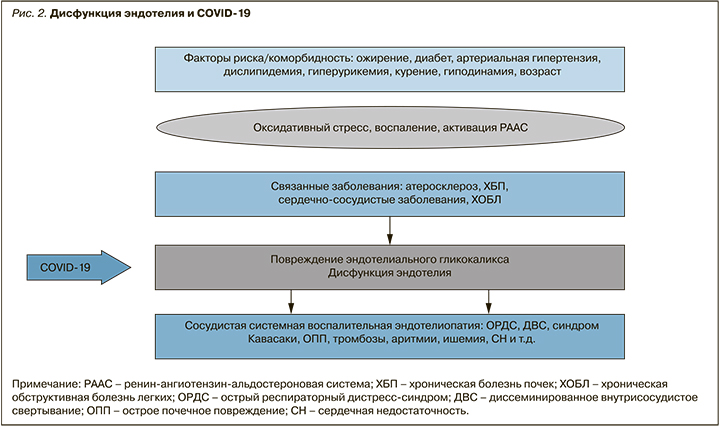
К настоящему времени сформулирована концепция «системного воспалительно-реактивного микрососудистого эндотелиоза (SIRME)», в патогенезе которого большое значение отводится разрушению эндотелиального гликокаликса [27, 28].
Повреждение эндотелиального гликокаликса
Гликокаликс представляет собой сложный гелеобразный слой из гликозилированных липидно-белковых смесей, который покрывает поверхность всех живых клеток и служит физическим защитным слоем, а также буферной областью между клетками и внеклеточным матриксом для контроля различных клеточных функций [29]. Эндотелиальный гликокаликс (ЭГК) играет существенную роль в регуляции различных функций эндотелиальных клеток сосудов, таких как коагуляция, воспаление, тонус и проницаемость сосудов, ангиогенез [30, 31]. Гликокаликс включает содержащие сиаловую кислоту гликопротеины, основные белки, состоящие из мембраносвязанных протеогликанов (синдекан, глипикан и т.д.), боковых цепей гликозаминогликанов (гепарансульфат, хондроитинсульфат и др.) и длинноцепочечной гиалуроновой кислоты [32]. Гликокаликс стабилизирует напряжение сдвига, и эта стабилизация имеет решающее значение для выработки оксида азота (NO) в эндотелиальных клетках сосудов [33]. ЭГК защищает эндотелиальные клетки сосудов от турбулентности, вызванной кровотоком, и участвует в регуляции функции барьера сосудистой проницаемости. Кроме того, ему принадлежит важная роль в функционировании микрососудистого эндотелия, поскольку ЭГК контролирует реактивность сосудов и вовлечен во взаимодействие между эндотелиальными клетками сосудов и компонентами крови [34]. Выявлено разрушение гликокаликса на фоне тяжелых инфекций, включая COVID-19, при сепсисе, геморрагическом шоке [35–37].
Большой интерес представляет исследование, опубликованное в Journal of Thrombosis and Haemostasis [38], которое показывает значение длительно существующей дисфункции эндотелия с активацией эндотелиальных клеток и гиперкоагуляции при синдроме длительного COVID-19. В его рамках было обследовано 50 пациентов в среднем через 68 дней после выписки из стационара или после регресса симптомов новой коронавирусной инфекции. У них наблюдалось статистически значимое увеличение показателей теста генерации тромбина (эндогенный тромбиновый потенциал, максимальное количество тромбина) в сравнении с контрольной группой. Также в группе реконвалесцентов COVID-19 было обнаружено увеличение плазменного уровня фактора VIII и фактора Виллебранда (синтезируется в эндотелии и мегакариоцитах, стабилизирует циркулирующий фактор VIII, служит маркером дисфункции эндотелия) и растворимого тромбомодулина.
В этом исследовании впервые было продемонстрировано, что устойчивая эндотелиопатия сохраняется до 10 нед после острой инфекции, вызванной SARS-CoV-2. Эти результаты представляют немалый интерес с учетом того значительного вклада, который вносит эндотелиопатия в патогенез острого COVID- 19. Вместе с тем в дальнейшем потребуются новые клинические испытания с достаточной мощностью, чтобы определить, играют ли эта устойчивая активация эндотелиальных клеток и гиперкоагуляция роль в стратификации пациентов с повышенным риском тромботических событий после разрешения острой инфекции COVID-19. Это, в свою очередь, поможет индивидуализированной оценке выгоды от тромбопрофилактики после выписки для снижения риска синдрома длительного COVID-19.
Таким образом, прогрессирующая эндотелиопатия выступает основным патофизиологическим механизмом прогрессирования и дебюта сердечно-сосудистой патологии в после перенесенной коронавирусной инфекции, способствуя ускорению процессов атерогенеза, коронарной микровососудистой дисфункции с развитием клинической манифестации (ишемические события, аритмии, сердечная недостаточность и т.д.).
ТЕРАПЕВТИЧЕСКИЕ СТРАТЕГИИ
При планировании терапевтических стратегий в постковидный период у пациентов с дебютом или обострением сердечно-сосудистой патологии особое внимание следует обращать на применение методов терапии с потенциальным влиянием на предполагаемые патогенетические механизмы при COVID-19 (воспаление, эндотелиопатию, микрососудистую дисфункцию, тромбообразование). В качестве лекарственных препаратов, способных оказывать эндотелий-корригирующие эффекты, традиционно обсуждаются блокаторы РААС, статины, дезагреганты, блокаторы кальциевых каналов.
С учетом патогенеза органных повреждений при COVID-19, а также значения сосудистой дисфункции и гиперкоагуляции в отдаленном периоде после перенесенной коронавирусной инфекции огромное значение имеет антитромботическая терапия. При наличии показаний к длительной терапии антикоагулянтами и/ или дезагрегантами (фибрилляция предсердий, тромбоз глубоких вен/тромбоэмболия легочной артерии в анамнезе, протезы клапанов, тромбофилии, периферический атеросклероз, острое нарушение мозгового кровообращения в анамнезе, ишемическая болезнь сердца, острый коронарный синдром, стентирование в анамнезе) необходимо продолжить прием этих препаратов или же инициировать терапию в соответствии с текущими рекомендациями и пересмотреть показания для пролонгации лечения.
При отсутствии показаний к антитромботической терапии текущие рекомендации позволяют пролонгировать терапию антикоагулянтами до 45 дней после выписки в соответствии с рассчитанным тромботическим риском. Согласно Временным методическим рекомендациям «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)» (версия 15) Минздрава России, «продленная профилактика у больных с COVID-19 после выписки (до 30–45 дней) рекомендуется при сохраняющемся повышенном риске венозных тромбоэмболических осложнений и низком риске кровотечений в случаях, когда не требуются лечебные дозы антикоагулянта по другим показаниям. При продленной профилактике ТГВ/ТЭЛА у терапевтических больных в исследованиях, выполненных до начала пандемии COVID-19, есть свидетельства пользы профилактической дозы эноксапарина (40 мг 1 раз в сутки) и ривароксабана в дозе 10 мг 1 раз в сутки. Тенденция к преимуществу продленной профилактики ТГВ/ТЭЛА отмечалась также при использовании апиксабана в дозе 2,5 мг 2 раза в сутки. Для отбора больных для продленного использования профилактических доз антикоагулянтов разумно использовать модифицированную шкалу IMPROVE VTE с учетом уровня D-димера во время госпитализации. Длительность применения антикоагулянтов при амбулаторном лечении COVID-19 не ясна и, по-видимому, может продолжаться вплоть до 30 сут в зависимости от динамики клинического состояния пациента и сроков восстановления двигательной активности» [39].
Нет оснований для пролонгации применения антикоагулянтов более 30 сут у амбулаторных пациентов и более 45 сут после выписки из стационара с целью тромбопрофилактики, без четких показаний. С точки зрения некоторых исследователей, анализ клинического статуса пациентов (гиперкоагуляционное состояние, повышение СРБ, Д-димера, фибриногена) позволяет не использовать унифицированную стратегию длительности применения антикоагулянтов у пациентов с синдромом длительного COVID-19 [40].
Ввиду отсутствия клинических показаний для пролонгации терапии оральными антикоагулянтами в долгосрочной перспективе могут быть использованы эндотелий-корректоры и антикоагулянты с альтернативными механизмами действия, не требующие контроля гипокоагуляции и имеющие низкий риск кровотечений.
Сулодексид занимает особое место между вазопротекторами, гепаринами, антиагрегантами и активаторами фибринолиза. Этот препарат представляет собой комбинацию двух природных гликозаминогликанов – дерматансульфата (20%) и высокоподвижной гепариноподобной фракции (80%). Сулодексид оказывает свое действие через образование комплексов с антитромбином и кофактором гепарина II, в результате чего происходит ингибирование тромбина и активация фибринолиза. Эффекты сулодексида связаны также с восстановлением гликокаликса. Улучшение целостности гликокаликса не только восстанавливает барьерную функцию эндотелия, но и позволяет эндотелиоцитам модулировать генерацию ключевых воспалительных молекул, включая ИЛ-1β, ИЛ-6, ИЛ-8 и фактор некроза опухоли альфа (ФНО-α,) а также подавлять ответ эндотелия на эти молекулы [41–43].
Кроме того, описано антипролиферативное (гладкомышечные клетки сосудов), гиполипидемическое (снижение уровня триглицеридов) и противовоспалительное (снижение выработки ИЛ-6, молекул межклеточной адгезии, фактора Виллебранда) действие препарата [43].
Важная характеристика Сулодексида – низкий риск кровотечений, поскольку его антитромботическая активность при пероральном приеме является результатом многофакторного воздействия на сосудистую стенку (ангиопротектор), профибринолитического эффекта и ингибирования адгезии тромбоцитов без антикоагулянтного действия. Применение препарата не требует рутинного контроля показателей коагуляции.
В соответствии с европейскими рекомендациями по ведению острого легочного эмболизма (2019) Сулодексид следует применять для продленной профилактики венозных тромбэмболических осложнений при невозможности использования оральных антикоагулянтов. В свою очередь, в европейских рекомендациях по ведению пациентов с хронической венозной патологией нижних конечностей (2020) Сулодексид рассматривается как препарат выбора для профилактики рецидива венозных тромбоэмболических осложнений (ВТЭО) и развития посттромботического синдрома у пациентов с высоким риском рецидива ВТЭО и высоким риском кровотечения, у больных с промежуточным риском рецидива ВТЭО и высоким риском кровотечения и, наконец, у пациентов с низким риском рецидива ВТЭО [44–45].
Помимо теоретического обоснования Сулодексида в острый период COVID-19 и в постковидном периоде, доступны результаты практического использования препарата у амбулаторных пациентов с коронавирусной инфекцией – «Сулодексид в лечении пациентов с COVID-19 ранней стадии: рандомизированное контролируемое исследование». Раннее назначение Сулодексида пациентам с COVID-19 снижало количество госпитализаций и потребность в кислородной поддержке, хотя и не оказывало значительного влияния на смертность в связи с тем, что выборка для достижения этого показателя оказалась не столь значительной. Лечение пациентов с COVID-19 Сулодексидом в течение 3 дней после клинического начала заболевания улучшало клинические исходы [46].
Принимая во внимание вышесказанное, наличие эндотелиопатии с высоким риском тромбообразования в постковидном периоде не вызывает сомнений. Текущие рекомендации по применению прямых оральных антикоагулянтов с целью тромбопрофилактики, по сути, подразумевают их назначение off-label, так как в инструкциях к этим препаратам данное показание отсутствует. Использование оральных антикоагулянтов регулируется Временными методическими рекомендациями Минздрава России, согласно которым длительность терапии этими препаратами составляет до 30 дней на амбулаторном этапе и до 45 дней после выписки из стационара. Однако различные исследования указывают на сохранение эндотелиопатии и гиперкоагуляции в течение более длительного периода. Клинически оправданным и логичным выходом из этой ситуации может стать применение альтернативных лекарственных средств с многофакторным воздействием на сосудистую стенку и гемостаз. В инструкции по применению препарата Сулодексид есть показание «ангиопатии с повышенным риском тромбообразования», «микроангиопатии (нефропатия, ретинопатия, невропатия)», что позволяет использовать его в постковидном периоде и у пациентов симптомами Long-ковида.
ЗАКЛЮЧЕНИЕ
Пандемия новой коронавирусной инфекции бросила беспрецедентный вызов медицинскому сообществу. В основе нашего понимания патогенеза COVID-19 и постковидных расстройств лежит представление о роли воспаления, эндотелиального повреждения и гиперкоагуляции. Знание механизмов активации и дисфункции эндотелия может быть использовано для расширения понимания патогенеза COVID-19 и разработки новых терапевтических стратегий.


