ВВЕДЕНИЕ
Пандемия новой коронавирусной инфекции (COVID-19) привела к появлению пациентов, у которых даже после разрешения заболевания отмечается ряд патологических симптомов [1]. Усталость (астения или повышенная утомляемость) [2] относится к наиболее распространенным симптомам после острой инфекции COVID-19 [3].
Ключевой патогенетический механизм астении после COVID-19 напрямую связан с предположением о нейроинвазивности/нейротоксичности SARS-CoV-2 [4, 5], что подразумевает развитие сложной последовательности событий: дисбаланс нейромедиаторов (в том числе дофамина и серотонина), снижение возбудимости нейронов (вследствие воспаления и метаболических расстройств), замедление проводимости нервного импульса по нейронам и др. [2].
Дисбаланс нейромедиаторов в центральной нервной системе (ЦНС), рассогласование деятельности различных ее отделов вызывают формирование астении, стресс-индуцированного расстройства, тревоги и депрессии [2, 5, 6]. Последние усугубляют дисбаланс медиаторов, запуская порочный круг и поддерживая патологическое состояние, следствием которого становятся астения и когнитивные нарушения после COVID-19.
Значимая часть реконвалесцентов, перенесших COVID-19, нуждается в проведении неврологического и нейропсихологического обследования и при необходимости в дальнейшем вмешательстве/терапии [6]. Благоприятный эффект в отношении постинфекционного астенического синдрома оказывают курсы реабилитации неврологической, кардиологической и скелетно-мышечной направленности [7–9]. Отдельно в этом направлении выделяют постепенное увеличение интенсивности физической нагрузки до предшествующего болезни уровня, физиотерапию и когнитивно-поведенческую терапию [6, 9]. Вместе с тем в литературе недостаточно сведений о фармакологической коррекции симптомов астении после завершения острой фазы клинических проявлений COVID-19 [3].
В качестве фармакологического кандидата для лечения постинфекционного астенического синдрома у больных, перенесших острую инфекцию COVID-19, можно рассматривать препарат Проспекта (OOO «НПФ «МАТЕРИА МЕДИКА ХОЛДИНГ»), содержащий аффинно очищенные, модифицированные (технологически обработанные) антитела к мозгоспецифическому белку S-100 – 10 000 единиц модифицирующего действия (ЕМД) [10]. Технологически обработанные антитела способны приводить к конформационным изменениям белковых молекул-мишеней путем влияния на их гидратные оболочки [11, 12]. Установленный механизм действия технологически обработанных антител, процесс приготовления которых предусматривает высокие разведения, позволяет констатировать перспективность их использования в биологии и медицине [13, 14]. В частности, действующее вещество Проспекты обеспечивает ноотропное и выраженное антиастеническое действие препарата [10].
Применение препарата Проспекта продемонстрировало высокую эффективность и безопасность в терапии постинфекционного астенического синдрома у больных, перенесших острую инфекцию COVID-19, в реальной клинической практике [15, 16]. Такая терапия способствовала значимому уменьшению повышенной физической и психической утомляемости у большинства пациентов [15]. В двойном слепом плацебо-контролируемом рандомизированном клиническом исследовании применение препарата привело к существенному улучшению состояния когнитивных функций у большинства пациентов с умеренными когнитивными нарушениями в раннем восстановительном периоде ишемического инсульта [17].
Целью проведенного исследования стало изучение эффективности и безопасности препарата Проспекта в лечении астении у пациентов после острой инфекции COVID-19.
МАТЕРИАЛ И МЕТОДЫ
Многоцентровое двойное слепое плацебо-контролируемое рандомизированное клиническое исследование в параллельных группах проводилось с 15 октября 2021 г. по 29 апреля 2022 г. на базе 35 клинических центров в Российской Федерации в соответствии с Федеральным законом от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» (с доп.), Guideline for Good Clinical Practice. Исследование получило одобрение Совета по этике при Минздраве России (выписка из протокола № 574 от 24 сентября 2021 г.).
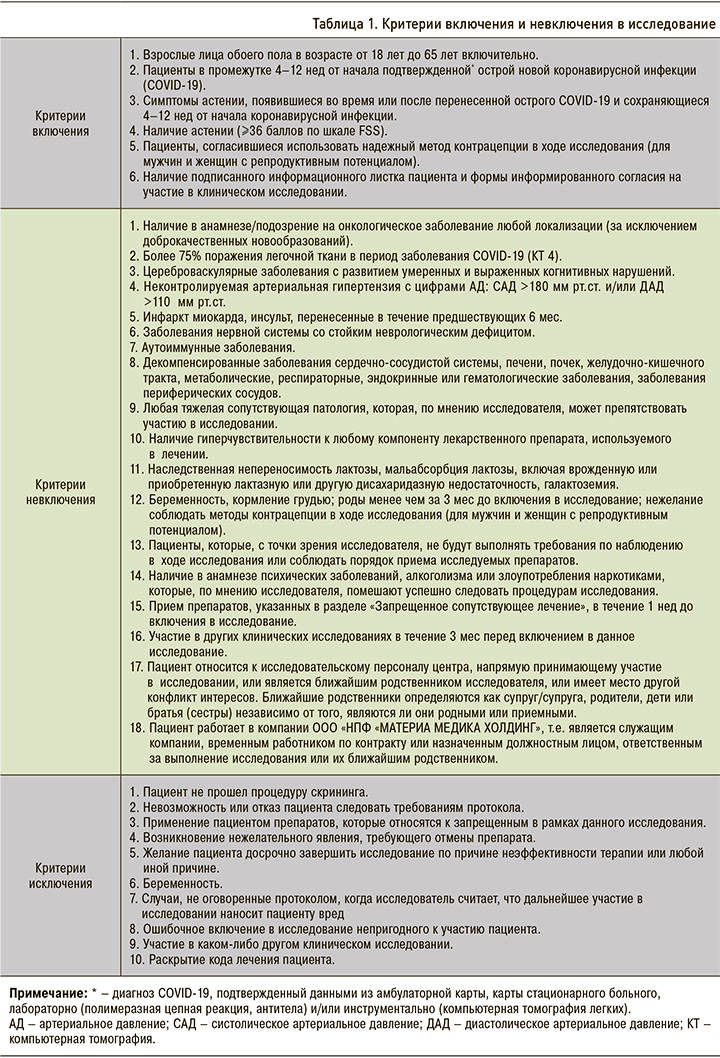
В исследование отбирались взрослые пациенты обоего пола в возрасте от 18 до 65 лет после острой инфекции COVID-19, при наличии симптомов астении, появившихся во время или после COVID-19 и сохраняющихся от 4 до 12 нед от начала заболевания. В исследование включались пациенты с общим баллом 36 и более по Шкале оценки тяжести усталости (Fatigue Severity Scale, FSS), что служило необходимым условием для объективного подтверждения выраженности симптомов астении и предупреждения недооценки эффекта воздействия препарата в погранично низких уровнях астении (ceiling effect).
После подписания участником информационного листка пациента и формы информированного согласия на участие в исследовании проводился сбор жалоб, анамнеза, объективное обследование, регистрация показателей жизненно важных функций (ЖВФ), заполнение пациентом Шкалы FSS и Госпитальной шкалы тревоги и депрессии (the Hospital Anxiety and Depression Scale, HADS) [18]. С целью объективной оценки физической толерантности выполнялся тест 6-минутной ходьбы (6МХ): в рамках этого теста фиксировалась пройденная дистанция, увеличение которой свидетельствовало о повышении переносимости физической нагрузки. Также регистрировались сопутствующая терапия, сопутствующие заболевания и состояния.
При соответствии критериям включения и отсутствии критериев невключения (табл. 1) на Визите 1 (День 1) пациент рандомизировался в одну из двух групп:
- пациенты группы 1 получали препарат Проспекта по 1 таблетке 2 раза/сут в течение 4 нед;
- пациенты группы 2 получали плацебо по схеме приема исследуемого препарата.
При проведении исследования использовался электронный дневник пациента (ЭДП), в котором участники регистрировали любое ухудшение состояния.
В ходе Визита 2 (Неделя 4 ± 3 дня) врач выполнял сбор жалоб, регистрировал данные объективного обследования и показатели ЖВФ, изменения проявлений сопутствующих заболеваний и состояний. Пациент заполнял шкалы FSS и HADS, проходил тест 6МХ. Врач контролировал назначенную терапию и терапию сопутствующих заболеваний, оценивал безопасность проводимого лечения и степень приверженности пациента исследуемой терапии (комплаентность), заполнению дневника.
По окончании периода лечения наблюдение за пациентом продолжалось 4 нед (период последующего наблюдения по окончании курса лечения).
На Визите 3 (завершающий визит, Неделя 8 ± 3 дня) врач вновь проводил сбор жалоб, регистрировал данные объективного обследования и показатели ЖВФ, изменения сопутствующих заболеваний и состояний. Пациент заполнял шкалы FSS и HADS, проходил тест 6МХ. Врач оценивал безопасность проведенного лечения, контролировал заполнение дневника.
За 1 нед до включения в исследование, а также в ходе его проведения (с момента подписания информационного листка пациента и формы информированного согласия на участие в исследовании и начала скрининга) запрещался прием любых препаратов, способных повлиять на психоэмоциональный и психофизический статус пациента, процессы возбуждения-торможения в ЦНС: противоэпилептических средств, миорелаксантов, антихолинергических, дофаминергических средств, препаратов депротеинизированного гемодеривата крови телят, психолептиков, в том числе анксиолитиков (транквилизаторов), снотворных и седативных препаратов, психоаналептиков, включая антидепрессанты, психостимуляторов и ноотропов, глюкокортикоидов системного действия (за исключением топических стероидов), общетонизирующих средств, анаболиков для системного применения.
Пациенты были рандомизированы в группы препарата Проспекта и плацебо с помощью автоматизированной интерактивной голосовой системы, основанной на генераторе случайных цифр.
В исследовании применялся двойной слепой плацебо-контроль. Таблетки плацебо и препарата Проспекта имели одинаковый вид и органолептические свойства. Исследуемый препарат поставлялся в упаковках и блистерах, не несущих на себе информации, которая указывала бы на содержащееся действующее вещество. На картонной пачке были проставлены номер серии и номер упаковки, номер протокола исследования, количество таблеток в упаковке, способ применения. Пациенты, исследователи, сотрудники исследовательских центров и команда спонсора проекта не были информированы о назначенной исследуемой терапии (Проспекта или плацебо) до завершения исследования и закрытия базы данных.
Первичным критерием оценки эффективности проводимой терапии служило изменение среднего балла по шкале FSS через 4 нед лечения.
В качестве дополнительных критериев оценки эффективности использовались изменение дистанции при выполнении теста 6МХ через 4 нед лечения; изменение выраженности тревоги и депрессии по подшкалам шкалы HADS через 4 нед лечения; изменение среднего балла по шкале FSS в течение 4-недельного периода последующего наблюдения по окончании курса лечения; изменение дистанции при выполнении теста 6МХ в течение 4-недельного периода последующего наблюдения по окончании курса лечения; изменение выраженности тревоги и депрессии по подшкалам шкалы HADS в течение 4-недельного периода последующего наблюдения по окончании курса лечения.
Критериями оценки безопасности были динамика показателей ЖВФ через 4 нед лечения и в течение 4 нед периода последующего наблюдения по окончании курса лечения; наличие и характер нежелательных явлений (НЯ), их интенсивность (степень тяжести), связь с приемом препарата, исход.
Статистический анализ
Размер выборок оценивался на основании следующих положений и допущений:
- мощность статистических критериев принималась равной 80%, вероятность ошибки первого рода «α» допускалась менее 5%, используемые статистические критерии межгрупповых сравнений являлись двусторонними;
- расчет размера выборок строился на предположениях об ожидаемом эффекте, задекларированном в основном критерии эффективности протокола настоящего исследования;
- соотношение между размерами выборок групп Проспекта и плацебо составит 1 к 1;
- различие между средним изменением среднего балла шкалы FSS между группами составит [0,65; 0,41] (в соответствии с адаптивным дизайном указывается диапазон от лучшего до худшего случая) при стандартном отклонении σ=1,81.
Для оценки превосходства исследуемого препарата над плацебо предполагалось, что размеры групп Проспекта и плацебо составят по 323 человека. С учетом коэффициента выбывания (Кв=0,2), планировалось подписание информированного согласия как минимум 680 пациентами – по 323 пациента в каждой группе.
С целью сравнения результатов в двух группах для непрерывных переменных использовали двухвыборочный t-критерий Стьюдента, непараметрический критерий Вилкоксона. Для анализа динамики показателей в двух группах применяли двухфакторный дисперсионный анализ, где факторами служили «Группа» и «Визит». Частотный анализ долей (процентов) в двух группах выполнялся посредством точного критерия Фишера. Обработка данных и все статистические расчеты по данному протоколу проводились с использованием статистического пакета SAS-9.4 Лицензиат: ООО «НПФ «МАТЕРИА МЕДИКА ХОЛДИНГ», № 70100045.
Представлены результаты ITT (Intention-to-treat) и РР (Per Protocol) [в квадратных скобках] анализа эффективности.
Движение пациентов в ходе исследования
Всего были отобраны и подписали информированное согласие 680 пациентов (выборка Total set). После прохождения процедур скрининга в исследование рандомизировали 676 пациентов – 330 в группу Проспекта и 346 в группу плацебо (рис.). Эта выборка (количество «включенных пациентов, получивших хотя бы одну дозу исследуемого препарата») использовалась для оценки безопасности исследуемой терапии и ITT анализа эффективности.
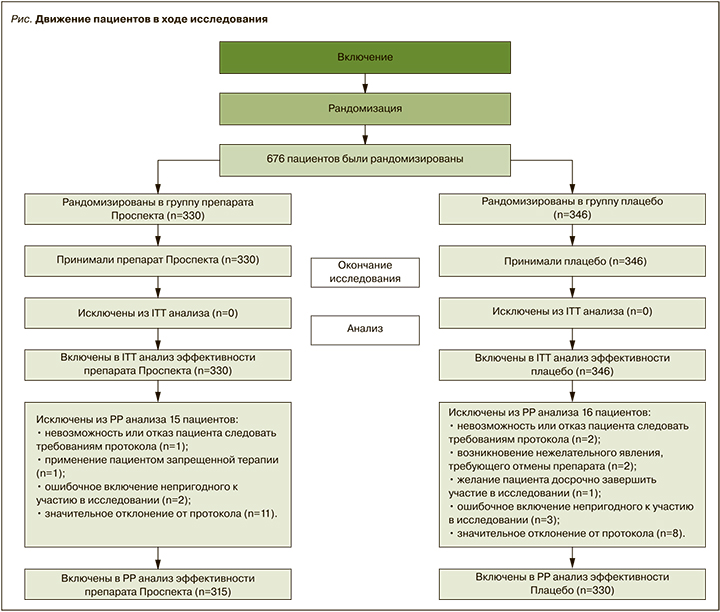
Данные 31 пациента (15 пациентов из группы Проспекта и 16 пациентов из группы плацебо) не были включены в PP анализ эффективности по разным причинам; выборку для РР анализа составили 645 пациентов – 315 из группы Проспекта и 330 из группы плацебо.
Характеристика пациентов
Средний возраст включенных и рандомизированных пациентов, данные которых вошли в ITT и РР анализы, в группе препарата Проспекта был 44,3±12,5 [44,2±12,6] лет, в группе Плацебо – 42,8±12,6 [42,4±12,6] лет. Мужчины составляли 34,6% [34,6%] и 31,8% [31,5%], женщины ‒ 65,4% [65,4%] и 68,2% [68,5%] в группах препарата Проспекта и плацебо соответственно. Пациенты обеих групп не отличались по возрасту (p=0,11 [p=0,07]) и полу (p=0,46 [p=0,45]).
Исходный средний балл по шкале FSS в группе препарата Проспекта равнялся 46,4±6,9 [46,4±6,7], в группе плацебо – 45,9±6,6 [46,0±6,4] баллов, по подшкале «тревога» HADS – 8,5±4,1 [8,5±4,1] и 8,8±3,9 [8,8±3,9] баллов, по подшкале «депрессия» HADS – 8,1±3,7 [8,1±3,7] и 8,3±3,8 [8,3±3,8] баллов, по тесту 6МХ – 426,4±119,2 [424,3±118,9] и 416,9±112,8 [413,1±112,2] м соответственно.
Сопутствующие заболевания имели 39,4% [38,7] пациентов в группе препарата Проспекта и 46,2% [45,5] в группе плацебо (р=0,07 [p=0,09]). Обе группы значительно не различались по количеству сопутствующих заболеваний у пациентов (табл. 2).
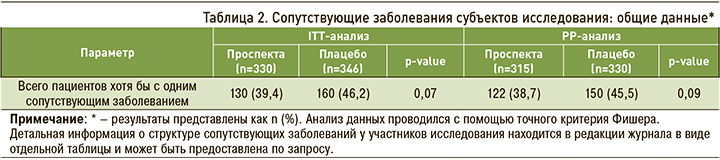
Препараты сопутствующей терапии получали 29,4% [28,6] пациентов группы препарата Проспекта и 31,5% [30,6] группы плацебо (р=0,56 [p=0,61]). Статистический анализ с помощью точного критерия Фишера не показал статистически значимых различий между группами по частоте сопутствующих заболеваний (р=0,07 [p=0,09]) и применения препаратов сопутствующей терапии (р=0,56 [p=0,61]) (ITT- и РР-анализы).
В группе препарата Проспекта 66,2% [66,5] женщин были способны к деторождению, в группе плацебо – 67,4% [68,6]. В постменопаузе в течение 12 нед и более находились 32,9% [32,5] участниц исследования в группе препарата Проспекта и 30,5% [29,7] – в группе плацебо. Прекращение функции яичников из-за недостаточности или их хирургического удаления в исследуемых группах наблюдалось у 0,5 [0,5] и 0,4% [0,0], отсутствие матки – у 0,5% [0,5] и 1,3% [1,3] женщин соответственно; хирургическая стерилизация (перевязка маточных труб) была выполнена ранее 0,0% [0,0] и 0,4% [0,4] участницам соответственно. Барьерный метод контрацепции использовали 54,6% [54,9] женщин в группе препарата Проспекта и 56,4% [57,5] в группе плацебо. Остальные методы контрацепции встречались реже.
9,1% [99,1] мужчин в группе препарата Проспекта и 99,1% [99,0] в группе плацебо применяли барьерный метод контрацепции.
Оценка комплаентности, проведенная по результатам подсчета препарата, возвращенного на Визите 2, продемонстрировала высокий уровень приверженности пациентов к назначенной терапии.
РЕЗУЛЬТАТЫ
Оценка эффективности
К окончанию 4-й недели лечения в группе препарата Проспекта наблюдалось уменьшение выраженности астении в виде снижения среднего балла по шкале FSS с 46,4±6,9 [46,4±6,7] до 29,9±9,2 [29,8±9,0]; в группе плацебо этот показатель снизился с 45,9±6,6 [46,0±6,4] до 31,9±9,9 [32,1±9,8] баллов. Таким образом, в группе препарата Проспекта отмечено изменение среднего балла по шкале FSS между исходным значением и через 4 нед лечения на 16,5±9,5 [16,6±9,5], в группе плацебо – на 14,0±9,4 [13,9±9,2]. Разница значений среднего балла по шкале FSS на фоне терапии препаратом Проспекта и плацебо составила 2,49±9,44 [2,70±9,36], p=0,0016 [p=0,0007]. У 99% пациентов на фоне приема препарата Проспекта произошло статистически значимое уменьшение выраженности астении по сравнению с плацебо (р=0,04).
К окончанию 4-й недели лечения при выполнении теста 6МХ в группе Проспекта имело место увеличение среднего значения пройденной дистанции с 426,4±119,2 [424,3±118,9] до 457,8±118,2 [456,2±118,3] м, в группе Плацебо – с 416,9±112,8 [413,1±112,2] до 444,7±110,7 [440,6±109,4] м. В основной группе исследования отмечено изменение среднего значения пройденной дистанции между исходным значением и через 4 нед на 31,4±44,5 [31,9±44,2] м, в группе Плацебо – на 27,8±38,1 [27,5±37,6] м; разница значений при выполнении теста 6МХ на фоне терапии препаратом Проспекта и плацебо составила 3,62±41,35 [4,37±40,94] м, р=0,3183 [p=0,3109].
4-недельная терапия препаратом Проспекта способствовала снижению выраженности тревоги и депрессии в виде уменьшения среднего балла подшкал «тревога» и «депрессия» HADS с 8,5±4,1 [8,5±4,1] до 5,5±3,2 [5,4±3,1] и с 8,1±3,7 [8,1±3,7] до 4,7±2,9 [4,7±2,9]; в группе плацебо баллы снизились с 8,8±3,9 [8,8±3,9] до 6,0±3,3 [6,0±3,3] и с 8,3±3,8 [8,3±3,8] до 5,2±3,0 [5,2±3,0] соответственно. В группе препарата Проспекта зафиксировано изменение среднего балла тревоги и депрессии между исходным значением и через 4 нед на 3,0±3,2 [3,0±3,2] и 3,4±3,0 [3,4±3,0], в группе плацебо – на 2,8±3,1 [2,8±3,1] и 3,1±3,1 [3,1±3,0] соответственно. Разница между изменениями средних баллов по подшкалам «тревога» и «депрессия» шкалы HADS на фоне исследуемой терапии составила 0,15±3,16 [0,21±3,13] (р=0,5805 [p=0,4819]) и 0,26±3,02 [0,22±3,02] (р=0,2143 [р=0,2562]) соответственно.
В рамках исследования был выполнен корреляционный анализ между изменением общего балла по шкале FSS и изменением выраженности тревоги и депрессии по соответствующим подшкалам HADS через 4 нед лечения препаратом Проспекта и приема плацебо. Выявлена положительная корреляционная связь между выраженностью астении (шкала FSS) и тяжестью тревоги и депрессии (подшкалы «тревога», «депрессия» HADS) у наблюдавшихся пациентов (для группы препарата Проспекта: r=0,3821, p <0,0001; r=0,4014, p <0,0001 соответственно; для группы плацебо: r=0,3645, p <0,0001; r=0,3803, p <0,0001 соответственно) без статистически значимой разницы между исследуемыми группами.
В течение 4-недельного периода последующего наблюдения по окончании курса лечения выраженность астении по шкале FSS у участников исследования не претерпевала существенных изменений и статистически значимо не различалась между группами (7,1±6,3 [6,9±6,0] баллов в группе препарата Проспекта и 7,0±6,9 [7,0±6,9] баллов в группе плацебо; р=0,8156 [p=0,9569]). При этом «антиастенический» эффект препарата Проспекта сохранился у 90% пациентов после отмены терапии.
Изменение дистанции при выполнении теста 6МХ в течение 4-недельного периода последующего наблюдения по окончании курса лечения в группах препарата Проспекта и плацебо статистически значимо не различалось: 15,9±32,1 [15,9±32,2] и 18,8±32,0 [19,4±31,9] м соответственно; р=0,1049 [p=0,0721].
Изменение выраженности тревоги и депрессии по шкале HADS в течение 4-недельного периода последующего наблюдения по окончании курса лечения в группах исследуемой терапии также статистически значимо не различалось: в группе препарата Проспекта соответствующие показатели составили 1,5±2,3 [1,5±2,2]/1,4±2,1 [1,4±2,1] баллов, в группе плацебо – 1,6±2,3 [1,6±2,3]/1,5±2,1 [1,5±2,1] баллов (р=0,7260 [p=0,7306]/р=0,6808 [p=0,7095]).
Оценка безопасности
Безопасность исследуемой терапии определялась на основании данных всех включенных в исследование пациентов, которые получили хотя бы одну дозу изучаемого препарата или плацебо (n=676). В ходе исследования проводилась оценка показателей ЖВФ, регистрировались НЯ, изучалась их связь с приемом препарата, степень тяжести и исход.
Всего было выявлено 52 НЯ у 40 пациентов, в том числе 24 НЯ у 20 (6,1%) пациентов группы препарата Проспекта и 28 НЯ у 20 (5,8%) пациентов группы плацебо (р=1,00). По частоте встречаемости НЯ, показателям их тяжести, степени причинно-следственной связи, исходам и распределению по нозологическим формам показатели препарата Проспекта не превосходили аналогичные показатели плацебо. В основной группе 13 НЯ (54,2%) были легкой и 11 (45,8%) средней степени тяжести (p=1,0). Наиболее частый исход НЯ в группе Проспекта – выздоровление/разрешение – был зарегистрирован в 22 (91,7%) случаях, отсутствие выздоровления/разрешения – у 2 (8,3%) пациентов (p=0,17). Причинно-следственная связь (ПСС) НЯ с приемом исследуемого препарата в группе Проспекта, по мнению врачей-исследователей, отсутствовала в 20 (83,3%) случаях, была вероятной в 3 (12,5%) и возможной в 1 (4,2%) случае. По степени достоверности ПСС получены значимые различия за счет большей частоты НЯ с сомнительной ПСС в группе плацебо (0 против 9% в группах препарата Проспекта и Плацебо; p=0,004).
Средние показатели ЖВФ (систолическое и диастолическое артериальное давление, частота сердечных сокращений, частота дыхания) в периоде наблюдения статистически значимо не отличались относительно исходных значений и при сравнении между исследуемыми группами.
Случаев развития серьезных НЯ в ходе исследования выявлено не было.
ОБСУЖДЕНИЕ
Оценка эффективности по первичной конечной точке исследования показала, что 4-недельная терапия препаратом Проспекта способствовала клинически значимому уменьшению выраженности астении у больных, перенесших COVID-19, о чем свидетельствовало снижение среднего балла по шкале FSS. Согласно литературным данным, максимальная выраженность астении отмечается в первый месяц после COVID-19, в дальнейшем же наблюдается некоторая спонтанная редукция постинфекционного астенического синдрома [13]. Наше исследование продемонстрировало, что на фоне приема препарата Проспекта скорость разрешения симптомов астении превосходит таковую в отсутствие терапии.
К окончанию 4-й недели лечения в группе препарата Проспекта наблюдалось тенденция к удлинению пройденной дистанции при выполнении теста 6МХ на 31,4±44,5 [31,9±44,2] м (в группе плацебо аналогичное значение составило 27,8±38,1 [27,5±37,6] м). Получение маргинально значимых результатов, возможно, объясняется недостаточной мощностью исследования для дополнительного критерия эффективности и значительным количеством сопутствующих заболеваний, вносящих вклад в физическую толерантность пациентов.
Информация о состоянии психического статуса пациентов до заболевания COVID-19 отсутствовала. Стратификация пациентов по выраженности тревоги и депрессии на этапе включения в клиническое исследование не осуществлялась, поскольку использование шкалы HADS было направлено на изучение патогенеза астении после COVID-19, а не на оценку эффективности терапии астении. В ходе 4-недельной терапии наблюдалось снижение выраженности психоэмоциональных нарушений (тревоги, депрессии) до нормального уровня по результатам шкалы HADS. Дополнительно проведенный корреляционный анализ определил положительную взаимосвязь между выраженностью астении и тяжестью тревоги и депрессии у пациентов после COVID- 19. Статистически значимой разницы между группами препарата Проспекта и плацебо обнаружено не было. Наши наблюдения могут свидетельствовать о развитии реактивных психоэмоциональных нарушений (тревоги и/или депрессии) при коронавирусной инфекции, поскольку их регресс происходил параллельно с уменьшением выраженности постинфекционного астенического синдрома и улучшением состояния пациентов. Таким образом, вероятен вклад психоэмоциональных нарушений в развитие астении после COVID-19. Однако этот аспект требует дальнейшего изучения.
За время последующего 4-недельного наблюдения по окончании курса лечения выраженность астении, тревоги/депрессии, изменение дистанции в группах препаратов Проспекта и плацебо статистически значимо не различались.
Исследование подтвердило безопасность препарата Проспекта, назначаемого с целью устранения постинфекционного астенического синдрома у больных, перенесших острую инфекцию COVID- 19. За наблюдаемый период не было выявлено отрицательного влияния проводимой терапии на показатели ЖВФ, а также НЯ, имеющих определенную причинно-следственную связь с приемом препарата. Пациенты с астенией после COVID-19 хорошо переносили лечение и показали высокий уровень приверженности к терапии.
ЗАКЛЮЧЕНИЕ
Таким образом, в многоцентровом двойном слепом плацебо-контролируемом исследовании подтверждена терапевтическая эффективность и безопасность применения препарата Проспекта в терапии астении у пациентов после COVID- 19. Терапевтическая эффективность препарата Проспекта у пациентов с астенией после COVID- 19 объясняется его влиянием на нейрогенные звенья патогенеза усталости.
Протокол исследования опубликован на сайте ClinicalTrials.gov. Identifier: NCT05074888.



