ВВЕДЕНИЕ
Хроническая ревматическая болезнь сердца (ХРБС) – заболевание, которое характеризуется поражением сердечных клапанов в виде поствоспалительного краевого фиброза клапанных створок или порока сердца (недостаточность и/или стеноз), сформировавшихся после перенесенной острой ревматической лихорадки (ОРЛ) [1]. Из-за высокого риска преждевременной заболеваемости, смертности и инвалидности ХРБС остается важнейшей проблемой общественного здравоохранения во всем мире, особенно во многих странах с низким уровнем дохода [2, 3].
За последние десятилетия борьба с обсуждаемой патологией достигла заметного прогресса [4–7]. Так, по данным отчета исследования The Global Burden of Disease (GBD), в 2015 г. в мире было зарегистрировано 33,4 млн случаев заболевания, из них причиной смерти стали 319 400 случаев, а возрастная смертность снизилась на 47,8% с 1990 по 2015 г. [8–10].
Согласно сведениям официальной статистики, распространенность ХРБС в России в 2019 г. равнялась 113 на 100 тыс. взрослого населения; преобладающую долю (55,24%) этой когорты составили лица старшей возрастной группы [11–13].
Известно, что перенесенная ОРЛ служит ведущей причиной ХРБС, оказывая влияние на формирование приобретенных пороков сердца с развитием хронической сердечной недостаточности (ХСН), сердечных аритмий, тромбозов и тромбоэмболий, которые и определяют дальнейший прогноз пациента [14, 15]. Особенностью современного течения этой патологии является отсутствие у нее бурного клинического манифестирования в виде четко очерченной симптоматики ОРЛ, которая в прошлом сопровождала острый фарингит, вызванный ревматогенными штаммами стрептококка [16].
В настоящее время в развитых странах Европы ревматизм как причина формирования порока клапанов сердца потерял свою значимость, но в России остается одним из ведущих [11]. По данным ряда авторов, работы которых были направлены на оценку вклада ревматических и неревматических поражений клапанов в структуру смертности населения от приобретенных пороков сердца, установлено, что в России в возрастной группе старше 50 лет максимальные показатели смертности женщин и мужчин обусловлены ревматическими болезнями (48,4 и 39,1% соответственно), а также множественными поражениями клапанов (32,9 и 28,4% соответственно) [17].
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациентка А., 65 лет, поступила в кардиологическое отделение ГБУ РО «Ростовская областная клиническая больница» с жалобами на одышку, боли в области сердца давящего характера при умеренной физической нагрузке (ходьбе до 100 м), подъемы артериального давления (АД) до 160/110 мм рт.ст., перебои в работе сердца, головокружение.
Данные анамнеза: пациентка считает себя больной с детства, когда у нее был выявлен порок сердца. У кардиолога не наблюдалась, постоянного лечения не получала. В 2010 г. у больной появилась давящая боль за грудиной, одышка при физической нагрузке, перебои в работе сердца. После обращения к терапевту по месту жительства и выполненного диагностического поиска пациентке был поставлен диагноз «Нарушение ритма сердца по типу постоянной формы фибрилляции предсердий». Была назначена стандартная медикаментозная терапия. Последние 6 мес пациентка стала отмечать ухудшение состояния в виде участишихся приступов стенокардии, уменьшения толерантности к физическим нагрузкам, в связи с чем была госпитализирована для дообследования и определения дальнейшей тактики ведения.
Наследственный, аллергологический анамнез не отягощены.
Пациентка на постоянной основе принимает бисопролол 2,5 мг/сут, варфарин 1 таб. + 3/4 таб. спиронолактона 25 мг/сут, левотироксин натрия 175 мг/сут, торасемид 15 мг/сут, ацетазоламид по 1 таб. 3 раза/сут.
Объективное состояние больной при поступлении оценивалось как средней степени тяжести, обусловленное наличием клинических проявлений сердечной недостаточности, стенокардии высокого функционального класса. Пациентка нормостенического телосложения, кожные покровы нормальной окраски, сухие, видимые слизистые бледного цвета, без патологических элементов. Лимфатические узлы, доступные к пальпации, не увеличены, подвижные, безболезненные, кожа над ними не изменена. Костно-мышечная система без видимой патологии, активные и пассивные движения в пределах нормы.
Неврологический статус без патологии. Зрачки и рефлексы Р=5. Грудная клетка цилиндрической формы, межреберные промежутки при пальпации безболезненные, обе половины грудной клетки симметрично участвуют в акте дыхания. Экскурсия грудной клетки 1,5 см. Перкуторно: границы легких в пределах нормы. Над всей легочной поверхностью определяется притупление перкуторного тона. Частота дыхательных движений 18/мин. Область сердца без видимых костно-мышечных изменений. Патологическая пульсация не определяется. При пальпации отмечается смещение верхушечного толчка. Границы относительной тупости сердца: правая – 1,0 см у правого края грудины в четвертом межреберье, левая + 1,2 см от среднеключичной линии слева, верхняя – третье ребро слева по парастернальной линии. Аускультативно: тоны приглушены, аритмичные, отмечается систолодиастолический шум над всеми точками аускультации. Пульс над лучевыми артериями симметричный, аритмичный, слабого наполнения и напряжения. Частота сердечных сокращений (ЧСС) 75 уд./мин. АД на правой руке 120/65 мм рт.ст., на левой – 120/65 мм рт.ст.
Живот участвует в акте дыхания, увеличен за счет подкожно-жировой клетчатки, при пальпации мягкий, безболезненный. Печень при пальпации не увеличена, безболезненна. Стул 1 раз/сут без патологических примесей. Мочеиспускание свободное, безболезненное 2–3 раза/сут.
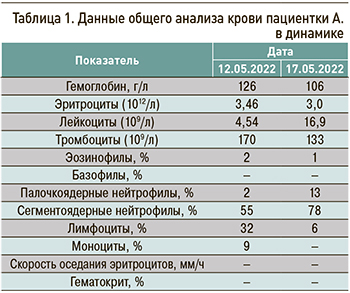
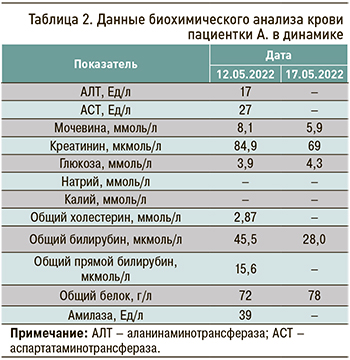
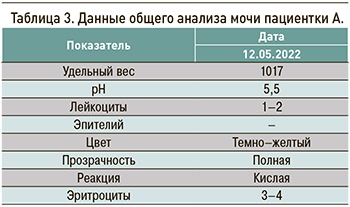
Результаты лабораторных исследований пациентки представлены в таблицах 1–4.
Данные эхокардиографии (ЭхоКГ): аорта: основание – 33 мм; синотубулярная зона – 26 мм; восходящий отдел – 30 мм. Выходной отдел левого желудочка (ВОЛЖ) – 19 мм.
Аортальный клапан (фиброзное кольцо – 19 мм): трехстворчатый, створки утолщены. Регургитация на аортальном клапане (АК): нет градиента давления (ГД) ср. на АК – 3 мм рт.ст.
Левое предсердие – 55 мм, объем левого предсердия – 131 мл.

Митральный клапан (фиброзное кольцо – 44 мм): створки утолщены, задняя стенка митрального клапана (МК) подукорочена, коаптация нарушена. Регургитация на митральном клапане (МК): 3+ VC – 10 мм, площадь МК – 2,7 см2 PG ср. на МК – 4 мм рт.ст.
Систолическая функция левого желудочка: конечный диастолический размер (КДР) – 55 мм, конечный диастолический объем (КДО) – 130 мл, межжелудочковая перегородка (МЖЖП) – 11 мм, задняя стенка левого желудочка (ЗСЛЖ) – 10 мм, фракция выброса – 60%, правый желудочек – 32 мм, выходной отдел правого желудочка (ВОПЖ) – 28 мм, правое предсердие – 39 см2.
Трикуспидальный клапан (фиброзное кольцо – 45 мм): створки утолщены, кооптация створок отсутствует. Регургитация на трикуспидальном клапане: 3+VC – 15 мм, легочная артерия – 28 мм, левая легочная артерия – 20 мм, правая легочная артерия – 20 мм. Регургитация на легочном клапане: нет ГД ср. на легочном клапане – 3 мм рт. ст. Систолическое давление в легочной артерии – 44 мм рт.ст., среднее давление в легочной артерии – 20 мм рт.ст.
Данные Холтеровского мониторирования электрокардиограммы (Холтер-ЭКГ): регистрируется постоянная форма фибрилляции предсердий, частота желудочковых сокращений 116–60/мин. Эпизоды неустойчивой (менее 30) пароксизмальной ширококомплексной тахикардии с максимальной ЧСС 169/мин. Частые политопные желудочковые экстрасистолы, периодически ритмичные по типу бигеминии, тригеминии. Парные (куплеты) и групповые (триплеты) желудочковые экстрасистолы. Ишемическая девиация ST-T не зарегистрирована. Интервал QT и комплекс QRST в пределах нормы.
Данные исследования функций внешнего дыхания: выявлено умеренное снижение вентиляционной функции легких по обструктивному типу при нормальной жизненной емкости легких.
Результаты комплексного ультразвукового исследования органов брюшной полости: диффузные изменения печени и поджелудочной железы, выявлена киста левой почки.
Фиброгастродуоденоскопия: поверхностный гастрит, дуоденит, дуоденогастральный рефлюкс.
По данным ультразвукового триплексного исследования венозной системы нижних конечностей, ультразвуковой допплерографии отдельных органов и тканей отмечено варикозное расширение притоков большой подкожной вены на голени с двух сторон. Несостоятельные перфоранты на голени с двух сторон. Ретикулярный варикоз с двух сторон, а также умеренный лимфостаз на голени с двух сторон.
По результатам коронарографии диагностировано отсутствие гемодинамически значимых стенозов.
Таким образом, на основании жалоб, клинико-анамнестических данных, результатов лабораторных и инструментальных обследований пациентке было выполнено оперативное вмешательство: пластика митрального клапана опорным кольцом Мединж, размер 28, пластика трикуспидального клапана по Batista, редукция левого предсердия, пликация ушка левого предсердия, ушивание дефекта межпредсердной перегородки в условиях искусственного кровообращения.
После оперативного вмешательства пациентка была переведена в отделение анестезиологии-реанимации, где у нее был зафиксирован синдром Фредерика.
По результатам проведенного консилиума был рекомендован перевод больной в отделение нарушения ритма сердца с целью имплантации однокамерного кардиостимулятора. После проведенного вмешательства пациентка была выписана с диагнозом:
- основной: ХРБС. Тяжелая недостаточность митрального клапана, трикуспидального клапана;
- фоновый: гипертоническая болезнь III стадии, 3-й степени, риск 4 (очень высокий);
- осложнение основного: ХСН IIа, функциональный класс (ФК) III. Легочная гипертензия. Нарушение ритма сердца по типу постоянной формы фибрилляции предсердий, брадисистолический вариант (переходящий синдром Фредерика). Пресинкопальные состояния;
- сопутствующий: варикозная болезнь вен нижних конечностей. Состояние после флебэктомии двух сторон (1998). Рецидив заболевания (хроническая венозная недостаточность II). Хронический гастродуоденит в стадии ремиссии. Стеатогепатоз. Хронический гингивит в стадии ремиссии. Вазомоторный ринит. Дисциркуляторная энцефолопатия 1 ст., дискординаторный синдром.
При выписке пациентке были даны следующие рекомендации и назначения
1. Наблюдение кардиолога по месту жительства.
2. Гиполипидемическая диета с ограничением поваренной соли (3 г/сут), животных жиров, углеводов, употребление жидкости 1,5–2,0 л/сут.
3. Самоконтроль пульса (целевое значение 55–60 ударов/мин), АД (целевой уровень 120–130/70–80 мм рт.ст.).
4. Рациональный режим физических нагрузок (дозированная ходьба в умеренном темпе от 30 мин с тренирующей ЧСС до 120 уд./мин, 3 раза/ нед).
5. Антикоагулянт апиксабан 5 мг 2 раза/сут под контролем международного нормализованного отношения (МНО) до достижения целевых уровней, затем контроль 1–2 раза/мес, постоянно.
6. Антиаритмический препарат III класса амиодарон 200 мг 2 раза/сут первую неделю, затем 200 мг 1 раз/сут утром под контролем тиреоидных гормонов (тиреотропный гормон, трийодтиронин, тироксина) 1 раз в полгода.
7. Петлевой диуретик торасемид 15 мг 1 раз/сут утром (08:00), постоянно, под контролем электролитов крови (К+, Na+).
8. Антагонист минералокортикоидных рецепторов спиронолактон 50 мг 1 раз/сут утром (08:00)
9. Бета-блокатор бисопролол 2,5 мг 1 раз/сут утром (08:00) постоянно под контролем ЧСС.
10. Статин розувастатин 20 мг 1 раз/сут в день (20:00) после еды, постоянно, под контролем АЛТ, АСТ, липидограммы 1 раз в 3 мес. Первый контроль – через 1 мес.
11. Ингибитор протонной помпы омепразол 20 мг 2 раза/сут (08:00, 20:00) за 20 мин до еды, 2 нед, затем по 20 мг 1 раз/сут утром за 20 мин до еды, 2 нед.
12. При подъемах АД – агонист имидазолиновых рецепторов моксонидин 0,2–0,4 мг под язык.
13. Холтер-ЭКГ в плановом порядке.
ОБСУЖДЕНИЕ
Известно, что наиболее частым, клинически значимым и специфическим проявлением ОРЛ выступает вальвулит [7, 11, 18, 19]. В его диагностике ведущим инструментом служат ЭхоКГ в сочетании с допплерографией (ДЭхоКГ), обладающие большей чувствительностью и специфичностью в сравнении с традиционной аускультацией [16]. Методы визуализации позволяют диагностировать клапанные поражения при ОРЛ в отсутствие аускультативных признаков вальвулита – так называемый латентный вальвулит, частота которого составляет не менее 17% и имеет тенденцию к увеличению. Современные клинические наблюдения свидетельствуют о преобладании у пациентов, перенесших ОРЛ, изолированных пороков сердца, таких как митральная недостаточность, недостаточность аортального клапана, митральный стеноз. Также известно, что в некоторых случаях возможен сочетанный порок аортального и митрального клапанов [20], при этом комбинированный митрально-трикуспидальный порок является редкой патологией.
В ряде случаев у пациентов может развиваться сердечная недостаточность, обычно связанная с тяжелой клапанной регургитацией вследствие вальвулита; при ее наличии и в случае отсутствия результата от медикаментозного лечения может потребоваться оперативное вмешательство [21]. Хирургическое лечение пороков показано симптомным пациентам с тяжелой митральной и трикуспидальной недостаточностью с приемлемым хирургическим риском [22, 23].
ЗАКЛЮЧЕНИЕ
Представленный клинический случай демонстрирует важность комплексного подхода к лечению коморбидных пациентов с ХРБС. Слаженная работа Heart Team, сочетание консервативной терапии и высокотехнологичной хирургической помощи повышают выживаемость, улучшает качество жизни и позволяет сохранить социальную и экономическую активность пациентов с этим заболеванием.


