«Родовое» понятие «ревма-», обязанное своим происхождением острой ревматической лихорадке (ОРЛ), объединило многочисленные болезни хронической воспалительной природы, известные как ревматические заболевания (РЗ). Последние в МКБ-10 представляют XVIII класс «Болезни костно-мышечной системы и соединительной ткани». В системе представлений о них фундаментальное значение придается концепции аутоиммунных и аутовоспалительных заболеваний [1–5]. Однако с учетом новых данных в тени остается принципиально важный вопрос соответствия сущности «родового» понятия патологии, изначально вошедшей в историю как «стерильное осложнение» инфекции, вызванной бета-гемолитическим стрептококком A (БГСА), действительной природе болезни. Первые представления о «новой» форме септического эндокардита – первично хроническом септическом эндокардите (П-ХСЭ), который представляет собой осложнение первично хронического сепсиса (П-ХС), ассоциируемое нами с системным первично хроническим неспецифическим (септическим) эндоваскулитом, – были сформулированы (Г.М. Бушманова) в начале 80-х гг. ХХ в. [6, 7]. Особенности П-ХСЭ не позволяют ему соответствовать существующим представлениям о септическом эндокардите как болезни sui generis. Болезнь позиционируется нами как «новый» клинический феномен XX–XXI вв., который пополнил когорту неконтролируемых иммунной системой инфекционных болезней, определяющих тяжелый жизненный прогноз общества. К ним относятся пандемически протекающие инфекции (ВИЧ/СПИД, Т-клеточный лейкоз), сывороточные гепатиты, хронический герпесвирусный сепсис и др. [8–11]. В ходе изучения феномена возникла необходимость проведения дифференциальной диагностики между острой ревматической лихорадкой (ОРЛ) и клинически впервые выявленным (Г.М. Бушманова) П-ХСЭ у больных приобретенными пороками сердца до операции. Характер полученных результатов должен определить конкретные принципиально различные стратегические направления терапии.
Цель исследования – доказать, что у больных приобретенными пороками сердца под маской ОРЛ скрывается П-ХСЭ.
МАТЕРИАЛ И МЕТОДЫ
Для достижения поставленной цели были преду-смотрены следующие особенности верификации дооперационного диагноза:
- постановка во главу угла диагностического поиска предложенной нами (Г.М. Бушманова) пентады экстракардиальных клинических симп-томов, предположительно имеющих патогномоничную (абсолютную) для П-ХС и П-ХСЭ значимость;
- получение доказательств с помощью прямого интраоперационного исследования основного субстрата поражения – эндокарда.
Материалом послужили результаты многолетнего изучения проблемы П-ХСЭ (1980–2020) сначала на базе функционировавшего свыше 20 лет отделения бактериальных (септических) эндокардитов отдела кардиохирургии приобретенных пороков сердца (заведующий – к.м.н. Л.А. Девятьяров) НИИ патологии кровообращения Минздрава России им. акад. Е.Н. Мешалкина, а затем на базе Института молекулярной патологии и патоморфологии ФИЦ ФТМ. Первые результаты нашли отражение в 1986 и 1988 гг. в докладах и материалах двух Республиканских конференций «Септические эндокардиты в хирургии пороков сердца», проведенных Институтом, двух тематических сборниках (1987, 1989) и докладах на форумах различного уровня, включая Всесоюзную конференцию по сепсису, Международные конгрессы по иммунореабилитации и реабилитации в медицине (1998–2000, 2002, 2005, 2007, 2009, 2013) и др. В работе представлен анализ материала, полученного от 1962 оперированных больных ППС.
Патоморфологические особенности П-ХСЭ изучены В.А Гроссом [13]. Спектр проведенных нами исследований включал клинические, макро- и гистоморфологические, бактериологические, бактериоскопические, цитологические с иммуногистохимическим (ИГХ) методы исследования.
С помощью сканирующей электронной микроскопии (СЭМ) изучен биопсийный и аутопсийный материал резецированных клапанов от 73 оперированных больных.
Особенности морфологических изменений внутренних органов у больных приобретенными пороками сердца на фоне П-ХСЭ описаны П.М. Ларионовым [14]. Получен патент на изобретение «Способ диагностики стадий бактериального эндокардита» [15]. В.А. Терлецким и Л.Г. Ахмеровой обследованы 2 группы пациентов с исходно ранними стадиями П-ХСЭ (22 – в 2007 г. и 20 – в 2014 г.) на кровепаразитарную инфекцию (бабезии, бартонеллы, риккетсии) методом Романовского–Гимза в модификации А.В. Терлецкого и Л.Г. Ахмеровой. Получен патент на изобретение «Способ диагностики кровепаразитарных инфекций» [16]. Эхокардиографические исследования проведены И.Г. Зориной.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Поступившие в отделение септических эндокардитов больные имели входной диагноз «ревматизм, приобретенный порок сердца». Известно, что достоверных диагностических критериев ОРЛ не существует [17]. Наряду с общепринятым клиническим обследованием проводилось выявление экстракардиальных симптомов, составляющих пентаду клинических проявлений П-ХС и П-ХСЭ. Кардинальным симптомом являются некрозы конъюнктивы (рис. 1). Частота предложенных нами клинических маркеров болезни, объединенных в 2 малых синдрома, представлена ниже.
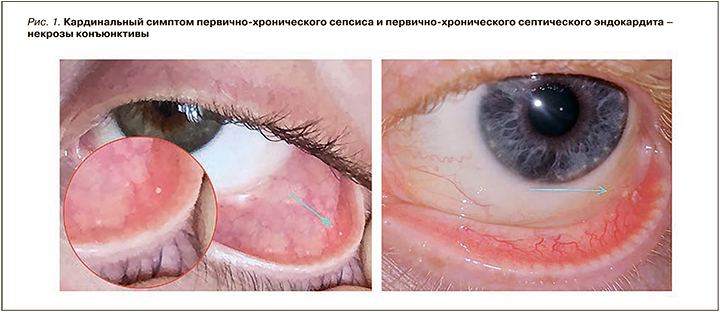
- Синдром микротромбоэмболий:
- некрозы конъюнктивы – эволютивный вариант пятен Лукина–Либмана: 80%;
- спонтанные подногтевые геморрагии – «занозы»: 54%.
- Синдром везикулезных высыпаний на коже и слизистых оболочках:
- мелковезикулезная экзантема преимущественно кистей и стоп: 24%;
- мелковезикулезная энантема твердого нёба, ближе к мягкому нёбу: 86%;
- элементы мелкоочаговой атрофии и/или гипертрофии кожи: 30%.
Основные принципы диагностики П-ХСЭ описаны нами ранее [18]. До операции у всех больных приобретенными пороками сердца, требующими хирургического лечения, был выявлен П-ХСЭ. Частота положительной гемокультуры представлена в таблице 1. После операции она составила 60%. В этиологической структуре доминировали (75%) коагулазонегативный Staphylococcus epydermidis и коагулазопозитивный Staphylococcus aureus. Грам(+) микробиота встречалась в виде кокков (8%) и палочек, последние иногда идентифицировались как дифтероиды (в 10% случаев). Грам(-) палочки были выявлены в 6%, Candida – в 1% случаев. Приведенные выше данные получены при обследовании больных, подвергнутых открытому вмешательству на сердце в 1982–1984 гг.
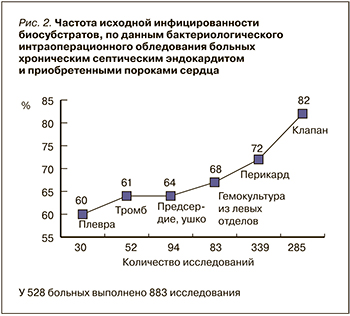 Бактериологическое исследование 883 различных биосубстратов от 528 больных установило их исходную микробную инфицированность (рис. 2), наиболее выраженную со стороны клапана (82%!) – непосредственного источника вторичной, патогенетической бактериемии. По мере удаления от него отмечается последовательное снижение процента инфицирования до уровня исходной бактериемии, выявляемой посевом крови на стерильность [19, 20], полученным на госпитальном этапе до операции.
Бактериологическое исследование 883 различных биосубстратов от 528 больных установило их исходную микробную инфицированность (рис. 2), наиболее выраженную со стороны клапана (82%!) – непосредственного источника вторичной, патогенетической бактериемии. По мере удаления от него отмечается последовательное снижение процента инфицирования до уровня исходной бактериемии, выявляемой посевом крови на стерильность [19, 20], полученным на госпитальном этапе до операции.
Обследование хронического абсцесса сердца (13% из 511 оперированных больных) в 85% случаев позволило культивировать возбудителя, обнаружив при этом высокий удельный вес (55%) Грам(-) палочковидных бактерий. Частота выявления стафилококка и прочей микробиоты составила 35 и 10% соответственно. Присутствие микробных ассоциаций было установлено в 25% случаев [21].
При сопоставлении результатов бактериоскопии (Л.А. Шмерлинг) 184 отпечатков с клапанов с микробиотой из операционных проб 127 положительных отпечатков подтверждены в 85% случаев ростом различных культур в бульоне. Отмечена высокая частота микробных ассоциаций, представленных сочетаниями стафилококка (кокков) с представителями палочковидной микробиоты (Грам(+), Грам(-)), реже в сочетании c Candida. Еще реже последняя встречалась в виде монокультуры. Иногда наблюдалось сочетание идентичных по морфологии кокков (Грам(+), Грам(-)) с палочками (Грам(+), Грам(-)), что косвенно могло свидетельствовать о присутствии вируса [22].
Положительные результаты микроскопии отпечатков с клапанного эндокарда составили 70 и 83% (табл. 2, рис. 3).

Частота выявленных в разных исследованиях микробных ассоциаций представлена в таблице 3 [23]. Визуально во время операции у 47% обследованных больных были выявлены вегетации и деструкция эндокардиальных структур.
 СЭМ обнаружила в два раза более выраженную дооперационную бактериальную инфицированность эндокарда и других биосубстратов по сравнению с результатами, полученными с применением светооптической микроскопии. На рис. 4 представлены отдельные результаты, подтверждающие это. Отмечено значительное обсеменение микробами структур клапана, нередко обнаруживались сплошные ковры кокковидных микробов. Кокковая микробиота была выявлена даже в клетках гранулем, включая гранулему Ашоффа–Талалаева (1,5% случаев), что свидетельствует о неспецифичности последней. Наряду с кокками в толще клапана выявлялась палочковидная микробиота. Стрептококковая микробиота и различные формы представителей грибковой микробиоты встречались редко. Можно было увидеть активно размножающиеся микробы. Отмечалось особое сродство процессов дегенерации, кальцификации и размножения микроорганизмов. При СЭМ отпечатков с клапана и поверхности сорбента после гемосорбции была обнаружена аналогичная картина [13]. Присутствие микст-инфекции выявлено в 1/3 случаев. При проведении анализов операционных проб – посевов и отпечатков – в целом отрицательные результаты имели место только в 6% случаев [13]. Выраженная инфицированность биосубстратов составила 94% (по результатам секционного исследования совпадение диагноза в 1993 г. – 93%).
СЭМ обнаружила в два раза более выраженную дооперационную бактериальную инфицированность эндокарда и других биосубстратов по сравнению с результатами, полученными с применением светооптической микроскопии. На рис. 4 представлены отдельные результаты, подтверждающие это. Отмечено значительное обсеменение микробами структур клапана, нередко обнаруживались сплошные ковры кокковидных микробов. Кокковая микробиота была выявлена даже в клетках гранулем, включая гранулему Ашоффа–Талалаева (1,5% случаев), что свидетельствует о неспецифичности последней. Наряду с кокками в толще клапана выявлялась палочковидная микробиота. Стрептококковая микробиота и различные формы представителей грибковой микробиоты встречались редко. Можно было увидеть активно размножающиеся микробы. Отмечалось особое сродство процессов дегенерации, кальцификации и размножения микроорганизмов. При СЭМ отпечатков с клапана и поверхности сорбента после гемосорбции была обнаружена аналогичная картина [13]. Присутствие микст-инфекции выявлено в 1/3 случаев. При проведении анализов операционных проб – посевов и отпечатков – в целом отрицательные результаты имели место только в 6% случаев [13]. Выраженная инфицированность биосубстратов составила 94% (по результатам секционного исследования совпадение диагноза в 1993 г. – 93%).
При цитологическом и ИГХ-исследовании крови в первой (2007) и второй (2014) группах обследованных на кровепаразиты частота выявленных патогенов составила соответственно: Babesia – 100 и 100%; Bartonella – 82 и 82%; Rikketsia – 15 и 50% с паразитемией в 39,4 и 28,9% случаев. Внутриэритроцитарное присутствие выявленных патогенов можно рассматривать как новый аспект проблемы сепсиса с участием зооантропонозной кровепаразитарной инфекции, требующий изучения [24–29].
Полученные спустя более полувека результаты подтвердили справедливость преданной незаслуженному забвению хрониосептической теории ревматизма, сформулированной основоположником клинической медицины Н.Д. Стражеско (1875–1952) [30]. Работами В.Г Талалаева, И.В. Давыдовского, А.И. Струкова была доказана свойственная ОРЛ системность поражения с присутствием универсального васкулита. Эти представления выдающихся ученых с полным основанием можно экстраполировать на П-ХСЭ.
Обращаясь через более чем полувека к исследованиям В.А. Вальдмана, не утратившим своей актуальности и сегодня, следует отдать должное ученому, сумевшему прозорливо заглянуть в глубины прогностически грозной болезни. Он выстроил логическую цепочку последовательного становления и формирования структурной основы «ревматической» (хрониосептической) патологии. В основу этого легли сформулированные им представления об «эндотелиозе» как инициальной стадии септического васкулита и эндокардита [31]. Сегодня «баночную» пробу автора сменили новые, более совершенные технологии.
Нами при изучении ЭхоКГ (И.Г. Зорина) установлено, что основным исходным морфологическим субстратом болезни служит фиброз эндокарда, приводящий к прогрессирующему фиброзированию экстравальвулярных и вальвулярных эндокардиальных структур, переходящему в склероз с последующим формированием стеноза клапанных отверстий [32–34]. Прогрессирующее фиброзирование эндокарда и сосудистой системы в целом закладывает основы системного органосклероза, запускающего формирование органной патологии и хронической сердечной недостаточности. Под маской фиброза при наличии низковирулентного возбудителя могут скрываться плоские стелющиеся вегетации [35], недоступные визуализации при светооптической микроскопии, но выявляемые с помощью СЭМ в виде сплошного коврового роста кокковой микробиоты (см. рис.4) [13]. Клинической демонстрацией этого является картина эхокрадиографии (ЭхоКГ), получаемая при обследовании больных П-ХСЭ [36,37]. Нарастающее фиброзирование эндокарда отражает переход исходной очаговости поражения к диффузному, распространенному процессу.
Представляется, что основы П-ХСЭ заложены в исходном системном первично хроническом септическом эндоваскулите, запускаемом вирусными патогенами. Бактериальная и протозойная суперинфекция, вероятно, наслаивается позже, вторично, формируя паразитоценоз, отражающий присутствие в организме многокомпонентной нециклической инфекции (МНЦИ).
В истории познания природы ревматизма значимое место занимают исследования известного ревматолога Г.Д. Залесского. Выдвинутая им рабочая гипотеза о связи генеза ревматизма с вирусно-стрептококковой ассоциацией рассматривала выделяемый у больных активным ревматизмом в 82% случаях вирус, оказавшийся Коксаки A13, в качестве этиологического фактора болезни, придавая БГСА патогенетическое значение [38]. Исследования синдрома повышенной проницаемости капилляров, начатые ученым, легли в основу концепции эндотелиальной дисфункции.
В МКБ-10 понятия о хрониосепсисе и ХСЭ как болезни sui generis не существует. Современная классификация системных васкулитов не содержит дефиниции септического васкулита. Этиологические факторы большинства первичных системных васкулитов остаются неизвестными. В данном случае впервые речь идет о возможной причинной связи происходящей структурной перестройки эндотелиальной системы, сопровождающей системный эндоваскулит, с конкретной болезнью – пандемически протекающим первично хроническим неспецифическим (септическим) эндоваскулитом как облигатной составляющей современной МНЦИ, представления о которой выдвинуты известным экспертом-микробиологом М.В. Супотницким. Возможно, что в качестве ее триггера выступают представители семейства Herpesviridae, запустившие в 1999 г. одноименную пандемию.
В настоящее время в ревматологической практике особое значение придается проблеме мультиморбидности [39,40]. Представляется, что результатом клинической реализации названного системного эндоваскулита являются атеросклероз, артериальная гипертензия, ишемическая болезнь сердца, кардио-, церебро- и тромбоваскулярная патологии, ревматоидный артрит, сахарный диабет 2 типа, болезнь Грейвса и другая коморбидная патология. Предположительно это можно ассоциировать с унитарностью генеза основных приобретенных заболеваний человека и их инфекционной природой, тренд нарастающей актуальности которых в настоящее время вызывает большую тревогу. На этом фоне абсолютным противопоказанием видится назначение статинов.
Е.Л. Насонов с соавт. говорят о необходимости рассматривать ревматические заболевания через призму своеобразной «мультиморбидной болезни», в которую интегрированы все без исключения приобретенные хронические заболевания.
А.М. Лила с соавт. в свою очередь замечают, что концепция полиморбидности нуждается в уточнении, поскольку не любую сопутствующую патологию можно признать равным по значимости хроническому воспалительному ревматическому заболеванию. На этом фоне выглядит неслучайной приобретающая нарастающую актуальность дисфункция эндотелия с сопровождающими ее оксидативным стрессом и тромбофилией, манифестирующими активность хрониосептического васкулита.
Эндотелиальная система, функционирующая в условиях замкнутого круга сосудистой системы в силу своей убиквитарности, оказалась в организме связующим звеном «всего со всем», своеобразной константой, как бы нивелирующей нозологическое разнообразие за счет ее ведущей роли в генезе полиморбидной патологии. То есть рассматриваемый эндоваскулит представляется своеобразной матричной основой, со временем «воспроизводящей» в соответствии с фактически существующей в организме программой различные нозологии (нозосиндромы), относимые сегодня к нозологически самостоятельным, «неифекционным», соматическим болезням. Это ставит под вопрос их нозологическую самостоятельность и неинфекционную природу. Ранее к проблеме инфекционных болезней, выступающих под клиническими «масками» соматических, обращался М.В. Супотницкий [8–10] и др. Этот же вопрос поднимается сегодня на примере иерсиниоза и болезни Грейвса [41].
П-ХСЭ по мере скрытого, «закадрового» течения может выходить на клинически манифестный уровень, приобретая вторично подострое или вторично острое течение. Такое течение сопровождается переходом хронического (пролиферативного, первично хронического) воспаления в клинически манифестное экссудативно-деструктивное с формированием недостаточности вовлеченных в процесс клапанов за счет развития их деструкции, свойственной такого рода воспалению.
Уникальность феномена П-ХСЭ заключается в том, что он начинается практически в «клинике здорового человека», возможно, интранатально как следствие трансплацентарной передачи плоду инфекции от матери вертикально, путем трансмиссии патогена на фоне существующей физиологической гестационной иммуносупрессии и превращения плаценты из барьерного органа физиологической защиты плода от инфекции в источник инфекции. Это видится единственно возможным объяснением свойственного болезни первично хронического характера сопровождающего ее воспаления.
Результаты проводимого в настоящее время глобального международного проекта «Микробиом человека», являющегося продолжением глобального международного проекта «Геном человека», свидетельствуют об инфицированности всей женской и мужской репродуктивной систем, грудного молока, крови (!) [42–51]. Эти данные, полученные за последнее десятилетие зарубежными учеными с помощью современных методов ДНК-секвенирования, правомочно рассматривать как самый высокий на сегодня метагеномный уровень доказательства текущей пандемии эндогенного сепсиса – облигатной составляющей МНЦИ, представляющей, по мнению М.В. Супотницкого, катастрофическое природное явление. Выявляемое нами присутствие П-ХСЭ в трех поколениях (ребенок <мать <бабушка) повышает степень вероятности высказанного предположения о возможности его интранатального, трансплацентарного генеза. Последний определяет конечную необратимость МНЦИ, неконтролируемой иммунной системой [9–11], a priori запрограммированной на пожизненное течение.
Характерные для П-ХСЭ особенности, которые можно ассоциировать с четырьмя признаками медленной вирусной инфекции по Б. Сигурдсону, на первый взгляд позволяют отнести болезнь к данной патологии. В настоящее время установлено, что любой вирус, длительно находящийся в организме человека, включая вирус гриппа, как было доказано известным вирусологом, академиком В.А. Зуевым, может вызвать медленную вирусную инфекцию [52]. В приведенной ученым классификации медленных вирусных инфекций с предполагаемой этиологией среди прочих болезней фигурирует атеросклероз (герпесвирусы) [53]. При П-ХСЭ в качестве основной тканевой системы, являющейся мишенью для развертывания патологического процесса, в отличие от классических медленных инфекций, вероятно, выступает система эндотелия, что придает патологии уникальность. Однако в условиях существующей пандемически протекающей МНЦИ целесообразность выделения отдельной дефиниции «медленной вирусной инфекции» представляется неоправданной.
Как было показано В.А. Гроссом, клапанный эндокардит у кардиохирургических больных ППС характеризуется слабо выраженным хроническим неспецифическим (пролиферативным, продуктивным, первично хроническим) воспалением, сопровождаемым выраженным склерозом и дегенеративно-кальцинозными изменениями. Такой тип воспаления причинно ассоциируются чаще всего с вирусами или риккетсиями [54, 55]. То есть речь идет о первично дегенеративном характере процесса, причинно ассоциируемым с названными патогенами. Однако первично дегенеративный процесс, обнаруживающий свою значимость в патологии на морфологическом уровне, сочетается с первично хроническим септическим процессом. Это позволяет предполагать значимое участие в процессе как минимум представителей двух самостоятельных таксонов: вирусов и бактерий.
Проведенное исследование по верификации дооперационного диагноза П-ХСЭ подтвердило его точность и патогномоничность симптомов, составляющих пентаду клинических маркеров болезни, не оставив ОРЛ прав на существование как самостоятельной нозологии. Названные симп-томы позволяют обеспечить раннее клиническое распознавание болезни на доклапанной стадии, что свидетельствует о предпочтительности такого диагностического подхода перед широко рекомендуемыми модифицированными критериями Duke (2000) и Европейскими рекомендациями по диагностике инфекционного эндокардита, обес-печивающими диагностику лишь поздних стадий грозной болезни.
Проведенное исследование подтвердило правомочность выдвинутой нами (Г.М. Бушманова) концепции П-ХСЭ, скрывающегося под маской ОРЛ. С учетом этого возникает необходимость принципиально иного, чем при ОРЛ, подхода к лечению больных на уровне изменения основной стратегии, что обеспечивает отчетливый клинический эффект от терапии со сдерживанием прогрессии болезни. Первичный подострый септический эндокардит Б.А. Черногубова (1879–1957) [56] – болезнь, преодолевшая к настоящему времени свойственную временам ее автора спорадичность встречаемости и вышедшая на уровень высокого эпидемического порога, – представляется возможным рассматривать как позднюю стадию П-ХСЭ.
ЗАКЛЮЧЕНИЕ
Таким образом, проведенное исследование позволило подтвердить выдвинутую нами (Г.М. Бушманова) в начале 80-х гг. прошлого века концепцию П-ХСЭ – осложнения П-ХС, ассоциируемого нами в настоящее время с системным первично хроническим неспецифическим (септическим) эндоваскулитом. В течение многих лет эта болезнь, позиционируемая нами как «новый» клинический феномен XX–XXI вв., скрывалась под маской несуществующей болезни – ОРЛ, о чем свидетельствуют результаты настоящего исследования. ОРЛ, обязанная легендой своего существования предполагаемой специфичности гистоморфологического феномена – гранулемы Ашоффа–Талалаева, после доказательства его неспецифичности утратила право на существование как нозологически самостоятельная болезнь sui generis. В связи с этим возникла необходимость революционной смены парадигмы, касающейся ОРЛ, что предполагает смену «родового» понятия ОРЛ («ревма-») на «хрониосепсис» с соответствующим изменением основных направлений терапевтической стратегии. И это относится ко всем ревматическим заболеваниям.
Предполагается, что системный эндоваскулит выступает облигатной составляющей пандемически протекающей в настоящее время МНЦИ.
В условиях текущей пандемии эндогенного сепсиса неинфекционная природа таких приобретенных заболеваний как атеросклероз, артериальная гипертония, ишемическая болезнь сердца, сахарный диабет 2 типа и других, ассоциируемых в настоящее время с пандемией неинфекционной патологии, представляется невозможной. Приведенные в работе аргументы позволяют нам (Г.М. Бушманова) выдвинуть рабочие гипотезы об унитарности генеза основных приобретенных болезней человека, их инфекционной природе и трансплацентарном генезе П-ХС и П-ХСЭ. На примере ОРЛ показано, что существующие постулаты о «неинфекционной» природе многих приобретенных заболеваний человека, их принадлежности к числу соматических могут быть ошибочными, диктующими неадекватную с точки зрения генеза болезни, терапию.
В настоящее время проблема взаимоотношения человека с представителями микромира приобретает особую остроту. Вышеприведенные уникальные данные последнего десятилетия, полученные зарубежными учеными с помощью использования современных методов ДНК-секвенирования, можно рассматривать как еще один, самый высокий на сегодня, метагеномный уровень подтверждения наших представлений о существовании в настоящее время пандемии эндогенного сепсиса, являющегося облигатной составляющей пандемически протекающей МНЦИ – по-настоящему катастрофического природного явления.
В своем развитии наука в наши дни возвращается на круги своя, напоминая нам о воззрениях выдающихся представителей российской медицины Н.Д. Стражеско, В.А. Вальдмана, Г.Д. Залесского: плодотворность их идей получает продолжение в новом прочтении болезни, открывающем широкую перспективу для дальнейших фундаментальных исследований в области внутренней медицины. П-ХСЭ принадлежит к числу болезней, само существование которых, их место в патологии и значимость для человека еще предстоит осознать с течением времени. Между тем уже сегодня он олицетворяет сопровождаемое жестким естественным отбором нарастающее противостояние двух великих Миров, решающих каждый для себя в ожесточенной схватке извечный, сакраментальный шекспировский вопрос истории: «Быть или не быть»?», в то время как природа уже дала на него однозначный ответ.
…Брошенный ею дерзкий вызов интеллекту и клиническому мастерству исследователей не должен остаться без ответа человека разумного.


