АКТУАЛЬНОСТЬ
Здоровье полости рта – один из показателей общего здоровья и качества жизни человека. Стоматологические и общие заболевания организма нередко сочетаются и отягощают течение друг друга. Изменения слизистой оболочки полости рта, пародонта и зубов могут быть проявлением системного соматического заболевания, следствием побочного действия лекарственных препаратов или же обусловлены ухудшением качества гигиены полости рта ввиду тяжелого состояния пациента [1–3]. Воспалительные заболевания полости рта могут осложнять течение сопутствующих соматических заболеваний, способствуя поддержанию хронического системного воспалительного фона [4, 5]. Такие стоматологические проявления, как галитоз (неприятный запах изо рта), пародонтоз, выпадение зубов (полная или частичная адентия), могут выступать причиной не только физического и психологического дискомфорта, но и свидетельствовать о наличии ряда серьезных патологий [6].
Статья посвящена актуальности такого физикального метода исследования, как осмотр, в выявлении патологических изменений полости рта у пациентов с различными соматическими заболеваниями. Последовательный подход и соблюдение ряда правил при исследовании полости рта позволит более эффективно использовать диагностические возможности этого метода.
Цель обзора – повысить осведомленность врачей лечебных специальностей, в первую очередь терапевтов, врачей общей практики и стоматологов, о выявляемых с помощью осмотра изменениях губ, полости рта и зубов, которые могут сопутствовать соматическим заболеваниям. Нами были изучены материалы зарубежных и отечественных исследований, касающихся различных изменений стоматологического статуса пациентов с соматическими патологиями. При этом в рассмотрение брались данные литературы преимущественно за последние 5–7 лет.
ОБЩИЕ ПРИНЦИПЫ ОСМОТРА ПОЛОСТИ РТА
Как известно, осмотр необходимо проводить при хорошем освещении с применением шпателя. Процедуру начинают с осмотра губ, оценки состояния слизистой оболочки, наличия сухости, шелушения, заед в углах рта, пятен, симметричности углов рта. В процессе обследования необходимо оценить запах полости рта, состояние зубов, слизистой оболочки десен, языка, мягкого и твердого нёба, зева, глотки, слюнных желез.
У пациента осматривают слизистую щечной поверхности справа и слева, слизистую и десну верхней и нижней челюсти. При этом определяют цвет слизистой оболочки. При осмотре зубов обращают внимание на наличие кариозных зубов, зубного камня (грязно-желтый налет у шейки зуба), количество отсутствующих зубов. При исследовании миндалин оценивают их размер, цвет, рыхлость, наличие гнойных пробок – пробок Дитриха (желтоватые или желтовато-гнойные точки на поверхности миндалин с неприятным, иногда зловонным, запахом), налетов. При осмотре языка учитываются его размеры, окраска и наличие налета, влажность или сухость, состояние сосочков [7].
ИЗМЕНЕНИЯ СЛИЗИСТОЙ ОБОЛОЧКИ ПОЛОСТИ РТА И ЗУБОВ ПРИ ЗАБОЛЕВАНИЯХ ОРГАНОВ ДЫХАНИЯ
В данном случает первоочередное внимание врача должны привлечь изменения окраски слизистых оболочек, такие как гиперемия и цианоз. Такие изменения при болезнях органов дыхания распространяются на слизистую полости рта (зев, нёбные дужки, мягкое нёбо), губ и щек.
Цианоз служит проявлением гипоксии. Для длительной гипоксии, сопровождающей хронические заболевания легких, могут быть характерны глубокие трофические изменения полости рта: у соответствующих пациентов чаще наблюдают поражение пародонта, возможно образование язв.
Гиперемия обычно сопутствует воспалительным заболеваниям, протекающим с лихорадкой. Слизистая оболочка полости рта может приобретать зернистый вид вследствие воспаления мелких лимфатических фолликулов. Также воспалительные заболевания органов дыхания зачастую сопровождаются инфекционными поражениями слизистой оболочки полости рта, такими как герпетический стоматит, гнойничковые стоматиты, язвенно-некротический гингивит и стоматит Венсана, лейкоплакия [8].
Данные одного из метаанализов показали значительную связь между патологией легких и пародонта. В частности, при хронической обструктивной болезни легких (ХОБЛ), бронхиальной астме и пневмонии отмечалось ухудшение состояние пародонта [9, 10]. У пациентов с астмой может наблюдаться язвенное поражение полости рта, у них чаще, чем в популяции в целом, встречаются «географический язык», «волосатый язык» и изменения прикуса, снижение средней скорости слюноотделения и сухость во рту, отмечается большая выраженность кариеса и кровоточивости зубов [11, 12].
Изменения полости рта могут возникать и в ответ на ту или иную терапию заболеваний дыхательной системы. Так, отдельного внимания при физикальном обследовании заслуживают пациенты, использующих ингаляционные глюкокортикостероиды (ГКС), особенно на постоянной основе. Эти препараты откладываются на слизистой оболочке глотки и полости рта, что способствует развитию кандидоза, который проявляется ксеростомией, приводит к затруднению глотания и речи. Снижение слюноотделения, в свою очередь, способствует развитию кариеса вследствие нарушения физиологического механизма очистки поверхности зубов [13]. Напомним, что частым осложнением антибиотикотерапии также становится орофарингеальный кандидоз (рис. 1).
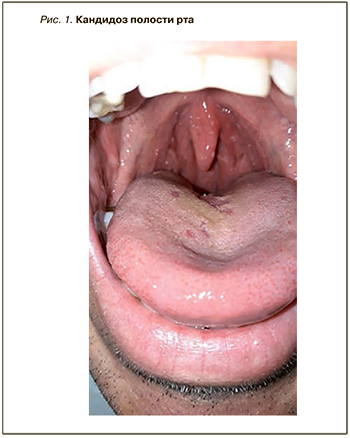
У пациентов с аллергическим ринитом в ряде случаев при попадании в организм перекрестно-реагирующих антигенов, содержащихся в некоторых продуктах, в первые минуты или через 1–2 ч может развиться оральный аллергический синдром. В этом случае отмечаются отечность, покалывание, зуд и жжение в области языка, десен, нёба, губ, а также эритематозные элементы в периоральной области, на шее. Нередко наблюдаются усиление заложенности носа, насморк, чихание, явления конъюнктивита, при этом возможно их сочетание с бронхообструктивным синдромом и системными реакциями [14].
ЗАБОЛЕВАНИЯ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
Результаты ряда исследований убедительно свидетельствуют о связи стоматологических и сердечно-сосудистых заболеваний. Ранние вмешательства, направленные на единые патогенетические механизмы этих заболеваний, могут сыграть важную роль в предотвращении заболеваемости и смертности от кардиоваскулярных событий в будущем [15, 16].
При патологии сердечно-сосудистой системы, осложненной хронической сердечной недостаточностью (ХСН), во время осмотра выявляются полнокровие, цианоз слизистой оболочки полости рта, петехиальные кровоизлияния, отек слизистых десен, щек и языка, набухшие десневые сосочки, сухость и стянутость губ, шелушение, мацерация углов рта, с образованием трещин, очаги ограниченного воспаления слизистых оболочек (мягкого нёба, нёбных дужек, миндалин), а также налеты на языке [17]. У части пациентов с гипертонической болезнью на языке, щеках, мягком нёбе периодически могут появляться одиночные пузыри с кровянистым содержимым, определяемые как пузырно-сосудистый синдром [18]. Часто поражение слизистой оболочки полости рта у больных с артериальной гипертензией сочетается с красным плоским лишаем и сахарным диабетом и носит эрозивно-язвенный характер (синдром Потекаева–Гриншпана) [19]. При инфекционном эндокардите могут выявляться небольшие кровоизлияния в слизистую оболочку полости рта, особенно мягкого и твердого нёба.
ПАТОЛОГИЯ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) – заболевание, для которого характерно атипичное (в пришеечной зоне) развитие кариеса (рис. 2). Результаты исследований подтвердили более высокую распространенность эрозии зубов и кариеса у пациентов с рефлюксом по сравнению со здоровыми людьми. Больные с эрозией зубов имеют более высокую распространенность рефлюкса, чем контрольная группа. Патофизиологические механизмы таких изменений включают изменения в физиологии слюны и микробиоты полости рта [20, 21].
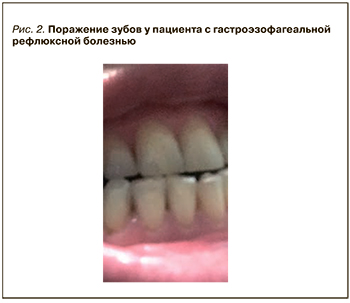
Ранняя диагностика ГЭРБ крайне актуальна, так как воздействие кислого (при гастроэзофагеальном рефлюксе) и щелочного (при дуоденогастральном рефлюксе) рефлюктата приводит не только к быстрому разрушению зубов, но и к развитию предракового заболевания (пищевода Баррета), раку пищевода и внепищеводным проявлениям болезни, таким как кашель, приступы удушья, осиплость голоса. Галитоз и привкус во рту при ГЭРБ обусловлены патологией замыкательных (клапанных) структур верхнего отдела пищеварительного тракта и могут стать причиной развития психоэмоционального дискомфорта у пациентов [22].
При осмотре полости рта у больных с заболеваниями желудка нередко выявляются кариес и пародонтоз, гипертрофия сосочков языка, бледность и отечность слизистой оболочки полости рта, катаральный гингивит, петехии, усиление сосудистого рисунка слизистой оболочки. С.В. Косюга с соавт. в результате обследования пациентов с заболеваниями слизистой оболочки полости рта выявили, что H. pylori способствует увеличению степени тяжести таких заболеваний. Иногда при болезнях желудка могут наблюдаться гипертрофия грибовидных и нитевидных сосочков, десквамативный глоссит, лейкоплакия [23]. При хроническом гастрите на языке часто обнаруживается налет беловато-желтоватого цвета. При распаде злокачественной опухоли желудка появляется зловонный запах изо рта. При сниженной кислотности желудка язык обложен, сосочки сглажены, наблюдаются сухость губ, ангулярный хейлит. Атрофический гастрит, рак желудка нередко сопровождаются сглаживанием сосочков языка, который в таких случаях становится как бы лакированным [24, 25].
ПАТОЛОГИЯ ГЕПАТОБИЛИАРНОЙ СИСТЕМЫ
У больных с патологией печени могут отмечаться желтушное окрашивание слизистой рта, сосудистые расстройства и геморрагические проявления, наиболее выраженные в области мягкого нёба. Также возможны десквамация эпителия различных частей слизистой полости рта (красной каймы губ, языка), сглаживание сосочков языка, разрастание отдельных участков эпителия языка, появление борозд на спинке языка [26].
Показано, что у пациентов с различными заболеваниями печени чаще обнаруживают заболевания пародонта. При этом такие изменения слизистой полости рта, как сухость во рту, кровоточивость десен, глоссит, стоматит кандидоз могут выступать следствием соответствующей медикаментозной терапии [27–29].
В качестве одного из внепеченочных признаков гепатита С в настоящее время рассматривается красный плоский лишай полости рта. Он проявляется нарушением трофических процессов в слизистой, возникновением на слизистой полости рта элементов в виде узелков, папул, бляшек, эрозий, пузырей [30]. К другим оральным проявлениям гепатита С можно отнести лейкоплакию, кандидоз, кровоточивость десен, желтуху, хейлит, ксеростомию [31–33].
При хроническом холецистите и панкреатите в полости рта имеет место высокая интенсивность кариеса зубов с атипичной локализацией кариозного процесса. Также в случае холецистита пациентов часто беспокоят гингивит и катаральный стоматит, отмечаются складчатость и увеличение размеров языка (рис. 3), а при панкреатите – гиперсаливация, сухость губ, ангулярный хейлит [34].
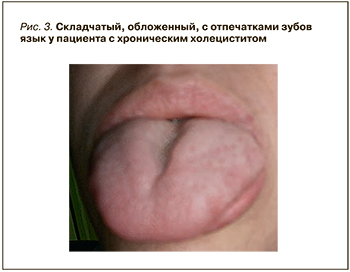
При хронических воспалительных заболеваниях кишечника (болезни Крона, неспецифическом язвенном колите) жалобы больных часто включают неприятный запах изо рта, металлический привкус во рту. При осмотре обнаруживаются различные формы хронических стоматитов, кандидоз, геморрагические высыпания, афты, десквамативный глоссит, ангулярный хейлит. Слизистая оболочка языка покрыта белым налетом, имеет по краям отпечатки зубов. Вышеуказанные изменения являются в своей основе отражением системного воспалительного процесса, нарушения процессов полостного и мембранного пищеварения, мальабсорбции с развитием дефицита витаминов, микроэлементов и других нутриентов, а также могут быть побочным действием назначаемых лекарственных средств [35, 36].
ПАТОЛОГИЯ ПОЧЕК
У пациентов с заболеваниями почек стоматологические проявления зависят от характера патологического процесса и степени почечной дисфункции. При осмотре таких больных могут выявляться сухость, отечность и анемичность слизистой полости рта, кровоточивость десен. Для пациентов с хронической почечной недостаточностью характерен запах мочевины в выдыхаемом воздухе. Наряду с этим часто наблюдаются гиперестезия эмали, кариес, гингивит, пародонтит, пародонтоз. Количество выделяемой слюны уменьшается, что способствует образованию налета и ухудшению гигиенического состояния полости рта [37, 38].
РЕВМАТИЧЕСКИЕ ЗАБОЛЕВАНИЯ
Характерные изменения слизистой оболочки полости рта и зубов при патологиях опорно-двигательного аппарата возникают довольно часто: обычно они относятся к ранним признакам заболевания или служат показателем его активности. Среди ревматических заболеваний с потенциальными оральными проявлениями можно назвать ревматоидный артрит, воспалительные миопатии, системный склероз (системную склеродермию), системную красную волчанку (СКВ), рецидивирующий полихондрит и болезнь Шегрена [39, 40]. При системном склерозе, СКВ, болезни Шегрена, саркоидозе имеет место аутоиммунное поражение слюнных желез с развитием хронического паренхиматозного сиалоаденита (чаще паротита) и ксеростомии – сухости слизистой полости рта вследствие нарушения продукции слюны и изменения ее физико-химических свойств. Также клинические проявления болезни Шегрена в полости рта включают рецидивирующий паротит, сухость губ, ангулярный хейлит и множественный кариес. Отметим, что прогрессирующий множественный кариес приводит к частичной или полной адентии у больных с выраженной и поздней стадией заболевания. Нормального скопления слюны у основания уздечки языка в клинически выраженных случаях не наблюдается [41, 42].
При системном склерозе в научной литературе описаны такие симптомы, как сужение ротовой щели вследствие атрофии и склероза кожи в области рта («кисетообразный рот», «рыбий рот»), ксеростомия, телеангиэктазии [43, 44].
Один из симптомов саркоидоза – поражение слюнных желез и развитие сухости полости рта (ксеростомии) [45]. Поражение полости рта может быть изолированным или выступать частью генерализованного заболевания: клинически оно выражается в форме безболезненной четко очерченной коричневато-красной или фиолетовой припухлости, папул или подслизистых узелков, которые могут изъязвляться, а также в виде красного разрастания десен [46].
При СКВ у трети больных, наряду с кожными изменениями, часто отмечаются поражения слизистых оболочек полости рта и носоглотки: хейлит, безболезненные эрозии (язвы, афты), ксеростомия [47, 48]. Рецидивирующие язвы полости рта, афтозные язвы слизистой оболочки полости рта, слизистой оболочки губ, задней стенки глотки, мягкого нёба, языка характерны также для болезни Бехчета [49] и гранулематоза с полиангиитом (устарвешее название – гранулематоз Вегенера), узелкового полиартериита и других заболеваний [50]. У больных с узелковым полиартериитом, помимо этого, описаны инфаркты языка, кожи и/или периферических тканей (носа, мочки ушей и др.) [39, 51].
Для ревматоидного артрита типичны гипосаливация, ксеростомия, нарушениe функции височно-нижнечелюстного сустава, поражения слизистой оболочки полости рта, заболевания пародонта [52].
Ревматическая полимиалгия и гигантоклеточный артериит (болезнь Такаясу) чаще всего дебютируют в пожилом возрасте. Больные могут отмечать жалобы на дисфункцию челюсти, языка, болезненность жевательных мышц [53]. При гигантоклеточном артериите в литературе описаны и такие симптомы, как некроз кожи головы и языка, зубная боль [54].
ЭНДОКРИННЫЕ ЗАБОЛЕВАНИЯ
Сахарный диабет рассматривается как фактор риска развития, прогрессирования и тяжести течения периодонтита и гингивита. При осмотре пациента с этим заболеванием можно выявить кандидоз полости рта, рак и предрак полости рта (актинический хейлит, лейкоплакия) [55]. После сердечно-сосудистых заболеваний, заболеваний периферических сосудов, ретинопатии, нейропатии и нефропатии агрессивный пародонтит является шестым серьезным осложнением диабета. У пациентов с постоянно неконтролируемой гипергликемией системные воспалительные или иммунные реакции могут вызывать заболевания пародонта и кариес зубов, что приводит к прогрессирующему сердечно-сосудистому риску [56, 57].
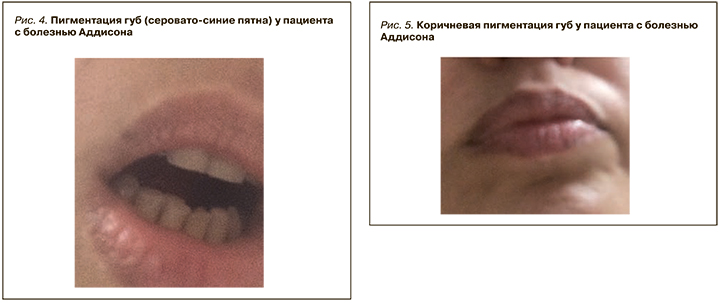
При акромегалии и гипотиреозе часто наблюдается увеличенный в размере язык с отпечатками зубов на ее боковой поверхности [58]. При гипотиреозе также можно отметить бледную окраску языка. У больных с хронической надпочечниковой недостаточностью (болезнью Аддисона) осмотр позволяет выявлить наряду с пигментацией кожи участки синевато-коричневого цвета на слизистой оболочке щек, десен, твердого нёба и красной кайме губ (рис. 4, 5) [59]. Нарушение метаболизма кальция при гипопаратиреозе вызывает появление кольцевидных или точечных дефектов зубной эмали.
ПАТОЛОГИЯ КРОВЕТВОРНОЙ СИСТЕМЫ
При осмотре полости рта у больных с железодефицитной анемией можно увидеть покраснение языка, сглаженность сосочков («лакированный» язык), заеды в углах рта (ангулярный хейлит), бледность слизистой полости рта. Для B12-дефицитной анемии характерен гладкий малиновый (Гунтеровский) язык. При гемолитической анемии помимо желтушного окрашивания кожи отмечается желтушность слизистых оболочек, в том числе в полости рта. Для болезни Минковского–Шофара типичны изменение формы и расположения зубов, высокое нёбо [6].
Геморрагические диатезы – группа гетерогенных заболеваний, которые характеризуются врожденной или приобретенной наклонностью к кровоточивости, возникающей как самопроизвольно, так и в результате незначительных травм. Экстракция зубов также сопровождается длительным, трудно останавливаемым кровотечением. При этой патологии имеет место высокая распространенность кариеса, наблюдаются гингивиты, сухость и атрофия нитевидных сосочков языка, петехии, гематомы в мягких тканях слизистой оболочки, телеангиэктазии на языке, красной кайме губ, слизистой полости рта [60, 61].
Лимфопролиферативные заболевания очень часто дебютируют с развития некротической ангины, появления некротических поражений (афт) слизистой полости рта. При ее осмотре можно отметить гиперплазию, кровоточивость, багрово-синюшные уплотнения десен (лейкемиды), морфологическим субстратом которых являются опухолевые клетки крови, а также эритродермии, стоматиты, периодонтиты и ксеростомию [62].
Осмотр полости рта у пациентов с полицитемией (болезнью Вакеза) дает возможность выявить характерный симптом Купермана – изменение цвета мягкого нёба при сохранении обычной окраски твердого нёба. Язык и губы при этом синевато-красного цвета [63]. Кроме того, в случае этой патологии нередко развивается геморрагический синдром. Например, при истинной полицитемии описаны случаи трудно останавливаемого кровотечения после экстракции зуба [64].
Итак, изменения слизистой оболочки полости рта, зубов, десен могут свидетельствовать об инфекционных, онкологических заболеваниях, интоксикациях, быть следствием лекарственной терапии. Адекватная и как можно ранняя оценка таких проявлений позволит правильно выстроить диагностический маршрут пациента, своевременно выявить основное заболевание и назначить этиопатогенетическую терапию. В ряде случаев целесообразно назначение симптоматической терапии в виде средств местного действия, таких как стоматофит, фитодент, настойка листьев шалфея и др., с целью купирования явлений воспаления, болезненных ощущений и облегчения дискомфорта у пациентов.
Добавим, что с учетом высокой частоты возникновения стоматологических нарушений при широком круге системных хронических заболеваний некоторые фармакологические средства местного действия можно использовать для заблаговременного снижения риска развития таких нарушений, а если они уже появились, – для уменьшения их интенсивности. К числу таких средств относятся пробиотики Streptococcus salivarius М18 и Streptococcus salivarius К12 – полезные бактерии, представители нормобиоты полости рта.
S. salivarius М18 (входит в состав средства ДентоБЛИС) обладает местным защитным действием благодаря способности продуцировать бактериоцин-подобные ингибирующие вещества саливарицины 9, А, M, MPS. Они способны угнетать рост различных условно-патогенных микроорганизмов, вовлеченных в развитие инфекций полости рта, таких как S. mutans (одного из главных «виновников» развития кариеса), Actinomyces spp., Porphyromonas spp., Aggregatibacter spp. и др. [65, 66]. Помимо этого, S. salivarius М18 вырабатывает фермент декстраназу, способствующий разрушению зубного налета, и фермент уреазу, который помогает уменьшить/нормализовать значения местного pH [65, 67–69]. Целый ряд клинических исследований показал эффективность и хорошую переносимость S. salivarius М18 в снижении риска развития кариеса [65, 69–72], комплексной терапии пародонтита [73], устранении галитоза [74].
Широкий спектр полезных свойств и внушительная доказательная база характерна и для S. salivarius К12 (входит в состав средства БактоБЛИС) – наиболее изученного штамма данного вида стрептококков. Вырабатываемые им саливарицины А и В обладают выраженным прямым антагонизмом в отношении бактериальных возбудителей инфекций полости рта и горла (грамположительных кокков) за счет угнетения синтеза клеточной стенки бактерий, а также нарушают адгезию/прикрепление грибов рода Candida к слизистым оболочкам, препятствуя избыточной колонизации полости рта этими грибами [65, 66, 75]. К настоящему времени накоплены значительные экспериментальные и практические данные, подтверждающие положительный эффект S. salivarius K12 в предупреждении и комплексной коррекции стоматита [65, 76], кандидоза полости рта [75, 77, 78], а также галитоза [79].
ЗАКЛЮЧЕНИЕ
Таким образом, осмотр полости рта и зубочелюстного аппарата может служить ценным диагностическим инструментом врача первичного звена. Приведенные в работе данные направлены на повышение осведомленности терапевтов, врачей общей практики, педиатров, стоматологов и других специалистов в вопросе стоматологических проявлений заболеваний внутренних органов. Нормализация биоценоза полости рта может играть благоприятную роль в профилактике и уменьшении негативных изменений полости рта и зубов (стоматит, пародонтит, кандидоз, кариес и др.), нередко сопутствующих пульмонологическим, гастроинтестинальным, гепатобилиарным, эндокринным, нефрологическим, ревматологическим и гематологическим заболеваниям.


