ВВЕДЕНИЕ
Остеоартрит (ОА) – одна из наиболее важных медико-социальных мировых проблем в связи с высокой распространенностью и существенными затратами на преодоление его последствий. Это заболевание приводит к значительному ухудшению качества жизни, временной и стойкой утрате трудоспособности, уверенно занимая одну из лидирующих позиций в структуре причин инвалидизации населения. По последним данным, наличие ОА в 1,6 раза увеличивает риск общей смертности [1]. В 2018 г. Управление по контролю качества пищевых продуктов и лекарственных средств США (Food and Drug Administration, FDA) [2] причислило ОА к серьезным заболеваниям, требующим как можно более ранней диагностики и адекватной терапии [3].
ОА ассоциирован с коморбидностью и полипрагмазией, что ухудшает течение и прогноз заболевания и ограничивает назначение лекарственных средств [4, 5]. Именно структура коморбидности определяет высокий риск смерти в популяции, увеличение числа госпитализаций, нарушение физического и психического здоровья, исход заболевания и более низкие показатели качества жизни. Систематический обзор и метаанализ 42 обсервационных исследований продемонстрировали, что общая распространенность любого хронического заболевания среди лиц с ОА составила 66%: у 29% пациентов имелось одно сопутствующее заболевание, у 25% – 2, а у 24% – более 3. Наиболее часто регистрировалась патология сердечно-сосудистой (35%), скелетно-мышечной (34%) и нервной системы (30%), а также верхних отделов желудочно-кишечного тракта (19%). Ведущими хроническими заболеваниями были артериальная гипертензия (АГ) (50%), дислипидемия (48%), боли в спине (33%), заболевания щитовидной железы (26%) и депрессия (17%) [4].
У пациентов с ОА и высокой коморбидностью выбор терапии должен основываться на использовании наиболее безопасных препаратов, персонализированном подходе при оценке риска развития побочных эффектов, назначении минимально эффективных доз и локальных форм лекарственных средств в сочетании с нефармакологическими методами терапии [6]. Поиск высокоэффективного лекарственного препарата с благоприятным профилем безопасности, соответствующий современным принципам лечения ОА, остается актуальной задачей [7].
В настоящее время, к сожалению, так и не решена проблема лечения больных пожилого и старческого возраста, которые в связи с высокой коморбидностью вынуждены получать большое количество лекарственных средств. Так, у лиц 60–69 лет полипрагмазия встречается в 7,4–28,6%, в возрасте ≥80 лет – в 18,6–51,8% случаев. Пациентам старших возрастных групп при наличии двух сопутствующих заболеваний в 20,8% случаев одновременно назначаются от 4 до 9 препаратов и в 1,1% – от 10 и более; пациентам с шестью и более сопутствующими заболеваниями – 47,7 и 41,7% соответственно [7]. При назначении лекарств в гериатрической практике необходимо помнить, что у пожилых людей более высока вероятность возникновения серьезных нежелательных явлений (НЯ) и непрогнозируемых лекарственных взаимодействий из-за полипрагмазии и физиологических изменений организма. Исследования, проведенные в разных странах мира, свидетельствуют, что НЯ при приеме одного лекарственного средства у пожилых возникают в 10%, при приеме более 10 препаратов – практически в 100% случаев, а летальность при этом приближается к 10% [7]. В процессе старения угнетается ферментативная активность печени, уменьшаются клубочковая фильтрация и содержание жидкости и мышечной массы, изменяется чувствительность рецепторов, снижается холинергическая передача, повышается проницаемость гематоэнцефалического барьера. Эти особенности организма приводят к изменению фармакокинетики и фармакодинамики лекарственных средств, значительно повышая частоту развития НЯ.
В условиях реальной клинической практики существуют лекарственные препараты, отличающиеся благоприятным профилем безопасности, применение которых позволяет достигать терапевтического эффекта у пациентов с ОА и коморбидными заболеваниями.
Медикаментозная терапия ОА, согласно последним рекомендациям ESCEO [8] и Федеральным клиническим рекомендациям [9], включает в первую очередь применение симптоматических препаратов замедленного действия (Symptomatic Slow Activity Drugs for Osteoarthritis, SYSADOA), которые считаются препаратами выбора при терапии ОА, в том числе при наличии противопоказаний для назначения нестероидных противовоспалительных препаратов (НПВП), поскольку участвуют в подавлении катаболического воспаления, лежащего в основе прогрессирования ОА, и обладают собственным анальгетическим эффектом [10]. В России на протяжении длительного времени в лечении ОА используется оригинальный стандартизированный биоактивный концентрат мелких морских рыб (БКММР), также относящийся к SYSADOA.
Несмотря на длительную историю изучения и большое количество работ, посвященных оценке эффективности и безопасности применения БКММР у пациентов с ОА коленного сустава, безусловный интерес представляет изучение особенностей фармакотерапии пациентов разных возрастных групп.
Цели исследования:
- основная – оценить эффективность и безопасность БКММР у пациентов старческого возраста с ОА коленного сустава и высокой коморбидностью;
- дополнительная – оценить эффективность терапии в течение периода наблюдения.
МАТЕРИАЛ И МЕТОДЫ
В исследовании приняли участие 20 больных с диагнозом ОА коленного сустава, установленным в соответствии с критериями ACR и подтвержденным рентгенологическим исследованием, которые наблюдались врачом-ревматологом в амбулаторных условиях с января 2021 г. по декабрь 2022 г. Средний возраст обследованных равнялся 77,6 (75,8; 80,5) лет.
Длительность исследования составила 12 мес, число визитов – 3: В0 – день 1 (визит включения в исследование и начала терапии); В1 – 21-й день терапии, В2 – через 12 мес от начала лечения.
Критерии включения: подписанное информированное согласие на участие в исследовании, пациенты в возрасте от 75 лет и старше с OA коленного сустава по критериям ACR (1986 г.), с болью в коленном суставе не менее 40 мм по визуальной аналоговой шкале (ВАШ), II или III рентгенологической стадией по Келлгрену–Лоуренсу, потребностью в приеме НПВП в стабильной дозе не менее 30 дней в предшествующие 3 мес.
Критерии невключения: аллергические реакции на морепродукты, остеонекроз суставных поверхностей, внутрисуставное введение любых препаратов в течение предшествующих 6 нед, прием SYSADOA менее чем за 3 мес до начала исследования, травмы и/или операции на коленном суставе в анамнезе, непереносимость компонентов, входящих в состав БКММР.
Работа была одобрена локальным этическим комитетом ФГБОУ ВО «Кемеровский государственный медицинский университет» Минздрава России. Исследование выполнялось в соответствии с требованиями Хельсинской декларации Всемирной медицинской ассоциации об этических принципах проведения медицинских исследований с участием человека в качестве субъекта (с изменениями от 2013 г.).
Клиническая характеристика пациентов, включенных в исследование, представлена в таблице 1.
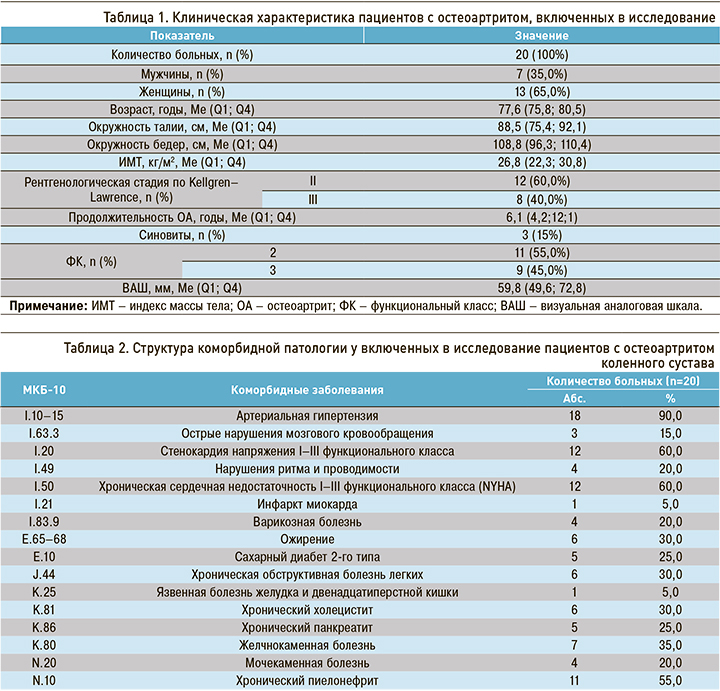
У всех пациентов был проведен анализ коморбидной патологии (табл. 2). Ведущее место в структуре сопутствующих заболеваний занимали болезни сердечно-сосудистой системы: артериальная гипертензия (90,0%), стенокардия напряжения (60,0%) и хроническая сердечная недостаточность (60,0%). Несколько реже встречались хронический пиелонефрит (55,0%), желчнокаменная болезнь (35,0%), хроническая обструктивная болезнь легких (30,0%), ожирение (30,0%), сахарный диабет 2-го типа (25,0%). В среднем у одного больного было зарегистрировано 5,4+0,8 коморбидных заболеваний.
Влияние коморбидной патологии на отдаленный прогноз оценивалось с помощью индекса коморбидности Charlson. Этот индекс представляет собой балльную оценку (от 0 до 40) наличия сопутствующих заболеваний и используется для прогноза 10-летней летальности, которая в отсутствие коморбидности составляет 12%, при 1–2 баллах – 26%, 3–4 баллах – 52%, ≥5 баллах – 85%.
Лекарственную терапию для лечения коморбидной патологии получали все участники исследования. Установлено, что пациенты принимали 5,2±1,3 различных препаратов, что указывает на наличие у них полипрагмазии. Наиболее часто больным назначались блокаторы ренин-ангиотензиновой системы – 12 (60,0%), диуретики – 8 (40,0%), антитромботические (антикоагулянты и антиагреганты) – 7 (35,0%), бета-адреноблокаторы – 6 (65,8%), антагонисты кальция – 6 (30,0%), агонисты имидазолиновых рецепторов – 5 (25,0%), пероральные сахароснижающие препараты (метформин) – 4 (20,0%), ингибиторы протонной помпы совместно с приемом НПВП – 20 (100%).
Все пациенты получали инъекции БКММР ежедневно по 1 мл внутримышечно курсами по 20 дней с 6-месячным интервалом (в сумме 2 курса).
Эффективность терапии оценивалась на всех визитах с помощью индекса WOMAC, позволяющего самому пациенту указать выраженность симптомов ОА (боль, скованность, функциональная активность) с использованием ВАШ. Ответом на проводимую терапию считалось уменьшение боли по ВАШ на ≥20% от исходного уровня.
На каждом визите проводился сбор жалоб и анамнеза, оценивались объективный статус, интенсивность болевого синдрома, потребность в приеме НПВП, переносимость проводимой терапии и динамика лабораторных показателей (общий анализ крови, глюкоза, общий холестерин, АСТ, АЛТ, креатинин с расчетом СКФ).
Статистический анализ проводился с помощью программного пакета STATISTICA версии 6.1.478.0 для Windows компании StatSoft, Inc. (США). Полученные результаты были обработаны непараметрическими и параметрическими методами. Различия считались статистически значимыми при р≤0,05.
РЕЗУЛЬТАТЫ
Установлено, что на фоне приема БКММР у подавляющего большинства больных отмечалось существенное уменьшение боли по шкале ВАШ. Так, количество пациентов, ответивших на терапию уменьшением боли в коленном суставе по ВАШ на 20% и более, к В1 составило 13 (65,0%), к В2 – 12 (60,0%) человек.
Выявлено статистически значимое снижение суммарного индекса WOMAC на всех визитах по сравнению с показателями, полученными при включении пациента в исследование: В0 – 1125±135,0, В1 – 647±229,0, В2 – 642±224,0 (р ≤0,001).
Улучшение самочувствия больных привело к существенному уменьшению потребности в НПВП. Исходно, с учетом выраженного болевого синдрома, все участники исследования были вынуждены использовать эту группу препаратов. К В1 отказались от приема НПВП 6 (30,0%), к В2 – 7 (35,0%) пациентов. Статистически значимое снижение количества дней приема НПВП было достигнуто через 12 мес после начала терапии и составило 5 (0; 10) дней за 1 мес против 14 (7; 15) дней на момент начала исследования (р=0,005).
Индекс Charlson составил 1–2 балла у 2 (10,0%) пациентов, 3–4 балла – у 14 (70,0%), ≥5 баллов – у 4 (20,0%), что свидетельствует о 26; 52 и 85% вероятности наступления смерти в ближайшие 10 лет соответственно (при отсутствии коморбидности – 12%).
Клинически значимых изменений основных гематологических и биохимических показателей за весь период исследования зарегистрировано не было (табл. 3).
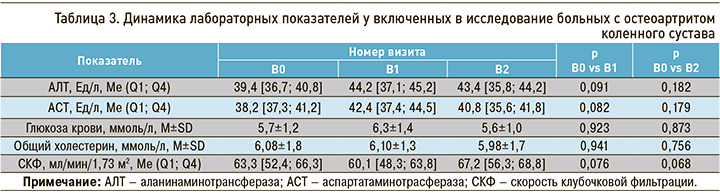
Наблюдалось однократное повышение уровня АЛТ и АСТ у 2 (10,0%) больных на В2. Значения указанных лабораторных показателей не превышали верхнюю границу нормы более чем в 2 раза, что не потребовало отмены или коррекции лечения.
У 2 (10,0%) пациентов с сахарным диабетом 2-го типа была зарегистрирована декомпенсация заболевания, что потребовало консультации эндокринолога и коррекции сахароснижающей терапии. Однако у остальных пациентов, как с этим заболеванием, так и без установленного диагноза, не отмечалось клинически значимого повышения глюкозы. Эти данные подчеркивают безопасность терапии БКММР и указывают на возможность назначения препарата пациентам с сахарным диабетом 2-го типа.
Повышение артериального давления (АД) было выявлено у 4 (20,0%) участников исследования, из них у 1 (5,0%) пациента после первой инъекции имело лишь кратковременное однократное повышение АД не более чем на 10% от исходных цифр, не потребовавшее коррекции антигипертензивной терапии и купировавшееся приемом моксонидина 0,2 мг. У 1 (5,0%) больного произошла декомпенсация артериальной гипертензии, что потребовало коррекции антигипертензивной терапии.
О появлении головокружения на В1 сообщил 1 (5,0%) участник исследования. На В2: наличие головной боли отметили 2 (10,0%) пациента, в одном случае (5,0%) был зафиксирован дискомфорт в эпигастрии и тошнота. Данные явления, по мнению пациентов, не были связаны с приемом исследуемого препарата. Указанные симптомы носили кратковременный характер, разрешились самостоятельно и не потребовали изменения или отмены терапии.
За время наблюдения не наблюдалось случаев аллергических и местных реакций на введение препарата. У одного пациента была выявлена болезненность в месте постановки инъекции.
Серьезных НЯ за весь период наблюдения зарегистрировано не было.
ОБСУЖДЕНИЕ
В России широко применяется многокомпонентный препарат из группы SYSADOA – оригинальный препарат Алфлутоп®, представляющий собой стандартизированный раствор для инъекций на основе БКММР. Действие его хорошо изучено в доклинических исследованиях in vivo на различных животных моделях и in vitro.
Согласно результатам исследований, препарат демонстрирует интегрированное влияние на патологические процессы, специфичные для ОА: замедляет деградацию хрящевой ткани (ингибирование экспрессии протеаз и гиалуронидазы); интенсифицирует анаболические процессы (увеличение синтеза аггрекана и гиалуроновой кислоты); обладает противовоспалительным эффектом (угнетение высвобождения интерлейкинов 6 и 8, сосудистого эндотелиального фактора роста, подавление экспрессии циклооксигеназы-2, регуляция экспрессии генов провоспалительных цитокинов); оказывает антиоксидантное действие; влияет на фосфорно-кальциевый обмен (уменьшение резорбции кости и снижение потери ионов кальция) [11].
Эффективность и безопасность препарата Алфлутоп® подтверждена многочисленными доклиническими и рандомизированными клиническими исследованиями. Так, в работах Л.И. Алексеевой с соавт. продемонстрирована высокая безопасность БКММР у пациентов с ОА коленного сустава [11, 12]. За двухлетний период лечения серьезных НЯ на фоне его применения зарегистрировано не было. Отмечались лишь единичные случаи клинически незначимых изменений АЛТ, АСТ, гамма-глутамилтранспептидазы и повышение уровня глюкозы, которые не потребовали отмены препарата.
Относительная безопасность применения БКММР была показана и в исследовании Л.К. Пешехоновой с соавт., в котором наблюдались единичные НЯ со стороны желудочно-кишечного тракта. НЯ (гастралгия, тошнота, диарея и метеоризм) были легкими и купировались симптоматическими лекарственными средствами [13].
Высокий профиль нефробезопасности препарата Алфлутоп® продемонстрирован в работе Н.В. Ворониной с соавт.: в когорте пациентов с ОА коленного сустава и сопутствующей ХБП I–II стадии нефротоксические эффекты при применении БКММР отсутствовали [14].
Несмотря на то что речь идет об использовании многочисленных инъекций, местные НЯ при введении БКММР развиваются редко (в среднем у 1–13% пациентов). Чаще всего отмечается возникновение боли в месте инъекции, которая не требует назначения анальгетиков и отмены терапии [15].
Результаты настоящего исследования, выполненного на когорте пациентов старческого возраста с высокой коморбидностью, свидетельствуют об отсутствии клинически значимых НЯ при применении БКММР и вполне согласуются с данными ранее выполненных работ.
Заключение
Результаты проведенного исследования демонстрируют эффективность БКММР у больных с ОА коленного сустава и подтверждают безопасность его применения у пациентов старческого возраста с высокой коморбидностью, что позволяет рассматривать его в качестве препарата первой линии в комплексной терапии ОА.



