ВВЕДЕНИЕ
Сон – одно из наиболее сложно организованных состояний живого организма. Это состояние является значимым фактором нормального функционирования, поэтому при различных расстройствах сна можно наблюдать изменения не только поведения человека, но и важных физиологических функций, обеспечивающих его жизнедеятельность. Самым распространенным из расстройств сна выступает инсомния, которая оказывает влияние как на психическое здоровье, так и физическое благополучие человека.
Инсомния как расстройство характеризуется присутствием одного или нескольких симптомов, нарушающих ночной сон. Среди них выделяют затруднение засыпания, частые ночные пробуждения с трудностями инициации сна и ранние утренние пробуждения. Эти симптомы должны возникать не менее 3 раз в неделю при условии, что одновременно соблюдаются все необходимые условия для нормального сна (время, отведенное для сна, тихая и затемненная комната, лишенная отвлекающих факторов). Также к необходимым критериям постановки диагноза инсомнии относятся «дневные» жалобы – неудовлетворенность сном и наличие негативных последствий недостаточного сна (сниженный уровень внимания, памяти, обеспокоенность своим сном и т.д.). В соответствии с Международной классификацией расстройств сна 3-го пересмотра (МКРС-3) инсомнию принято разделять на 3 формы: острую, хроническую и неуточненную. Границей между острой и хронической инсомнией служит временной промежуток в 3 мес [1].
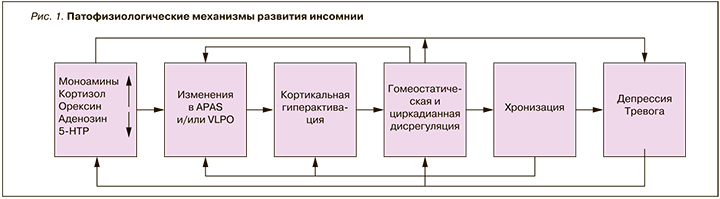
Инсомния является следствием нарушения работы системы, обеспечивающей цикл «сон–бодрствование». Переключение между этими фазами описывает модель «качелей», предложенная К. Сейпером в 2001 г. [2]. Согласно ей, в центральной нервной системе (ЦНС) можно выделить две популяции нейронов, одна из которых отвечает за поддержание бодрствования, другая – за поддержание сна. К первой системе относят глутаматергические нейроны ядра моста и парабрахиальных ядер, гистаминергические нейроны туберомаммилярных ядер, холинергические нейроны среднего мозга и педункулопонтинных ядер, моноаминергические и орексинергические нейроны задних ядер гипоталамуса, а также структуры восходящей активирующей ретикулярной формации. В свою очередь, одной из основных систем, обеспечивающих сон, выступает ГАМКергическая система вентролатеральных преоптических ядер (вентролатеральная преоптическая область, ВЛПО) [3]. Для объяснения развития стойких нарушений сна при инсомнии высказывается предположение о наличии дисбаланса в работе этих систем [4]. Иными словами, согласно теории Сейпера, сторона качелей, отвечающая за поддержание бодрствования, превосходит по «весу» противоположную сторону.
Выделяют острую и хроническую формы инсомнии. Острая (кратковременная) инсомния развивается в результате определенного стрессогенного воздействия, вследствие чего увеличивается общий уровень активации ЦНС. Продолжительность этой формы инсомнии не превышает 3 мес. Диагноз хронической инсомнии, соответственно, устанавливается при длительности заболевания более этого срока. Схематическое изображение механизмов возникновения и хронизации инсомнии представлено на рисунке 1.
ИНСОМНИЯ И СОПУТСТВУЮЩИЕ ЗАБОЛЕВАНИЯ
Распространенность инсомнии среди людей старше 50 лет варьирует в пределах от 9 до 17% в зависимости от выборки. Одной из основных ее характеристик является снижение продолжительности сна – как субъективно ощущаемой пациентом, так и подтверждающейся объективными методами. Также с помощью ночной полисомнографии было продемонстрировано, что у пациентов, страдающих инсомнией, отмечаются более высокий индекс активаций в ночное время, сниженная эффективность сна (показатель, отражающий отношение времени сна к времени, проведенному в постели), а снижение общего времени сна при этом достигается за счет уменьшения глубокого медленно-волнового сна и фазы быстрого сна (ФБС) [5]. Сокращение времени сна может приводить к соматическим и психическим заболеваниям. Например, было показано, что у людей, испытывающих недостаток ночного сна (менее 5 ч за ночь) на 26% повышается риск развития сердечно-сосудистых заболеваний [6].
Риск развития инсомнии увеличивается, если у человека есть хронические заболевания. При наличии только одного заболевания указанный риск повышается в 1,41, двух – в 2,55, трех – в 3,22, четырех – в 7,62 раза. Если взять соматические формы патологии, то, согласно данным исследования по проблемам старения в Европе (COURAGE), наиболее часто жалобы на расстройства сна инсомнического характера встречаются у пациентов с артериальной гипертензией (30,3% респондентов), сахарным диабетом (7,8%) и артритом (14,2%) [7].
Сахарный диабет 2-го типа
Одно из серьезных последствий длительно текущей инсомнии – повышение риска развития сахарного диабета 2-го типа (СД 2). В исследовании Vgontzats A. et al. была проведена оценка риска развития этого заболевания при симптомах инсомнии. Авторы показали, что у пациентов с наличием инсомнии наблюдается повышение риска развития диабета (относительный риск 2,95) в сравнении с теми, кто не предъявляет жалоб на расстройство сна и у кого привычная продолжительность сна составляет >6 ч [8]. Обсуждается, что одним из ведущих механизмов развития СД 2 на фоне хронической инсомнии выступает снижение чувствительности к инсулину периферических тканей, развивающееся при ограничении сна [9]. В то же время, основываясь на данных метаанализа, включившего 71 исследование, было показано, что распространенность бессонницы и ее симптомов у людей с СД 2 типа составляет 39%; это в 4 раза выше, чем в общей популяции. Распространенность инсомнии была еще выше с увеличением возраста (44%) или при наличии сопутствующих заболеваний (60%) [39]. Как было продемонстрировано в исследовании COURAGE, ожирение сопровождается инсомнией у 14,4% респондентов [7]. В связи с этим уместно вспомнить, что распространенность ожирения в России составляет 27,5% среди мужчин и 31,4% среди женщин (у взрослых) [10]. Наличие тесной взаимосвязи между ожирением и инсомнией объясняют снижением уровня грелина (гормона, отвечающего за чувство голода) и повышением уровня лептина (гормона, отмечающего за чувство сытости) на фоне снижения количества и качества сна.
Артериальная гипертензия
Другое соматическое заболевание, нередко сопровождающееся жалобами на инсомнию, – артериальная гипертензия (АГ). Как было продемонстрировано в исследовании Suka M. et al., наличие инсомнии повышает риск развития этого заболевания в ближайшие 4 года почти в 2 раза. При этом немаловажен характер симптомов у пациента: при наличии жалоб на затруднение инициации сна риск развития АГ повышался в 1,96 раза, при жалобах на частые ночные пробуждения – в 1,88 раз [11]. Примечательно то, что связи между ранними ночными пробуждениями и повышением риска развития этого состояния выявлено не было.
Важно отметить, что хроническая инсомния не только служит фактором риска развития АГ, но и утяжеляет ее течение. Clark A. et al. продемонстрировали, что пациенты с инсомнией и начальной АГ чаще нуждаются в медикаментозном лечении (в том числе диуретиками, бета-блокаторами, блокаторами кальциевых каналов), чем пациенты, не имеющие жалоб на нарушение сна (сравнение проводилось в однородных по другим факторам риска группах) [12]. В исследовании Ramos A. et al., где также оценивалась зависимость тяжести АГ от выраженности инсомнии, было обнаружено, что чем сильней симптомы последней, тем тяжелее протекает АГ; это обстоятельство, наряду с прочим, вызывает необходимость расширения медикаментозной поддержки. Также было продемонстрировано, что для пациентов с инсомнией характерно нарушение суточного профиля артериального давления (АД) по нон-диппер-типу, когда АД в ночное время снижается в недостаточной степени (менее чем на 10% от дневного уровня) [13].
Определить патофизиологические механизмы развития АГ при инсомнии окончательно пока не удалось. Считается, что главную роль при этом играет увеличение активности симпатической части вегетативной нервной системы, следствием чего становится нарушение работы ренин-ангиотензин-альдостероновой и гипоталамо-гипофизарно-надпочечниковой систем, а это, в свою очередь, вызывает постепенное нарастание АД и развитие толерантности к его высоким значениям [14]. Немаловажным фактором также является нарушение иммунных механизмов. Burgos I. et al. показали, что при инсомнии в плазме крови повышается уровень интерлейкина 6 (провоспалительного цитокина), что впоследствии ведет к реакции системного воспаления и более интенсивному нарастанию атеросклеротических бляшек на эндотелии сосудов [14].
Ревматоидный артрит
Часто инсомния встречается и при ревматоидном артрите (РА) – аутоиммунном заболевании, которое проявляется симметричным полиартритом с деформацией суставов и вызывает раннюю утрату трудоспособности. По данным Louie G. et al., именно инсомния является наиболее частым коморбидным состоянием при РА (32,1% в группе с РА и 13,9% в контрольной группе) [15]. При этом проявления инсомнии во многом связаны, скорее, не с активностью аутоиммунного процесса, а со степенью выраженности болевого синдрома. Также Bjurstrom М. et al. акцентируют внимание на взаимосвязи между выработкой провоспалительных цитокинов и качеством сна. При повышении эффективности сна и снижении выраженности жалоб у пациентов с РА отмечалось уменьшение уровня фактора некроза опухоли-альфа и интерлейкина 6 (маркеров, отражающих степень активности аутоиммунного процесса) [16]. В другом исследовании было продемонстрировано, что при снижении активности аутоиммунного процесса (независимо от выраженности болевого синдрома) субъективная эффективность сна у пациентов с РА повышалась [17]. Правда, несмотря на субъективное улучшение качества сна, при проведении полисомнографического исследования у этих пациентов не удалось обнаружить значительного изменения структуры и продолжительности сна.
Депрессия
Еще одним заболеванием, часто сопутствующим инсомнии, является депрессия. Показано, что инсомния выступает провоцирующим фактором развития депрессии в будущем, а наличие этого расстройства сна у пациентов с депрессией приводит к более тяжелому течению психического заболевания [18]. Ведущей патогенетической моделью, объясняющий коморбидность депрессии и инсомнии, служит «воспалительная теория». Установлено, что при инсомнии на фоне активации симпатического отдела нервной системы и стимуляции β-адренорецепторов повышается экспрессия ядерного фактора-каппа В, что приводит к увеличению продукции фактора некроза опухоли-альфа и интерлейкина-6, которые, в свою очередь, также могут спровоцировать депрессию [19]. При этом у пациентов с депрессией, но без инсомнии также наблюдается повышение содержания провоспалительных маркеров, свидетельствующее об обоюдном влиянии воспаления и депрессии [20].
Фактор полипрагмазии
Как отдельный аспект проблемы коморбидности инсомнии с различными заболеваниями рассматривается полипрагмазия – явление, при котором пациенту одновременно назначается 5 препаратов и более. Обнаружено, что у людей, принимающих 5 и более фармакологических средств одновременно, инсомния встречается достоверно чаще (42% против 5,7% у пациентов без полипрагмазии) [21].
Немаловажным фактором является и то, какие именно препараты используются для коррекции основной патологии. Так, антидепрессанты из группы селективных ингибиторов обратного захвата серотонина (СИОСЗ) могут вызывать симптомы инсомнии в среднем у 17% людей, принимающих их на постоянной основе [22]. На фоне приема флуоксетина побочный эффект в виде инсомнии наблюдается у 27% людей, флувоксамина – у 31%; реже всего такое нежелательное явление отмечается при применении циталопрама [23]. Добавим, что при использовании флувоксамина нередко наблюдается и сонливость – в 29% случаев [23].
Среди селективных ингибиторов обратного захвата серотонина и норадреналина (СИОЗСН) инсомния наиболее часто встречается при приеме венлафаксина или дулоксетина – у 24% получающих препарат [24]. Некоторые антидепрессанты, напротив, обеспечивают дополнительный снотворный эффект за счет блокады центральных H1-рецепторов: это тразодон, миансерин, миртазапин и агомелатин [25]. На фоне их применения нередко возникает противоположный инсомнии симптом – избыточная дневная сонливость. Так, при лечении миртазапином в низких дозировках (<30 мг/сут) этот побочный эффект встречался в 54% случаев против 18% в группе плацебо [24]. При приеме тразодона инсомния наблюдалась менее чем в 2% случаев, а вот сонливость – в 46% [25]. В связи с наличием таких свойств эти препараты используют в том числе для лечения хронической инсомнии, хотя их эффективность при этом расстройстве сна пока еще окончательно не определена [25]. Наиболее часто побочное действие в виде сонливости встречается у миртазапина и флувоксамина [23].
Свойствами блокаторов центральных H1-рецепторов со снотворным действием обладают этаноламины дифенилгидрамин и доксиламин. Механизм их действия заключается в снижении активности мозговой гистаминергической системы [3].
Согласно результатам метаанализа 2022 г., при применении доксиламина у пациентов с инсомнией размер эффекта по сравнению с плацебо составил 0,47 (доверительный интервал: 0,006–0,89), а вероятность развития побочных эффектов – 0,61 (для сравнения: у Z-препарата зопиклона аналогичные показатели равнялись 0,58 и 0,81). Убедительность доказательств лечебных эффектов доксиламина в этом исследовании была оценена как средняя [26].
Одним из препаратов доксиламина, доступных в России, является Донормил (ООО «Свикс Хэлскеа»). Он назначается на срок 2–5 дней при наличии жалоб на нарушенный ночной сон. Донормил обладает благоприятным профилем безопасности, вплоть до возможности назначения женщинам на любом сроке беременности [27].
Лекарственными средствами, которые часто назначаются при хронических болевых синдромах при полиартрите, но нарушающими ночной сон, могут оказаться нестероидные противовоспалительные препараты (НПВП). Механизм их действия, напомним, заключается в блокаде циклооксигеназы 1-го и 2-го типа (ЦОГ-1 и ЦОГ-2), что влечет за собой снижение синтеза простагландинов, отвечающих за процесс воспаления. Вместе с тем простагландины участвуют и в регуляции цикла «сон–бодрствование»: например, уровень простагландина D2 возрастает по мере бодрствования, что способствует инициации сна [28]. Механизм воздействия на сон НПВП может заключаться в их влиянии на синтез простагландинов, снижении секреции мелатонина и изменении температуры тела [29]. В исследованиях с применением полисомнографии было продемонстрировано, что при применении ибупрофена или ацетилсалициловой кислоты увеличивается время бодрствования в постели, снижается представленность 2-й и 3-й стадий медленного сна, увеличивается латенция сна [30].
Пациентам с сердечно-сосудистыми заболеваниями часто назначаются препараты из группы β-адреноблокаторов. Среди их нежелательных эффектов также встречается инсомния [31], причем немаловажным фактором ее развития в данном случае выступают физико-химические свойства препаратов. Чаще нарушение сна вызывают β-адреноблокаторы, обладающие высокой липофильностью, а также сопутствующим блокирующим воздействием на 5-НТ2а-рецепторы. В этом плане наиболее выраженным инсомническим побочным действием обладают метопролол, лабеталол и пропранолол, в то время как при приеме бисопролола, небиволола и атенолола риск возникновения инсомнии оказался ниже [32].
Негативное влияние на сон может оказывать и ингибитор АПФ каптоприл – на фоне его использования описаны редкие случаи возникновения инсомнии [33]. При этом такое нежелательное явление во многом связывают со способностью ингибиторов АПФ вызывать сухой кашель [32].
КЛЮЧЕВЫЕ ПОДХОДЫ К ЛЕЧЕНИЮ ИНСОМНИИ
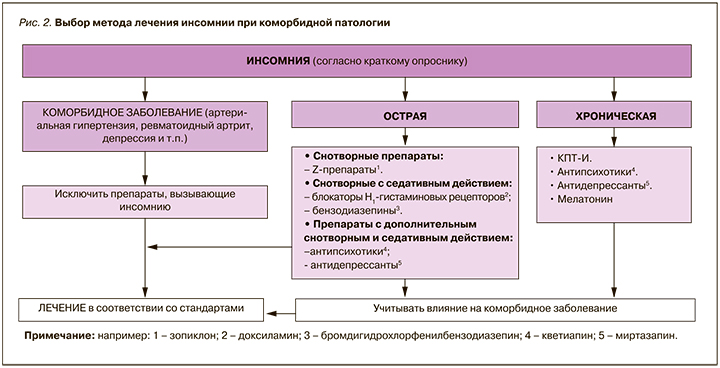
При выборе тактики лечения инсомнии у пациентов с различными коморбидными состояниями следует учитывать не только эффективность различных методов терапии в отношении этого заболевания, но и их влияние на сопутствующую патологию. Более чем в 10% случаев острая инсомния переходит в хроническую форму. Для предотвращения хронизации в период действия стрессового фактора обсуждается возможность назначения лекарственных препаратов со снотворным действием (бензодиазепиновых и небензодиазепиновых ГАМКергических препаратов, блокаторов центральных H1-рецепторов) короткими курсами.
Предпочтительным методом лечения хронической инсомнии служит когнитивно-поведенческая терапия (КПТ-И) [34]. Показано, что улучшение сна на фоне применения этого метода у пациентов с АГ сопровождается снижением уровней как диастолического (до 14 мм рт.ст.), так и систолического АД (до 11 мм рт.ст.) [35]. КПТ-И оказывается эффективной методикой и при лечении инсомнии, коморбидной с депрессией. При длительном (на протяжении 3 лет) наблюдении соответствующих пациентов улучшение сна при применении КПТ-И было более стойким, чем при назначении антидепрессантов [36], тем более что применение антидепрессивных средств в качестве снотворных пока недостаточно убедительно обосновано. У пожилых людей с депрессией и нарушением сна на фоне КПТ-И отмечалось как снижение тяжести инсомнии, так и симптомов психического заболевания [37]. Также при лечении инсомнии на фоне депрессии рекомендуется ограничить применение бензодиазепиновых и небензодиазепиновых агонистов ГАМКА-рецепторного комплекса (в том числе Z-препаратов) ввиду того, что они могут ухудшать течение основного заболевания [26].
Другая группа средств, используемых для лечения инсомнии при коморбидных состояниях, представлена препаратами, содержащими мелатонин. При приеме мелатонина отмечается достоверное уменьшение латенции сна и увеличение его качества относительно плацебо. Несмотря на то, что по сравнению с другими снотворными препараты мелатонина обладают меньшим влиянием на показатели сна, значение этих средств не следует недооценивать, поскольку они играют важную роль в регуляции циркадианных (околосуточных) ритмов, а механизм их действия принципиально отличается от эффектов гипнотиков [38].
ЗАКЛЮЧЕНИЕ
Инсомния представляет собой часто встречающееся при любой форме патологии нарушение сна. Наличие этого расстройства отягощает течение сопутствующего заболевания, а успешное устранение часто сопровождается облегчением его течения. Поэтому важно, чтобы в арсенале врача имелся простой скрининговый инструмент (опросник), позволяющий с высокой вероятность предположить наличие инсомнии у данного пациента (табл.). При лечении острой хронической инсомнии, наряду с нефармакологическими (гигиена сна) методами применяют лекарственные, основанные на концепции взаимодействия активирующих и синхронизирующих систем мозга при участии внутренних часов. При выборе тактики лечения острой инсомнии следует учитывать особенности коморбидного заболевания.

Для лечения острой инсомнии в период действия стрессового фактора возможно назначение лекарственных препаратов со снотворным эффектом. Быстрое купирование симптомов инсомнии дает возможность уточнить причины нарушения сна и подобрать этиопатогенетическое лечение, а также внести коррективы в терапию коморбидного заболевания. При этом обсуждается вопрос назначения агонистов ГАМКА-рецепторов с выраженным снотворным действием бензодиазепиновой и небензодиазепиновой структуры (зопиклон, бромдигидрохлорфенилбензодиазепин), различных антипсихотиков (алимемазин, кветиапин). Одним из препаратов выбора для кратковременного использования при острой инсомнии является блокатор центральных гистаминовых H1-рецепторов доксиламин (Донормил).
Ниже предложен алгоритм маршрутизации больных с острой и хронической инсомнией, который поможет специалисту не упустить важный симптом – инсомнию, которая в свою очередь может влиять на течение основного заболевания (рис. 2).