В настоящее время продолжает увеличиваться количество больных подагрой, что связывают с изменением образа жизни и пищевых привычек населения, увеличением потребления алкоголя, нарушениями питания, гиподинамией и другими факторами, приводящими к метаболическим нарушениям [1]. В Великобритании распространенность этой болезни за период с 2000 по 2005 г. составляла 1,4% [2], а к 2012 г. достигла 2,49% [2, 3]. По итогам Рочестерского проекта, заболеваемость подагрой в США в 1990-х гг. по сравнению с 1970-ми гг. удвоилась, а подагрический артрит сегодня является самой распространенной формой артрита у мужчин [2–4].
Известно, что четвертая часть населения развитых стран мира страдает метаболическим синдромом (МС), при котором наряду с абдоминальным ожирением, дислипидемией, предиабетом или сахарным диабетом и артериальной гипертензией (АГ) часто встречается гиперурикемия. В России встречаемость МС у лиц, страдающих подагрой, составляет в среднем 57% [5–7].
При сравнении частоты коморбидной патологии (сердечно-сосудистые заболевания, болезни почек, гипотиреоз, анемия, псориаз, хронические заболевания легких, остеоартрит, депрессия) у 39 111 пациентов с подагрой и у сопоставимого числа лиц, не страдавших этой болезнью, было показано, что различные коморбидные заболевания достоверно чаще регистрировались при наличии гиперурикемии. При этом среднее время до появления нового коморбидного состояния после первого приступа подагрического артрита уменьшается почти втрое по сравнению с аналогичным показателем у лиц с отсутствием подагры (43 и 111 мес соответственно). Приведенные данные подтверждают тот факт, что с увеличением длительности течения подагры нарастает количество коморбидных заболеваний [6]. Помимо высокой распространенности коморбидной патологии, подагра характеризуется смертностью, превышающей популяционную.
Наличие взаимосвязи подагры и гиперурикемии с коморбидной патологией демонстрируют как крупномасштабные исследования (PIUMA, NHANES I, III, LIFE), так и проведенные сравнительные исследования и метаанализы [7–21]. Российские данные, посвященные изучению оcобенностей течения подагры и основных ее форм, немногочисленны и представляют особый интерес.
Цель настоящего исследования – на основании данных регистра пациентов с подагрой в Санкт-Петербурге за 2016–2018 гг. оценить особенности течения подагрического артрита (ПА) и встречаемость сердечно-сосудистых и почечных коморбидных состояний.
МАТЕРИАЛЫ И МЕТОДЫ
Оценка особенностей течения ПА, изучение наличия и распространенности сопутствующей сердечно-сосудистой и почечной патологии проводились на основании медицинских документов пациентов, обратившихся в Санкт-Петербургский городской центр подагры с активным подагрическим артритом в период с 01.01.2016 по 31.12.2018 и включенных в городской регистр больных подагрой. Включение пациентов в исследование проводилось при наличии информированного согласия на использование их анонимизированных данных, получаемых при обследовании и обработке медицинской документации.
В регистр включали эпидемиологические данные (возраст, пол, социальный статус больного), сведения о первичной или вторичной природе подагры, особенностях течения артрита (острый, хронический, рецидивирующий), специфике текущего приступа подагрического артрита, по поводу которого пациент обратился в центр подагры (острый артрит, затяжной приступ, хронический артрит), данные о лабораторных показателях (уровень общего холестерина (ммоль/л), мочевой кислоты (мкмоль/л), мочевины (ммоль/л) и креатинина (мкмоль/л) сыворотки крови, экскреция мочевой кислоты и креатинина с мочой). На основании полученных данных устанавливали варианты развития ПА (гиперсекреторный или гипоэкстреторный). Наряду с этим учитывали скорость клубочковой фильтрации (СКФ – EPI) и стадию хронической болезни почек (ХБП) согласно классификации K/DOQI (2002, 2006, 2007), а также наличие ишемической болезни сердца (ИБС), артериальной гипертензии, сахарного диабета и традиционных факторов риска сердечно-сосудистых заболеваний. В регистр вносили сведения о лечении подагрического артрита и коморбидных состояний (данные представлены частично).
Регистр был сформирован на базе облачной электронной системы хранения данных GALENOS (©OOO «TexЛаб»). Формирование регистра подагры было одобрено комитетом по этике Клинической ревматологической больницы № 25 (Санкт-Петербург). Все данные вносились и хранились в системе в анонимном виде, не позволяющем идентифицировать отдельного пациента как личность.
Статистический анализ проведен с использованием программ Microsoft Office Exсel 2007 (Microsoft Corp., США) и STATISTICA 8.0 (StatSoft Inc, США). Характер распределения данных оценивали графическим методом и с использованием критерия Шапиро–Уилка. В случае нормального распределения признака его описывали в виде среднее ± стандартное отклонение (M±SD). При описании признаков, отличных от нормального распределения, результаты были представлены в виде Ме [Q1; Q3], где Me – медиана, Q1 и Q3 – первый и третий квартили. При характере распределения данных, отличном от нормального, применяли непараметрические методы: критерий Манна–Уитни, критерий Вальда–Вольфовица, критерий χ2, критерий Вилкоксона, критерий знаков. Корреляционные взаимосвязи между количественными признаками рассчитывались с применением коэффициентов корреляции Спирмена или Пирсона. Различия и взаимосвязи считали достоверными при p ≤0,05.
РЕЗУЛЬТАТЫ
Суммарно в регистр было включено 1445 пациентов, из которых 462 пациента с ПА имели полный набор необходимых для настоящей работы сведений и были включены в статистический анализ (табл. 1).
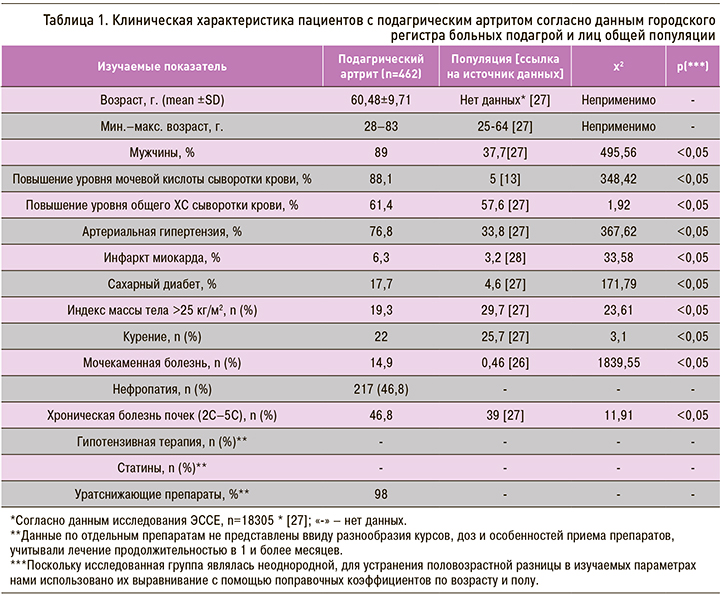
В группе пациентов с ПА, включенных в регистр, первичная форма подагры была диагностирована в 94,8% случаев. При этом хронический ПА наблюдался у 65,2% обратившихся в городской центр подагры, острый артрит – у 3,2% пациентов. Тофусная подагра была установлена у 31,6% больных. Умеренная функциональная недостаточность суставов (ФНС) выявлялась у 98,5% пациентов с ПА, легкая – у 0,2%, выраженная – у 1,3% больных.
Средний уровень мочевой кислоты (МК) у пациентов с ПА на момент госпитализации составил 545±115 мкмоль/л, при этом у 88,1% из них наблюдалось значимое повышение этого показателя по сравнению с показателями нормы. Механизм накопления МК в 40,5% случаев был расценен как метаболический, в 0,9% – как гипоэкскреторный, в 30,7% – как смешанный. Еще в 27,9% он остался не определенным.
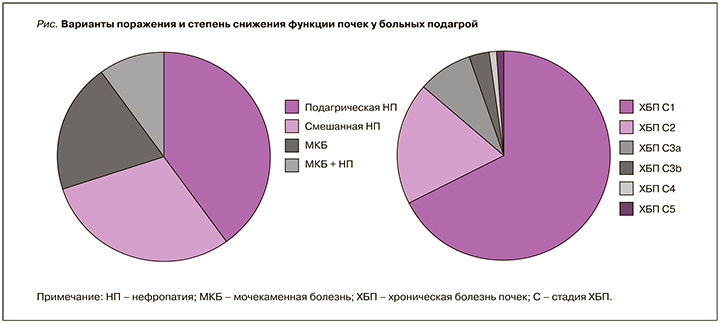
Нефропатия была выявлена у 46,8% больных ПА (у 28,6% – подагрическая, у 18,2% – смешанная), мочекаменная болезнь (МКБ) – у 14,9% пациентов, а сочетание МКБ и нефропатия наблюдалось в 6,3% случаев. ХБП С1 стадии установили у 31,4%, С2 стадии – у 9,3%, С3а стадии – у 3,7%, С3б стадии – у 1,7%, С4 стадии – у 0,4%, С5 стадии – у 0,2% пациентов (рис. 1).
Одно сопутствующее заболевание было диагностировано у 37,5% больных ПА, два – у 37,9%, три – у 18,2%, четыре – у 5,8%, пять – у 0,6% пациентов.
Для купирования обострения ПА нестероидные противовоспалительные препараты (НПВП) использовались в 85,3%, глюкокортикостероиды (ГКС) – в 37,4% случаев, сочетанное применение НПВП и ГКС потребовалось у 25,1% пациентов, колхицин применялся в 6% случаев (до 2018 г. препарат не был зарегистрирован). Плазмаферез выполнялся 69 (15%) пациентам с ПА.
Средний уровень холестерина (ХС) в группе больных ПА составил 5,4±1,2 ммоль/л, при этом в 61,4% случаев он был повышенным. Взаимосвязей между уровнями МК и ХС выявить не удалось (r Спирмена = -0,08, p <0,05).
Уратснижающая терапия, проводившаяся в амбулаторных условиях, включала аллопуринол (432 пациента; 94%) или фебуксостат (12 больных; 3%).
ОБСУЖДЕНИЕ
В ходе проведенного исследования были получены данные, свидетельствующие о высокой частоте некомпенсированной гиперурикемии у пациентов с обострением ПА, направляемых на госпитализацию в Центр подагры Санкт-Петербурга. При этом у них значительно чаще выявлялись сердечно-сосудистые заболевания и болезни почек (АГ, ИБС с инфарктом миокарда, ХБП с хронической почечной недостаточностью) по сравнению с лицами общей популяции. Согласно данным регистра, 17,7% больных ПА имели сахарный диабет, тогда как у людей, не страдающих подагрой, он отмечался лишь в 4,2% случаев. Это подтверждает важную роль гиперурикемии в патогенезе МС, занимающего ведущее место в развитии и прогрессировании АГ и ИБС.
Интересным представляется и то, что более высокая встречаемость сердечно-сосудистых событий в сочетании с ПА наблюдалась при сопоставимом уровне общего холестерина в сыворотке крови у больных ПА и лиц общей популяции. При этом в группе пациентов с ПА не удалось выявить взаимосвязи между содержанием общего холестерина и мочевой кислоты, что косвенно может свидетельствовать о самостоятельной роли гиперурикемии в повышении риска кардиоваскулярной заболеваемости [27, 29]. Подтверждением этому служит тот факт, что в проведенном нами исследовании АГ была выявлена у 76,8% пациентов с ПА. Эти данные согласуются с результатами многоцентрового исследования коморбидности при подагре [11], в котором АГ была установлена у 75% пациентов с ПА. Однако в ряде источников литературы приводятся сведения о том, что частота АГ у больных подагрой колеблется от 36 до 41%, хотя при сочетании с МС она увеличивается до 72% [22].
Известно, что развитие АГ при подагре патогенетически связано с поражением почек. В связи с этим вопрос развития уратной нефропатии и нарушения функции почек у пациентов с первичной подагрой вызывает особый интерес. По данным разных авторов, частота образования уратных камней у больных подагрой варьирует от 10–20 до 50% [26] и значимо превышает показатели в общей популяции. В исследовании H.J. Kramer et al. частота нефролитиаза была почти в 2 раза выше у мужчин, больных подагрой, чем у мужчин без подагры (15 и 8% соответственно) [26]. В нашей когорте больных ПА частота МКБ составила 14,9%, что соответствует данным литературы. В целом ряде исследований приводятся данные о том, что уратная нефропатия выявляется у 30–70% больных подагрой, при этом хроническая почечная недостаточность развивается у 48% пациентов [13, 26].
Доказано, что азотовыделительная функция почек снижается по мере увеличения возраста больных подагрой и длительности болезни. При этом снижение функции почек коррелирует с индексом тяжести подагры и его компонентами (числом пораженных суставов, наличием тофусов и длительностью последнего обострения). Следует отметить, что наши данные о частоте развития нефропатии у больных ПА (46,8%) согласуются с исследованиями ряда авторов [26]. В двух когортных исследованиях, суммарно включавших 13 388 человек, D. Weiner et al. было установлено, что повышение уровня МК в сыворотке крови пациентов с подагрой на каждый 1 мг/дл ассоциировалось со значимым увеличением риска развития ХБП (отношение шансов 1,07 при 95% доверительном интервале от 1,01 до 1,14 для скорости клубочковой фильтрации и 1,11 при 95% доверительном интервале от 1,02 до 1,21 для уровня креатинина в сыворотке крови). В другом исследовании (22 000 здоровых лиц) был проведен анализ развития ХБП в зависимости от наличия умеренной (7–8,9 мг/дл или 416–529 ммоль/л) и тяжелой степени гиперурикемии (>9 мг/дл или >535 ммоль/л), который показал, что риск ХБП был высок как у лиц с умеренно повышенным уровнем МК в крови, так и с тяжелой степенью гиперурикемии [13].
Приведенные материалы собственного исследования и данные литературы подтверждают необходимость коррекции гиперурикемии не только для предотвращения повторных приступов ПА, но и в целях профилактики коморбидных заболеваний сердечно-сосудистой системы, а также подагрической нефропатии и хронической почечной недостаточности.
ЗАКЛЮЧЕНИЕ
По данным Городского регистра подагры г. Санкт-Петербурга, подавляющее большинство пациентов с ПА имеют повышенный уровень МК и большую по сравнению с популяционной встречаемость сердечно-сосудистых и почечных коморбидных состояний. Это косвенно подтверждает самостоятельную роль гиперурикемии как фактора сердечно-сосудистого и почечного риска.



