ВВЕДЕНИЕ
Сахарный диабет 2-го типа (СД 2) – одно из самых распространенных и тяжелых метаболических заболеваний, многократно увеличивающее риск осложнений со стороны сердечно-сосудистой системы и почек. По официальным данным, СД страдают более полмиллиарда человек в мире, что составляет 9,3% взрослого населения нашей планеты. Международная диабетическая федерация (International Diabetes Federation, IDF) прогнозирует, что это число возрастет до 10,9% (~ 700 млн) к 2045 г., причем 90% случаев заболевания придется именно на СД 2 [1].
К наиболее частым и начальным осложнениям СД относятся хроническая сердечная недостаточность (ХСН) и почечная дисфункция. Согласно эпидемиологическим данным, во всем мире около 64 млн человек имеют ХСН и почти 700 млн человек страдают хронической болезнью почек (ХБП); по отдельности мировыми сообществами СД, ХСН И ХБП признаны основными пандемиями ХХI в. [2].
На сегодняшний день данные результатов многочисленных исследований убедительно указывают на тесную взаимосвязь между СД 2, сердечно-сосудистыми заболеваниями (ССЗ) и ХБП на эпидемиологическом, патофизиологическом и молекулярном уровнях. Сочетание этих нозологий объединено в понятие «кардио-рено-метаболический континиум» [3]. Еще в прошлом веке исследование Framingham Heart Study продемонстрировало, что диабет, независимо от других факторов риска, увеличивает риск СН в 2 раза у мужчин и в 5 раз у женщин по сравнению с контрольной группой того же возраста [4]. В другом эпохальном Британском исследовании, UKPDS, частота развития СН у пациентов с СД 2 составляла от 2,3 до 11,9 на 1000 пациенто-лет в течение 10 лет наблюдения [5]. В свою очередь, ХБП является одним из наиболее частых и тяжелых сопутствующих состояний как при СД, так и СН, и связана с повышенной заболеваемостью и смертностью [6].
В настоящее время диабетическая нефропатия (ДН) выступает ведущей причиной терминальной стадии почечной недостаточности (ТСПН), а ХБП в целом признано эквивалентом ишемической болезни сердца (ИБС). У лиц старше 65 лет распространенность ССЗ в 2 раза выше среди пациентов с ХБП по сравнению с больными без почечной дисфункции (65 против 32%). В соответствии с выводами, полученными в рамках проведенной в США программы Medicare, 24% пациентов с почечной недостаточностью имели нарушение ритма сердца по типу фибрилляции предсердий, а у 51% больных с ХБП и ФП диагностируется СН [7]. По эпидемиологическим оценкам, больше половины пациентов с ХБП 4–5 стадии имеют ССЗ, и приблизительно 40–50% летальных исходов у этих больных приходятся на кардиоваскулярную патологию, а вероятность смерти от сердечно-сосудистых причин более чем в 5 раз выше по сравнению с пациентами без почечной дисфункции. В исследовании Birkeland K.I. et al. с участием более 1 млн пациентов, 66% из которых имели СД 2, было установлено, что самыми частыми и первыми осложнениями у больных СД 2 были СН и почечная дисфункция. В общей сложности их встречаемость составила 60% (СН – 24%, ХБП – 36%), что оказалось в 4,4 и 6 раз выше, чем аналогичные показатели для инсульта (16%), инфаркта миокарда (14%) и заболеваний артерий нижних конечностей (10%) [8]. Кроме того, было выявлено, что ХСН и ХБП у больных СД 2 связаны с высоким риском смерти от кардиоваскулярной патологии (отношение рисков (ОР) 2,02; 95% доверительный интервал (ДИ): 1,75–2,33) и смертности от всех причин (ОР 2,05; 95% ДИ: 1,82–2,32), а при сочетании этих состояний риск летальности увеличивался в 3–4 раза.
Таким образом, каждая из представленных нозологий по отдельности ассоциирована с высокой заболеваемостью, инвалидностью и ухудшением качества жизни. СД 2 служит независимым и значимым фактором риска развития ХБП и ХСН, которые часто проявляются как первые его осложнения. Своевременное обнаружение и раннее терапевтическое вмешательство, направленное на первичную профилактику, имеют принципиальное значение в снижении бремени кардиоренальных осложнений и увеличении продолжительности жизни пациентов с СД 2.
С 2015 г. серии CVOT-исследований убедительно показали, что эффекты двух инновационных классов сахароснижающих лекарственных средств, ингибиторов натрий глюкозного ко-транспортера 2-го типа (иНГЛТ-2) и агонистов рецепторов глюкагоноподобного пептида-1 (арГПП-1), выходят за пределы гликемического контроля: они обладают широким спектром доказанных негликемических эффектов в различных органах и тканях, и, главное, являются жизнесберегающими препаратами. На сегодняшний день некоторые препараты этих классов применяются не только при СД 2: так, отдельные арГПП-1 рекомендованы для лечения ожирения, а иНГЛТ-2 – для терапии ХСН (независимо от фракции сердечного выброса) и ХБП (вне зависимости от стадии и фенотипа). Это позволяет утверждать, что лечение СД 2 эволюционировало от глюкоцентрического к глюко-кардиометаболическому подходу, что легло в основу персонализации терапии. Так, согласно алгоритмам ведения пациентов с диабетом, при выборе сахароснижающей терапии необходимо выделить доминирующую клиническую проблему больного, после чего с учетом доказанных кардио- и нефропротектных эффектов арГПП-1 и иНГЛТ-2 эти препараты должны быть интегрированы в схемы лечения независимо от уровня гликированного гемоглобина (НbА1с) [3, 4]. По данным крупных метаанализов, в целом арГПП-1 и иНГЛТ-2 снижают первичную конечную точку MACE (нефатальный инфаркт/инсульт, сердечно-сосудистая смерть) в одинаковой степени, особенно у пациентов с установленными атеросклеротическими ССЗ (АССЗ). Более того, иНГЛТ-2 оказывали более выраженное влияние на предотвращение госпитализаций по поводу СН и замедление прогрессирования ХБП, тогда как арГПП-1 в большей степени снижали риск АССЗ [3]. С учетом кардиометаболических фенотипов ХСН и ХБП применение арГПП-1 и иНГЛТ-2 привлекает все большее внимание как потенциальная терапевтическая стратегия, направленная на предотвращение развития указанных состояний у пациентов с СД 2.
Медицинское, социальное и экономическое бремя, обусловленное этими заболеваниями и их осложнениями, представляет собой серьезную проблему для систем здравоохранения во всем мире. Выявление на раннем этапе патологии сердечно-сосудистой системы и почек имеет важное клиническое значение, поскольку, по результатам масштабных CVOT-исследований, доказана роль некоторых противодиабетических препаратов не только в отношении снижения главных конечных точек, улучшения качества жизни, но и в увеличении продолжительности жизни пациентов с СД 2.
Целью настоящей работы стало проведение диагностики ХСН и ХБП у больных с СД 2 на стационарном этапе во время госпитализации в отделение эндокринологии ГКБ им. В.П. Демихова и назначение им эффективной органопротективной терапии.
МАТЕРИАЛ И МЕТОДЫ
В рамках одномоментного, проспективного, наблюдательного исследования в течение 3 произвольно выбранных месяцев больным СД 2, проходившим стационарное лечение в отделении эндокринологии ГКБ им. В.П. Демихова Департамента здравоохранения г. Москвы, в соответствии с рекомендациями Минздрава России проводились все необходимые диагностические мероприятия, направленные на раннее выявление ХБП и ХСН. В общей сложности за период исследования в отделение было госпитализировано 387 человек с СД 2, которые оценивались согласно сформированным критериям диагностики ХСН и ХБП для определения показаний и проведения прицельного диагностического обследования.
Критериями отбора в исследование были возраст старше 50 лет, наличие установленного диагноза СД 2 и факторов, позволяющие заподозрить у пациентов ХСН: характерных жалоб (одышка, слабость, повышенная утомляемость) и/или физикальных признаков недостаточности кровообращения (хрипы в легких, периферические отеки, набухание вен шеи), изменений на электрокардиограмме (ЭКГ), а также присутствия в анамнезе ИБС, артериальной гипертензии (АГ) и приема диуретиков или наличия ХБП по данным лабораторных анализов (рис. 1).
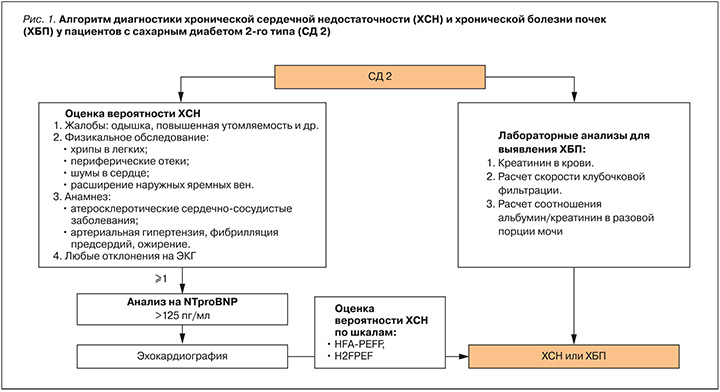
Для выявления нарушений функции почек всем поступившим в отделение эндокринологии пациентам выполнялась необходимая лабораторная диагностика. Диагноз ХБП выставлялся при наличии структурного или функционального повреждения почек в течение более 3 мес. У всех больных осуществлялся расчет скорости клубочковой фильтрации (рСКФ) по формуле CKD-EPI и определялось соотношение альбумин/креатинин (А/Кр) в разовой порции мочи.
Для отбора пациентов на начальном этапе проводились сбор жалоб и данных анамнеза, физикальный осмотр, а также ЭКГ-исследование сердца. При наличии более 1 признака выполнялся анализ на NTproBNP, который считался повышенным при >125 пг/мл. Эхокардиография (ЭхоКГ) выполнялась в состоянии покоя по общепринятой методике с расчетом массы миокарда левого желудочка (ММЛЖ) и последующим учетом веса и индексацией этого показателя на площадь поверхности тела для определения индекса ММЛЖ (ИММЛЖ). Гипертрофию левого желудочка (ЛЖ) диагностировали при ИММЛЖ >115 у мужчин и >95 г/м2 у женщин. Определялась ранняя диастолическая скорость движения септальной и латеральной части митрального кольца (e’), поздней диастолической скорости движения септальной и латеральной части митрального кольца (а’), а также отношения пиковых скоростей раннего трансмитрального кровотока и раннего диастолического движения митрального кольца (E/e’), систолическое давление в легочной артерии, индекс объема левого предсердия, относительная толщина стенки левого желудочка. Также оценивалась вероятность наличия сердечной недостаточности с сохранной фракцией выброса (ХС-сФВ) по шкалам, предложенным Европейскими и Американскими кардиологическими сообществами (HFA-PEFF и H2FPEF). Диагноз ХСН в соответствии с клиническими рекомендациями устанавливался при наличии следующих критериев: характерных жалоб и физикальных признаков, а также соответствующих доказательств систолической и диастолической дисфункции ЛЖ по данным ЭхоКГ (рис. 2).
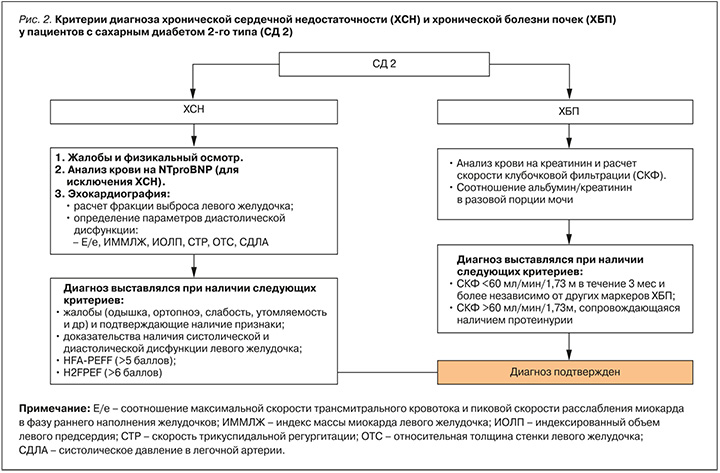
У всех пациентов оценивались параметры углеводного обмена по уровню HbA1c, глюкозы крови натощак (ГН) и постпрандиальной глюкозе (ППГ). Рассчитывался индекс инсулинорезистентности TYG (triglyceride glucose index): пороговым его значением, указывающим на инсулинорезистентность, считался уровень более 4,49. Липидный профиль определялся по уровню холестерина липопротеидов низкой (ХС ЛПНП), высокой (ХС ЛПВП) плотности и триглицеридов (ТГ). Проводилась оценка антропометрических данных – индекса массы тела (ИМТ) и окружности талии (ОТ).
Систематизация исходной информации и визуализация полученных результатов выполнялись в программах Microsoft Office Excel 2016. Статистический анализ осуществлялся с помощью Jamovi и IBM SPSSS Statistics 23 (IBM, USA). Проверка нормальности распределения количественных признаков проводилась с использованием критерия Колмогорова–Смирнова, с указанием медианы и межквартального диапазона [25-й и 75-й перцентили]. Данные из совокупностей сравнивались посредством критерия Манна–Уитни. Для сравнения качественных данных использовалась таблица сопряженности по критерию χ2 Пирсона и точному критерию Фишера. Различия расценивались как статистически значимые при p <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
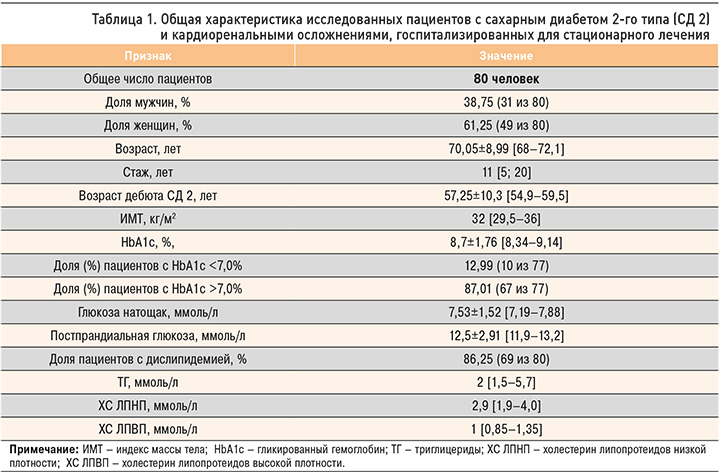
Среди пациентов, госпитализированных в отделении эндокринологии с диагнозом СД 2, критериям развернутого диагностического поиска соответствовали 168 человек: у 80 из них был установлен или подтвержден диагноз ХСН и/или ХБП. Средний возраст пациентов с кардиоренальной патологией составил 70±8,99 лет, длительность СД 2 – 11 [5; 20] лет. Возраст дебюта СД 2 соответствовал 57,2±10,3 годам. Общая характеристика исследованных пациентов с кардиоренальными осложнениями диабета отображена в таблице 1.
По данным лабораторно-инструментального обследования, ХСН имели 33,93% пациентов, среди которых эта патология была впервые выявлена у 10,12% (n=17, медиана возраста 72,9±9,2 лет, длительность СД 2 – 14,5 [6; 25] лет). ХСН была подтверждена у 23,83% (n=40, средний возраст 70±9,5 лет, длительность СД 2 – 12,5 [5;20] лет), исключена – у 66% человек.
ХБП была обнаружена в 39,52% случаев, при этом на долю впервые выявленной ХБП пришлось 7,14% (n=12, средний возраст 72,8±8,7 лет, длительность СД 2 – 10 [7; 20] лет). Имели в анамнезе почечную дисфункцию различной степени тяжести 32,14% пациентов (n=54, средний возраст 71,1±8,9 лет, длительность СД 2 – 12,5 [6,5; 20] лет. У 60,71% участников исследования не было выявлено ХБП (n=102, средний возраст 62,5 [58; 71] лет, длительность СД 2 – 9 [5; 18] лет).
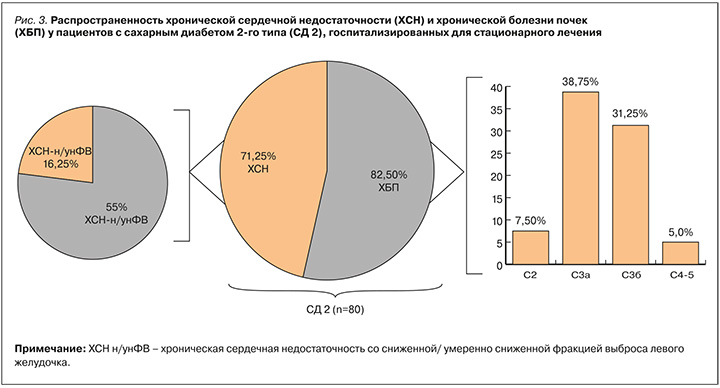
Среди 80 пациентов с установленными кардиоренальными осложнениями СД 2, по данным проведенной лабораторно-инструментальной диагностики, на долю ХСН приходилось 71,25% этих осложнений. Среди них преобладающее количество больных имело фенотип ХСН-сФВ: их доля составила 55% (медиана ФВ 59,6±4,5%, уровень NTproBNP – 198 [155; 241] пг/мл). 16,25% пациентов имели сниженную или умеренно сниженную ФВ (медиана ФВ 37,3±8,1%, уровень NTproBNP – 3129 [553,5; 4356] пг/мл; рис. 3). Средний возраст пациентов составил 70,68±9,32 лет, длительность СД 2 – 10 [5; 20] лет. Возраст дебюта СД 2 соответствовал 58,68±10,7.
В 75,44% случаев ХСН сочеталась с ХБП: последняя в 59,65% случаев регистрировалась у пациентов с сохранной ФВ и в 15,79% – со сниженной или умеренно сниженной ФВ.
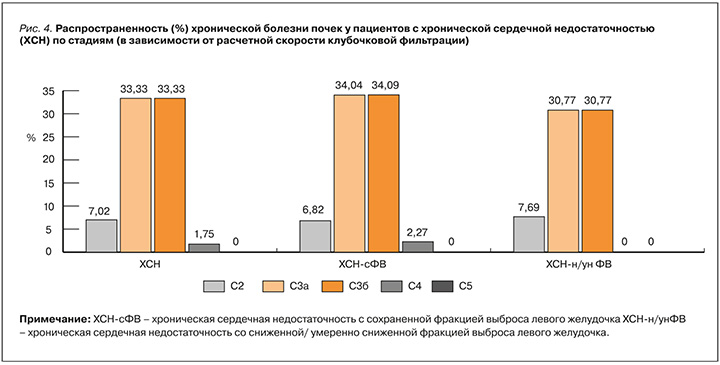
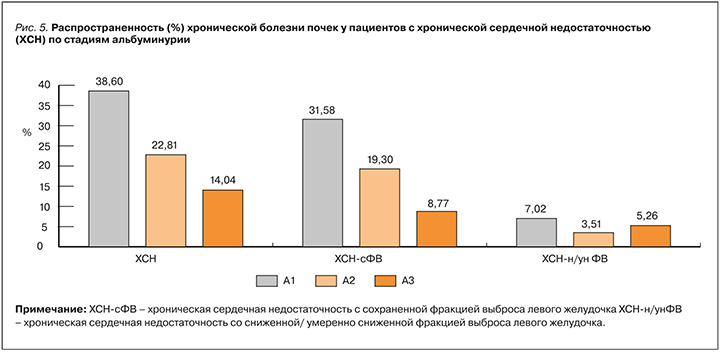
Стадия ХБП С2 наблюдалась у 7,02%, умеренное снижение рСКФ (С3а) – у 33,33% человек. Еще 33,33% исследуемых имели стадию заболевания С3б, у 1,75% была тяжелая почечная недостаточность со снижением рСКФ до 15 мл/мин/см2. В зависимости от тяжести протеинурии стадия ХБП А1 была верифицирована у 38,6%, А2 – у 22,81%, А3 – у 14,04% пациентов. Обращает на себя внимание тот факт, что среднее значение рСКФ у пациентов с ХСН-сФВ было равно 49 [40; 59,5] мл/мин/1,73 см2, а А/Кр – 18,5 [9,5; 126] мг/г. При этом у больных ХСН со сниженной ФВ (ХСН-нФВ) аналогичные показатели составили 56,7± 20,44 мл/мин/1,73 см2 и 20 [11;164] мг/г. Распространенность ХБП у исследованных пациентов с ХСН представлено на рисунках 4 и 5.
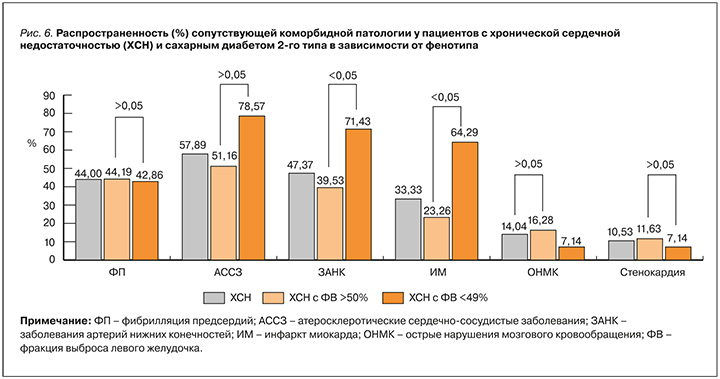
При анализе коморбидной патологии у пациентов с СД 2 и ХСН было установлено, что самым частым сопутствующим заболеванием у них была АГ – ею страдали 100% участников, при этом средняя величина систолического артериального давления (САД) составила 128±16,5 мм рт.ст., а диастолического (ДАД) – 70,58±9,82 мм рт ст. Кроме того, у исследуемых отмечался высокий процент заболеваний ишемического генеза, которые встречались в 57,89%, случаев: среди них на перенесенный острый инфаркт миокарда (ИМ) в анамнезе пришлось 33,33%, на острые нарушения мозгового кровообращения (ОНМК) – 14,04%, на заболевания артерий нижних конечностей (ЗАНК) – 47,37%, на стенокардию – 10,53%. Нарушения ритма сердца по типу фибрилляции предсердий (ФП) регистрировалось у 43,86% пациентов (рис. 6). При более подробном анализе данных пациентов с ХСН в зависимости от фенотипа заболевания, нами было установлено, что среди пациентов с ХСН-нФВ статистически достоверно чаще встречались ИМ и ЗАНК по сравнению с больными ХСН-сФВ (см. рис. 5). ОНМК в 2 раза чаще отмечались в группе с ХСН и ФВ более 50%, однако разница в данном случае не достигла статистической достоверности. У пациентов с ХСН-сФВ в 51,16% случаев имелись АССЗ: ЗАНК (39,53%), ИМ (23,26%), ОНМК (16,28%), стенокардия (11,63%). Пациенты с ХСН с ФВ менее 50% характеризовались высокой распространенностью заболеваний атеросклеротического генеза – 78,57% случаев. На ЗАНК среди них пришлось 71,43%, кроме того, в 64,29% случаев был выявлен перенесенный острый ИМ в анамнезе. ОНМК перенесли 7,14% больных, еще 7,14% страдали стенокардией. При этом у исследуемых наблюдалась высокая встречаемость ФП независимо от фенотипа ХСН, которая была зарегистрирована у 44,19% человек в группе с сохранной ФВ и в 42,86% – в группе со сниженной ФВ.
При оценке основных метаболических параметров у пациентов с ХСН и СД 2 средний показатель HbA1c был равен 8,7±1,77%, ГПН – 7,58±1,49 ммоль/л, ППГ – 12,2±2,69 ммоль/л, при этом у 86,21% пациентов уровень HbA1c оказался выше 7,0%. При анализе антропометрических показателей медиана ИМТ равнялась 32 [30; 40] кг/м2, ОТ – 109,5±14,1 см; ожирение имели 70,69% участников исследования. Дислипидемия регистрировалась в 84,46% случаев, наблюдались высокие показатели ХС ЛПНП (2,95 [1,75; 4,0] ммоль/л), ХС ЛПВП (1 [0,85;1,35] ммоль/л), ТГ 2 [1,4; 2,15] ммоль/л), ХС не-ЛПВП (3,3 [2,2; 4,5] ммоль/л). При сравнительном анализе пациентов в зависимости от фенотипа ХСН статистической достоверной разницы в параметрах углеводного и липидного обмена выявлено не было. Лабораторные показатели и характеристика исследованных пациентов с ХСН представлены в таблице 2.
Таким образом, фенотип ХСН-сФВ встречался чаще у лиц женского пола с более длительным стажем СД 2 на фоне более выраженной гипергликемии и незначительного повышения показателя NTproBNP. Больные с ХСН и ФВ менее 49% (фенотип ХСН-нФВ) были преимущественно лицами мужского пола среднего возраста с короткой продолжительностью СД 2, высокой частотой встречаемости заболеваний атеросклеротического генеза (ИБС, ЗАНК) на фоне относительно удовлетворительного контроля углеводного обмена и значительно повышенного параметра NTproBNP.
Преферентную сахароснижающую терапию, доказавшую свои органопротективные эффекты у пациентов с СД 2 и кардиоренальными осложнениями, получали 26,31% участников исследования. В большинстве случае такой терапией было применение иНГЛТ-2 (21,05%). Интенсивную инсулинотерапию получали 36,84%, а комбинацию базального инсулина с пероральными сахароснижающими препаратами – 22,81%. 8,77% человек не использовали вообще никакой медикаментозной сахароснижающей терапии. 45,61% пациентов принимали метформин, 26,32% – ингибиторы дипептидилпептидазы 4-го типа (иДПП-4), 24,54% – производные сульфонилмочевины (ПСМ).
В рамках комплексной медикаментозной терапии сопутствующей патологии блокаторы ренин-ангиотензин-альдостероновой системы и бета-блокаторы получали 68,4 и 64,9%, блокаторы кальциевых каналов – 26,3%, диуретики – 52,6%, антиагреганты – 29,8%, антикоагулянты – 33,3% человек. Статины применяли в 36,8% пациентов.
Вместе с диагностикой ХСН у всех госпитализированных с СД 2 пациентов проводилась лабораторная диагностика ХБП. Из общего количества обследованных больных (n=168) она была выявлена у 39,29%. Среди пациентов с кардиоренальными осложнениями (n=80) распространенность ХБП составила 82,5%, при этом у преобладающего количества исследуемых регистрировалось умеренное снижение рСКФ – С3а (38,75%). 31,25% человек имели С3б, 5% – продвинутые стадии ХБП со снижением рСКФ менее 30 мл/мин/1,73см2, на долю ХБП С2 пришлось 7,5%. Средний показатель рСКФ составил 56,3±19,2 мл/мин/см2, А/Кр – 32 [11; 212] мг/г.
Общее число пациентов в данной группе составило 66 человек – 23 мужчин (34,85%) и 43 женщин (65,15%). Средний возраст этих пациентов равнялся 71,1±8,91 лет, длительность СД 2 соответствовала 11 [5; 20] годам, возраст на момент дебюта диабета составлял 58,6±10,6 лет.
При анализе клинической характеристики госпитализированных пациентов с СД 2 и ХБП было установлено, что они имели высокие показатели HbA1c, средний уровень которого был равен 8,8±1,84%. При этом у 84,85% человек его уровень превышал 7,0%. Средняя величина ГПН соответствовала 7,47±1,58 ммоль/л, уровни ППГ составили в среднем по группе 12,5±2,99 ммоль/л. Анализ параметров липидного метаболизма показал медиану ХС ЛПНП 2,8 [1; 4], ХС ЛПВП – 1 [0,85; 1,35], ТГ 2 [1,5; 2,7] ммоль/л. Дислипидемия была зарегистрирована у 89,39%, ожирение – у 68,18% участников.
Медиана ИМТ составила 32 [29; 35,5] кг/м2, индекс TYG был равен 1,95 [1,7; 2,3].
Гипертоническая болезнь выявлялась в 100% случаев, средние значения САД и ДАД равнялись 128,7±16,6 и 69 [62; 79] мм рт.ст. соответственно, частота сердечных сокращений – 70 [64; 82] уд/мин. Медиана гормона NTproBNP соответствовала 167,5 [64; 314] пг/мл. Общая характеристика исследованных пациентов с СД 2 и ХБП представлена в таблице 3.
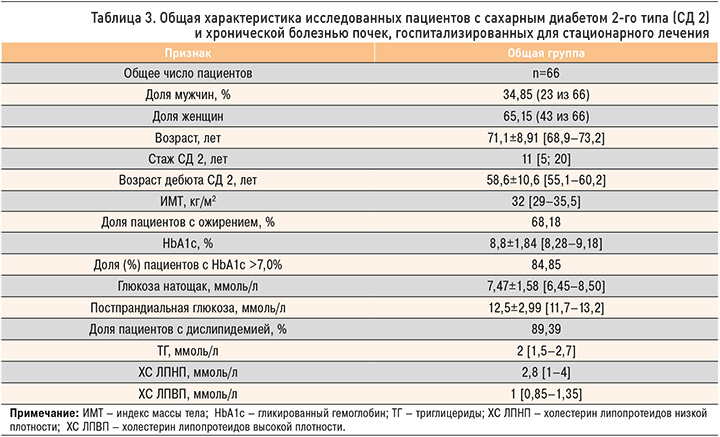
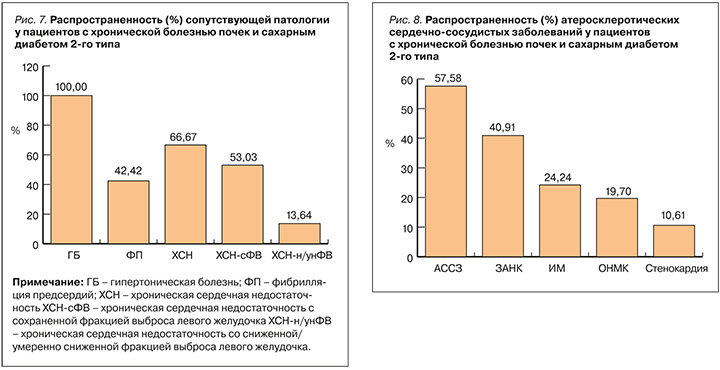
Следует подчеркнуть, что развитие ХБП сочеталось с ХСН у 66,67% человек; у 53,03% пациентов имела место ХСН-сФВ, у 13,64% – ХСН-нФВ. Нарушение ритма сердца по типу ФП наблюдалось в 42,42% случаев (рис. 7). АССЗ страдали 57,58% пациентов, среди них у 24,24% был острый ИМ в анамнезе, у 10,61% – стенокардия, у 19,7% – ОНМК и у 40,91% – ЗАНК (рис. 8).
Согласно анализу сахароснижающей терапии пациентов с СД 2 и ХБП, препараты из группы иНГЛТ-2 типа получали только 18%, арГПП-1 – 3,03% человек. Метформин применялся больными в 37,88%, иДПП-4 – в 22,73%, ПСМ – в 16,67% случаев. Отмечалась высокая частота назначения инсулинотерапии в различных схемах лечения: так, базис-болюсный режим использовали 48%, а комбинацию базального инсулина с пероральными сахароснижающими препаратами – 22,73% пациентов. Кроме того, нефропротективную терапию (ингибиторы АПФ или блокаторы рецепторов ангиотензина II) получали только 71,21% пациентов. Бета-блокаторы применяли 59,09%, на блокаторы кальциевых каналов – 27,27%, на диуретики – 56,06% человек. Прием антикоагулянтов осуществлялся в 27%, антиагрегантов – в 33% случаев. Терапия статинами проводилась 39% больным.
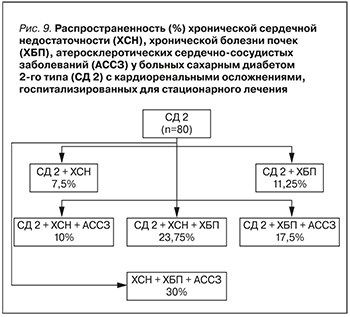
Детально анализируя распространенность различных сопутствующих заболеваний у больных СД 2 с выявленными кардиоренальными осложнениями, мы установили, что изолированная ХСН или ХБП встречались в 7,5 и 11,25% случаев, соответственно, а сочетание ХБП и ХСН, но без АССЗ, регистрировалось в 2 раза чаще (23,75%). Тем не менее, сочетание различных атеросклеротических коморбидных состояний у пациентов с ХСН было ниже, чем у пациентов с ХБП и диагностировалось у 10 и 17,5% больных соответственно. Отметим, что у преобладающего числа включенных в анализ пациентов с СД 2, находившихся на стационарном лечении, наблюдалась развернутая картина поражения кардио-ренальной системы, а сочетание АССЗ, ХСН и ХБП имело место у 30% больных (рис. 9). При этом первичная диагностика ХСН имела место у 10,12% пациентов, а ХБП была впервые выявлена у 7,14% что указывает на необходимость более тщательного диагностического поиска и требует от врачей-клиницистов своевременного проведения лабораторно-инструментальных обследований пациентов с СД 2, направленных на диагностику ХСН и ХБП. Полученные нами данные в рамках настоящего проспективного исследования согласуются с результатами опубликованного ранее ретроспективного анализа большой выборки пациентов, включавшей 1150 больных с СД 2. В рамках этого анализа также была установлена высокая распространенность ХСН на фоне диабета, которая регистрировалась у 56% больных, и ХБП, которая диагностировалась у 47,83%. Кроме того, у четверти пациентов с СД 2 (25,22%) наблюдалось одновременное сочетание АССЗ, ХСН и ХБП [10], несмотря на небольшую продолжительность СД 2.
Наравне с множественной коморбидной патологией исследованные нами пациенты характеризовались высокой распространенностью множественных факторов риска развития осложнений со стороны сердечно-сосудистой системы и почек. У них отмечались неудовлетворительные показатели основных параметров углеводного, липидного обменов. Так, целевой показатель HbA1c менее 7,0%, рекомендованный для большинства пациентов, регистрировался только у 12,9% участников на фоне высокого процента ожирения (70%) и уровней ХС ЛПНП. В исследовании Aguilar D. et al., которое включало 5815 пациентов с СД и СН, было показано, что кривая летальности у этих пациентов имеет U-образный характер с самым благоприятным уровнем HbA1с в пределах 7,1–7,8% [11]. Авторы показали, что как высокий, так и низкий уровень HbA1c ассоциировался с высоким риском смертности у данной когорты пациентов. Также чрезмерный контроль гликемии в известном исследовании ACCORD был ассоциирован с повышенным риском смерти без значительного влияния на сердечно-сосудистые исходы. При оценке параметров липидного метаболизма пациенты характеризовались высокой частотой дислипидемии (86% пациентов); при этом, несмотря на очень высокий риск ССЗ, более половины (62,5%) больных СД 2 не получали терапию статинами.
На сегодняшний день в лечении пациентов с СД 2, помимо контроля основных факторов риска развития ССЗ, краеугольным камнем являются безопасное достижение целевого гликемического контроля, ранняя инициация комбинированной терапии, своевременная интеграция в терапию преферентных препаратов, доказавших свои органопротективные преимущества, способность снижать риски развития и бремени ССЗ и ХБП и, главное, улучшать продолжительность жизни пациентов. При анализе комплексной терапии нами было отмечено, что независимо от сопутствующей патологии преобладающее количество пациентов не получали соответствующую терапию иНГЛТ-2 и арГПП-1. Алгоритмы специализированной медицинской помощи больным с СД обозначили препараты класса иНГЛТ-2 как терапию первой линии у пациентов с ХСН и ХБП наряду с метформином. Однако, несмотря на наличие в анамнезе такой значимой коморбидной патологии, как АССЗ, ХСН, ХБП, только 18,75% исследованных нами пациентов получали инновационную терапию препаратами этого класса. На сегодняшний день эксперты профессиональных сообществ мира по ведению пациентов с СД 2 подчеркивают, что ингибиторы иНГЛТ-2 должны в обязательном порядке назначаться больным с вышеуказанными патологиями независимо от уровня HbA1c ввиду их высокой доказательной базы в отношении улучшения долгосрочного прогноза и снижения риска летальности в этой когорте.
ЗАКЛЮЧЕНИЕ
СД 2 выступает общепризнанным фактором риска развития как макро-, так и микрососудистых осложнений. Люди, страдающие этим заболеванием, имеют более высокую частоту ХСН, ХБП и худшие исходы, по сравнению с теми, кто не имеет диабета. По данным крупных эпидемиологически исследований, ХСН и ХБП являются первыми проявлениями у пациентов с СД 2.
Нами отмечена высокая выявляемость ХСН и ХБП при расширенном диагностическом поиске у пациентов с СД 2, госпитализированных в отделении эндокринологии, в первую очередь для компенсации углеводного обмена и подбора сахароснижающей терапии, что диктует необходимость более тщательного обследования таких больных на предмет ХСН. Согласно исследованиям, представители иНГЛТ-2 и арГПП-1 обладают положительным влиянием на главные конечные точки MACE. Кроме того, иНГЛТ-2 продемонстрировали убедительные результаты в плане улучшении прогноза пациентов с недостаточностью кровообращения и/или ХБП, и на сегодняшний день рекомендованы для лечения пациентов с ХСН независимо от наличия нарушений углеводного обмена и значений ФВ. Ранее выявление и профилактика развития ХСН/ХБП у пациентов с СД 2 имеет принципиальный характер с точки зрения улучшения долгосрочного прогноза и увеличения продолжительности жизни таких пациентов.



