ВВЕДЕНИЕ
Фибрилляция предсердий (ФП) – распространенное нарушение сердечного ритма, которое ассоциируется с повышением риска тромбоэмболических осложнений, и в первую очередь кардиоэмболического инсульта. Пероральные антикоагулянты являются эффективными средствами профилактики инсульта, но их применение может быть сопряжено с развитием геморрагических осложнений, в том числе желудочно-кишечных кровотечений (ЖКК), которые в ряде случаев могут стать причиной летального исхода. ЖКК опасны еще и тем, что могут развиваться бессимптомно, на фоне кажущегося благополучия, а при наличии клинических проявлений часто имеют неспецифические симптомы (например, диспепсические расстройства), затрудняющие диагностический поиск.
Применение так называемых новых (или не-антагонистов витамина К) оральных антикоагулянтов (НОАК), к которым относят дабигатрана этексилат, ривароксабан, апиксабан и эдоксабан, в целом ассоциируется с повышением риска большого ЖКК на 25–45% по сравнению с терапией антагонистом витамина К варфарином [1–2]. Вместе с тем величина этого риска неодинакова у разных НОАК. Как показали результаты рандомизированных контролируемых исследований, по сравнению с варфарином риск большого ЖКК у пациентов с ФП, получавших дабигатрана этексилат 150 мг 2 раза/сут, был выше на 48% (отношение рисков (ОР) 1,48; 95% доверительный интервал (ДИ): 1,19–1,86; р <0,001) [3], ривароксабан – на 61% (ОР 1,61; 95% ДИ: 1,30–1,99; р <0,001) [4], эдоксабан 60 мг (1 раз/сут) – на 23% (ОР 1,23; 95% ДИ: 1,02–1,50; р=0,03) [5]. В то же время при использовании апиксабана (ОР 0,89; 95% ДИ 0,70–1,15; р=0,37) [6] и дабигатрана этексилата в дозе 110 мг 2 раза/сут (ОР 1,10; 95% ДИ: 0,86–1,41; р=0,43) [3] повышения риска ЖКК отмечено не было, а при лечении эдоксабаном в дозе 30 мг 1 раз/сут риск ЖКК был на 33% ниже (ОР 0,67; 95% ДИ: 0,53–0,83; р <0,001) относительно варфарина [5].
Апиксабан проявил себя как один из наиболее безопасных в плане риска ЖКК антикоагулянт и в крупных исследованиях реальной клинической практики. Так, в ретроспективном когортном исследовании (субанализ исследования ARISTOPHANES) [7], в которое включили 381 054 пациента с ФП и высоким риском ЖКК (из них 23,4% принимали апиксабан, 7,4% – дабигатрана этексилат, 31,1% – ривароксабан и 38,1% – варфарин), терапия апиксабаном ассоциировалась со снижением риска большого ЖКК на 41% (ОР 0,59; 95% ДИ: 0,54–0,64; р <0,001) по сравнению с варфарином, на 36% (ОР 0,64; 95% ДИ: 0,50–0,81; р <0,001) – в сопоставлении с дабигатрана этексилатом и на 53% (ОР 0,47; 95% ДИ: 0,43–0,51; р <0,001) – относительно ривароксабана.
Развитию ЖКК практически всегда предшествует повреждение слизистой оболочки желудочно-кишечного тракта (ЖКТ). Обычно оно становится осложнением уже существующего заболевания ЖКТ (например, язвенной болезни) или лекарственно-индуцированной гастро- и/или энтеропатии. Считается, что пероральные антикоагулянты не обладают самостоятельным повреждающим действием на слизистую оболочку ЖКТ, в отличие от той же ацетилсалициловой кислоты (АСК), известной своим ульцерогенным эффектом. Патогенез ЖКК, связанных с приемом пероральных антикоагулянтов, включает 3 механизма [8]: 1) системное или локальное (топическое) антикоагулянтное действие, обусловленное неполной абсорбцией препарата в ЖКТ; 2) наличие винной кислоты в составе капсулы отдельных прямых ингибиторов тромбина; 3) нарушение репарации слизистой оболочки кишечника.
В соответствии с концепцией, предложенной Shay H. и Sun D.C. более 60 лет назад и впоследствии названной «Весы Шея», пероральные антикоагулянты, наряду с другими лекарственными средствами (нестероидными противовоспалительными препаратами, антиагрегантами, глюкокортикоидами и т.д.), рассматриваются как экзогенные внутрипросветные факторы агрессии для слизистой ЖКТ, а дисбаланс между факторами агрессии и защиты приводит к возникновению заболеваний ЖКТ. Впоследствии было установлено, что итогом негативного воздействия факторов агрессии на слизистую ЖКТ может быть не только ее повреждение с образованием эрозий и язв, но и повышение проницаемости из-за нарушения межклеточных взаимодействий (разрушения плотных межклеточных контактов), в результате чего развивается бактериальная транслокация (проникновение бактерий и токсинов из просвета кишечника в кровоток), способная инициировать воспалительный процесс при различных заболеваниях. Такое состояние получило название «синдром повышенной эпителиальной проницаемости» (СПЭП) и в настоящее время рассматривается как один из базовых механизмов развития патологии человека. Проблема СПЭП была подробно рассмотрена в опубликованном в 2021 г. первом в нашей стране мультидисциплинарном национальном консенсусе «Синдром повышенной эпителиальной проницаемости в клинической практике» [9]. За несколько десятилетий, прошедших с момента постулирования концепции «Весы Шея», знания и представления об агрессивных и защитных механизмах значительно обогатились и расширились, но сама концепция при этом не перестала быть актуальной. По мнению экспертов [9], парадигма СПЭП может рассматриваться в качестве теории, развивающей концепцию «Весы Шея».
Поскольку антикоагулянты при ФП назначаются на длительный срок, проблема обеспечения безопасности лечения становится очень актуальной и все чаще привлекает к себе внимание экспертов. Так, в декабре 2021 г. был опубликован первый в нашей стране согласительный документ «Консенсус экспертов по снижению риска желудочно-кишечных кровотечений у пациентов, получающих оральные антикоагулянты» [10]. В нем сформулированы критерии высокого риска ЖКК, обоснована необходимость защиты слизистой оболочки ЖКТ на фоне приема антикоагулянтов, предложен алгоритм оценки риска ЖКК и выбора гастроэнтеропротективной терапии. В качестве средств профилактики ЖКК эксперты рассматривают препараты из группы ингибиторов протонной помпы (ИПП) и ребамипид. Помимо этого, эксперты считают, что с точки зрения минимизации риска ЖКК приоритетным НОАК является апиксабан, и рекомендуют рассматривать его в качестве препарата первого выбора при наличии у пациента соответствующих показаний.
ИПП – хорошо изученные препараты, которые в течение последних десятилетий традиционно назначаются для защиты слизистой ЖКТ пациентам, принимающим антиагреганты и нестероидные противовоспалительные препараты (НПВП). Ребамипид же – относительно новый для нашей страны препарат, несмотря на более чем 30-летний опыт использования в качестве противоязвенного агента в клинической практике стран Азии. В нашей стране он доступен под коммерческим названием Ребагит («ПРО.МЕД.ЦС Прага а. о.», Чешская Республика). Ребамипид уникален тем, что сочетает свойства и гастро-, и энтеропротектора; на сегодняшний день это единственный препарат с энтеропротективным действием.
Гастропротективный эффект ребамипида обусловлен стимуляцией синтеза простагландина Е2 в слизистой оболочке желудка и простагландинов Е2 и I2 в содержимом желудочного сока, тогда как его энтеропротективное действие связано с устранением повышенной проницаемости кишечной стенки и восстановлением целостности кишечного барьера посредством увеличения количества бокаловидных клеток и стимуляции их пролиферации, усиления (восстановления) плотных межклеточных контактов и подавления воспалительных реакций.
Следует особо отметить, что ребамипид реализует свои эффекты на всех трех структурных уровнях слизистой оболочки на всем протяжении ЖКТ. На первом уровне (слизь, покрывающая эпителий) препарат стимулирует восстановление слизистого слоя, на втором (клетки эпителия) – регенерирует эпителиоциты, «сшивает» нарушенные контакты между ними, на третьем (нервно-мышечный слой под эпителием, обеспечивающий кровоснабжение слизистой) – улучшает кровоснабжение, способствуя регенерации эпителия, и регулирует воспалительный ответ. Поскольку в качестве одного из механизмов, посредством которого НОАК вызывают ЖКК, рассматривается их способность ингибировать заживление слизистой ЖКТ (что, вероятно, обусловлено тем, что НОАК как факторф агрессии для слизистой ЖКТ могут приводить к развитию СПЭП), то с высокой долей вероятности можно предположить, что применение ребамипида для профилактики ЖКК на фоне применения НОАК будет патогенетически обоснованным.
Рассмотрим возможности защиты слизистой ЖКТ и профилактики ЖКК при использовании антикоагулянтов на конкретных клинических примерах.
ОПИСАНИЕ КЛИНИЧЕСКОГО ПРИМЕРА № 1
Мужчина, 79 лет, страдающий постоянной формой ФП с высоким риском как инсульта (CHA2DS2-VASc = 7 баллов), так и кровотечения (HAS-BLED = 3 балла), получает апиксабан в дозе 5 мг 2 раза /сут. Этот коморбидный пожилой пациент (табл. 1) имеет 2 критерия высокого риска ЖКК: язвенную болезнь двенадцатиперстной кишки (ДПК) с ЖКК в анамнезе и возраст старше 75 лет. В соответствии с алгоритмом защиты ЖКТ при терапии оральными антикоагулянтами [10] ему показан как минимум 3-месячный курс гастроэнтеропротективной терапии ИПП + ребамипид, по окончании которого рекомендуется перейти на прием ИПП в поддерживающей дозе и далее в режиме «по требованию» и продолжать принимать ребамипид на всем протяжении антикоагулянтной терапии. При этом пациент уже получает пероральный антикоагулянт, наиболее безопасный в отношении риска ЖКК (апиксабан).
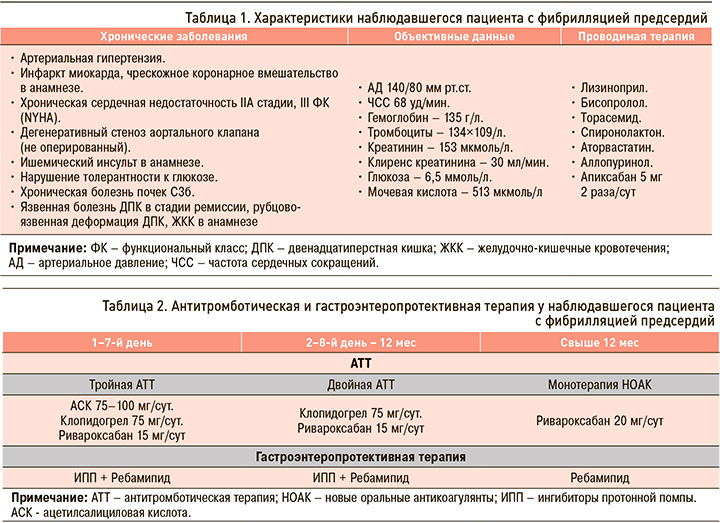
ОПИСАНИЕ КЛИНИЧЕСКОГО ПРИМЕРА № 2
Мужчина, 72 года, имеющий пароксизмальную форму ФП с высоким риском инсульта (CHA2DS2-VASc = 4 балла) и низким риском кровотечения (HAS-BLED = 2 балла), получает ривароксабан 20 мг 1 раз/сут. В анамнезе – артериальная гипертензия и сахарный диабет 2-го типа, по поводу которых больной принимает эналаприл и пероральный сахароснижающий препарат. Перенес острый инфаркт миокарда с подъемом сегмента ST; после выполненного первичного чрескожного коронарного вмешательства со стентированием инфаркт-связанной артерии были назначены розувастатин, бисопролол и тройная антитромботическая терапия (табл. 2). У пациента имеется фактор высокого риска ЖКК – тройная, а затем двойная антитромботическая терапия (АТТ) на протяжении 12 мес.
Известно, что при комбинированной АТТ риск ЖКК возрастает в значительно большей степени, чем при монотерапии антиагрегантами или антикоагулянтами. Например, Delaney J.A. et al. [11] показали, что назначение АСК в сочетании с клопидогрелом ассоциируется с повышением риска ЖКК почти в 4 раза (ОР 3,90; 95% ДИ: 2,78–5,47), а при комбинации АСК с варфарином – в 6,5 раз (ОР 6,48; 95% ДИ: 4,25–9,87). С учетом этого рассматриваемый пожилой пациент с высоким риском ЖКК нуждается в усиленной защите слизистой ЖКТ. Согласно алгоритму защиты ЖКТ при терапии оральными антикоагулянтами [10], такому пациенту показан прием ИПП в сочетании с ребамипидом в течение всего периода двойной АТТ (12 мес), после чего следует перейти на прием одного ребамипида в продолжение всего срока лечения антикоагулянтами (после завершения применения клопидогрела пациент продолжит монотерапию ривароксабаном в дозе 20 мг 1 раз/сут).
Необходимо добавить, что эффективность и безопасность ребамипида у пациентов, получающих двойную АТТ, были установлены в рандомизированных контролируемых исследованиях [12–13]. Например, в одном из них [13] была продемонстрирована эффективность ребамипида в предотвращении пептических язв желудка диаметром ≥5 мм у пациентов, получающих двойную АТТ на протяжении ≥1 года, а в экспериментальном исследовании [14] выявлена способность ребамипида предупреждать желудочное кровотечение, индуцированное воздействием на слизистую желудка крыс АСК в сочетании с клопидогрелом, причем в сплане этой споособности ребамипид не уступал другим антисекреторным средствам.
Для снижения риска кровотечения доза ривароксабана в составе тройной и двойной АТТ должна быть снижена до 15 мг 1 раз/сут [15]. Такая рекомендация основана на результатах исследования PIONEER-AF PCI [16], в котором было установлено, что у пациентов с ФП, подвергнутых плановому чрескожному коронарному вмешательству, применение низких доз ривароксабана (стандартная доза 15 мг 1 раз/сут; доза 10 мг 1 раз/ сут – при клиренсе креатинина 30–50 мл/ мин) в сочетании с антиагрегантом в течение 12 мес было ассоциировано с меньшей частотой клинически значимых кровотечений (ОР 0,59; 95% ДИ: 0,47–0,76; р <0,001) при сопоставимой эффективности (ОР 1,08; 95% ДИ: 0,69–1,68; р=0,75) по сравнению с сочетанной терапией варфарином и антиагрегантом.
ОПИСАНИЕ КЛИНИЧЕСКОГО ПРИМЕРА № 3
Женщина, 83 года, страдающая постоянной формой ФП с высоким риском инсульта (CHA2DS2-VASc = 5 баллов) и низким риском кровотечения (HAS-BLED = 2 балла), получает дабигатрана этексилат 110 мг 2 раза/сут. Имеет сопутствующие заболевания: артериальную гипертензию, хроническую сердечную недостаточность и остеоартрит, по поводу последнего регулярно принимает НПВП (2–3 раза/неделю, иногда ежедневно). Также получает эналаприл, бисопролол, амлодипин, дигоксин, торасемид и спиронолактон. У пациентки имеется 2 критерия высокого риска ЖКК: возраст старше 75 лет и сопутствующий прием НПВП.
Согласно алгоритму защиты ЖКТ при терапии оральными антикоагулянтами [10], пациентке показан как минимум 3-месячный курс гастроэнтеропротективной терапии ИПП + ребамипид, по окончании которого рекомендуется перейти на применение ИПП в поддерживающей дозе и далее в режиме «по требованию» и продолжить принимать ребамипид в течение всего курса антикоагулянтной терапии. Однако пациентка уже принимает 8 лекарственных препаратов, поэтому к назначению двух новых препаратов нужно подходить очень взвешенно и осторожно во избежание нерациональной полипрагмазии.
В настоящее время накоплено достаточно данных, свидетельствующих о том, что лечение ИПП ассоциировано с повышенным риском развития нежелательных явлений, таких как нарушение всасывания витаминов и микроэлементов, падения, переломы, деменция, инфаркт миокарда, инфекционные осложнения и др. [17]. У больных пожилого и старческого возраста риски этих побочных эффектов еще выше [18]. Помимо этого, в нескольких исследованиях [19–21] было выявлено, что длительное использование ИПП ассоциируется с повышением риска смерти. Так, по данным одного из 37 исследований [21], включенных в систематический обзор [20], у пожилых пациентов (n=491; средний возраст 80±6 лет) терапия ИПП в любых дозах ассоциировалась с увеличением риска смерти от всех причин на 51% (ОР 1,51; 95% ДИ: 1,03–2,77), тогда как при лечении высокими дозами ИПП этот риск был выше уже в 2,6 раза (ОР 2,59; 95% ДИ: 1,22–7,16). Приведенные данные указывают на то, что в пожилом возрасте ИПП следует применять с осторожностью и избегать назначения высоких доз.
Эксперты Российской ассоциации геронтологов и гериатров считают, что потенциальный вред ИПП при назначении пожилым пациентам нельзя считать незначительным, поэтому в последние годы все больше внимания уделяют депрескрайбингу ИПП у пожилых пациентов (депрескрайбинг – это плановый и контролируемый процесс снижения дозы или прекращения приема лекарственного средства, которое потенциально может причинить вред пациенту и/или не приносит ему пользы) [22]. В 2019 г. в Российском геронтологическом научно-клиническом центре был разработан проект национальных рекомендаций «Алгоритм депрескрайбинга ингибиторов протонной помпы для больных пожилого и старческого возраста (документ размещен на сайте центра в разделе «Клинические рекомендации и методические материалы»). По мнению экспертов, у ряда пожилых пациентов ИПП могут быть безопасно отменены.
Механизм действия ИПП основан на способности блокировать Н+/K+-АТФазу париетальных клеток слизистой оболочки желудка и вследствие этого уменьшать секрецию соляной кислоты [23]. Исходя из этого, ИПП «работают» только в желудке и не могут защитить слизистую оболочку нижнего отдела ЖКТ. Более того, существуют данные [24–26], что ИПП могут усиливать проявления лекарственно-индуцированной энтеропатии (в частности, НПВП-ассоциированной) и «смещают» локализацию ЖКК в нижний отдел ЖКТ, увеличивая частоту кровотечений из нижнего отдела ЖКТ.
В ряде исследований [27–29] также было установлено, что у пациентов, получающих НОАК, ИПП эффективны только для предотвращения ЖКК из верхнего отдела ЖКТ и при наличии язвенной болезни или ЖКК в анамнезе. Например, в гонконгском ретроспективном когортном популяционном исследовании [27] участвовали 5041 пациент, принимавших дабигатрана этексилат. Частота ЖКК составила 2,5% (4,2/100 пациенто-лет). Сопутствующее применение гастропротекторов было связано со снижением риска ЖКК на 48% (ОР 0,52; 95% ДИ: 0,35–0,77). При этом использование ИПП снижало риск ЖКК на 47% (ОР 0,53; 95% ДИ: 0,31–0,91), а блокаторов Н2-рецепторов гистамина – на 39% (ОР 0,61; 95% ДИ: 0,40–0,94). Дальнейший анализ показал, что применение гастропротекторов снижало риск ЖКК только из верхнего отдела ЖКТ (ОР 0,29; 95% ДИ: 0,15–0,54) и только у пациентов с язвенной болезнью или ЖКК в анамнезе (ОР 0,14; 95% ДИ: 0,06–0,30). Таким образом, в настоящее время нет оснований рутинно рекомендовать прием ИПП всем пациентам, получающим НОАК.
У данной пациентки отсутствует патология со стороны ЖКТ, поэтому, по нашему мнению, с учетом всего вышеизложенного следует воздержаться от назначения ей ИПП и рекомендовать прием одного ребамипида на весь период антикоагулянтной терапии. В первых двух клинических примерах назначение ИПП было вполне оправдано, так как у первого пациента в анамнезе имеется серьезная патология ЖКТ с эпизодом ЖКК, а второму предстоит принимать двойную АТТ в течение года. Кроме того, ИПП рекомендованы этим пациентам не для постоянного применения, а на ограниченный срок: в первом случае – на 3 мес (далее возможен прием «по требованию» или прекращение приема), во втором – на 12 мес.
ЗАКЛЮЧЕНИЕ
Пожилые пациенты с ФП, принимающие пероральные антикоагулянты, как правило, являются коморбидными и имеют высокий риск ЖКК, поэтому нуждаются в защите слизистой оболочки ЖКТ и профилактике кровотечений. Эксперты рекомендуют назначать таким пациентам ИПП и ребамипид. Поскольку ИПП действуют только на уровне желудка, они эффективны в предупреждении ЖКК лишь из верхнего отдела ЖКТ и у пациентов с язвенной болезнью или ЖКК в анамнезе. Ребамипид имеет отличный от ИПП механизм гастропротективного действия и дополнительно обладает энтеропротективным эффектом. Для снижения риска побочных эффектов ИПП рекомендуется назначать на непродолжительное время (обычно 3 мес), тогда как ребамипид можно принимать в течение длительного времени (эксперты рекомендуют неопределенно долгий прием) без риска серьезных нежелательных явлений.



