Результаты исследования различных факторов, влияющих на темп снижения функции легких при хронической обструктивной болезни легких (ХОБЛ) и бронхиальной астме (БА), противоречивы [1−3]. Воздействие табачного дыма на формирование стойких нарушений вентиляционной функции легких при ХОБЛ не вызывает сомнений [3]. Однако влияние других факторов на указанную функцию при ХОБЛ оценивается неоднозначно [4, 5].
Согласно результатам ряда исследований, отрицательное влияние на скорость снижения объема форсированного выдоха за 1-ю секунду (ОФВ1) у пациентов с БА имеют пожилой возраст, продолжительность курения, длительность заболевания более 10 лет [2]. Однако, по данным других авторов, эти факторы на темп снижения вентиляционной функции легких при БА не влияют [1].
В ряде рандомизированных клинических исследований показано замедление прогрессирования нарушения функции легких, а иногда даже ее улучшение у больных ХОБЛ при применении тиотропия бромида и комбинации длительно действующих β2-адреноагонистов с ингаляционными глюкокортикостероидами (ИГКС) [6]. Однако, по результатам других исследований, применение такой терапии не влияет или слабо влияет на темп падения ОФВ1 при ХОБЛ в долгосрочной перспективе [7, 8]. По данным W.R. Douma и соавт. (2002), K.F. Chung и соавт. (2009), при БА использование ИГКС приводит к увеличению ОФВ1, которое может сохраняться до 5 лет, но не у всех пациентов [9, 10].
Большая социальная и экономическая значимость проблемы, неуклонная тенденция к росту заболеваемости ХОБЛ и БА, а также необходимость выявления факторов, способных влиять на прогрессирование этих заболеваний, позволяют считать предлагаемое исследование целесообразным и актуальным.
МАТЕРИАЛЫ И МЕТОДЫ
По электронной базе данных многопрофильного клинического госпиталя были отобраны пациенты с диагнозом ХОБЛ или БА, проходившие лечение с 01.01.1993 г. по 31.12.2004 г. Проведена ретроспективная ревизия диагнозов. Все диагнозы соответствовали международным критериям ХОБЛ и БА, действующим на момент проведения исследования, − GOLD (Global Initiative For Chronic Obstructive Lung Disease, 2008) и GINA (Global Initiative For Asthma, 2007) соответственно [11, 12]. Пациенты с другими респираторными и внелегочными заболеваниями, способными повлиять на показатели спирометрии, в исследование не включались.
В исследовании участвовали 177 пациентов: 89 − с ХОБЛ и 88 − с БА. Средний возраст пациентов с ХОБЛ составлял 58,1±14,6 года, с БА − 47,9±11 лет. Среди пациентов с ХОБЛ 75,3% составляли мужчины, 24,7% − женщины, среди больных БА − 60,2 и 39,8% соответственно. Средняя длительность наблюдения составила 7,8±3 года (min – 3 года, max – 16 лет). Мощность исследования (средняя длительность наблюдения × количество пациентов) составила 1380,6 человеко-лет.
В качестве конечной точки рассматривалась скорость снижения ОФВ1 – показатель, принятый в большинстве крупных международных исследований для оценки прогрессирования ХОБЛ и БА. Темп изменения ОФВ1 был рассчитан на основании всех зарегистрированных у пациента измерений функции внешнего дыхания (ФВД) за время наблюдения.
Работа выполнена в соответствии с международными рекомендациями по организации эпидемиологических исследований STROBE [13, 14], согласно которым при обработке данных используются статистические методы: однофакторный (ОА) и многофакторный (МА) анализ. ОА – это оценка связи с изучаемой конечной точкой каждого фактора по отдельности, МА – оценка связи с изучаемой конечной точкой всей совокупности факторов одновременно. Согласно требованиям STROBE, на первом и втором этапах исследования с помощью методов ОА и МА отбирались значимые вмешивающиеся факторы (ВФ), т.е. факторы, не являющиеся прямыми воздействиями, но способные, по мнению исследователя, повлиять на изучаемый исход.
Всего проанализировано 115 потенциальных ВФ: 80 факторов, таких как пол, антропометрические характеристики, клинические проявления, факторы риска и особенности течения основного заболевания, аллергологический статус, результаты лабораторных и инструментальных методов исследования, и 35 сопутствующих нозологий.
Окончательные результаты получены в ходе третьего этапа − МА влияния лечебных воздействий на скорость снижения ОФВ1 с учетом значимых ВФ, отобранных на первом и втором этапах. Оценивалось влияние 29 групп препаратов и 2 немедикаментозных воздействий – аутотрансфузии ультрафиолетового облученной крови (АУФОК) и плазмафереза.
При анализе влияния каждой из групп препаратов на темп прогрессирования нарушения легочной функции у пациентов с ХОБЛ и БА использовался предложенный нами показатель – средняя относительная доза (СОД), представляющий собой отношение дозы, в которой принимался препарат, и максимально допустимой дозы для данного средства (по данным Российского регистра лекарственных средств), соотнесенное с процентом длительности приема препарата за изучаемый период наблюдения. При расчете показателя суммировались (Σ) все случаи приема всех препаратов соответствующего класса за изучаемый период. Нами была использована формула:
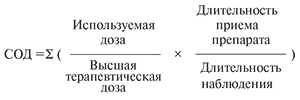
Следует отметить, что при таком подходе к обработке данных выявляется взаимонезависимое влияние факторов и воздействий на конечную точку (исход), т.е. достоверно определяется влияние на темп снижения ОФВ1 того или иного фактора или воздействия, независимо от влияния других факторов и лечебных воздействий. Поскольку мы оценивали связь СОД – интегральной характеристики дозы и длительности приема препарата со скоростью снижения ОФВ1, то при наличии достоверного результата можно говорить о дозозависимой корреляции СОД с динамикой ОФВ1, т.е. чем больше СОД используемых препаратов, тем более выражено их влияние на ускорение или замедление темпа падения ОФВ1.
Для обработки результатов использовалась статистическая программа SPSS 11.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Скорость снижения ОФВ1 у пациентов с ХОБЛ составляла 57 мл/год, у больных БА – 65 мл/год [15].
На первом этапе анализа материала из представленных выше 115 потенциальных ВФ в результате ОА были отобраны факторы, имеющие корреляционные связи с динамикой ОФВ1 (p<0,1): пол, возраст, длительность заболевания, исходные показатели ФВД, вазомоторный ринит, ишемическая болезнь сердца (ИБС) [15].
На втором этапе исследования при помощи МА были отобраны значимые ВФ (p<0,05), достоверно связанные со скоростью снижения ОФВ1 (таблица). У пациентов с ХОБЛ к таким факторам относились длительность заболевания (p<0,001), исходный уровень жизненной емкости легких (ЖЕЛ), ОФВ1, мгновенная объемная скорость − МОС25 (p=0,030, p<0,001, p=0,038 соответственно), ИБС: стенокардия напряжения I, II, III функциональных классов (ФК; p=0,007, p=0,011, p=0,036 соответственно). У пациентов с БА это были длительность заболевания (p=0,023), исходный уровень ЖЕЛ, ОФВ1, МОС25 (p=0,047, p<0,001, p=0,041 соответственно) [15].
На третьем этапе исследования был осуществлен МА влияния на скорость снижения ОФВ1 лечебных воздействий с учетом значимых ВФ. Полученные результаты представлены в таблице [15].
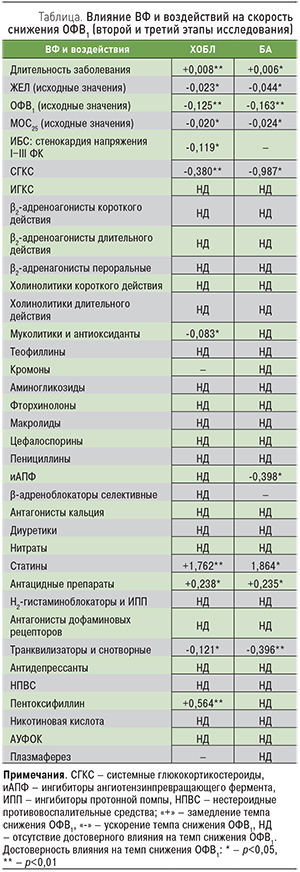 Широко применяемые для базисного и симптоматического лечения ХОБЛ и БА группы препаратов – ИГКС, β2-адреноагонисты короткого и длительного действия, пероральные β2-адреноагонисты, антихолинергические средства короткого и длительного действия, ацетилцистеин, теофиллины, кромоны, по нашим данным, не оказывают влияния на темп снижения ОФВ1 у пациентов с ХОБЛ и БА в долгосрочной перспективе в условиях реальной клинической практики. Необходимо уточнить, что в нашем исследовании не изучались β2-агонисты ультрадлительного действия (индакатерол), а антихолинергический препарат длительного действия тиотропия бромид применялся только у 4 пациентов. Эти средства стали широко использоваться лишь в последние годы.
Широко применяемые для базисного и симптоматического лечения ХОБЛ и БА группы препаратов – ИГКС, β2-адреноагонисты короткого и длительного действия, пероральные β2-адреноагонисты, антихолинергические средства короткого и длительного действия, ацетилцистеин, теофиллины, кромоны, по нашим данным, не оказывают влияния на темп снижения ОФВ1 у пациентов с ХОБЛ и БА в долгосрочной перспективе в условиях реальной клинической практики. Необходимо уточнить, что в нашем исследовании не изучались β2-агонисты ультрадлительного действия (индакатерол), а антихолинергический препарат длительного действия тиотропия бромид применялся только у 4 пациентов. Эти средства стали широко использоваться лишь в последние годы.
Согласно полученным нами данным, применение СГКС у пациентов с ХОБЛ и БА (р=0,005 и р=0,036 соответственно), а также муколитиков и антиоксидантов (р=0,045) у пациентов с ХОБЛ ассоциируется с ускорением темпа снижения ОФВ1 [15]. Следует отметить, что отрицательное действие муколитиков и антиоксидантов на темп снижения ОФВ1 осуществлялось за счет препарата бромгексин, который принимало большинство пациентов как с ХОБЛ, так и с БА (p=0,010 и p=0,025 соответственно), тогда как у амброксола и ацетилцистеина такого эффекта не отмечено [15].
Изученные антибактериальные препараты (аминогликозиды, фторхинолоны, макролиды, цефалоспорины, пенициллины), применявшиеся в период обострения, по нашим данным, не оказывают влияния на темп снижения ОФВ1 у пациентов с ХОБЛ и БА [15].
У кардиотропных препаратов (антагонисты кальция, селективные β-адреноблокаторы, диуретики и нитраты) влияние на темп снижения ОФВ1 у пациентов с ХОБЛ и БА, по нашим данным, отсутствует.
Использование иАПФ коррелирует с увеличением темпа снижения ОФВ1 у пациентов с БА (р=0,016) [15]. В то же время применение статинов ассоциируется с замедлением снижения ОФВ1 у пациентов с ХОБЛ и БА (р=0,007 и р=0,036 соответственно) [15].
Использование антацидных препаратов у пациентов с ХОБЛ и БА коррелирует с замедлением скорости снижения ОФВ1 (р=0,009 и p=0,034 соответственно) [15].
Н2-гистаминоблокаторы, ИПП и антагонисты дофаминовых рецепторов влияния на темп снижения ОФВ1 у пациентов с ХОБЛ и БА не оказывают. Не влияют на скорость снижения ОФВ1 у пациентов с ХОБЛ и БА также антидепрессанты, НПВС и препараты никотиновой кислоты.
Использование транквилизаторов и снотворных средств у пациентов с ХОБЛ и БА коррелирует с ускорением темпа снижения ОФВ1 (р=0,042 и р=0,006 соответственно) [15]. Применение пентоксифиллина у больных ХОБЛ ассоциируется с замедлением снижения ОФВ1 (р=0,004) [15].
Влияния немедикаментозных методов лечения (АУФОК, плазмаферез) на темп снижения ОФВ1 у пациентов с ХОБЛ и БА в нашем исследовании не обнаружено [15].
Долгосрочное когортное исследование, в котором в условиях реальной клинической практики выявлены факторы и лечебные воздействия, влияющие на скорость снижения ОФВ1 при ХОБЛ и БА, в России проведено впервые и по мощности (1380,6 человеко-лет) не уступает ряду крупных зарубежных рандомизированных исследований, таких как EUROSCOP – 963 человеко-лет [4], ISOLDE – 1127 человеко-лет [16], BRONCUS – 785 человеко-лет [17], TRISTAN – 733 человекл-лет [18].
Скорость снижения ОФВ1 у изученных нами пациентов соответствует результатам других исследований − от 35 до 79 мл/год при ХОБЛ [19, 20] и от 18,1 до 88,0 мл/год при БА [19, 21].
Согласно полученным нами данным наибольший темп снижения ОФВ1 при ХОБЛ и БА отмечается в начале заболевания при более высоких показателях ФВД. По мере прогрессирования заболеваний темп падения ОФВ1 замедляется. Полученные результаты согласуются с данными литературы [20]. Зависимость темпа снижения ОФВ1 от длительности заболевания и исходных значений ФВД необходимо учитывать при оценке состояния пациентов с ХОБЛ и БА, а также эффективности проводимого лечения.
Интересно следующее наблюдение. Наличие в анамнезе ИБС (стенокардии напряжения I–III ФК) у пациентов с ХОБЛ ассоциируется с ускорением темпа снижения ОФВ1. Известно, что ХОБЛ способствует возникновению ИБС [22] и увеличению риска смертельного исхода у больных ИБС на 50% [23]. Эффект взаимного отягощения ХОБЛ и ИБС также известен [24, 25]. Однако отрицательное влияние ИБС на динамику ОФВ1 у пациентов с ХОБЛ в долгосрочной перспективе в условиях реальной практики описано нами впервые.
Выявленное ускорение темпа снижения ОФВ1 у пациентов ХОБЛ и БА при использовании СГКС можно объяснить формированием стероидиндуцированной миопатии у этих больных [26]. Полученные результаты указывают на необходимость максимально осторожного применения СГКС в лечении ХОБЛ и БА. В настоящее время их использование рекомендуется при обострениях ХОБЛ, тяжелых обострениях БА, а также при тяжелом течении БА, если они оказывают выраженный положительный клинический эффект и способствуют уменьшению тяжести заболевания [27, 28]. Строгий отбор пациентов с БА для лечения этими препаратами, использование их в минимальных достаточных дозах, а также своевременное прекращение применения СГКС после обострений могут улучшить долгосрочный прогноз у таких больных. Кроме того, согласно современным рекомендациям альтернативой пероральным ГКС при лечении обострений ХОБЛ может быть небулайзерная терапия будесонидом [28].
Результаты изучения эффективности муколитиков указывают на необходимость коррекции их использования. Нами получены данные о возможности негативного влияния бромгексина на долгосрочный прогноз пациентов с ХОБЛ и БА, что, вероятно, объяснятся его способностью провоцировать бронхиальную обструкцию и кумулятивными свойствами [29]. Амброксол относительно мало применялся в изучавшейся когорте больных. Однако с учетом того факта, что амброксол является действующим метаболитом бромгексина, мы полагаем, что и его применение требует повышенной осторожности. В случаях, требующих использования муколитиков, альтернативой указанным препаратам может стать ацетилцистеин, не имеющий, по нашим данным, негативных долгосрочных эффектов, а также карбоцистеин, рекомендуемый к применению у пациентов с ХОБЛ [28].
Обнаруженное нами отрицательное влияние иАПФ на долгосрочную динамику ОФВ1 у пациентов с БА, вероятно, связано с усилением симптомов обструкции дыхательных путей, повышением реактивности бронхов за счет накопления в верхних дыхательных путях и легких провоспалительных медиаторов (брадикинина и субстанции P) [30]. С учетом результатов нашего исследования, представляются целесообразными ограничение использования иАПФ у пациентов с БА и сопутствующей сердечно-сосудистой патологией, строгая оценка соотношения «риск–польза» для каждого конкретного пациента, более частый контроль функциональной способности легких и, по возможности, применение альтернативных групп препаратов.
Выявленный позитивный эффект статинов на долгосрочную динамику ОФВ1 может быть объяснен известным противовоспалительным действием этих препаратов [31]. Данный факт не является основанием для выделения ХОБЛ и БА в качестве самостоятельных показаний к назначению статинов. В то же время можно говорить о несомненной целесообразности применения статинов у таких пациентов по общепринятым показаниям.
Результаты нашего исследования указывают на связь приема антацидов с замедлением прогрессирования ХОБЛ и БА. Вероятно, это является следствием бактериостатических свойств препаратов висмута [32] и их позитивного влияния на течение гастроэзофагеальной рефлюксной болезни (ГЭРБ), что приводит к снижению микроаспирации соляной кислоты в бронхи и уменьшению вследствие этого воспалительного процесса в их стенках [33]. В связи с этим мы полагаем, что необходимо ввести обязательный скрининг всех пациентов с ХОБЛ и БА на предмет выявления ГЭРБ.
Полученные нами данные позволяют подтвердить отмеченную в действующих рекомендациях нерациональность использования транквилизаторов и снотворных средств у пациентов с ХОБЛ и БА, отрицательное действие которых на темп снижения ОФВ1, вероятно, связано с их угнетающим действием на дыхательный центр и диафрагму [34].
Обнаруженная нами связь приема пентоксифиллина с замедлением темпа прогрессирования ХОБЛ также, вероятно, связана с противовоспалительными свойствами этого препарата [35]. Известно, что пентоксифиллин является производным ксантина (неселективный ингибитор фосфодиэстеразы) и имеет схожую с ним молекулярную структуру, что позволяет рассматривать наличие ХОБЛ как дополнительный аргумент при выборе пентоксифиллина в качестве средства лечения сосудистых заболеваний у этих больных.
Следует еще раз отметить, что выявленные нами закономерности при наличии статистически значимой достоверности носят дозозависимый характер, т.е. чем больше доза и длительность приема препарата, тем более выражена его способность ускорять или замедлять темп падения ОФВ1.
Полученные результаты не свидетельствуют о необходимости «нестандартной» терапии пациентов с ХОБЛ и БА антацидами, статинами и пентоксифиллином. Однако при наличии коморбидной патологии, которая часто сопутствует ХОБЛ и БА, назначение этих препаратов может не только благотворно повлиять на заболевание, по поводу которого они назначаются, но и улучшить течение ХОБЛ и БА.
Следует особо подчеркнуть, что наши данные не оспаривают стандартную базисную (бронхолитическую и противовоспалительную) терапию ХОБЛ и БА, принятую в международных и отечественных рекомендациях. Достоинства базисной терапии ХОБЛ и БА в виде купирования обострений и сокращения их количества, уменьшения выраженности симптомов заболевания, улучшения качества жизни пациентов не вызывают сомнений. Мы лишь говорим о ее неспособности повлиять на темп снижения ОФВ1 в долгосрочной перспективе, что согласуется с данными современной литературы, в соответствии с которыми среди применяемых для лечения ХОБЛ и БА медикаментозных средств не существует препаратов, способных замедлить прогрессирующее снижение ОФВ1 [8, 10].
Проведенное нами исследование является поисковым, и выявленные в нем закономерности можно рассматривать как предпосылки для проведения последующих рандомизированных или наблюдательных исследований. Информация о факторах и воздействиях, способных замедлить или ускорить темп снижения функции легких у пациентов с ХОБЛ и БА, может быть использована в клинической практике для оптимизации лечения больных ХОБЛ и БА с сопутствующей патологией, определения соотношения «риск–польза» при применении тех или иных препаратов, а также объективизации оценки состояния пациентов.
ВЫВОДЫ
- У обследованного контингента больных при длительном наблюдении (до 16 лет) в условиях реальной практики отмечается снижение ОФВ1: при ХОБЛ в среднем на 57 мл/год, при БА – на 65 мл/год.
- Наибольший темп снижения ОФВ1 при ХОБЛ и БА отмечен в начале заболевания при более высоких показателях ФВД. По мере прогрессирования заболеваний темп снижения ОФВ1 замедляется. Наличие в анамнезе у больных ХОБЛ ИБС – стенокардии напряжения I−III ФК ассоциируется с ускорением темпа снижения ОФВ1.
- Применение статинов и антацидов у пациентов с ХОБЛ и БА, а также пентоксифиллина у больных ХОБЛ статистически достоверно ассоциируется с замедлением темпа снижения ОФВ1 в долгосрочной перспективе.
- Применение СГКС, бромгексина, транквилизаторов и снотворных средств у больных ХОБЛ и БА, а также иАПФ у пациентов с БА статистически достоверно ассоциируется с ускорением темпа снижения ОФВ1 в долгосрочной перспективе.
- Применение у изученного контингента пациентов с ХОБЛ и БА ИГКС, β2-адреноагонистов короткого и длительного действия, антихолинергических средств короткого действия, ацетилцистеина, антибиотиков не способствует замедлению темпа падения ОФВ1 в долгосрочной перспективе.



