В настоящее время наблюдается увеличение количества пациентов, страдающих хронической обструктивной болезнью легких (ХОБЛ) [11]. На сегодняшний день смертность от ХОБЛ занимает 3-е место в мире после сердечно-сосудистых заболеваний (ишемической болезни сердца и инсульта) и продолжает расти [3, 10].
В соответствии с современными представлениями ХОБЛ – заболевание с персистирующим ограничением скорости воздушного потока, которое обычно прогрессирует и связано с повышенным хроническим воспалительным ответом легких на действие патогенных частиц и газов [11]. Однако в данном определении фокус внимания направлен на бронхолегочные проявления ХОБЛ. Хотя по последним данным ХОБЛ – это системное заболевание, обладающее внелегочными (системными) проявлениями. К ним относятся поражение сердечно-сосудистой системы, кахексия, дисфункция скелетных мышц, остеопороз [1, 11, 24].
У больных ХОБЛ легкие служат очагом патологического персистирующего воспаления с выбросом в кровоток провоспалительных цитокинов, оксидантов, что в свою очередь ведет к системному воспалению, усугублению процессов атерогенеза, поражению сосудов, сердца, почек, истощению скелетной мускулатуры [36, 37]. В настоящее время терапия ХОБЛ имеет два направления: симптом-модифицирующее (уменьшение симптомов ХОБЛ, улучшение толерантности к физической нагрузке, улучшение качества жизни) и болезнь-модифицирующее (влияние на прогноз: замедление прогрессирования ХОБЛ, предупреждение обострений ХОБЛ, снижение смертности) [4, 11]. Современные пульмонологические стратегии лечения ХОБЛ с использованием м-холинолитиков, β2-агонистов и глюкокортикостероидов уменьшают выраженность симптомов ХОБЛ, количество и тяжесть обострений, повышают переносимость физических нагрузок, улучшают качество жизни пациентов с ХОБЛ, но не влияют на смертность, не могут в значительной мере препятствовать прогрессированию снижения легочной функции [11]. Поэтому необходим поиск новых препаратов для лечения ХОБЛ, влияющих на легочное и системное воспаление и оказывающих воздействие как на патологический процесс в легких, так и на системные внелегочные проявления ХОБЛ и коморбидные заболевания. К новым противовоспалительным стратегиям в лечении ХОБЛ относят:
- применение ингибиторов фосфодиэстеразы-4. Однако показанием для использования рофлумиласта является лишь тяжелое течение ХОБЛ (постбронходилатационный объем форсированного выдоха в 1-ю с (ОФВ1) должен составлять менее 50% от рассчитанного должного показателя) у пациентов с частыми обострениями ХОБЛ в анамнезе [18];
- создание новых препаратов для лечения ХОБЛ, механизм действия которых тесно связан с патогенезом ХОБЛ (антагонисты хемокиновых рецепторов, ингибиторы цитокинов, антипротеазы, ингибиторы фосфатидилинозитол-3 киназы (IP3K), ингибиторы селектина, ингибиторы P38 митоген-активированной протеинкиназы) [7, 12, 13, 18, 20];
- использование уже известных препаратов, назначаемых по другим показаниям, но обладающих антиоксидантными, противовоспалительными свойствами, к ним относятся N-ацетилцистеин, макролиды, блокаторы ренин-ангиотензин-альдостероновой системы (РААС), статины.
Одним из известных антиоксидантов является N-ацетилцистеин. Данные по применению этого препарата у больных ХОБЛ носили противоречивый характер, но последние исследования показали, что высокие дозы N-ацетилцистеина (600 мг 2 раза/сут) у больных ХОБЛ не только улучшают мукоцилиарный клиренс, но и оказывают антиоксидантное и противовоспалительное действие, что способствует профилактике обострений ХОБЛ [8, 9, 14, 19, 33].
Обсуждается применение макролидов у больных ХОБЛ. Однако существует проблема колонизации дыхательных путей макролид-резистентными штаммами, поэтому эту группу препаратов не рекомендуют применять в рутинной практике и советуют использовать только у пациентов ХОБЛ с частыми обострениями [11, 18, 23].
Еще одной фармакотерапевтической группой, обладающей дополнительными положительными эффектами у больных ХОБЛ, являются блокаторы РААС. Блокада РААС ведет к снижению уровня системного воспаления, уменьшению проницаемости сосудов и экспрессии провоспалительных цитокинов, уменьшению молекул адгезии, снижению образования активных форм кислорода, что особенно актуально у больных ХОБЛ [2].
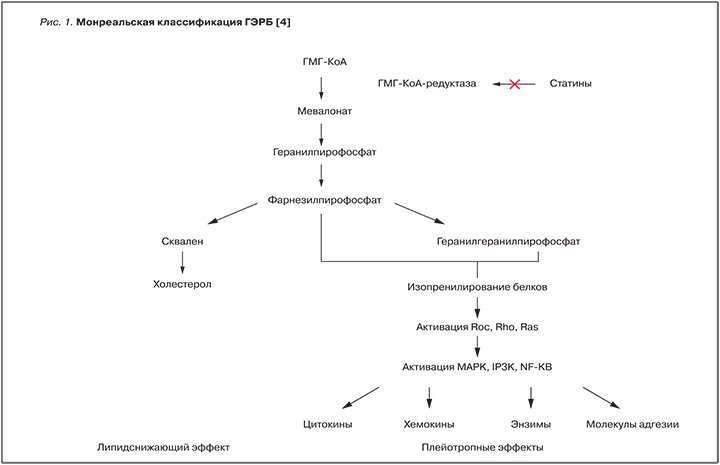
Наиболее перспективным представляется изучение плейотропных эффектов статинов у больных ХОБЛ. В течение последних 5–7 лет появились работы по применению статинов у больных ХОБЛ, в которых были обнаружены положительные результаты их применения в виде снижения смертности (общей, сердечно-сосудистой, от ХОБЛ), снижения количества обострений, уменьшения числа госпитализаций, повышения толерантности к физической нагрузке, уменьшения потребности в интубации, уменьшения риска развития рака легких, ослабления снижения легочной функции [6, 7, 15, 22, 25–32, 35–37]. Общеизвестно, что статины – ингибиторы 3-гидрокси-3-метилглутарил-КоА (ГМГ-КоА) редуктазы, ингибируют синтез холестерола в печени, оказывая тем самым гиполипидемический эффект. Плейотропные эффекты статинов обусловлены тем, что при ингибировании синтеза предшественника холестерина (мевалоната) статины прерывают образование продуктов каскада синтеза холестерина, а именно фарнезилпирофосфата и геранилгеранилпирофосфата, которые путем изопрениляции активируют внутриклеточные сигнальные регуляторные молекулы семейства GTP-связывающих белков (Ras, Rho, Rос), способствующие выработке цитокинов, хемокинов, ферментов молекул адгезии (рисунок) [5, 16–18, 21, 34, 37]. Описаны следующие плейотропные (дополнительные) эффекты статинов у больных ХОБЛ: противовоспалительный, антиоксидантный, иммуномодулирующий, эндотелийпротективный, антиадгезивный, влияние на процессы ремоделирования, антитромботический, торможение злокачественной трансформации клеток в легких [5, 36].

МАТЕРИАЛЫ И МЕТОДЫ
В исследование были включены 110 больных ХОБЛ со 2–3 степенью тяжести ограничения скорости воздушного потока (Global Initiative for Chronic Obstructive Lung Disease, GOLD, 2013), стабильного течения. Средний возраст пациентов 63,0 [61,0; 70,6] года. Все больные имели длительный стаж табакокурения, индекс курения составил 49,0 [40,0; 70,0] пачка/лет. Все пациенты подписали информированное согласие на участие в исследовании.
Критерии включения в исследование: мужчины в возрасте от 55 до 75 лет, с ХОБЛ, GOLD 2–3 степень тяжести ограничения скорости воздушного потока, стабильное течение или не ранее, чем через месяц после купирования обострения, отсутствие приема системных глюкокортикостероидов в течение последних 6 мес, отсутствие приема статинов.
Критерии невключения в исследование: наличие в анамнезе бронхиальной астмы, ишемической болезни сердца, острого нарушения мозгового кровообращения, транзиторной ишемической атаки, сахарного диабета, хронической сердечной недостаточности, декомпенсированного хронического легочного сердца, неконтролируемой артериальной гипертензии (АД >140/90 мм рт. ст.), симптоматической артериальной гипертензии, пороков сердца, онкологических, ревматологических и других заболеваний, которые могут помешать оценке полученных результатов.
Всем пациентам проводили оценку сердечно-сосудистого риска по шкале SCORE (Systematic Coronary Risk Estimation), который оказался высоким и очень высоким 10,0 [8,0; 18,0]. Больные были поделены на две группы. В группу розувастатина вошли 90 пациентов с ХОБЛ, которым с целью коррекции сердечно-сосудистого риска был назначен гиполипидемический препарат розувастатин 10 мг (Мертенил, компания «Гедеон Рихтер») длительностью 1 год с титрацией дозы до достижения целевых значений холестерина липопротеинов низкой плотности (ХС ЛПНП). Контрольную группу составили 20 пациентов ХОБЛ. Статистически значимой разницы между группами по возрасту, стажу курения, длительности и тяжести ХОБЛ, количеству обострений, применяемой ингаляционной терапии ХОБЛ не было. Базисная терапия ХОБЛ не менялась на всем протяжении исследования. Пациенты принимали ингаляционные антихолинергические препараты (ипратропия бромид, тиотропия бромид), β2-адреномиметик (фенотерол), ингаляционные глюкокортикостероиды, согласно рекомендациям GOLD.
Всем пациентам проводился осмотр, анализ жалоб и анамнеза, фиксировалось количество обострений ХОБЛ, выполнялось общеклиническое обследование: общий анализ крови, мочи, биохимический анализ крови, глюкоза крови, ЭКГ. Контроль липидного профиля (определение уровня холестерина, триглицеридов, ХС ЛПНП, ХС ЛПВП) осуществляли до начала терапии, через 1, 3, 6 и 12 мес от начала приема розувастатина. До начала терапии розувастатином и через 12 мес у пациентов в сыворотке крови проводилась оценка уровня системного воспаления с помощью определения высокочувствительного С-реактивного белка (вч-СРБ), воспалительных (фактор некроза опухолей ɑ [ФНО-ɑ], интерлейкин-8 [ИЛ-8]) и противовоспалительных (ИЛ-4, ИЛ-10) цитокинов. Оценивалась эндотелиальная дисфункция – по концентрации молекулы межклеточной адгезии первого типа VCAM-1, исследовалась активность оксидативного стресса – по уровню ацилгидроперекисей (АГП) и ферментов антиоксидантной защиты – по концентрации антиоксидантов (супероксиддисмутазы [СОД] и глутатионпероксидазы [ГПО]).
Вч-СРБ исследовался иммунотурбодиметрическим методом. Определение цитокинов и VCAM-1 осуществлялось методом иммуноферментного анализа (ИФА) с использованием соответствующих наборов реагентов. Интенсивность процессов перекисного окисления липидов (оксидативный стресс) изучали по концентрации конечных продуктов – ацилгидроперекисей по методике В.Б. Гаврилова и М.И. Мишкорудной с использованием спектрофотометра «Specord 205». Исследование процессов антиоксидантной защиты осуществляли с помощью наборов для определения СОД и ГПО на биохимическом анализаторе «Сапфир 400» в соответствии с приложенными к наборам инструкциям.
Для оценки выраженности симптомов выполняли оценочный тест течения ХОБЛ (Chronic obstructive pulmonary disease Assessment Test, CAT), оценивали выраженность одышки по шкале modified Medical Research scale (mMRC). Мониторирование функции внешнего дыхания осуществляли исходно, через 6 мес и через год на бодиплетизмографе волюметрического типа. Для оценки толерантности к физической нагрузке применяли тест 6-минутной ходьбы по стандартной методике с использованием пульсоксиметра MIROxi с встроенной в прибор программой данного теста.
Статистический анализ проводили в статистической программе SPSS 22 версии. Учитывая, что полученные данные в основном не имели нормального распределения, для описания выборки использовали медиану, первый и третий квартиль, сравнение двух независимых выборок проводили, применяя критерий Манна–Уитни, сравнение двух зависимых выборок выполняли с помощью двустороннего Т-критерия Вилкоксона. Сравнение выборок переменных, сводимых к дихотомическим, для несвязанных выборок проводили по двустороннему точному критерию Фишера, а для связанных выборок – по двустороннему точному критерию Мак-Немара. Статистически значимыми считались различия при p<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате титрации дозы розувастатина к 3-му мес терапии все пациенты достигли целевых значений ХС ЛПНП: c 3,3 [2,9; 3,8] до 1,6 [1,2; 1,8] ммоль/л (p<0,001). Произошло статистически значимое снижение уровня общего ХС на 31,0 [-42,1; -27,6]%, триглицеридов на 25,0 [-31,3; -12,5]%, ХС ЛПНП на 50,2 [-63,2; -39,5]%. Значимой динамики уровня ХС ЛПВП получено не было. В контрольной группе статистически значимой динамики липидного состава крови не наблюдалось. Достоверной динамики по показателям биохимического анализа крови, в том числе печеночных трансаминаз глюкозы крови, скорости клубочковой фильтрации не обнаружено.
На фоне терапии розувастатином отмечено достоверное снижение количества обострений ХОБЛ в течение 1 года в среднем на 25%. В контрольной группе статистически значимой динамики не обнаружено (табл. 1).
Обнаружено статистически значимое уменьшение количества баллов CAT в группе пациентов, принимающих розувастатин (p<0,001), что говорит о положительном влиянии розувастатина на клиническое течение ХОБЛ, уменьшении интенсивности симптомов ХОБЛ. В контрольной группе статистически значимой динамики не получено (табл. 1).
На фоне терапии розувастатином произошло статистически значимое снижение степени тяжести одышки по шкале mMRC. Увеличилось количество пациентов c 1 степенью одышки с 11 до 18%, (p<0,001), снизилось число пациентов с 3 степенью одышки с 33 до 28% (p<0,001), данные пациенты на фоне терапии розувастатином отметили снижение выраженности одышки и по результатам mMRC набрали на 1 балл меньше, чем в начале исследования.
По результатам теста 6-минутной ходьбы выявлено статистически значимое повышение уровня толерантности к физической нагрузке в группе больных ХОБЛ, принимающих розувастатин, и увеличение пройденной дистанции в среднем на 50 м (13,2%) (p<0,001). В контрольной группе наблюдалось уменьшение (p=0,001) пройденной дистанции в среднем на 19 м, что составляет 5% и обусловлено прогрессированием ХОБЛ (табл. 1). Статистически значимой динамики показателей спирометрии на фоне терапии розувастатином не обнаружено, в контрольной группе наблюдалось достоверное снижение ОФВ1 (p<0,001), что свидетельствует о возможности розувастатина через плейотропные противовоспалительные, антиоксидантные эффекты препятствовать прогрессированию ХОБЛ.
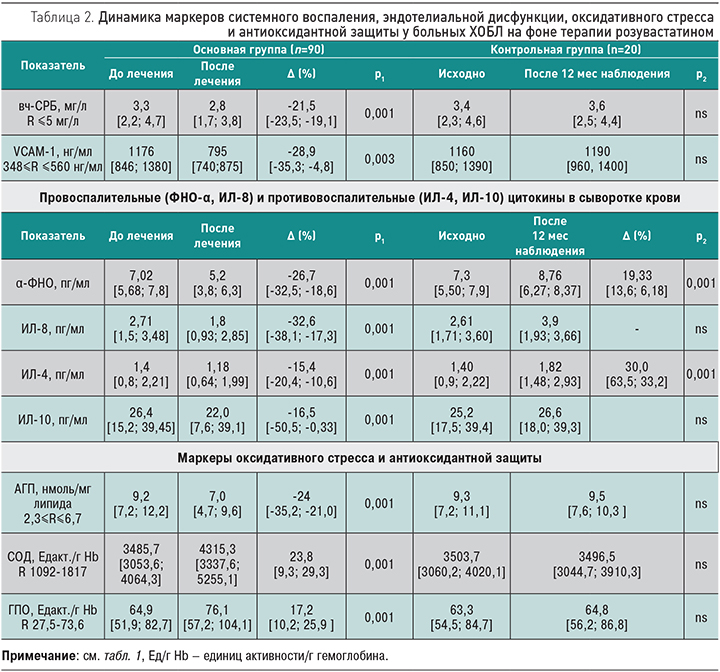
Полученные нами положительные клинические эффекты применения розувастатина у больных ХОБЛ обусловлены его противовоспалительным действием, антиоксидантным действием, эндотелийпротективным действием. На фоне терапии розувастатином обнаружено снижение уровня вч-СРБ на 21,5% (p=0,001). В контрольной группе статистически достоверной динамики уровня вч-СРБ не наблюдалось (табл. 2). У пациентов, принимающих розувастатин, произошло значимое (p=0,003) снижение уровня сосудистой молекулы адгезии-1 на 28,9% без динамики в контрольной группе (табл. 2). Снижение уровня вч-СРБ и VCAM-1 на фоне терапии розувастатином свидетельствует о противовоспалительном и эндотелий-корригирующем действии розувастатина, что особенно важно для больных ХОБЛ.
В процессе терапии розувастатином снизился уровень провоспалительных цитокинов в сыворотке крови у больных ХОБЛ: ФНО-α на 26,7% (p=0,001), ИЛ-8 на 32,6% (p=0,001). Одновременно наблюдалось снижение уровня противовоспалительных цитокинов (ИЛ-4 на 15,4%, ИЛ-10 на 16,5%; p=0,001), что обусловлено уменьшением уровня системного воспаления и потребности в цитокинах, обладающих противовоспалительными эффектами и препятствующих развитию гипервоспаления через подавление активности макрофагов, продуцирующих ФНО-α и ИЛ-8 (табл. 2). Данные результаты подтверждают противовоспалительные и иммуномодулирующие эффекты розувастатина у больных ХОБЛ. У пациентов контрольной группы продолжало нарастать системное воспаление: увеличилась концентрация ФНО-α в сыворотке крови на 19,3% (p=0,001) с рефлекторной активацией противовоспалительных систем (рост концентрации ИЛ-4 на 30%; p=0,001) (табл. 2).
При исследовании уровня оксидантов и антиоксидантов обнаружено увеличение в крови больных ХОБЛ как оксидантов (ацилгидроперекисей), так и ферментов антиоксидантной защиты СОД и ГПО в сравнении с референсными значениями, что связано с активацией ресурсов антиоксидантной защиты для поддержания баланса в системе оксидант/антиоксидант. На фоне терапии розувастатином в системе оксидант/антиоксидант наблюдалось преимущественное снижение уровня АГП, маркера оксидативного стресса, на 24% (p=0,001), повышение антиоксидантной защиты с увеличением уровня ферментов СОД и ГПО на 23,8 и 17,2% соответственно (p=0,001). В контрольной группе динамики выявлено не было (табл. 2), что свидетельствует о выраженном антиоксидантном эффекте розувастатина.
Таким образом, розувастатин у больных ХОБЛ обладает противовоспалительным, антиоксидантным, эндотелийпротективным, иммуномодулирующими эффектами, влияет на ключевые системные процессы развития ХОБЛ и сердечно-сосудистых заболеваний, способен улучшить клиническое течение ХОБЛ (снижение количества обострений, уменьшение выраженности симптомов, степени тяжести одышки, улучшение толерантности к физической нагрузке).
ЗАКЛЮЧЕНИЕ
Всем пациентам с ХОБЛ необходимо рассчитывать сердечно-сосудистый риск по общепринятой методике, определять показания к назначению статинов и индивидуальные целевые значения ХС ЛПНП. Целесообразно включение розувастатина в схемы терапии больных ХОБЛ, т.к. розувастатин воздействует на ключевые механизмы прогрессирования ХОБЛ и сердечно-сосудистого повреждения, обладает противовоспалительным, антиоксидантным, эндотелийпротективным эффектами, способен модифицировать течение ХОБЛ и улучшать прогноз больных ХОБЛ.



