Оптимальным методом оценки состояния организма человека в норме и патологии является системный анализ. Система представляет собой группу целенаправленно взаимодействующих элементов с одиночным циклом действий. Системный анализ классифицирует системы и их элементы во взаимосвязи между ними и подцели системы, на которые подразделяется ее основная генеральная цель. Достаточность или недостаточность взаимодействия элементов системы определяется соответствием между результатом действия системы (актуальной величиной) и ее целью (должной величиной).
Целенаправленность систем играет решающую роль при системном анализе живого организма. В системе кровообращения есть подсистема стабилизации артериального давления (АД), ее цель поддерживать АД на заданном ей уровне, и она осуществляет ее за счет баланса между общим сосудистым сопротивлением (ОПСС), ударным объемом (УО) и объемом циркулирующей крови (ОЦК). АД является результирующей функцией от этих и других аргументов, и при изменении баланса между ними развивается нарушение функции системы – артериальная гипертензия (АГ). В этом случае не величина АД будет фактором болезни, а признаки, обуславливающие повышения ОПСС, УО и ОЦК (гиперволемия)[1, 2].
Развитие дисфункции эндотелия со снижением продукции оксида азота (NO) и других биологически активных веществ, нарушение систем регуляции вегетативной (ВНС) и центральной нервной системы (ЦНС), изменение параметров гемодинамики являются главными факторами становления, течения АГ и развития ее осложнений. Снижение синтеза NO является основной причиной развития дисфункции эндотелия у больных с АГ [3, 4]. С другой стороны, NO вносит существенный вклад в регуляцию кровотока, коагуляцию, функции ВНС и ЦНС, синоптическую, нейрональную, гуморальную, нейрогормональную активность и нейротрансмиссию, ростовые факторы, апоптоз и, следовательно, в регуляторные механизмы всех систем организма человека. Не вдаваясь в подробный анализ систем, их иерархии и составляющих системных единиц, можно сформулировать основы системного анализа на примере структурно-морфологической классификации их взаимосвязей.
Известно, что в условиях умеренной гипоксии продукция NO увеличивается за счет адаптационных процессов: активации NO-синтаз и нитритредуктазной активности гемопротеинов (гемоглобина, миоглобина, ферритина, цитохромоксидазы), а также эритроцитоза, снижения элиминации NO свободными радикалами и других адаптационных процессов [5, 6].
Цель исследования: проведение системного анализа дисфункции эндотелия на основе оценки отдельных систем и подсистем организма у больных АГ и здоровых жителей высокогорья.
МАТЕРИАЛЫ И МЕТОДЫ
В высокогорных районах Приэльбрусья (2200–4100 м над уровнем моря) обследованы 195 коренных жителей, которые были выделены в следующие группы: 1-я группа – 40 больных АГ 1 степени (ст.; 18 мужчин и 22 женщины, средний возраст 47,4±3,2 года), индекс массы тела (ИМТ) 24,6±0,3 кг/м2; 2-я группа – 55 больных АГ 2 ст. (22 мужчины и 23 женщины, средний возраст 54,1±3,6 года), ИМТ 23,6±0,5 кг/м2; 3-я группа – 50 больных АГ 3 ст. (23 мужчины и 27 женщин, средний возраст 56,1±3,8 года), ИМТ 22,9±0,4 кг/м2; 4-я группа – контрольная, 50 здоровых жителей высокогорья, 26 мужчин и 24 женщины, средний возраст 45,8±3,9 года, ИМТ 23,3±0,4 кг/м2. Обследованные пациенты были сопоставимы по возрасту, полу и ИМТ. Все пациенты были ознакомлены с методиками исследований и дали свое информированное согласие на дальнейшее участие.
Диагноз АГ и уровень АД верифицировали на основании данных клинических, инструментальных, лабораторных и биохимических методов исследования. Стратификацию факторов риска и общего риска определяли в соответствии с рекомендациями Рабочей группы по лечению артериальной гипертонии Европейского общества гипертонии и Европейского общества кардиологов (ESH/ESC) 2013 г. [7].

Критерии исключения из исследования: пациенты с симптоматической АГ; метаболическими и эндокринными заболеваниями; признаками сопутствующих воспалительных заболеваний; нарушениями ритма и проводимости; выявленной стенокардией и/или постинфарктным кардиосклерозом в анамнезе; получающие лекарственную терапию, влияющую на концентрацию нитритов и нитратов в крови.
Для выбора функциональных единиц с целью выполнения системного анализа всем пациентам было проведено общеклиническое, лабораторно-инструментальное и биохимическое обследования. Проводилась компьютерная электрокардиография, эхокардиография. Больным АГ дополнительно проводили ультразвуковое исследование почек, щитовидной железы и осмотр глазного дна. Состояние сердечно-сосудистой системы оценивали с помощью компьютерной электрокардиографии «Cardiette» (Италия), эхокардиографии «Aloka SSD-500» (Япония), «ACUSON Antares Siemens Medical Solutions» (США). Систолическое АД (сАД) и диастолическое АД (дАД) определялось с помощью приборов «AND» и «Omron» (Япония) и суточных многофункциональных портативных носимых мониторов ЭКГ и АД «ДМС-Передовые технологии» (Россия). Среднее динамическое АД (АДср) и пульсовое АД (ПАД) вычисляли расчетным путем. Эхокардиографию проводили в М, В, М/В режимах, согласно общепринятым рекомендациям. Рассчитывали: конечный систолический и конечный диастолический размеры (КДР, см; КСР, см) и объемы (КДО, мл; КСО, мл) левого и правого желудочков (ЛЖ, ПЖ), ударный индекс ЛЖ (УИ=УО, мл/м2), удельное периферическое сосудистое сопротивление (УПСС=ОПСС, дин*с/см3/м2). Показатели глобальной сократимости ЛЖ: фракцию выброса (ФВ, %), относительное сокращение (ОС, %), скорость циркулярного сокращения волокон миокарда ЛЖ (Vcf, с-1); удельное время механической систолы (УВМС, мс/мл) и объемную скорость сердечного выброса (ОССВ, мл/мс). Индекс контрактильности (ИК) миокарда рассчитывали по формуле (ФВ/конечный систолический меридиональный стресс [КСМС]). Рассчитывали массу миокарда ЛЖ (ММЛЖ, г) и индекс массы миокарда (иММ, г/м2); параметры, характеризующие геометрию ЛЖ: индекс дилатации (КДР/Р, см/м2, где Р – поверхность тела в м2); относительную толщину стенки ЛЖ (ОТС ЛЖ); индекс напряжения миокарда ЛЖ (САД/КСО, мм рт. ст./мл); объемно-массовое отношение (иКДО/иММ, мл/г/м2); функциональный индекс соответствия (ФИС=УИ/иММ, мл/г/м2); индекс артериальной жесткости (ИАЖ) – отношение (УИ/ПАД, мл/м2/мм рт. ст.). КСМС и диастолический (КДМС) меридиональный стресс рассчитывали по общепринятым формулам [8].
Для анализа вариабельности ритма сердца (ВРС) проводили запись ЭКГ в течение 15 мин. В 5-минутных стационарных интервалах записи рассчитывали: количество кардиоинтервалов (NN); стандартное отклонение кардиоинтервалов (SDNN, мс); среднеквадратичное отклонение абсолютных приращений длительностей кардиоинтервалов (RMSSD, мс); процент NN интервалов с разницей 50 мс и более (pNN50, %); коэффициент вариации (CV, %); моду (М, мс), амплитуду моды (АМо, %). Индексы по P.M. Баевскому: индекс напряжения регуляторных систем (SI, ед.), интегральные индексы функций регуляторных механизмов по уравнениям дискриминантной функции: функциональный резерв (ФР, ед.), ФР=0,112*HR+1,006*SI+0,047*pNN50+0,086*HF; степень напряжения (СН, ед.), СН=0,14*HR+0,165*SI+1,293*pNN50+0,623*HF [9].

В частотной области ВРС определяли: общую мощность спектра TP (мс2) – мощность всех R-R интервалов; спектральную мощность в диапазоне очень низких частот VLF (мс2) – влияние симпатической и эрготропной систем; мощность в диапазоне низких частот LF (мс2), отражающую симпатические кардиальные влияния; мощность в диапазоне высоких частот HF (мс2), парасимпатические кардиальные влияния. Индекс вагосимпатического баланса (LF/HF, ед.); индекс централизации ([LF+VLF)/HF], ед.); индекс активности подкорковых нервных центров (VLF/LF, ед.), характеризующий активность нервных центров, регулирующих частоту ритма сердца, дыхания и влияние на них коркового торможения [10].
Продукцию NO оценивали по концентрации его стабильных метаболитов: нитритов (NO2-) и нитратов (NO3-). Концентрацию NO2- и NO3- определяли в безбелковых фильтратах плазмы крови и трижды отмытых (0,91% раствор NaCl) эритроцитах спектрофотометрическим методом (СФ-6-А, Россия) с помощью реактива Грисса по методу Грина. Концентрацию NO3- определяли в безбелковых фильтратах плазмы и эритроцитов прямым методом, используя бруциновый реактив [11].
Для проведения статистического анализа исследованные величины представлены в виде среднего значения и стандартной средней ошибки (M±m). Для сравнения независимых групп использовали t-критерий Стьюдента и тест Манна–Уитни. Анализ корреляционных связей и регрессионный анализ были проведены в пакете программы Statistica Advanced. v. 10.01 (StatSoft Inc., США) в модулях «корреляция», «регрессия и множественная регрессия», «факторный анализ». Значимость факторов оценивали по F-критерию Фишера. Результаты обработаны на компьютере и считались статистически значимыми при коэффициенте достоверности различий р<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Концентрация стабильных метаболитов оксида азота NO – нитритов NO2- и нитратов NO3- в группах больных АГ 1, 2 и 3 ст. и в группе здоровых лиц представлены в табл. 1. Как видно из табл. 1, концентрация NO2- в крови достоверно не отличается в группе больных АГ 1 ст. от показателей в группе здоровых лиц (на 6%). В группах больных АГ 2 и 3 ст. выявлено снижение концентрации NO2- (на 54 и 83%) по сравнению с группой здоровых лиц. Концентрация NO3- в крови снижена в группе больных АГ 1 ст. (на 7%) по сравнению с группой здоровых лиц и достоверно снижена в группе больных АГ 2 и 3 ст. (на 48% и в 1,6 раза). Суммарное содержание NO2- и NO3- в крови – NO незначительно снижено в группе больных АГ 1 ст. и достоверно снижено в группах больных АГ 2 и 3 степени (на 67% и в 1,6 раза) по сравнению с группой здоровых лиц.
При сопоставимой длительности течения АГ в группах больных АГ 1, 2 и 3 ст. показатели морфофункциональной структуры ЛЖ, центральной и интракардиальной гемодинамики различались как между группами больных, так и по сравнению с группой здоровых лиц (табл. 2). Как видно из табл. 2, все показатели, отражающие массу и объемы камер сердца, в группах больных достоверно выше, чем у здоровых лиц. УПСС достоверно выше в группе больных АГ по сравнению с группой здоровых лиц. КСМС и КДМС достоверно выше в группах больных (16–68%). Показатели сократимости миокарда ЛЖ (ФВ, ОС) снижены в группах больных АГ 2 и 3 ст. Показатель напряженности миокарда (САД/КСО) достоверно увеличен в группах больных АГ, как и индекс артериальной жесткости (УИ/ПАД). УВМС достоверно выше в группах больных АГ 2 и 3 ст. ОССВ достоверно снижен в группах больных АГ. Индекс дилатации (КДР/Р) увеличен в группах больных АГ, а индекс ФВ/КСМС в группах больных АГ 1, 2 и 3 ст. достоверно снижен.
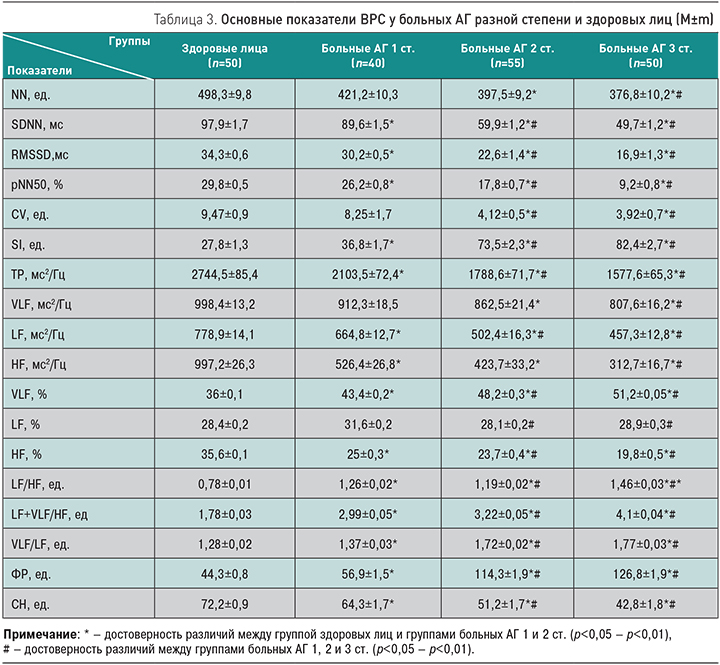
Как видно из табл. 3, показатели временной области ВРС снижены в группах больных АГ 1, 2 и 3 ст. (на 10–90%) по сравнению с группой здоровых лиц. Показатель вариационной пульсометрии (SI, ед.) в группах больных АГ достоверно увеличен (на 32%, в 2,6 раза и в 2,9 раза). В частотной области ВРС в группе больных АГ 1, 2 и 3 ст. наблюдается снижение общей мощности спектра (ТР) и во всех частотных диапазонах – сверхнизкочастотном (VLF), низкочастотном (LF) и высокочастотном (HF). Процентное соотношение частотных диапазонов в общей мощности спектра ТР у здоровых лиц составило VLF – 36%, LF – 24,8%, HF – 35,6%; в группе больных АГ 1 ст. – VLF – 43,4%, LF – 31,6%, HF – 25%; АГ 2 ст. – VLF – 48,2%, LF – 28,1%, HF – 23,7%; АГ 3 ст. – VLF – 51,2%, LF – 28,9%, HF – 19,8%.
У больных АГ 2 и 3 ст. выявлен высокий индекс централизации, индекс вагосимпатического баланса и увеличенный индекс активности подкорковых нервных центров: на 15–25% выше, чем в группе здоровых лиц. Индексы регуляторных систем ФР достоверно увеличены в группах больных АГ 2 и 3 ст., а СН снижена в сравнении с группой здоровых лиц и группой больных АГ 1 ст. Эти данные свидетельствуют о дисбалансе автономного контура регуляции и смещении регуляций ритма сердца в область гуморальных и центральных энергозатратных медленных симпатических влияний ВНС и ЦНС с ослаблением на них коркового торможения. Снижение активности быстрых регуляций на ВНС, преобладание эрготропной (надсегментарной) регуляции над трофотропной (сегментарной) характерно для нарушения систем адаптации, наиболее выражены в группах АГ 2 и 3 ст.
Проведены множественный корреляционный анализ и факторный анализ, вычислены уравнения множественной регрессии, которые показали закономерности, отражающие зависимость абсолютных и относительных параметров, индексов ВРС, морфофункциональных параметров ЛЖ и показателей гемодинамики от концентрации NO в крови, уровня АДСр и УПСС. Взаимосвязи 3-х параметров и более описаны при помощи уравнений множественной регрессии, которые могут быть представлены в виде: Y = f (β, X) + ε, где X = X(X1, X2, ..., Xn) – вектор независимых (объясняющих) переменных; β – вектор параметров (подлежащих определению); ε – случайная ошибка (отклонение); Y – зависимая (объясняемая) переменная.
Эмпирическое уравнение множественной регрессии можно представить в виде: Y = b0 + b1X1 + b1X1 + b2X2.. + bnXn + e, где b0, b1, ..., bn – оценки теоретических значений β0, β1, β2, ..., βn – коэффициентов регрессии (эмпирические коэффициенты регрессии); e – оценка отклонения ε.
Факторные признаки с автокорреляцией (ryxi) >0,6 исключались из модели. Рассчитывали частные коэффициенты эластичности (Еi) и доли каждого фактора в общей вариации результативного признака Y по коэффициентам детерминации, которые показывают, насколько процентов изменяется результативный признак Y с увеличением факторного признака – хj на 1% от своего среднего уровня. Если частный коэффициент эластичности E1 >1, он существенно влияет на результативный признак Y [12].
Уравнение регрессии у здоровых лиц представлено как зависимость следующих переменных: y(АДС) = b0+b1*X1(NO) + b2*X2(УПСС) + b3*X3(УИ) +b4*X4(иММ).
Коэффициент множественной корреляции R = 0,47 ± 0,12 (t=1,9) – не значим. Доли факторов X1–4 объясненной вариации результативного признака Y не достигают уровня 50%. Оценка регрессионным уравнением у здоровых лиц не значима. Т.е. уровень АДСр, NO, УИ не объясняется ни одним фактором, но доля фактора Х2 (УПСС) наиболее высокая – 39%.
Уравнения регрессии у больных АГ 1, 2 и 3 ст. рассчитаны аналогично и не приводятся в связи с большим объемом расчетов и формул. Наиболее значимые прямые взаимосвязи выявлены у больных АГ 2 и 3 ст. между уровнем АДСр и ММЛЖ, ОТС ЛЖ (r=0,685–0,768; p<0,01), обратно взаимосвязанные от концентрации NO в крови (r=- 0,896; p<0,001). Доля фактора X1(NO) на 89,6% объясняет вариацию результативного признака АДСр. Между уровнем АДСр и УИ, КСМС, КДМС у больных АГ 1, 2 и 3 ст. выявлены прямые взаимосвязи (r=0,473–0,718; p<0,001), зависимые от обратных взаимосвязей между АДСр, УПСС и концентрацией NO в крови (r=-0,583–0,809; p<0,001). Доля фактора УПСС на 80% объясняет вариацию результативного признака АДСр. КСМС, КДМС исключены из модели из-за высокой мультиколлинеарности (корреляционные связи между объясняющими переменными – rХ1Х3 >0,65).
У больных АГ 2 и 3 ст. установлена прямая взаимосвязь между индексами ФР и АДСр (r=0,583; p<0,001), зависимая от взаимосвязи СН и АДСр (r=-0,542; p<0,01). между АДСр и LF, LF/HF выявлена прямая взаимосвязь (r=0,723; r=0,748; p<0,001) и обратная – между АДСр и HF (r=- 0,765; p<0,001). В группе больных АГ 1 ст. аналогичные взаимосвязи менее выражены, чем в группах больных АГ 2 и 3 ст. Между показателями временной области ВРС – SDNN, RMSSD, ТР, СН (ед.) и АДСр выявлены обратные взаимосвязи (r=-0,467–0,759; p<0,001) как в группах больных АГ, так и в группе здоровых лиц. Обратные взаимосвязи выявлены между концентрацией NO в крови и ОТС ЛЖ, иММ, АДСр, Упсс, фр (r=-0,422 – r=-0,512; p<0,01) в группах больных АГ 2 и 3 ст. Между концентрацией NO в крови и SDNN, RMSSD, pNN50 установлены прямые слабовыраженные взаимосвязи (r=0,404–0,507; p<0,005). Между концентрацией NO и ин, LF+VLF/HF выявлены обратные взаимосвязи (r=-0,427–0,483; p<0,01). Не выявлено достоверных корреляций и коэффициентов регрессии между концентрацией NO в крови и АДСр, массовыми и объемными показателями ЛЖ и NO в группе здоровых лиц.
Таким образом, система эндотелий – NO не достигает своей основной генеральной подцели – стабилизации АД на физиологическом уровне и является недостаточной у больных АГ 2 и 3 ст. Следствием недостатка выработки NO и других эндотелиальных факторов является увеличение ОПСС и УО и, следовательно, уровня АДСр с характерными изменениями системных элементов в морфологии миокарда, сосудов и функций нейровегетативной регуляции ритма сердца. Уровень АД зависит только от 3-х факторов – ОПСС, УО и ОЦК, взаимосвязанных между собой, недостаточный синтез NO и других факторов эндотелием приводит к разрушению системных элементов, к уменьшению функции системы и недостаточности их для выполнения заданной цели – стабилизации АД на физиологическом уровне.
ЗАКЛЮЧЕНИЕ
В группах больных АГ 2 и 3 ст., в отличие от группы больных АГ 1 ст. и здоровых лиц, выявлены нарушения системных элементов и накопление дефектов системы эндотелий – NO. Эти изменения сопровождались изменениями в других подсистемах: достоверным снижением суммарной ВРС (недостаточностью системы нейровегетативной регуляции), изменениями геометрии ЛЖ, гемодинамики, тесно взаимосвязанных между собой.
Нарушения ВРС выявлены у 49% больных АГ 1 ст., у которых изменения морфофункциональных параметров и концентрации NO в крови были слабо выражены. Нарушения ВРС, изменение морфофункциональной структуры ЛЖ, параметров гемодинамики и снижение NO в крови были выявлены у 89% больных АГ 2 ст. и у всех больных АГ 3 ст. (ресурсы организма снижены, прогноз зависит от количества и иерархии разрушенных системных элементов).
Таким образом, недостаточность системы эндотелий – NO сопровождается недостаточностью функций ее подсистем, которые в значительной мере определяют прогноз, течение и терапевтические стратегии у больных АГ, жителей высокогорья. Снижение продукции NO эндотелием (монофункциональной системы) приводит к нарушению в многофункциональных системах, определяющих качество функций систем, которые выполняют действия для достижения основной цели системы.



