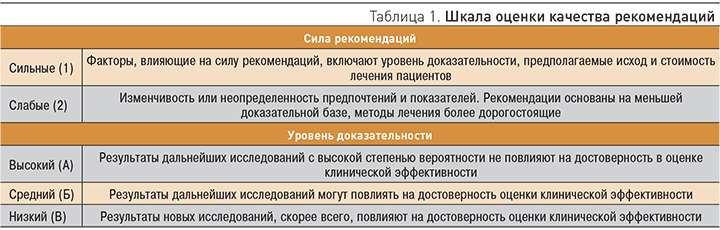
Настоящие обновленные методические рекомендации (2-я версия) основаны на обзоре и анализе публикаций последних лет по данной тематике в мировой и отечественной литературе, а также на опыте авторов по лечению пациентов с неалкогольной жировой болезнью печени (НАЖБП). Методические рекомендации предназначены для терапевтов и содержат описание предпочтительных подходов к оказанию диагностической, лечебной и профилактической помощи больным НАЖБП. Для оценки качества рекомендаций использована шкала GRADE (табл. 1), в которой сила рекомендаций подразделяется на сильную и слабую, а уровень доказательности имеет три градации.
ДЕФИНИЦИИ
НАЖБП – хроническое заболевание, объединяющее спектр клинико-морфологических изменений в печени (стеатоз, стеатогепатит, фиброз, цирроз) у лиц, не употребляющих в чрезмерном количестве алкоголь. НАЖБП диагностируется при отложении жировых вакуолей, содержащих триглицериды (ТГ), более чем в 5–10% гепатоцитов.
В МКБ-10 отсутствует единый код НАЖБП, отражающий диагноз в полной мере, в связи с чем целесообразно использовать один из нижеприведенных кодов:
- К 76.0 – жировая дегенерация печени, не классифицированная в других рубриках;
- К 73.0 – хронический персистирующий гепатит, не классифицированный в других рубриках;
- К 73.9 – хронический гепатит неуточненный;
- К 74.6 – другой и неуточненный цирроз печени (ЦП).
ЭПИДЕМИОЛОГИЯ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ
Распространенность НАЖБП в общей мировой популяции варьирует от 6,3 до 37,3%. НАЖБП выявляют в любой возрастной категории, однако у лиц, страдающих ожирением, распространенность заболевания значительно выше, чем в общей популяции, и, по данным различных исследований, достигает 62–93%. У 90% пациентов с НАЖБП выявляется не менее одного компонента метаболического синдрома (МС), у 30% – все составляющие МС. Частота НАЖБП у больных сахарным диабетом (СД) 2 типа и ожирением, по данным различных исследований, варьирует от 70 до 100%, при этом СД 2 типа или нарушение толерантности к глюкозе (НТГ) выявляют у 10–75%, ожирение – у 30–100%, гипертриглицеридемию – у 20–92% пациентов с НАЖБП. Показано, что жировая дегенерация печени может возникнуть задолго до развития МС и, в свою очередь, создавать существенные предпосылки для развития возможных метаболических нарушений (сила – 1, уровень – В). При этом НАЖБП как составляющая МС служит фактором риска развития заболеваний сердечно-сосудистой системы и определяет их исход даже в большей степени, чем исход заболевания печени. В связи с этим НАЖБП в рамках МС в настоящее время рассматривается как независимый фактор риска развития и прогрессирования заболеваний печени и сердечно-сосудистой системы (сила – 1, уровень – Б). В то же время имеются наблюдения, показывающие, что среди пациентов с НАЖБП 22% не имели избыточного веса и не страдали СД, 64% – не соответствовали минимальным критериям МС, а в 12% случаев не было выявлено ни одного критерия МС. Более того, в исследовании Y. Chang и соавт. (2006) показано, что стеатоз печени может развиваться при повышении массы тела, не сопровождающемся повышением индекса массы тела (ИМТ). Предполагается, что даже незначительное увеличение массы тела может сопровождаться перераспределением содержания липидов в тканях и нарушением их нормального метаболизма. В среднем на стадии стеатогепатита НАЖБП диагностируют в 18,5–26%, фиброза – в 20–37%, ЦП – в 9–10% случаев.
По данным имеющихся национальных эпидемиологических исследований, НАЖБП занимает лидирующее место в структуре заболеваний внутренних органов в РФ (сила – 1, уровень – Б). В России 30% трудоспособного населения имеет избыточную массу тела и 25% страдает ожирением, что создает благоприятную почву для формирования патологии. По результатам российского исследования DIREG 1 (2007) распространенность НАЖБП у амбулаторных пациентов составляла 27%, при этом у 80,3% диагностирован стеатоз, у 16,8% – стеатогепатит, у 2,9% – ЦП. Исследование DIREG 2 (2015) показало, что распространенность НАЖБП составила уже 37,3%, показав рост на 10% за 7 лет в сравнении с данными DIREG 1, при этом число больных с ЦП в исходе НАЖБП увеличилось до 5%.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ
В основе развития МС и НАЖБП лежит нарушение чувствительности и количества рецепторов к инсулину – инсулинорезистентность (ИР), приводящая к выраженным нарушениям липидного, углеводного и жирового обменов и дисбалансу между потреблением и утилизацией липидов. Накопление жира в клетках печени является следствием повышения поступления свободных жирных кислот (СЖК) в печень, снижения скорости β-окисления СЖК в митохондриях, избыточного их синтеза, снижения синтеза или секреции липопротеидов очень низкой плотности (ЛПОНП). ТГ в этой ситуации не могут быть утилизированы путем упаковки в ЛПОНП с целью выведения из печени. Поэтому избыток ТГ откладывается в виде жировых вакуолей в гепатоцитах, что приводит к формированию жировой инфильтрации печени – стеатоза.
Механизмами трансформации стеатоза в стеатогепатит являются:
- повышение продукции TNF-α жировой тканью;
- прогрессирующее увеличение концентрации СЖК, оказывающих прямой повреждающий эффект на мембраны гепатоцитов;
- активация цитохрома Р450;
- активация перекисного окисления липидов (ПОЛ);
- накопление свободнорадикальных (реактивных) форм кислорода с развитием оксидативного стресса и образованием избыточного количества высокотоксичных ксенобиотиков.
Результатом этих патологических реакций является хроническое воспаление (неалкогольный стеатогепатит – НАСГ), стимуляция коллагенообразования и прогрессирование фиброза в печени. У 15–50% больных НАЖБП определяется фиброз печени, у части (по данным различных авторов – до 11%) имеется риск трансформации в ЦП. Описаны случаи формирования гепатоцеллюлярной карциномы (ГЦК) на фоне НАЖБП.
У 10–15% популяции признаки НАЖБП обнаруживают при отсутствии МС; в данной ситуации в качестве патогенетических механизмов обсуждаются другие причины, например синдром избыточного бактериального роста в кишечнике (СИБР) и/и эндотоксемия. Основные механизмы развития жировой болезни печени при этих состояниях могут быть связаны с активацией ПОЛ и развитием окислительного стресса на фоне нарушения синтеза аполипопротеинов классов А и С, являющихся транспортной формой для ТГ в процессе образования ЛПОНП. Кроме этого, СИБР является причиной повышенного выброса эндотоксина, повреждающего гепатоцит и сосудистый эндотелий. При нарушении функционирования гепатоцита развивается дисбаланс в долях выводимого через основной и дополнительный пути холестерина (ХС), что сопровождается формированием атерогенной дислипидемии, НАЖБП, холестероза желчного пузыря, желчнокаменной болезни. Таким образом, гиперэндотоксинемия (или эндотоксиновая агрессия) потенциально является условием формирования НАЖБП и атеросклероза. Обсуждается также гипотеза о том, что одним из путей развития атеросклероза является первоначальное отложение липидов в стенке желчного пузыря с развитием его холестероза на фоне нарушения обмена ХС в гепатоците и последующим инициированием отложения липидов в стенке сосудов. Это подтверждается сходством гистологической картины стенки желчного пузыря при холестерозе и стенки сосудов при атеросклерозе в виде образования большого количества пенистых клеток.
ФАКТОРЫ РИСКА РАЗВИТИЯ И ПРОГРЕССИРОВАНИЯ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ
Выделяют первичные и вторичные факторы, способствующие развитию и прогрессированию НАЖБП. К первичным факторам относят: малоподвижный образ жизни, низкую физическую активность, МС, СД, висцеральное ожирение, дислипидемию, СИБР с гиперэндотоксинемией. Вторичные факторы: прием лекарственных препаратов (глюкокортикоиды, амиодарон, эстрогены, тамоксифен, тетрациклин, ацетилсалициловая кислота, индометацин, бруфен, антибиотики), нарушение питания (голодание, резкое сокращение или увеличение калорийности пищи, чрезмерное потребление углеводов, парентеральное питание, недостаток белков, витаминов и микроэлементов), нарушение процессов пищеварения и всасывания (хронические заболевания органов желудочно-кишечного тракта с секреторной недостаточностью пищеварительных ферментов), болезни обмена (Вильсона–Коновалова, Вебера–Крисчена, подагра), гипотиреоз, беременность, нарушение микробиоценоза кишечника.
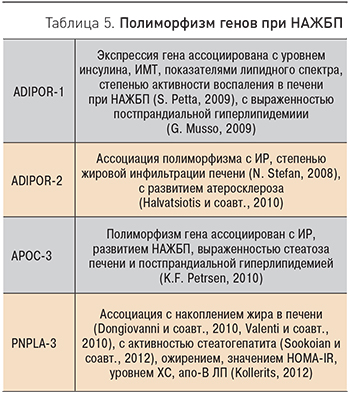
РОЛЬ ГЕНЕТИЧЕСКОГО ПОЛИМОРФИЗМА В ПАТОГЕНЕЗЕ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ
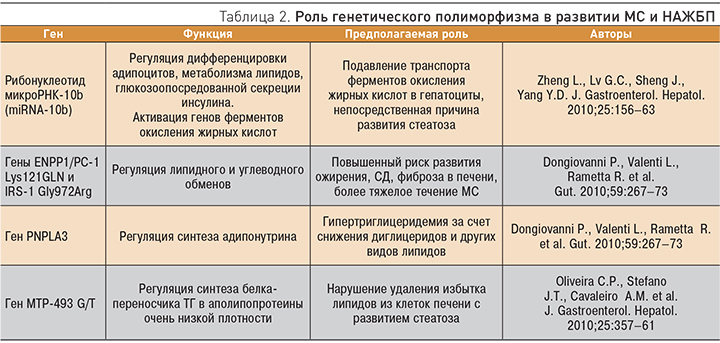
Имеются случайные наблюдения и данные единичных исследований о наличии НАЖБП у нескольких членов одной семьи, но достоверных сведений о наследственной природе заболевания нет. В связи с этим у взрослых пациентов с НАЖБП скрининг ближайших родственников на наличие заболевания нецелесообразен (сила – 1, уровень – Б). Однако в последние годы описано несколько генов, полиморфизм которых может иметь значение в развитии нарушений жирового и углеводного обменов и формировании НАЖБП (табл. 2)
КЛИНИЧЕСКАЯ КАРТИНА НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ
В целом для НАЖБП характерно бессимптомное течение. В повседневной практике врач может заподозрить эту патологию по наличию синдрома цитолиза и/или гепатомегалии, обнаруженных при обследовании по другому поводу. Обычно пациенты обращаются к врачу по поводу жалоб, не связанных с заболеванием печени, а именно по поводу артериальной гипертензии, ишемической болезни сердца (ИБС), заболеваний периферических сосудов, ожирения, СД 2 типа и др.
Основные клинические симптомы НАЖБП не специфичны:
- астенический синдром – слабость, повышенная утомляемость, нарушение сна;
- диспепсический синдром – метеоризм, тошнота, нарушения стула;
- болевой синдром – тупые боли и/или тяжесть в правом подреберье;
- гепатомегалия и/или спленомегалия.
Показатели биохимического анализа крови у пациентов на стадии стеатоза печени обычно не превышают границ нормы, на стадии стеатогепатита выявляют повышение активности аланиновой (АЛТ) и аспарагиновой (АСТ) аминотрансфераз до уровня 4–5 норм с преобладанием АЛТ, повышение активности щелочной фосфатазы (ЩФ) и гамма-глутамилтранспептидазы (ГГТП), гиперхолестеринемия, гипергликемия (НТГ или СД 2 типа), реже – повышение уровня билирубина.
Частым спутником НАЖБП является дислипидемия (проатерогенный сывороточный липидный профиль, включающий низкий уровень ХС липопротеидов высокой плотности [ЛПВП], высокий уровень ТГ, липопротеидов низкой плотности [ЛПНП] и аполипопротеина В100), развивающаяся независимо от стадии и степени выраженности заболевания и способствующая прогрессированию поражения печени и развитию заболеваний сердечно-сосудистой системы (сила – 1, уровень – Б).
При прогрессировании НАЖБП до стадии ЦП наблюдается преобладание АСТ над АЛТ, нарушение белковосинтетической функции печени в виде снижения уровня общего белка, альбумина, ХС, холинэстеразы и протромбинового индекса, повышение уровня билирубина, тромбоцитопения как проявление гиперспленизма. Наличие и прогрессирование фиброза характеризуется нарушением баланса соответствующих сывороточных маркеров: гиалуроновой кислоты, проколлагена III типа, N-терминального пептида проколлагена III, ламинина и др. На этом фоне постепенно формируется портальная гипертензия, которая проявляется расширением воротной и селезеночной вен, варикозным расширение вен пищевода и желудка, отечно-асцитическим синдромом.
Необходимо учитывать, что интенсивность предъявляемых жалоб и данные лабораторно-инструментального обследования обычно не коррелируют со степенью активности процесса, особенно на ранних стадиях. Отсутствие изменений лабораторных показателей, характеризующих функциональное состояние печени, не исключает наличия воспалительно-деструктивного процесса и фиброза.
ДИАГНОСТИКА НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ
У больных с подозрением на НАЖБП прежде всего необходимо исключить конкурирующие этиологические факторы и сопутствующие хронические заболевания печени (сила – 1, уровень – А), а именно:
- алкогольную болезнь печени;
- хронический вирусный гепатит (исследование на маркеры вирусных гепатитов В и С);
- болезнь Вильсона–Коновалова (исследование прямой фракции меди и церулоплазмина в сыворотке крови, меди в суточной моче);
- гемохроматоз (исследование показателей обмена железа: ферритин, трансферрин, степень насыщения трансферрина);
- аутоиммунные заболевания печени (исследование наличия аутоантител: антинуклеарных, антигладкомышечных, антинейтрофильных, антимитохондриальных, печеночно-почечных);
- врожденную недостаточность α1-антитрипсина (определение фермента в сыворотке крови).
Необходимо исключить вторичные факторы развития НАЖБП: прием лекарственных препаратов (амиодарон, аспирин, глюкокортикоиды, дилтиазем, нифедипин, тамоксифен, метотрексат и др.), парентеральное питание, голодание, быстрое снижение массы тела, воспалительные и аутоиммунные заболевания кишечника, хирургические вмешательства (гастропластика, еюно-илеальное шунтирование, обширная резекция тонкой кишки и др.).
Исключение алкогольной этиологии является одной из первых задач в диагностике НАЖБП. Приемлемой дозой употребления алкоголя у пациентов, которым диагностируется НАЖБП, следует считать употребление этанола не более 210 мл/нед для мужчин и не более 140 мл/нед для женщин (сила – 2, уровень – В). Для исключения алкогольной этиологии рекомендованы:
- опрос ближайших родственников пациента;
- апробированные опросники для количественной оценки потребления алкоголя;
- определение лабораторных маркеров злоупотребления алкоголем: уровня сывороточной ГГТП, АСТ, соотношения АСТ/АЛТ, среднего объема эритроцитов, уровня ТГ, углеводдефицитного трансферрина;
- определение алкогольного стеатоза с помощью диагностической панели «ФиброМакс» («АшТест»).
Визуализирующие методы в диагностике НАЖБП
Основное условие диагностики НАЖБП – установление наличия избыточного содержания жира в печени по данным инструментальных и/или морфологических исследований. С целью верификации наличия и степени выраженности жировой инфильтрации печени и портальной гипертензии рекомендовано инструментальное обследование: ультразвуковое исследование (УЗИ), компьютерная томография (КТ), магнитно-резонансная томография (МРТ).
Среди визуальных методов диагностики НАЖБП наибольшее распространение в виду своей доступности получило УЗИ, дающее возможность выявить стеатоз в печени и оценивать изменения в динамике. Основные ультразвуковые признаки стеатоза печени:
- дистальное затухание эхосигнала;
- диффузная гиперэхогенность печени («яркая белая печень»);
- увеличение эхогенности печени по сравнению с почками;
- нечеткость и обеднение сосудистого рисунка.
Наличие признаков стеатоза по данным УЗИ при неизменных лабораторных тестах является достаточным критерием для постановки диагноза НАЖБП, поскольку результаты биохимического анализа крови не всегда отражают наличие или отсутствие стеатоза печени. Основные признаки стеатоза печени по данным КТ:
- снижение рентгеноплотности печени до 3–5 единиц (норма 50–75 единиц);
- рентгеноплотность печени при стеатозе меньше рентгеноплотности селезенки;
- внутрипеченочные сосуды (воротная, нижняя полая вена) визуализируются как более плотные структуры по сравнению с печеночной тканью;
- для очаговой жировой инфильтрации характерно пересечение нормальными кровеносными сосудами печени зон пониженной рентгеноконтрастности.
При необходимости применяется современная высокопольная МРТ, преимуществами которой являются: высокая тканевая контрастность изображения за счет выгодного соотношения сигнал–шум, возможность получения целостного изображения органа в любой проекции, большие ресурсы программного обеспечения, используемые для дифференциальной диагностики.
Неинвазивная диагностика фиброза печени при НАЖБП
Для установления степени выраженности некровоспалительных изменений и стадии фиброза печени для больных НАЖБП применяют неинвазивные диагностические тесты:
- «ФиброМакс» включает в себя определение активности процесса – «АктиТест», стадии фиброза – «ФиброТест», степени выраженности стеатоза – «СтеатоТест» и воспаления (НАСГ) – «НэшТест» и «АшТест» (алкогольный стеатогепатит). По ряду биохимических показателей, с учетом пола, возраста, роста и веса пациента, на основании математического анализа производится расчет индекса, соответствующего той или иной шкале.
- «Fibro Test» – расчет индекса фиброза по специальной формуле с предварительным определением сывороточных маркеров фиброза (α2-макроглобулин [АМГ], гаптоглобин, аполипопротеин А1 [ApoAl], ГГТП, общий билирубин). Тест имеет высокую надежность при выраженных стадиях фиброза – прогностическая ценность отрицательного (NPV – negative predictive value) и положительного (PPV – positive predictive value) результата составляет 90 и 70% соответственно. При синдроме Жильбера, высоком цитолизе, высокой концентрации ЛПВП результаты «Fibro Test» не достоверны.
- Шкала оценки фиброза при НАЖБП (NAFLD fibrosis score) основана на ряде показателей: возраст (количество лет), нарушение толерантности к глюкозе (НТГ; есть = 1, нет = 2), ИМТ (ИМТ = масса тела в кг/рост в м2), количество тромбоцитов (1×109/л), уровень альбумина (г/дл), соотношение АСТ/АЛТ. Степень фиброза рассчитывается по формуле: – 1,675 + 0,037 – возраст (годы) + 0,094 – ИМТ (кг/м2) + 1,13 × гипергликемия натощак (или СД) + 0,99 × АсАТ/АлАТ – 0,013 × кол-во тромбоцитов (×109/л) – 0,66 × альбумин (г/дл) (калькулятор доступен он-лайн http://www.nafldscore.com). При значении менее 1,455 фиброз отсутствует, более 0,676 – выраженный фиброз (чувствительность шкалы 90%).
- «Original European Liver Fibrosis (OELF) test» (чувствительность 90%) включает определение ряда показателей: возраст, уровень тканевого ингибитора металлопротеиназы-1, концентрация гиалуроновой кислоты, концентрация N-терминального пропептида коллагена III типа.
- Транзиентная эластография (фибросканирование, фиброэластометрия) определяет эластичность ткани печени с помощью специального аппарата. Наиболее высокая диагностическая точность метода наблюдается при выраженных стадиях фиброза. Недостатком является отсутствие возможности оценки выраженности некровоспалительного процесса, неинформативность у пациентов с избыточной массой тела, искажение значения результатов у пациентов в стадии биохимической ремиссии, с острым гепатитом, невозможность оценки состояния печени на стадиях стеатоза, стеатогепатита и ранних стадиях фиброза.
Диагностическая биопсия печени
Пункционная биопсия печени является «золотым стандартом» диагностики НАЖБП, особенно в случаях, когда другие методы диагностики не дают возможности убедительно верифицировать заболевание.
Показания к биопсии печени при НАЖБП:
- возраст старше 45 лет и хронический цитолиз неустановленной этиологии;
- сочетание хронического цитолиза неустановленной этиологии по крайней мере с двумя проявлениями МС, независимо от возраста;
- невозможность другими методами исключить наличие конкурирующих этиологических факторов и сопутствующих хронических заболеваний печени (сила – 1, уровень – В);
- высокая вероятность наличия стеатогепатита и прогрессирующего фиброза печени (сила – 1, уровень – В);
- подозрение на НАЖБП в сочетании с устойчивым выраженным увеличением содержания железа и сывороточного ферритина на фоне гомозиготной или гетерозиготной мутации С282У в гене НFE (сила – 1, уровень – В).
Биопсия печени не показана лицам с НАЖБП со стеатозом, выявленным при инструментальном обследовании, в случае отсутствия признаков или симптомов печеночного заболевания и нормальных биохимических показателях (сила – 1, уровень – В), а также пациентам с установленной НАЖБП в рутинном обследовании для динамического наблюдения (сила – 2, уровень – В).
КЛАССИФИКАЦИЯ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ
По гистологическим признакам выделяют стеатоз, стеатогепатит (НАСГ), в том числе с наличием фиброза, и ЦП в исходе НАЖБП. Стеатоз печени определяется при наличии накопления жира в печени без признаков гепатоцеллюлярного повреждения в виде баллонной дистрофии гепатоцитов. НАСГ характеризуется наличием воспалительной инфильтрации на фоне стеатоза с фиброзом или без фиброза. На стадии ЦП выявляются морфологические признаки ЦП в сочетании с жировой инфильтрацией печени.
Основные морфологические критерии НАЖБП:
- крупнокапельный стеатоз, преимущественно в 3-й зоне ацинуса, характеризующийся наличием крупных липидных капель в цитоплазме со смещением ядра к периферии дольки;
- баллонная дистрофия гепатоцитов;
- преобладание лобулярного воспаления, представленного полиморфноядерными лейкоцитами и мононуклеарами;
- перисинусоидальный фиброз в 3-й зоне ацинуса – месте наихудшего кровоснабжения.
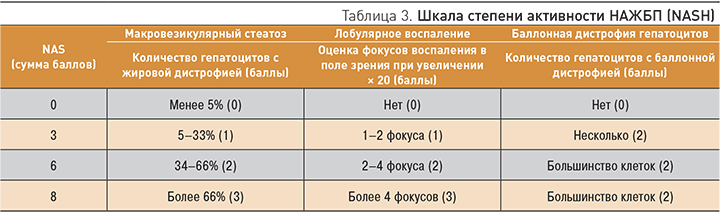
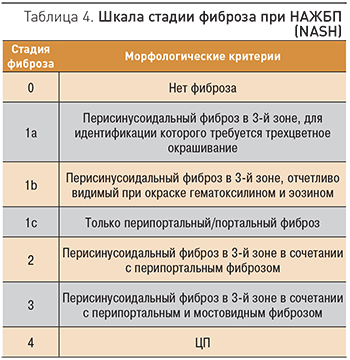
С целью определения гистологической активности заболевания разработана специальная шкала для определения активности НАЖБП (NAFLD activity score, NAS), которая представляет собой комплексную оценку морфологических изменений в баллах и объединяет такие критерии, как стеатоз, лобулярное воспаление и баллонную дистрофию гепатоцитов (табл. 3). При сумме баллов менее 3 – НАСГ отсутствует, 3–5 баллов – пограничное значение, более 5 баллов – имеется НАСГ. Аналогичная шкала разработана и для определения стадии фиброза при НАЖБП (табл. 4).
 НЕАЛКОГОЛЬНАЯ ЖИРОВАЯ БОЛЕЗНЬ ПЕЧЕНИ – НЕЗАВИСИМЫЙ ФАКТОР РИСКА СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ
НЕАЛКОГОЛЬНАЯ ЖИРОВАЯ БОЛЕЗНЬ ПЕЧЕНИ – НЕЗАВИСИМЫЙ ФАКТОР РИСКА СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ
НАЖБП, атеросклероз и смертность
По данным V. Ratziu (2010), при НАЖБП уровень общей смертности повышается на 35–85% по сравнению с лицами идентичного возраста и пола из общей популяции, однако наиболее высокие показатели зарегистрированы для смертности от сердечно-сосудистых заболеваний (ССЗ). По данным многочисленных исследований последних лет убедительно показано, что наличие НАЖБП увеличивает риск развития ССЗ в 4,12 раза в сравнении с лицами без НАЖБП (95% доверительный интервал [ДИ] 1,58–10,75; р=0,004), у женщин этот показатель почти в 2 раза выше, чем у мужчин (в 7,32 и в 3,56 раза соответственно, р<0,027). Согласно последним данным, НАЖБП повышает риск смертности от ССЗ в 2 раза. При наблюдении за лицами с НАЖБП в течение 21 года выявлено, что основной причиной смерти у этих больных явились ССЗ. В основе тесной взаимосвязи патологии печени и сердечно-сосудистой системы – общность патогенеза. В последние 6–8 лет обозначены несколько общих генетических маркеров, полиморфизм которых обуславливает развитие НАЖБП и ССЗ (табл. 5).
 Доказана связь между повышением ИМТ и возрастанием риска сердечно-сосудистой смерти. Известно, что ИР – общий главный фактор развития НАЖБП и ССЗ, поскольку гипергликемия и выраженные нарушения жирового обмена при снижении чувствительности рецепторов к инсулину способствуют развитию хронического системного воспаления (ХСВ). ХСВ является важным патогенетическим механизмом развития неалкогольного стеатогепатита и атеросклеротического поражения сосудов с последующим развитием атеротромбоза и цепочки сердечно-сосудистых событий. Наличие ХСВ подтверждаются обнаружением у больных НАЖБП и ССЗ аналогичных сывороточных маркеров (табл. 6).
Доказана связь между повышением ИМТ и возрастанием риска сердечно-сосудистой смерти. Известно, что ИР – общий главный фактор развития НАЖБП и ССЗ, поскольку гипергликемия и выраженные нарушения жирового обмена при снижении чувствительности рецепторов к инсулину способствуют развитию хронического системного воспаления (ХСВ). ХСВ является важным патогенетическим механизмом развития неалкогольного стеатогепатита и атеросклеротического поражения сосудов с последующим развитием атеротромбоза и цепочки сердечно-сосудистых событий. Наличие ХСВ подтверждаются обнаружением у больных НАЖБП и ССЗ аналогичных сывороточных маркеров (табл. 6).
В основе патогенеза сердечно-сосудистых заболеваний при метаболическом синдроме лежит взаимное отягощение НАЖБП, абдоминального ожирения и инсулинорезистентности. Наличие НАЖБП сопровождается увеличением продукции атерогенных липопротеидов, повышением ИР и потенцировании нарушений обмена глюкозы, а также стимуляцией системного высвобождения многочисленных активных медиаторов (провоспалительных цитокинов, прокоагулирующих и профибриногенных факторов, прооксидантных молекул). Прогрессирование НАЖБП потенцирует накопление жировой ткани в других органах (почки, сердце), увеличивает содержание перикардиального жира и непосредственно способствует развитию гипертрофии миокарда, атеросклероза сосудов, аритмий, хронической болезни почек.
 Пациенты с НАЖБП имеют более высокую распространенность ИБС, степень тяжести которой по данным коронарной ангиографии коррелирует не с традиционными факторами риска, а с проявлениями НАЖБП. Так, в большом популяционном исследовании с участием 21 335 здоровых лиц (средний возраст 41 год) у 11,2% пациентов с абдоминальным ожирением методом мультиспиральной КТ были выявлены признаки субклинического атеросклероза по данным оценки кальциевого индекса (КИ; КИ >0), при этом только диагностируемая по данным УЗИ НАЖБП являлась независимым маркером этих изменений. Такие ранние маркеры субклинического атеросклероза, как расстройство эндотелий-зависимой поток-опосредованной вазодилатации и увеличение толщины интима-медиа сонной артерии, также определяются у больных НАЖБП не зависимо от ожирения и других установленных факторов риска ССЗ.
Пациенты с НАЖБП имеют более высокую распространенность ИБС, степень тяжести которой по данным коронарной ангиографии коррелирует не с традиционными факторами риска, а с проявлениями НАЖБП. Так, в большом популяционном исследовании с участием 21 335 здоровых лиц (средний возраст 41 год) у 11,2% пациентов с абдоминальным ожирением методом мультиспиральной КТ были выявлены признаки субклинического атеросклероза по данным оценки кальциевого индекса (КИ; КИ >0), при этом только диагностируемая по данным УЗИ НАЖБП являлась независимым маркером этих изменений. Такие ранние маркеры субклинического атеросклероза, как расстройство эндотелий-зависимой поток-опосредованной вазодилатации и увеличение толщины интима-медиа сонной артерии, также определяются у больных НАЖБП не зависимо от ожирения и других установленных факторов риска ССЗ.
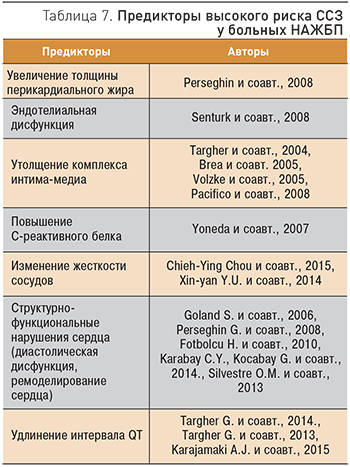
В последние годы опубликовано большое количество научных работ, свидетельствующих о том, что у больных НАЖБП наблюдается высокая частота обнаружения не только традиционных факторов риска ССЗ (ожирение, СД 2 типа, МС), но и так называемых «замещающих» маркеров (табл. 7), которые являются предикторами высокого риска развития ССЗ у больных с НАЖБП.
Предикторы риска ССЗ у больных с НАЖБП
Толщина эпикардиального жира является независимым фактором риска ССЗ, тесно коррелируя с толщиной висцерального жира, атеросклерозом сонных и коронарных артерий, а также параметрами жесткости сосудов. Толщина эпикардиального жира у пациентов с тяжелым стеатозом выше, чем у пациентов с умеренным стеатозом (9,7±0,2 против 8±0,7 мм соответственно, p<0,01). Показано, что эпикардиальный жир может служить ранним маркером ИР (при толщине 2,7 см – 4,5 мм наблюдаются повышенные значения НОМА-IR).
 Изменение толщины интимы-медиа. Мета-анализ 7 исследований, включающих около 3500 человек, показал, что диагностируемая методом УЗИ НАЖБП в высокой степени коррелирует с увеличением толщины интима-медиа сонной артерии и увеличением распространенности атеросклеротических бляшек. Согласно G. Targher (2006), изменения толщины интима-медиа сонной артерии возникают уже на ранних стадиях гистологически доказанного стеатоза печени и прогрессируют по мере утяжеления гистологических проявлений НАЖБП, независимо от классических факторов сердечно-сосудистого риска, ИР и компонентов МС.
Изменение толщины интимы-медиа. Мета-анализ 7 исследований, включающих около 3500 человек, показал, что диагностируемая методом УЗИ НАЖБП в высокой степени коррелирует с увеличением толщины интима-медиа сонной артерии и увеличением распространенности атеросклеротических бляшек. Согласно G. Targher (2006), изменения толщины интима-медиа сонной артерии возникают уже на ранних стадиях гистологически доказанного стеатоза печени и прогрессируют по мере утяжеления гистологических проявлений НАЖБП, независимо от классических факторов сердечно-сосудистого риска, ИР и компонентов МС.
Изменение жесткости сосудов. В ряде работ показана взаимосвязь между наличием НАЖБП и параметрами жесткости сосудов. Так, в отечественной работе у пациентов с НАЖБП выявлена достоверная обратная корреляция между уровнями сывороточных АЛТ и лептина и приростом (%) диаметра плечевой артерии, а также достоверная прямая корреляция прироста диаметра плечевой артерии (%) с концентрацией АпоА1 и адипонектина.
Структурно-функциональные нарушения со стороны сердца. У молодых пациентов с НАЖБП даже в отсутствие ожирения, артериальной гипертензии и СД 2 типа выявляются эхокардиографические признаки дисфункции левого желудочка (ЛЖ) в виде диастолической дисфункции, а по данным магнитно-резонансной спектроскопии с фосфором-31 определяются нарушения энергетического метаболизма миокарда. Имеется положительная корреляционная взаимосвязь между стадией диастолической дисфункции, выраженностью стеатоза и ИР. Тяжесть структурно-функциональных нарушений сердца (размер левого предсердия, конечно-диастолический объем, давление в легочной артерии) коррелируют с выраженностью поражения печени по шкале MELD.
Удлинение интервала QТ. Длительность интервала QT является предиктором сердечно-сосудистой смертности в общей популяции, поскольку удлинение QT сопровождается повышением риска развития злокачественных аритмий и риском внезапной смерти. В одном из исследований у 400 пациентов с НАЖБП и СД 2 типа наблюдалось удлинение QT, ассоциируемое с тяжестью НАЖБП (р<0,001). Корректировка по возрасту, полу, курению, употреблению алкоголя, ИМТ, наличию и выраженности артериальной гипертензии, гипертрофии ЛЖ и других переменных, связанных с СД и сопутствующими заболеваниями, не ослабляло связь между НАЖБП и удлинением QT (р<0,001). В нескольких работах показано, что НАЖБП тесно связана с увеличением числа случаев фибрилляции предсердий у больных СД 2 типа, возможно, за счет наличия активного ХСВ и вегетативной дисфункции у этих больных.
Лабораторно-инструментальные маркеры НАЖБП – маркеры высокого риска ССЗ. В ряде работ показано, что лабораторно-инструментальные маркеры НАЖБП также являются маркерами высокого риска ССЗ у этих больных. Так, установлено, что активность ГГТП, фермента, уровень которого является одним из основных маркеров повреждения печени при НАЖБП, является независимым предиктором сердечно-сосудистых осложнений. Ультразвуковые признаки стеатоза печени и Fatty Liver Index (FLI; индекс стеатоза печени) в общей популяции ассоциированы с высокой кардиоваскулярной смертностью и увеличением риска формирования неалкогольного стеатогепатита и фиброза печени. FLI признан суррогатным маркером НАЖБП и предиктором ССЗ, поскольку ассоциирован с ИР, толщиной комплекса интима-медиа и повышенным риском развития ИБС. Высокое значение FLI ассоциируется с высоким риском смертности как от сердечно-сосудистых причин, так и от патологии печени. У больных с МС выявлены корреляции между значением FLI и толщиной эпикардиального жира (r=0,52; p=0,0001), а также показателями ремоделирования миокарда (толщиной задней стенки ЛЖ (r=0,34; p=0,004), толщиной межжелудочковой перегородки (r=0,28; p=0,017), массой миокарда ЛЖ (r=0,48; p=0,0001).
СКРИНИНГ НА НАЛИЧИЕ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ
Скрининг на наличие НАЖБП целесообразен среди взрослых пациентов с СД, избыточной массой тела или ожирением (ИМТ ≥25 кг/м2), МС в связи с высоким риском возникновения у них заболеваний печени и сердечно-сосудистой системы (сила – 1, уровень – В).
План обследования пациентов с метаболическими нарушениями, обращающихся к врачу по поводу ИБС, СД 2 типа, артериальной гипертензии, гипотиреоза, холелитиаза и т.д.
- Сбор анамнеза (наследственность, образ жизни, пищевые привычки, физические нагрузки).
- Антропометрические измерения (ИМТ, объем талии [ОТ] и бедер [ОБ], индекс ОТ/ОБ).
- Объективный осмотр (выявление малых печеночных знаков: телеангиоэктазий, пальмарной эритемы, оценка размеров и консистенции печени, размеров селезенки).
- Мониторинг артериального давления, электрокардиографическое исследование.
- Оценка липидограммы: ТГ, общего ХС, ХС ЛПВП и ЛПНП, апо-В ЛП.
- Определение уровня глюкозы натощак, глюкозотолерантный тест по показаниям.
- Инсулин крови натощак.
- Оценка наличия и выраженности ИР – определение индекса HOMA-IR (HOmeostasis Model Assesment) по формуле: HOMA-IR = I0 × G0/22,5, где I0 – уровень инсулина натощак (мкМЕ/ мл), G0 – уровень глюкозы натощак (ммоль/л) (значение HOMA-IR у здоровых лиц менее 2,7, при нарушении толерантности к глюкозе, СД 2 типа – более 4, значимую диагностическую ценность при НАЖБП имеет увеличение индекса HOMA-IR более 5).
- Клинический анализ крови (наличие тромбоцитопении, анемии).
- Оценка биохимических показателей, отражающих функциональное состояние печени (АЛТ, АСТ, ГГТП, ЩФ, общий билирубин, протромбин, протеинограмма, коагулограмма).
- УЗИ органов брюшной полости (размеры печени и селезенки, наличие и выраженность портальной гипертензии).
- Эзофагогастродуоденоскопия – скрининг на наличие варикозно расширенных вен пищевода.
- КТ (МРТ) печени.
- Пункционная биопсия печени по показаниям.
ЛЕЧЕНИЕ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ
Основной целью терапии является профилактика прогрессирования болезни: уменьшение выраженности стеатоза, предотвращение прогрессирования заболевания в стеатогепатит, фиброз и ЦП, снижение риска сердечно-сосудистых осложнений. В ряде исследований показано, что комплексные меры по изменению образа жизни пациентов с НАЖБП способствуют снижению смертности от сердечно-сосудистых осложнений на 40%, что сопоставимо с эффективностью медикаментозной коррекции.
Основные принципы лечения НАЖБП:
- снижение массы тела (диета и физические нагрузки);
- обязательная отмена потенциально гепатотоксичных препаратов;
- коррекция метаболических нарушений:
- повышение чувствительности клеточных рецепторов к инсулину (метформин, тиазолидиндионы);
- коррекция нарушений липидного обмена.
- лечение окислительного стресса.
Не существует унифицированного немедикаментозного подхода в лечении пациентов с НАЖБП, целесообразным является приспособление диеты, снижение веса и увеличение физической нагрузки к индивидуальным потребностям пациента. Постепенное снижение веса и увеличение физической нагрузки являются ведущими факторами в лечении НАЖБП (сила – 1, уровень – А), потеря веса при использовании гипокалорийной диеты или ее сочетание с повышенной физической активностью способствует уменьшению проявлений стеатоза (сила – 1, уровень – А). Установлено, что для уменьшения выраженности стеатоза при НАЖБП требуется снижение веса тела не менее чем на 3–5%, а для устранения некротических и воспалительных изменений в печени при стеатогепатите необходимо снижение веса не менее чем на 10% (сила – 1, уровень – В). У взрослых пациентов физическая нагрузка уменьшает выраженность стеатоза даже при отсутствии дополнительных медикаментозных воздействий, однако ее влияние на нормализацию других гистологических изменений в печени остается неизвестной (сила – 1, уровень – В). Пациентам с НАЖБП противопоказано злоупотребление алкоголем (сила – 1, уровень – В).
Фармакологическая коррекция ИР
В клинических исследованиях по изучению эффективности метформина показано снижение ИР, уменьшение активности трансаминаз и выраженное снижение веса (более 10 кг) у 19% больных НАЖБП. Однако улучшение гистологической картины печени было незначительным: уменьшения выраженности стеатоза удается достигнуть только у 30% пациентов. Данные мета-анализа показали, что применение метформина в течение 6–12 мес на фоне изменения образа жизни не снижало выраженности цитолиза и улучшало гистологическую картину печени только при сравнении с изменением образа жизни. В связи с полученными данными метформин не рекомендуется в качестве специфического средства для лечения НАЖБП с синдромом ИР, поскольку не оказывает существенного влияния на гистологическую структуру печени (сила – 1, уровень – В). Метформин в дозе 20 мг/кг/сут (дозу наращивать постепенно, начиная с 500–850 мг/сут) курсами не менее года назначается пациентам с НАЖБП для лечения сопутствующего нарушения толерантности к углеводам и профилактики развития СД 2 типа.
Пиоглитазон может быть использован для лечения морфологически подтвержденного НАСГ, однако его безопасность и эффективность при длительной терапии не доказана (сила – 1, уровень – В).
Фармакологическая коррекция гиперлипидемии
Гиполипидемическую терапию следует проводить с учетом стадии НАЖБП, при необходимости – в комбинации с гепатопротекторами. Наиболее распространенными и изученными гиполипидемическими препаратами являются ингибиторы ГМК-КОА редуктазы – статины. У больных НАЖБП при отсутствии данных о повышенном гепатотоксическом риске под воздействием статинов они могут быть использованы для коррекции дислипидемии (сила – 1, уровень – В). Однако для специфического лечения НАСГ статины не рекомендуется применять до морфологического подтверждения их эффективности в РКИ (сила – 1, уровень – В). В исследованиях показано, что прием статинов в комбинации с препаратами урсодезоксихолевой кислоты (УДХК) в дозе 10–15 мг/кг/сут сопровождается более выраженным снижением уровня ХС ЛПНП. Такая комбинация предупреждает развитие цитолиза и способствует снижению исходно повышенных трансаминаз. На фоне лечения статинами рекомендуется активный лабораторный мониторинг каждые 3–4 нед:
- определение сывороточных печеночных тестов (билирубин, трансаминазы, ГГТП, ЩФ);
- определение показателей углеводного и липидного обменов (глюкоза, ТГ, общий ХС, ХС ЛПНП, ХС ЛПВП, инсулин).
В качестве средства первой линии у пациентов НАЖБП с триглицеридемией рекомендованы омега-3 жирные кислоты (сила – 1, уровень – В).
Кроме статинов, при нарушении липидного обмена у больных НАЖБП можно применять: производные фиброевой кислоты (фибраты), никотиновую кислоту (ниацин), секвестранты желчных кислот (ионно-обменные смолы). Однако в настоящее время отсутствуют РКИ по их использованию у больных НАЖБП.
Лечение окислительного стресса
В лечении НАЖБП патогенетически оправдано назначение лекарственных средств метаболического действия с антиоксидантной активностью.
Витамин Е в суточной дозе 800 МЕ у пациентов с НАЖБП, не страдающих СД, улучшает гистологическую картину печени. Препарат является средством терапии первой линии в качестве антиоксиданта у больных НАЖБП (сила – 1, уровень – В). Однако до получения убедительных данных об эффективности и безопасности витамина Е его не следует назначать пациентам с НАЖБП, не подтвержденной гистологическим исследованием, сочетающейся с СД, а также при ЦП в исходе НАЖБП (сила – 1, уровень – С).
УДХК как препарат, обладающий антиоксидантным, мембраностабилизирующим и иммуномодулирующим действиями, может быть использована для лечения НАЖБП с признаками стеатоза и стеатогепатита (сила – 1, уровень – В). УДХК назначается в дозе 10–15 мг/кг/сут в 2 приема не менее года, иногда до 2-х лет и более. Имеются данные о снижении цитолитического синдрома и уменьшении выраженности стеатоза печени при лечении больных НАЖБП УДХК.
Эссенциальные фосфолипиды. Эффективность эссенциальных фосфолипидов в терапии заболеваний печени реализуется за счет способности 3-sn-фосфатидилхолина (основное действующее вещество) включаться в поврежденные участки мембран гепатоцитов. Эссенциальные фосфолипиды также способны конкурентно замещать эндогенные фосфолипиды с меньшим количеством полиненасыщенных жирных кислот, что увеличивает пластичность мембран и улучшает их функционирование. Прием эссенциальных фосфолипидов 1800 мг/сут (2 капсулы 3 раза/ сут во время еды, курсами по 3 мес 2–3 раза в год) стабилизирует мембраны и улучшает антитоксическую функцию печени. Кроме этого, снижает внутрипеченочный синтез ХС и усиливает его элиминацию, снижает уровень ТГ и ЛПНП в сыворотке крови, активирует синтез белка. Прием эссенциальных фосфолипидов в 3-х репрезентативных группах пациентов с НАЖБП (первичная НАЖБП, НАЖБП и СД 2 типа на фоне базовой терапии метформином и пиоглитазоном, НАЖБП и смешанная гиперлипидемия, получающих аторвастатин и эзетимиб) сопровождается снижением активности трансаминаз, улучшением эхоструктуры печени (по данным УЗИ) и снижением индекса фиброза (по данным эластографии) вне зависимости от степени НАЖБП и наличия фонового заболевания (p≤0,001). Все пациенты получали эссенциальные фосфолипиды 1800 мг/сут в течение 24 нед, затем 900 мг в течение следующих 24 нед, стандартизированную диету и дозированные физические нагрузки. Рецидив через 6 мес после завершения лечения наблюдали у 35,9% больных первичной НАЖБП и у 27,1% – с НАЖБП и СД 2 типа или смешанной гиперлипидемией.
Комбинация эссенциальных фосфолипидов с метионином (исследование GOLD) оказывает гепатопротекторное действие, восстанавливает целостность мембран пораженных клеток печени, активирует расположенные в мембране фосфолипидзависимые ферменты, нормализует проницаемость мембран, повышает дезинтоксикационный и экскреторный потенциалы гепатоцитов. Клинически это выражается в статистически значимых снижениях уровней АЛТ, АСТ, ГГТ, ЩФ, общего и прямого билирубина, общего ХС, ТГ, ЛПНП.
Комбинация эссенциальных фосфолипидов с глицирризиновой кислотой (двойное слепое рандомизированное плацебо-контролируемое многоцентровое пострегистрационное клиническое исследование [«ГЕПАРД» PHG-M2/P02-12]) у больных с НАЖБП достоверно снижает уровень АЛТ (62,5 ед/л в сравнении с 78,3 ед/л в группе плацебо) на 2-й нед лечения. Индекс фиброза (NAFLD fibrosis score) снижается у 43% (27% в группе плацебо).
Полипренолы (продукты переработки древесной зелени ели европейской) воздействуют на основные звенья патогенеза НАЖБП: в дозе 54 мг/ сут оказывают антиоксидантное (повышают активность ферментов антиоксидантной защиты, поглощают образующиеся на мембране перекисные липиды, способствуют восстановлению мембран гепатоцитов, повышают уровни детоксицирующих цитохромов), иммуномодулирующее и гиполипидемическое действие (снижают уровень ХС, ТГ и ЛПНП, уменьшают признаки жировой инфильтрации печени), нормализуют белковосинтетическую функцию печени, снижают уровни цитолиза и фиброза (сила – 1, уровень – Б).
Одним из лекарственных средств для лечения НАЖБП является L-орнитин-L-аспартат, гепатопротективное действие которого обусловлено способностью улучшать энергетические процессы (за счет участия в орнитиновом цикле), активировать синтез белка и антиоксидантным эффектом. Важным действием препарата также является усиление β-окисления жирных кислот в митохондриях, снижение которого является одним из ведущих патогенетических факторов формирования избытка СЖК и отложения их в печени при НАЖБП. В научной работе из Великобритании (2016) впервые показано, что снижение сывороточного аммиака является важным патогенетическим звеном терапии ХЗП, поскольку гипераммониемия вызывает значительные, но обратимые изменения пролиферации и метаболической активности клеток печени, активирует звездчатые клетки и опосредованно может способствовать повышению портального давления за счет развития нитрозативного стресса. Высокая эффективность и хорошая переносимость L-орнитин-L-аспартата показана в мультицентровом нерандомизированном проспективном когортном исследовании с участием 1167 пациентов с ХЗП (из них — 648 больных НАСГ). В другом многоцентровом нерандомизированном клиническом исследовании с участием 289 пациентов с НАСГ прием препарата на протяжении 3-х мес сопровождался значимым улучшением клинико-биохимических показателей и качества жизни. L-орнитин-L-аспартат улучшает показатели внутрипеченочного кровотока у больных НАЖБП с нарушениями портопеченочного кровотока и способствует регенерации и восстановлению функции поврежденных гепатоцитов, препятствуя прогрессированию фиброза печени. С учетом полученных в исследованиях данных о механизмах действия L-орнитин-L-аспартата в обновленной в 2015 г. МЗ РФ инструкции зарегистрированы новые показания к применению — стеатозы и стеатогепатиты различного генеза.
Гидролизат человеческой плаценты для парентерального введения имеет выраженные иммуномодулирующие и гепатопротекторные свойства. Биологически активные вещества гидролизата (факторы роста гепатоцитов, инсулиноподобный и др. факторы роста, противовоспалительные интерлейкины) стимулируют регенерацию гепатоцитов, проявляют дезинтоксикационные свойства, активируют обмен веществ в печени, снижают отложение холестерина и липидов в печеночных клетках, повышают активность тканевого дыхания, снижают интенсивность развития соединительной ткани в печени. Применяется внутримышечно или внутривенно в виде монотерапии при неалкогольной или алкогольной болезни печени или их сочетаниях для устранения синдрома цитолиза, для предотвращения, замедления или устранения фибротического или цирротического процессов, предотвращения осложнений противовирусной терапии острых или хронических гепатитов, для лечения гиперферритинемии при ЦП и гемохроматозе.
Силимарин (140 мг 3 раза/сут курсами до 6 мес) предотвращает активацию звездчатых и купферовских клеток (путем снижения содержания реактивных форм кислорода [ROS] и синтеза лейкотриенов B4 и PDE4).
Метадоксин (500 мг 3 раза/сут), являясь мощным антиоксидантом, усиливает антитоксическую функцию печени, способствует уменьшению жировых отложений в печени, снижает коллагенообразование.
Адеметионин (400 мг 3 раза/сут) у больных с НАЖБП снижает активность ферментов цитолиза и способствует регрессии клинических симптомов.
Восстановление нарушений микробиоценоза кишечника у больных НАЖБП
Нарушение микробиоценоза кишечника у больных НАСГ является показанием для проведения его санации антибактериальными препаратами (рифаксимин 400 мг 2 раза/сут после еды, метронидазол 250 мг 3 раза/сут, ципрофлоксацин 250 мг 2 раза/сут 5–7 дней) с последующим назначением пробиотиков, пребиотиков, симбиотиков, синбиотиков на 3–4 нед (сила – 1, уровень – С).
Бариатрическая хирургия верхних отделов пищеварительного тракта
В качестве специфических методов лечения больным НАЖБП бариатрические хирургические вмешательства на верхних отделах пищеварительного тракта считаются преждевременными (сила – 1, уровень – В) даже для тучных пациентов с НАЖБП без верифицированного ЦП (сила – 1, уровень – А). У больных НАСГ с исходом в ЦП и избыточным весом пока не определены вид, безопасность и эффективность методов бариатрической хирургии верхних отделов пищеварительного тракта (сила – 1, уровень – В). Вместе с тем бариатрические вмешательства могут иметь ряд серьезных последствий, существенно ограничивающих их применение, в связи с чем они должны проводиться только по жестким показаниям.
ДИНАМИЧЕСКОЕ НАБЛЮДЕНИЕ ЗА БОЛЬНЫМИ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНЬЮ ПЕЧЕНИ
Динамическое наблюдение за больными НАЖБП осуществляет терапевт (врач общей практики) совместно с кардиологом и эндокринологом.
Каждые 6 мес рекомендуется:
- определение антропометрических данных (масса тела, ИМТ, ОТ);
- определение: сывороточных печеночных тестов (трансаминазы, гамма-глутамилтранспептидаза, ЩФ);
- определение показателей углеводного и липидного обменов (глюкоза, ТГ, общий ХС, ХС ЛПНП, ХС ЛПВП, инсулин);
- определение степени фиброза печени с помощью неинвазивных методов диагностики (фиброэластометрия, сывороточные тесты);
- ЭКГ, мониторинг артериального давления (в группах высокого риска ССЗ).
Каждые 12 мес рекомендуется:
- проведение УЗИ органов брюшной полости;
- проведение ЭхоКГ (в группах высокого риска ССЗ).
Оценка прогрессирования НАЖБП
Предикторами высокого риска прогрессирования НАЖБП с развитием гепатита и фиброза являются: возраст старше 45 лет, женский пол, ИМТ более 28 кг/м2, постоянное увеличение уровня АЛТ более 2 норм, уровень ТГ более 1,7 ммоль/л, артериальная гипертензия, СД 2 типа, индекс ИР (НОМА-IR) более 5. Наличие 2 критериев и более свидетельствует о высоком риске фиброза печени.
Оценка наличия и выраженности предикторов высокого риска развития ССЗ (в группах высокого риска)
- Степень выраженности стеатоза по УЗИ.
- Определение уровней АЛТ, ГГТП, СРБ, адипонектинов, ФНО-α, ИЛ-1в, ИЛ-6.
- Индекс стеатоза печени FLI = (е0,953 × loge (ТГ) + 0,139 × (ИМТ) + 0,718 × loge (ГГТП) + 0,053 × (ОТ) – 15,745) / (1 + е0,953×loge (ТГ) + 0,139 × (ИМТ) + 0,718 × loge (ГГТП) + 0,053 × (ОТ) – 15,745) ×100, где ОТ – окружность талии (при значении 30–60 риск высокий!) (G. Bedogni, S. Belle-ntai, L. Miglioli и соавт. The fatty liver index: a simple and accurate predictor of hepatic steatosis. BMC Gastroenterol. 2006;6:33).
- Оценка комплекса QT.
- Толщина комплекса интима-медиа.
- Толщина эпикардиального жира.
- Показатели ремоделирования миокарда (толщина задней стенки ЛЖ, межжелудочковой перегородки, масса миокарда ЛЖ).
НЕАЛКОГОЛЬНАЯ ЖИРОВАЯ БОЛЕЗНЬ ПЕЧЕНИ У ПАЦИЕНТОВ ПОЖИЛОГО И СТАРЧЕСКОГО ВОЗРАСТА
У лиц пожилого и старческого возраста жировая инфильтрация печени встречается в 25,2–86,3% случаев. Частота и выраженность стеатоза нарастает с возрастом и достигает пика в 40–60 лет. НАЖБП у пациентов пожилого и старческого возраста следует рассматривать как печеночное проявление МС (сила – 1, уровень – В).
Особенности диагностики НАЖБП у пациентов пожилого и старческого возраста
Пациенты гериатрического возраста с ИБС атеросклеротического генеза нуждаются в проведении дополнительного исследования на выявление жирового перерождения печени (сила – 1, уровень – В). Жировая инфильтрация печени у пожилых и старых мужчин сопровождается повышением в сыворотке крови уровня мочевой кислоты, снижением ЛПНП при нормальной активности трансаминаз. У пожилых и старых пациентов с НАЖБП активность аминотрансфераз не является абсолютным критерием диагностики заболевания, поскольку известно, что с увеличением возраста активность АЛТ и АСТ уменьшается (сила – 1, уровень – В). Биопсия печени для пожилых и, особенно, старых пациентов не имеет строго регламентированных показаний и противопоказаний, однако ее проведение ограничено (сила – 1, уровень – В).
Лечение НАЖБП у пациентов пожилого и старческого возраста
Гериатрическому больному НАЖБП показаны ежедневные 30–50-минутные физические упражнения с преимущественно аэробной нагрузкой (сила – 1, уровень – В). Снижение массы тела необходимо проводить в течение нескольких месяцев при соблюдении принципов геродиететики (сила – 1, уровень – В), рекомендуемый безопасный темп снижения массы тела должен соответствовать 2,0–3,0 кг/мес. Коррекция декомпенсированного СД 2 типа у пожилых и старых пациентов с НАЖБП требует назначения инсулинотерапии, несмотря на то, что терапия может интенсифицировать жировое перерождение печени (сила – 1, уровень – С).
Жировое перерождение печени у беременных женщин и у детей
Процесс жирового перерождения печени может также наблюдаться как у беременных женщин, так и у детей разного возраста. У беременных наиболее частыми проявлениями жировой инфильтрации печени являются стеатоз и острая жировая дистрофия печени (синдром Шихана), что зачастую связано с МС, проявляющимся ожирением, СД и артериальной гипертензией. У детей и подростков НАЖБП необходимо рассматривать в контексте заболевания взрослых. Чаще НАЖБП встречается у мальчиков подросткового возраста, что объясняется развитием умеренной физиологической резистентности к инсулину в период полового созревания. Выявление детей с повышенным риском развития НАЖБП должно производиться педиатрами, специалистами гастроэнтерологических, гепатологических, эндокринных, хирургических стационаров и клиник лечебного питания. Особенности этиопатогенеза, диагностики, клинического течения и профилактики НАЖБП у беременных, детей и подростков требуют дальнейшего изучения и рассмотрения специалистами в рамках соответствующих специальностей.



