Комплексный регионарный болевой синдром (КРБС) является одним из наименее изученных, трудно диагностируемых и наиболее клинически тяжелых вариантов нейропатической боли (НПБ).
Термин КРБС был предложен в 1994 г. для обозначения локальных болевых синдромов (БС), сочетающихся с вегетативными и трофическими нарушениями.
Ведущими проявлениями данного синдрома являются три группы симптомов:
- жгучие, интенсивные, стойкие боли с гиперестезией, гиперпатией, аллодинией;
- вегетативные симпатические вазомоторные (отек, цианоз и др.) и судомоторные (гипогидроз, гипергидроз) нарушения;
- дистрофические изменения кожи, подкожной жировой клетчатки, мышц, связок, костей (остеопороз) [1, 20].
Выделяют три типа КРБС. При периферических повреждениях, не сопровождающихся поражением периферических нервов, формируется КРБС I типа. О КРБС II типа говорят при развитии синдрома только после поражения периферического нерва (верифицированного по данным электронейромиографии). Именно II тип КРБС рассматривается как вариант НПБ. К КРБС III типа относят все случаи, не соответствующие клиническим диагностическим критериям I и II типа [8, 20].
Современные диагностические клинические критерии диагностики КРБС включают наличие 3 из 4 следующих категорий [9]:
- Длительная боль, несоразмерная полученному повреждению.
- Наличие хотя бы одного из четырех симптомов:
- сенсорные: гипералгезия и/или аллодиния;
- вазомоторные: температурная ассимметрия и/ или изменение окраски кожных покровов и/ или ее асимметрия;
- судомоторные: отек и/или изменения потоотделения и/или ассимметрия потоотделения;
- моторные/трофические: уменьшение объема движений и/или развитие двигательной дисфункции (слабость, тремор, дистония) и/или трофические изменения (волос, ногтей, кожи).
- Доказательства наличия в момент осмотра, по крайней мере, одного признака из следующих:
- сенсорные: признаки гипералгезии (булавочные пробы) и/или аллодинии (при легком прикосновении и/или глубоком нажатии и/или движении сустава);
- вазомоторные: признаки температурной ассимметрии и/или изменения окраски кожных покровов и/или ее асимметрии;
- судомоторные: признаки отека и/или изменения потоотделения и/или ассимметрии потоотделения;
- моторные/трофические: признаки уменьшения объема движений и/или двигательной дисфункции (слабость, тремор, дистония) и/или трофических изменений (волос, ногтей, кожи).
- Нет другого диагноза, объясняющего вышеуказанные признаки и симптомы.
В литературе встречаются лишь единичные работы по эпидемиологии этого заболевания. Согласно данным популяционного исследования, проведенного американской Клиникой Мейо [15], распространенность КРБС I типа составила за 10-летний период 20 человек на 100 000 населения, а заболеваемость – 5.46 на 100 000. Среди 74 больных КРБС I типа, выявленных в этом исследовании, преобладали женщины (4:1), а возрастной диапазон колебался от 4 до 80 лет. В большинстве случаев боль локализовалась на нижних и верхних конечностях (58 и 42% соответственно), а вовлечение нескольких зон наблюдалось в 69%. У 74% пациентов на фоне лечения было отмечено значительное улучшение или полное исчезновение симптомов. В этом же исследовании было выявлено 11 пациентов с КРБС II типа, что составило 0,82 на 100 000 населения за 10-летний период исследования.
Согласно данным ретроспективного когортного исследования, проведенного в Нидерландах в период с 1996 по 2005 гг., общий показатель заболеваемости КРБС составил 26,2 на 100 000 человеко-лет (95% доверительный интервал 23,0–29,7). Женщины страдали как минимум в 3 раза чаще, чем мужчины. Наибольшая заболеваемость наблюдалась у женщин в возрастной категории 61–70 лет. Верхняя конечность была затронута чаще, чем нижняя конечность, а перелом встречался наиболее часто (44%) [7].
СОБСТВЕННОЕ КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ КРБС
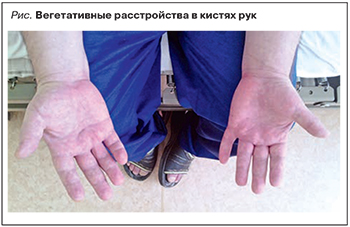 Пациент М. 1964 г.р., обратился с жалобами на спонтанные, ноющие боли в кистях рук, больше в правой, усиливающиеся вечером (не может заснуть); слабость в руках; повышенную чувствительность в руках, начиная с середины плеча; отечность кистей рук, больше правой (см. рис.).
Пациент М. 1964 г.р., обратился с жалобами на спонтанные, ноющие боли в кистях рук, больше в правой, усиливающиеся вечером (не может заснуть); слабость в руках; повышенную чувствительность в руках, начиная с середины плеча; отечность кистей рук, больше правой (см. рис.).
Анамнез заболевания
Со слов больного, вечером 16 февраля 2015 г., после приема около 1 литра алкогольных напитков, уснул в неудобном положении (на руках), проспал 3 часа и после пробуждения отметил онемение, выраженную слабость в руках (не мог поесть, не мог держать ложку в руке, но боли не было), после чего лег спать. Через несколько дней присоединилась жгучая, «горящая» боль в руках от локтей до кончиков пальцев («больно было подуть на них»), особенно сильные боли в кистях, внезапные, стреляющие боли в ладонях с акцентом в правой руке; а также отечность кистей, тугоподвижность в них («трудно сгибать и разгибать пальцы»). Не мог себя обслуживать, пальцы не двигались из-за отека и боли. В последующие дни данные симптомы наросли. Все они «ухудшались» к вечеру. Боль в руках мешала спать (7–8 баллов по ВАШ). Лечился амбулаторно: капельницы с анальгетиками, нестероидные противовоспалительные средства, миорелаксанты с минимальным положительным эффектом. Рекомендовано стационарное лечение.
В неврологическом статусе на момент первичного осмотра в неврологическом отделении 20.03.2015:
- черепно-мозговые нервы без особенностей;
- снижение мышечной силы в руках дистально до 3 баллов;
- снижены карпорадиальные рефлексы;
- гиперальгезия и аллодиния в кистях рук и на наружной поверхности предплечья, больше справа;
- вегетативные расстройства в кистях рук: отечность, цианоз, шелушение;
- поверхностная и глубокая чувствительности сохранны.
Инструментальные методы исследования
Электронейромиография (ЭНМГ). Отсутствие сенсорных ответов и снижение амплитуды М-ответа при исследовании нервов верхних конечностей, что соответствует выраженному сенсо-моторному (преимущественно сенсорному) аксональному поражению нервов верхних конечностей (проверялись сенсорная и моторная порции срединных нервов, локтевых нервов с двух сторон); отсутствие патологических изменений при исследовании нервов нижних конечностей. Нейрофизиологических данных за полиневропатию нет.
Ультразвуковая допплерография сосудов верхних конечностей: гемодинамика не нарушена.
Рентгенография кистей рук. Умеренно выраженный локальный остеопороз в области пястно-фаланговых и межфалановых суставов. Субхондральный остеосклероз суставных поверхностей пястно-фаланговых и межфалановых суставов. Мелкие краевые остеофиты в области межфалановых суставов.
Вегетотестер. Вариабельность базального ритма умеренно снижена, умеренное учащение сердечного ритма. При пробе с глубоким дыханием наблюдается умеренное снижение вариабельности ритма. При пробе Вальсальвы отмечается сниженная реактивность как симпатического, так и парасимпатического звена вегетативной нервной системы. В ортопробе отмечается сниженная активность парасимпатического отдела вегетативной нервной системы и умеренная гиперактиность симпатического отдела. Признаки умеренной вегетативной дизрегуляции с недостаточной активностью парасимпатики и умеренной гиперактивностью симпатического звена на нагрузки. Данных за периферическую вегетативную недостаточность нет.
Общие анализы крови и мочи, биохимические анализы, гликимический профиль – без особенностей.
Опросник DN 4 – 6 баллов (испытываемая боль соответствует болезненному ощущению холода, ощущению как от удара током; боль сопровождается покалыванием, онемением, зудом; боль можно вызвать или усилить проведя в этой области кисточкой).
Таким образом, у больного можно выделить следующие неврологические синдромы:
- БС нейропатического характера: гипералгезия, гиперпатия и аллодиния в дистальных отделах рук.
- Синдром вегетативных расстройств: в кистях рук отечность, больше справа, цианоз, шелушение.
- Синдром двигательных нарушений: снижение мышечной силы в руках до 3 баллов.
- Синдром параклинических изменений: по данным ЭНМГ выраженная аксональная дисфункция сенсорных и моторных волокон нервов верхних конечностей; по данным рентгенографии умеренно выраженный локальный остеопороз в области пястно-фаланговых и межфалановых суставов.
На основании данных синдромов, согласно современным критериям диагностики КРБС, пациенту выставлен диагноз: комплексный регионарный болевой синдром II типа.
Пациенту проводилась комплексная терапия, направленная на уменьшение БС (габапентин) и костной резорбции (бисфосфонаты), улучшение микроциркуляции (троксевазин) в сочетании с физиотерапией, рефлексотерапией и лечебной физкультурой.
Через 3 нед комплексной терапии интенсивности БС уменьшилась до 4 баллов по DN 4, наросла сила в кистях рук до 4 баллов, немного уменьшились вегетативные нарушения – отек и шелушение.
Остановимся подробнее на механизмах развития КРБС и возможностях терапии данного синдрома.
Теории патогенеза
Патогенез КРБС изучен недостаточно. В происхождении КРБС II типа обсуждается возможность посттравматической аберрантной регенерации между афферентными (сенсорными) и эфферентными (вегетативными) волокнами. Постулируется также, что длительная боль может оставлять следы памяти, делая человека более чувствительным к повторной боли. Существует точка зрения, что участки повреждения нерва становятся эктопическими пейсмейкерами с резко увеличенным числом α-адренорецепторов, которые возбуждаются спонтанно и при действии циркулирующего или освобождающегося из симпатических окончаний норадреналина. Согласно другой концепции, при КРБС особое значение имеет активация спинальных так называемых нейронов широкого диапазона, участвующих в передаче ноцицептивной информации. Полагают, что после травмы происходит интенсивное возбуждение этих нейронов, приводящее к их сенситизации. В дальнейшем даже слабые афферентные стимулы, действуя на эти нейроны, вызывают мощный ноцицептивный поток и боль.
Вследствие расстройств микроциркуляции, приводящих к развитию гипоксии, ацидозу и накоплению в крови кислых продуктов метаболизма, происходит усиленный распад фосфорно-кальциевых соединений кости и развивается остеопороз [2].
Лечение
В 2001 г. на конференции в Миннеаполисе (США) утверждены алгоритмы терапии КРБС, базирующиеся на реабилитационных мероприятиях, купировании БС и психотерапевтической поддержке, которые должны быть использованы одновременно [3, 8].
Одним из самых существенных и трудных аспектов терапии КРБС является купирование БС. Если удается редуцировать боль, то, как правило, наблюдается регресс вегетативных и трофических нарушений.
Тем не менее научных данных, подтверждающих эффективность фармакотерапии КРБС, немного. С точки зрения доказательной медицины для лечения КРБС эффективны противосудорожные средства, кортикостероиды, бисфосфонаты и кетамин. Неоднозначными являются рекомендации по использованию опиоидов, кальцитонина и антидепрессантов, а также симпатических блокад [3].
Противосудорожные средства
Противосудорожные средства традиционно используются в терапии невропатической боли [18].
В последние годы на первый план в лечении НПБ вышли антиконвульсанты нового поколения– габапентиноиды (габапентин и прегабалин) [2, 14].
Габапентин является жирорастворимой аминокислотой, по химическому строению схожей с тормозным медиатором ГАМК – нейротрансмиттером, участвующим в передаче и модуляции боли. Габапентин обладает рядом биохимических свойств, позволяющих воздействовать на патогенез НПБ:
- взаимодействие с α2-, δ2-субъединицами потенциал-зависимых Са2+-каналов и торможение входа ионов Са2+ в нейроны – таким образом снижается гипервозбудимость клеточных мембран, уменьшается сенситизация ноцицептивных нейронов;
- увеличивается синтез γ-аминомасляной кислоты (тормозного нейромедиатора), что стимулирует активность глутаматдекарбоксилазы – это приводит к повышению активности антиноцицептивной системы;
- ингибирование синтеза глутамата (возбуждающего нейромедиатора, обладающего к тому же эксайтотоксичностью) ведет к снижению возбудимости структур ноцицептивной системы и предотвращению гибели нейронов;
- модуляция активности NMDA-рецепторов воздействует на процессы формирования «болевой памяти».
Габапентин является одним из наиболее эффективных и наиболее часто назначаемых препаратов для лечения КРБС [10-12, 22]. В работе Serpell M.G. [17] показано, что габапентин обеспечивает значительный или умеренный эффект через 8 нед после начала лечения. Габапентин назначают по 300 мг на ночь с увеличением на 300 мг в неделю. При необходимости дозу увеличивают до 1200–3600 мг.
В двойном слепом плацебо-контролируемом исследовании, включавшем на 58 пациентов с КРБС, с двумя трехнедельными периодами лечения с габапентином и плацебо, разделенными двухнедельным периодом отмывания, van de Vusse A.C. и соавт. показали значительное облегчении боли в пользу габапентина в первом периоде [21].
Побочных эффектов у габапентина немного, и, как было показано в исследовании с участием 2216 пациентов, к основным относятся сонливость (15,2 %), головокружение (10,9 %) и атаксия (6,0 %). Однако тяжесть побочных эффектов была незначительной, а их длительность не превышала 2 нед даже при продолжении приема препарата [10]. Габапентин не метаболизируется в печени и выводится в виде целой молекулы через почки, поэтому он не взаимодействует с другими препаратами, но должен с осторожностью использоваться больными с нарушением функции почек.
Прегабалин по структуре подобен габапентину, но имеет бόльшую анальгетическую силу и лучший фармакокинетический профиль. В отличие от габапентина, прегабалин имеет линейную фармакокинетику, что обеспечивает предсказуемость изменений концентрации препарата в плазме крови при увеличении или уменьшении дозы. Прегабалин быстрее всасывается в кровь и обладает более высокой биодоступностью (90%) по сравнению с габапентином (33–66%). Вследствие этого препарат эффективен в меньших дозах, а вероятность развития побочных эффектов ниже. В результате метаанализа всех рандомизированных клинических исследований обоих препаратов было продемонстрировано, что максимальная доза габапентина – 3600 мг – по эффективности равна среднетерапевтической дозе прегабалина – 450 мг. Время достижения стабильной концентрации у прегабалина короче, т.е. требуется меньший период титрования и быстрее достигается терапевтическая концентрация и соответственно клинический эффект [2]. Однако встречаются лишь единичные публикации, касающиеся применения прегабалина при КРБС [16].
Прегабалин назначается внутрь по 150 мг/сут. В зависимости от достигнутого эффекта и переносимости через 3–7 дней дозу можно увеличить до 300 мг/сут, а при необходимости еще через 7 дней – до максимальной дозы 600 мг/сут. Длительность курса прегабалина – 8–13 нед.
Кортикостероиды
Хорошие результаты лечения КРБС были получены при использовании кортикостероидов в больших дозах. Пульс-терапия стероидами (60– 100 мг/ сут в течение 2 нед) показала эффективность при лечении КРБС на ранних сроках. При остром КРБС преднизолон по 10 мг 3 раза в день внутрь значительно улучшал клиническое состояние у 75% пациентов. При снижении их дозы интенсивность боли возвращалась ни исходный уровень. Клинический опыт показал, что применение кортикостероидов у пациентов с КРБС длительностью ≥6 месяцев малоэффективно [8, 11].
Бисфосфонаты
С учетом усиленной при КРБС костной резорбции были проведены рандомизированные исследования с использованием бисфосфонатов, в которых были получены положительные результаты. Бисфосфонаты эффективны как при ранних, так и при поздних стадиях КРБС. На фоне применения препаратов этой группы отмечено ослабление воспаления, уменьшение интенсивности боли, степени отека и увеличение двигательной активности. В комплексе лечения КРБС используют алендронат внутрь по 40 мг ежедневно в течение 8 нед или в виде внутривенной инфузии (7,5 мг в 250 мл изотонического раствора натрия хлорида) ежедневно в течение 3 дней, клодронат по 300 мг внутривенно в течение 10 дней или памидронат 60 мг внутривенно однократно. Тем не менее оптимальные дозы препаратов и продолжительность лечения требуют уточнения [3, 8, 13].
Кетамин
В качестве антагониста NMDA-рецепторов кетамин представляет особый интерес из-за его потенциальной способности препятствовать центральной сенситизации, что может обеспечить кратковременное облегчение рефрактерной НПБ [4, 19]. В исследовании Correll G.E. и соавт., включавшем 33 стационарных пациентов с КРБС, показано, что внутривенное введение субанестетических доз кетамина 10–30 мг в час значительно уменьшало интенсивность БС [6]. Однако для подтверждения высокой эффективности кетамина при КРБС требуются дальнейшие исследования. Кетамин следует использовать только после тщательной оценки риска/пользы для отдельного пациента, и его применение следует проводить под строгим врачебным контролем.
Опиоиды
Препараты этой группы обладают высокой анальгетической эффективностью, но они могут вызывать в организме и другие эффекты. Опиоиды действуют на систему дыхания, сердечную деятельность, желудочно-кишечный тракт и мочевыводящую систему, вызывая потенциально опасные побочные эффекты. Обезболивание с помощью опиоидов также связано с проблемами толерантности к лекарственным препаратам и развития физической зависимости, а также с психологическими побочными эффектами. Мнения о роли опиоидных анальгетиков в лечении НПБ противоречивы. НПБ не входит в число показаний к применению ни одного из опиоидных препаратов [2].
В исследовании de Mos M. и соавт., основанном на лечении 102 пациентов с КРБС, установлено, что на ранних стадиях синдрома в 21% случае назначали опиоиды. Имеется только одно плацебо-контролируемое рандомизированное исследование лечения КРБС I типа пероральным назначением морфина у 43 пациентов, которым ранее проводилась стимуляция спинного мозга. Существенного снижения интенсивности БС при назначении морфина по сравнению с плацебо выявлено не было. Более того, в группе с применением морфина частота побочных эффектов была на порядок выше, чем в группе плацебо. Достаточных доказательств в отношении эффективности морфина и других опиоидов в снижении БС не найдено [3, 11].
Кальцитонин
Кальцитонин – полипептидный гормон, состоящий из 32 аминокислот, вырабатываемый преимущественно парафолликулярными клетками щитовидной железы. Основные эффекты кальцитонина – гипокальциемический и гипофосфатемический. Они реализуются за счет угнетения дифференцировки и активности остеокластов и, как следствие, замедления костной резорбции. В ходе применения кальцитонина в клинической практике выявлен анальгетический эффект, механизм которого до конца не ясен. Обсуждаются серотонинергический, катехоламинергический эффекты кальцитонина, его влияние на кальциевые каналы, фосфорилирование белков, продукцию эндорфинов, активность циклооксигеназы. Несмотря на теоретическое обоснование, результаты применения кальцитонина для лечения КРБС по 300– 400 МЕ/ сут подкожно или интраназально в течение 3–4 нед противоречивы. В двух исследованиях достоверных различий между группами пациентов, получавших и не получавших кальцитонин, не было отмечено. Результаты двух других исследований доказали его эффективность в виде уменьшения интенсивности боли. Поэтому необходимы дальнейшие исследования для установления места этого препарата в лечении КРБС [8].
Антидепрессанты
Трициклические антидепрессанты (ТЦА) стали одними из первых препаратов, не относящихся к обезболивающим средствам, которые продемонстрировали свою эффективность в лечении пациентов с НПБ [5, 8, 18]. Механизм обезболивающего действия этих препаратов до конца не ясен, но считается, что ингибирование ими обратного захвата серотонина и норадреналина активизирует нисходящий путь торможения боли. Показано также, что ТЦА незначительно блокируют натриевые каналы в периферических нервах и обладают антагонизмом к NMDA-рецепторам. Хотя данных литературы по использовании ТЦА в терапии КРБС не достаточно, их используют около 20% пациентов [3]. Рекомендуется начинать применение этих препаратов с низких доз (10 или 25 мг/сут), затем дозу постепенно увеличивают на 25–50 мг до получения желаемого эффекта. В клинических исследованиях ТЦА применяли при НПБ в средних дозах от 30 до 200 мг/сут, однако на практике некоторым пациентам могут потребоваться и более высокие дозы. Помимо блокирования обратного захвата норадреналина и серотонина, ТЦА в разной степени блокируют другие постсинаптические рецепторы, включая м-холинергические, a1-адренергические и гистаминовые, что обусловливает целый ряд противопоказаний и побочных эффектов, ограничивающих их применение [2].
Регионарные блокады
Кохрановский обзор показал низкое качество доказательств того, что блокада звездчатого ганглия или поясничная симпатическая блокада местным анестетиком являются эффективными в снижении интенсивности боли. Это же относится и к регионарной внутривенной анестезии. Кроме того, следует подчеркнуть, что блокады могут иметь положительный эффект у ограниченного числа пациентов, так как симпатически поддерживаемая боль имеется только у 10% больных КРБС [3].
Реабилитация
Функциональное восстановление является ключевой задачей реабилитации больных КРБС, которая достигается постепенным увеличением амплитуды движений путем трудотерапии, дифференцированных режимов двигательной активности [3, 8].
Физиотерапия (электротерапия, мануальная терапия, физические упражнения, моделирование профессий) оказывает благотворное влияние, выражающееся в уменьшении боли, отека и температуры кожи, и бывает эффективна при острых и хронических КРБС [23].
Психотерапия
Многомерная биопсихосоциальная составляющая хронической боли требует обязательной интеграции эффективной психотерапии в комплексных программах лечения.
Основной целью психотерапии при КРБС является развитие способности больного контролировать боль, активно участвовать в ее лечении, а также в мероприятиях по реабилитации. Направленную психотерапию необходимо начинать на 6–8 нед после развития заболевания. В нескольких исследованиях психологического воздействия на больных КРБС показаны преимущества когнитивно-поведенческой терапии, обучения релаксации с биологической обратной связью и семейным воспитанием [3, 8].
Прогноз
Благоприятный прогноз можно гарантировать только в том случае, если лечение КРБС начато рано, не позднее чем через 3 мес после появления первых симптомов. Если же лечение не начать вовремя, то в результате изменений в нервах, мышцах и костях поражение может распространиться по всей конечности и стать необратимым. Наиболее поддающимся лечению является КРБС после переломов костей (91%) и вывихов (78%). КРБС, вызванный другими причинами, излечивается в 55% случаев. В 25–40% случаев заболевание длится дольше 2 лет и оставляет осложнения типа контрактур, суставных анкилозов, потери мышечной силы и/или хронических болей. Неблагоприятный исход заболевания связан с образованием на ранних стадиях контрактур, моторных нарушений (дистония, тремор, спастики), отека в сочетании с психологическими отклонениями [3].
ЗАКЛЮЧЕНИЕ
Таким образом, наиболее эффективным в лечении пациентов с КРБС, на наш взгляд, является междисциплинарный подход, который должен включать рациональную фармакотерапию, физические и когнитивно-поведенческие лечебные стратегии. Ни один из отдельно применяющихся методов фармакологического, физического или психологического лечения не сравним по эффективности с междисциплинарным комплексным подходом ведения пациентов с хроническими БС. Именно комплексная биопсихосоциальная реабилитация является более результативной в плане возобновления повседневной и трудовой активности пациентов.



