Фармакогенетика – это раздел медицинской генетики, изучающий роль генетических факторов в формировании фармакологического ответа организма человека на лекарственные средства (ЛС). Данный термин впервые был предложен немецким ученым Ф. Фогелем в 1958 г., а в последующем получил развитие в работе В. Калоу (1962).
Индивидуальный ответ пациента на ЛС в значительной мере обусловлен наследственными факторами. Ни один врач, впервые назначая пациенту лекарство, не может быть полностью уверен в том, насколько эффективным и безопасным окажется это лечение. Причина кроется, прежде всего, в генетических особенностях больного. Развитие молекулярной биологии и генетики позволило в значительной степени продвинуться в понимании наследственно обусловленного разнообразия фармакологического ответа организма пациентов на ЛС. Фармакогенетика лежит в основе персонализированной медицины, обеспечивающей индивидуальный подход к назначению ЛС пациенту [1, 2]. При этом наряду с фармакогенетикой при проведении фармакотерапии выделяют прикладное направление персонализированной медицины, связанное с влиянием генетических факторов на заболеваемость и прогноз заболеваний.
Предметом изучения фармакогенетики является генетический полиморфизм (ГПМ) у больного. В популяции один и тот же ген может быть представлен в виде различных аллельных вариантов или ГПМ. На основании информации, содержащейся в генах, в организме синтезируются белки, с помощью которых осуществляется фармакокинетическое и фармакодинамическое взаимодействие человека и ЛС.
В настоящее время можно выделить несколько направлений влияния ГПМ на фармакокинетику и фармакодинамику ЛС:
- полиморфизм генов ферментов, метаболизирующих ЛС;
- полиморфизм генов белков-транспортеров ЛС;
- полиморфизм генов белков или ферментов фармакологических мишеней ЛС.
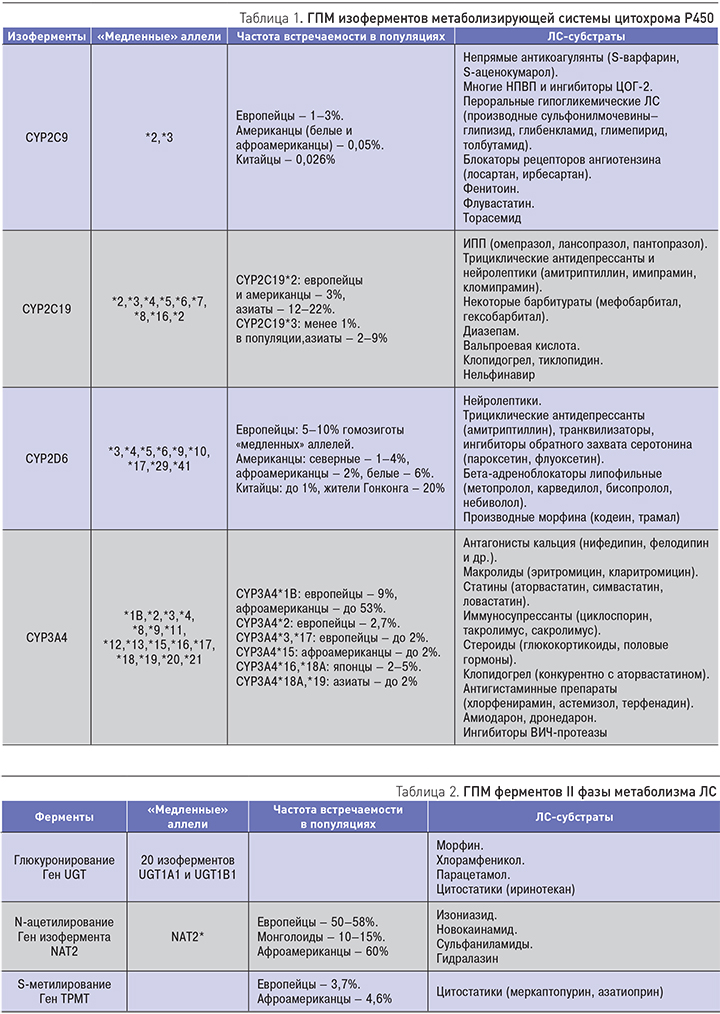
Сегодня активно изучают роль генов, контролирующих синтез и активность ферментов метаболизма ЛС, в частности, изоферментов цитохрома Р-450 (CYP2D6, CYP2D9, CYP2D19, CYP3А4) и ферментов II фазы биотрансформации (N-ацетилтрансфераза, UDP-глюкуронилтрансфераза, тиопурин-S-метилтрансфераза – ТРМТ, глутатион-S-трансфераза и т.д.).
В последние годы начато изучение влияния на фармакокинетику ЛС полиморфизма генов белков-транспортеров ЛС: транспортеров органических анионов (ОАТР-С, ОАТ-1, ОАТ-3), органических катионов (ОСТ-1) и Р-гликопротеина (MDR-1).
К группе фармакодинамических полиморфизмов отнесены гены, кодирующие молекулы-мишени действия ЛС (рецепторы, ферменты и др.), и гены, продукты которых вовлечены в патогенетические процессы заболевания.
Для выявления ГПМ генов-маркеров проводят фармакогенетическое тестирование (в основном ПЦР-диагностика). Очевидно, что применение таких тестов позволяет заранее прогнозировать фармакологический ответ на ЛС, а следовательно, индивидуально подойти к выбору ЛС и режима дозирования, а в некоторых случаях и к тактике ведения пациентов.
ФАРМАКОГЕНЕТИКА МЕТАБОЛИЗИРУЮЩИХ ФЕРМЕНТОВ
Наиболее обстоятельно изучен ГПМ ферментов печени системы цитохрома Р450, обеспечивающих I фазу метаболизма более 50% используемых в клинической практике ЛС. Среди них изоферменты CYP2D6, CYP2C9, CYP2C19, CYP3А4. В табл. 1, 2 приведены примеры полиморфных генов изоферментов цитохрома Р450, участвующих в метаболизме лекарств, их распространенность в популяциях и наиболее важные ЛС-субстраты.
Наиболее важным субстратом для CYP2C9 является варфарин, широко применяющийся для профилактики тромбоэмболических осложнений у пациентов с фибрилляцией предсердий. Выявление «медленных» аллелей (CYP2C9*2,*3) в гетерозиготном и гомозиготном наборе является предиктором развития эпизодов гипокоагуляции (МНО>3) и кровотечений, а также применения дозы варфарина <5 мг/сут для предотвращения геморрагических осложнений [3]. По данным метаанализа 9 рандомизированных клинических исследований (n=2775), у носителей «медленных» аллелей риск развития кровотечений составил 2,26, а снижение дозы варфарина составляло 27%, или в среднем на 1,47 мг [4]. В соответствии с современными клиническими рекомендациями (CHEST, ВНОК, 2012) фармакогенетическое тестирование необходимо проводить всем пациентам, которым планируется назначение варфарина и имеющим высокий риск развития кровотечений по шкале HAS-BLEND. Вместе с тем риск кровотечений на фоне приема варфарина связан также с ГПМ мишени витамин К-эпоксиредуктазы (VKORC1) и метаболизирующего фермента для витамина К (CYP4F2), что необходимо учитывать при индивидуальном дозировании препарата [5].
В ряде ретроспективных исследований показана ассоциация «медленных» аллелей (CYP2C9*2,*3) с риском развития желудочно-кишечных кровотечений, связанных с приемом нестероидных противовоспалительных препаратов (салицилаты, ибупрофен, диклофенак, флурбипрофен, пироксикам, кеторолак, темоксикам, лорноксикам, напроксен, целекоксиб) [6–8]; в метаанализе этих исследований риск развития желудочно-кишечных кровотечений у «медленных» метаболизаторов составил 2,33 [9]. Практическими рекомендациями при наличии «медленных» аллелей для предупреждения риска указанных кровотечений могут быть комбинация НПВП с ингибиторами протонной помпы (ИПП) или использование НПВП, которые не метаболизируются CYP2C9.
Субстратами CYP2D6 являются около 25% всех ЛС, среди них β-адреноблокаторы, трициклические антидепрессанты, нейролептики, производные морфина и другие препараты, многие из которых имеют узкую терапевтическую широту. Например, определены выраженные различия в фармакокинетических параметрах β-адреноблокаторов метопролола и карведилола у «быстрых» и «медленных» метаболизаторов по СYР2D6. Снижение скорости метаболизма этих препаратов приводит к формированию высоких плазменных концентраций, что усиливает фармакодинамические эффекты (брадикардитический, гипотензивный) и значительно повышают риск развития побочных явлений.
Субстратом для изофермента CYP2C19 является клопидогрел – важный антитромбоцитарный антиагрегант, необходимый для применения у пациентов с ишемической болезнью сердца, перенесших чрескожные коронарные вмешательства. Его применение у пациентов носителей «медленных» аллелей (CYP2C19*2,*3, а также *4,*5,*6,*7,*8) сопровождается нарушением образования активного метаболита и недостаточным антитромбоцитарным эффектом, что ухудшает исходы. По результатам метаанализа 9 рандомизированных клинических исследований (n=9685), у носителей «медленных» аллелей повышается риск тромбоза стентов (относительный риск 2,87) и неблагоприятных исходов (ОР 1,57) [10]. В клинических рекомендациях по фармакогенетике указано, что у пациентов с острым коронарным синдромом, являющихся «промежуточными» или «медленными» метаболизаторами, необходима альтернативная терапия другими антиагрегантами (прасугрел или тикагрелор) [11]. Кроме того, показана роль CYP2C19*17: у носителей «ультрабыстрого» аллеля на 26% повышен риск развития кровотечений [12].
Метаболизм ИПП происходит с участием изофермента CYP2C19, и его ГПМ оказывает влияние на антисекреторную активность этих препаратов [13]. У «медленных» метаболизаторов AUC («площадь под кривой концентрация-время») ИПП в несколько раз выше, что сопровождается достоверно более значимым повышением 24-часового внутрижелудочного рН. В результате клиническая эффективность ИПП, в частности эффективность эрадикационной терапии при хеликобактер-ассоциированных заболеваниях и эффективность лечения гастроэзофагеальной рефлюксной болезни, у «медленных» метаболизаторов достоверно более высокая. В нескольких метаанализах было показано, что относительный риск достижения эрадикации Helicobacter pylori у «медленных» метаболизаторов более чем вдвое превышает таковой у «экстенсивных» метаболизаторов, причем эти различия касаются преимущественно омепразола и лансопразола, метаболизм которых зависит от CYP2C19, и не значимы для рабепразола и пантопразола, в меньшей степени метаболизирующихся этим изоферментом [14, 15]. Для обеспечения высокой эффективности лечения может потребоваться индивидуальный выбор препарата из группы ИПП.
ФАРМАКОГЕНЕТИКА БЕЛКОВ-ТРАНСПОРТЕРОВ ЛС
Белки-транспортеры участвуют в выведении ЛС из организма на уровне органов экскреции (желудочно-кишечный тракт, печень, почки). К ним относятся Р-гликопротеин, транспортеры органических анионов и катионов и др.
Наиболее изучен генетический полиморфизм гена MDR-1, кодирующего Р-гликопротеин [16]. Этот фермент контролирует выброс различных ксенобиотиков из клетки, препятствует всасыванию ЛС из кишечника и обеспечивает выброс в желчь и первичную мочу. К «медленным» аллелям относится Т-аллель; гомозиготные носители «медленных аллелей (ТТ) характеризуются снижением функции Р-гликопротеина, в результате чего у них обнаруживаются высокие концентрации ЛС-субстратов в плазме крови. Частота встречаемости ТТ-аллелей среди европейцев и монголоидов может достигать 30%, тогда как среди афроамериканцев лишь 4%. Субстратами Р-гликопротеина являются сердечные гликозиды, блокаторы медленных кальциевых каналов, статины, макролиды, глюкокортикоиды, цитостатики, иммунодепрессанты, ингибиторы ВИЧ-протеазы. В связи с риском передозировки ЛС-субстратов для Р-кликопротеина при обнаружении у пациента полиморфного маркера следуют выполнять следующие практические рекомендации [17]:
- снизить дозы ЛС-субстратов Р-гликопротеина с узкой терапевтической широтой (дигоксин, циклоспорин);
- не применять ЛС-субстраты Р-гликопротеина, нежелательные лекарственные эффекты которых связаны с их проникновением через гистогематические барьеры (фексофенадин, лоперамид);
- назначать ЛС с низкой биодоступностью, так как у лиц с мутациями они могут оказаться наиболее эффективными (статины, ингибиторы ВИЧ-протеазы);
- назначать препараты, мишени которых расположены в ЦНС, а проникновение через гематоэнцефалический барьер затруднено, так как у этой категории пациентов они могут оказаться наиболее эффективными (противосудорожные средства, галоперидол).
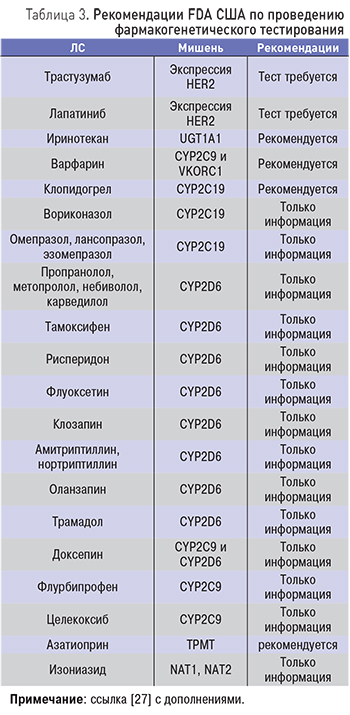 К хорошо изученным транспортерам ЛС также относятся трансмембранные белки-транспортеры органических анионов, локализованные в почках (ОАТ1-10) и печени (ОАТР). К субстратам этих транспортеров относятся такие широко применяемые лекарства, как антибиотики, диуретики, ингибиторы АПФ, сартаны, статины, противовирусные и противоопухолевые средства. Так, в частности, установлена ассоциация между носительством «медленных аллелей» гена ОАТР1В1 (С аллель гена SLCO1B1), нарушающих транспорт ЛС в гепатоциты, и миопатией при приеме статинов [18]. В соответствии с клиническими рекомендациями по фармакогенетике гомозиготным носителям СС-аллелей не следует назначать высокодозовую терапию статинами (симвастатин, аторвастатин, розувастатин) [19].
К хорошо изученным транспортерам ЛС также относятся трансмембранные белки-транспортеры органических анионов, локализованные в почках (ОАТ1-10) и печени (ОАТР). К субстратам этих транспортеров относятся такие широко применяемые лекарства, как антибиотики, диуретики, ингибиторы АПФ, сартаны, статины, противовирусные и противоопухолевые средства. Так, в частности, установлена ассоциация между носительством «медленных аллелей» гена ОАТР1В1 (С аллель гена SLCO1B1), нарушающих транспорт ЛС в гепатоциты, и миопатией при приеме статинов [18]. В соответствии с клиническими рекомендациями по фармакогенетике гомозиготным носителям СС-аллелей не следует назначать высокодозовую терапию статинами (симвастатин, аторвастатин, розувастатин) [19].
ФАРМАКОГЕНЕТИКА ФАРМАКОЛОГИЧЕСКИХ МИШЕНЕЙ ЛС
ГПМ генов белков, являющихся фармакологическими мишенями для ЛС (рецепторы, ферменты), может становиться причиной изменения фармакодинамики ЛС. Примерами генетического полиморфизма фармакологических мишеней могут служить полиморфизм генов, кодирующих β1- и β2-адренорецепторы.
Полиморфизм гена, кодирующего β1-адренорецепторы (ADRB1), способен влиять на фармакодинамику β-адреноблокаторов. В настоящее время исследования в отношении такого рода полиморфизма выполнены у пациентов с хронической сердечной недостаточностью. Установлено, что замена гуанина на аргинин в положении 389 в нуклеотидной последовательности гена ADRB1 (полиморфный маркер 389Arg) способствует более выраженной экспрессии ответа на агонисты β1-адренорецепторов [20]. В исследованиях показано, что эффекты β1-адренорецепторов у пациентов с хронической сердечной недостаточностью, несущих аллель Arg389, характеризуются не только более выраженным брадикардитическим и гипотензивным действием [21], но и обеспечивают лучшие отдаленные результаты по прогнозу и снижению смертности [22]. Частота встречаемости аллеля Arg389 у европейцев достигает 42%, у представителей негроидной расы – 27%.
Изучен ГПМ гена β2-адренорецептора (ADRB2), при котором в аминокислотной последовательности рецептора в 16 положении глицин заменяется на аргинин (атипичный аллель Arg16) [23]. У гомозигот и гетерозигот по этой мутации наиболее выражен бронхолитический эффект короткодействующих β2-адреноагонистов (сальбутамол). В метаанализе 3 ретроспективных исследований у детей с бронхиальной астмой (n=960) было показано, что носители Arg/Arg имели достоверный прирост ОФВ1 >15% в сравнении с носителями Arg/Gly и Gly/Gly (ОР=1,77; р=0,029) [24]. Кроме того, у носителей аллеля Arg16 имеется предрасположенность к снижению плотности β2-адренорецепторов в бронхах на фоне длительного регулярного применения β2-адреноагонистов по причине феномена down-регуляции, что может стать причиной ухудшения течения бронхиальной астмы [25, 26]. Показано, что при терапии β2-адреноагонистами у таких больных должны применяться интермиттирующие режимы дозирования. Распространенность гомозигот по указанной мутации высока и достигает в европейской популяции 40%, поэтому терапия бронхообструктивного синдрома у таких пациентов становится серьезной проблемой.
ПРАКТИЧЕСКОЕ ЗНАЧЕНИЕ ФАРМАКОГЕНЕТИЧЕСКОГО ТЕСТИРОВАНИЯ В КЛИНИЧЕСКОЙ ПРАКТИКЕ
Изучение ГПМ позволяет установить ассоциацию между носительством того или иного варианта гена и определенной фармакологической реакцией организма при применении ЛС. Фармакогенетическое тестирования особенно важно в тех случаях, когда применение ЛС сопровождается развитием жизнеугрожающих серьезных и частых побочных эффектов, так как оно позволяет определить необходимость коррекции фармакотерапии (дозы, кратности введения, пути введения, замены ЛС и т.д.) и повысить безопасность лечения.
Практическая значимость ряда фармакогенетических тестов уже доказана, и они внедрены в клиническую практику для индивидуализации фармакотерапии (варфарин, меркаптопурин, трициклические антидепрессанты и некоторые другие ЛС; табл. 3).
Интерес к проблемам фармакогенетики остается оправдано высоким, и, вероятно, в ближайшее время будут открыты новые ГПМ, которые позволят повысить эффективность и безопасность проводимой медикаментозной терапии и избежать прогнозируемых ошибок.
Уже разработан целый ряд положений фармакогенетического тестирования, внедряемых в клиническую практику, к числу которых относятся следующие:
- наличие выраженной ассоциации между выявляемым аллелем того или иного гена и неблагоприятным фармакологическим ответом (развитие нежелательных лекарственных реакций или недостаточная эффективность);
- должен быть хорошо разработан алгоритм применения ЛС в зависимости от результатов фармакогенетического теста: выбор ЛС, режима его дозирования, особая тактика ведения пациента и т.д.;
- выявляемый (как правило, негативный) аллель должен встречаться в популяции с частотой не менее 1%;
- должны быть доказаны преимущества применения ЛС с использованием результатов фармакогенетического теста по сравнению с традиционным подходом (повышение эффективности, безопасности фармакотерапии, а также экономическая рентабельность);
- фармакогенетический тест должен быть доступен больным и врачам.
Таким образом, современный взгляд на фармакогенетику позволяет выделить три ее основные задачи: поиск оптимального препарата для конкретного пациента, определение необходимой и достаточной его дозы и оптимизация побочных эффектов путем анализа индивидуального набора генов, участвующих как в реализации механизма действия лекарств, так и в их метаболизме.
На сегодняшний день развитие фармакогенетики еще не достигло того уровня, который позволил бы действительно получить ответы на эти вопросы. Но уже можно говорить о том, что нетипичные эффекты ЛС, а также некоторые их побочные эффекты могут быть объяснены с позиций молекулярной генетики, т.е. генотипом белков, влияющих на фармакодинамику ряда лекарственных препаратов.



