СПИСОК СОКРАЩЕНИЙ
АГ – артериальная гипертония
АГТ – антигипертензивная терапия
АД – артериальное давление
АМКР – антагонисты минералокортикоидных рецепторов
БКК – блокаторы кальциевых каналов
БРА – блокаторы рецепторов ангиотензина II
ВГД – внутригрудное давление
ВДП – верхние дыхательные пути
ДАД – диастолическое артериальное давление
ДП – дыхательные пути
ДН – дыхательная недостаточность
ДО – дыхательный объем
ИАПФ – ингибиторы ангиотензинпревращающего фермента
ИБС – ишемическая болезнь сердца
ИВЛ – искусственная вентиляция легких
ИМТ – индекс массы тела
ИР – инсулинорезистентность
ЛА – легочная артерия
ЛГ – легочная гипертензия
ЛЖ – левый желудочек
МЦК – минутная циркуляция крови
НВЛ – неинвазивная вентиляция легких
ОДН – острая дыхательная недостаточность
ПЖ – правый желудочек
РААС – ренин-ангиотензин-альдостероновая система
РКИ – рандомизированное контролируемое исследование
САД – систолическое артериальное давление
CД2 – сахарный диабет 2 типа
СМАД – суточное мониторирование АД
СНС – симпатическая нервная система
СКФ – скорость клубочковой фильтрации
ССЗ – сердечно-сосудистые заболевания
ЧДД – частота дыхательных движений
ЧСС – частота сердечных сокращений
ХБП – хроническая болезнь почек
ХСН – хроническая сердечная недостаточность
ЭхоКГ – эхокардиографическое исследование сердца
CPAP – continuous positive airway pressure – постоянное положительное воздухоносное давление
IPAP – положительное давление на вдохе
FiО2 – индекс Фика (содержание кислорода в газовой смеси)
PaCO2 – парциальное давление углекислого газа в артериальной крови
PaO2 – парциальное давление кислорода в артериальной крови
PCV – вентиляция легких с контролируемым давлением
PEEP – положительное давление в конце выдоха
PSV – вентиляция с поддерживающим давлением
SaO2 – сатурация кислорода
VT – дыхательный объем
МЕТОДЫ ПОДГОТОВКИ, КАЧЕСТВО ДОКАЗАТЕЛЬСТВ И СИЛА РЕКОМЕНДАЦИЙ
Методы, использованные для сбора/селекции доказательств:
- доказательной базой для рекомендаций являются публикации, вошедшие в Кокрановскую библиотеку, базы данных EMBASE и MEDLINE. Глубина поиска составляла 10 лет.
Описание методов, использованных для селекции доказательств:
- в анализ были включены метаанализы, систематические обзоры, рекомендации и консенсусы медицинских обществ разных стран. При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучалась для того, чтобы убедиться в ее валидности.
Методы оценки качества и силы доказательств:
- основным методом создания согласительных рекомендаций было достижение соглашения экспертов посредством создания основы рекомендаций и корректировка каждого раздела каждым экспертом с последующей доработкой и повторной коррекцией. Какие-либо различия в оценках повторно обсуждались всеми членами группы путем пересылки по электронной почте. При невозможности достижения консенсуса привлекался независимый эксперт.
Методы, использованные для формулирования рекомендаций:
- консенсус экспертов.
Рейтинговая схема для оценки силы рекомендаций:
- не применялась ввиду слабой доказательной базы.
Индикаторы доброкачественной практики (Good Practice Points – GPPs):
- рекомендуемая доброкачественная практика базировалась на клиническом опыте членов рабочей группы по разработке рекомендаций.
Экономический анализ:
- анализ стоимости не проводился, и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
- внешняя экспертная оценка;
- внутренняя экспертная оценка.
Описание метода валидизации рекомендаций:
- настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать прежде всего то, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания;
- получены комментарии со стороны врачей первичного звена и участковых терапевтов в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций как рабочего инструмента повседневной практики;
- предварительная версия была также направлена рецензенту, не имеющему медицинского образования, для получения комментариев с точки зрения перспектив пациентов;
- комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался, и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультация и экспертная оценка:
- предварительная версия была выставлена для широкого обсуждения, чтобы все заинтересованные лица имели возможность принять участие в обсуждении и совершенствовании рекомендаций;
- проект рекомендаций был рецензирован также независимыми экспертами, которых попросили прокомментировать прежде всего доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Рабочая группа:
- для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
1. ВВЕДЕНИЕ
 Цель настоящих рекомендаций – ознакомить врачей первичного звена с современными данными по эпидемиологии, патофизиологии, диагностике, лечению пациентов, страдающих резистентной артериальной гипертензией (РАГ) и обструктивным апноэ сна (ОАС). В рекомендациях отражены современные подходы к немедикаментозной терапии и медикаментозному лечению таких пациентов, приведены алгоритмы ранней диагностики и эффективной коррекции.
Цель настоящих рекомендаций – ознакомить врачей первичного звена с современными данными по эпидемиологии, патофизиологии, диагностике, лечению пациентов, страдающих резистентной артериальной гипертензией (РАГ) и обструктивным апноэ сна (ОАС). В рекомендациях отражены современные подходы к немедикаментозной терапии и медикаментозному лечению таких пациентов, приведены алгоритмы ранней диагностики и эффективной коррекции.
Рекомендации являются актуальными для врачей общей практики, терапевтов, а также представляют интерес для узких специалистов (пульмонологов, кардиологов и др.).
Медицинская и социальная значимость обструктивного апноэ сна и резистентной артериальной гипертензии не вызывает сомнения. К сожалению, в большинстве случаев практические врачи мало информированы о сущности ОАС, затрудняются дать пациенту обоснованные рекомендации по коррекции образа жизни, не владеют технологией медикаментозной терапии. Также в реальной клинической практике отсутствует унифицированный подход к тактике ведения пациентов с РАГ (алгоритм диагностического поиска, терапевтические стратегии). Одной из основных причин недостаточной осведомленности врачей является отсутствие единых терминологических и классификационных подходов. Также существуют разногласия в рациональных путях диагностики и лечения.
Внедрение в повседневную клиническую практику терапевта данных рекомендаций позволит унифицировать подходы к эффективному лечению пациентов с артериальной гипертензией и обструктивным апноэ сна. Предполагается, что рекомендации будут совершенствоваться по мере накопления научных знаний и практического опыта.
Основные положения рекомендаций базируются на результатах рандомизированных клинических исследований, метаанализов, исследований, а также мнениях комитетов экспертов. Данные российские рекомендации основываются на положениях рекомендаций Европейского общества кардиологов (ESC) и Европейского общества по гипертонии (ESH), Европейского респираторного общества (ERS), Американской ассоциации сердца (АСС).
Проект Рекомендаций был открыт для широкого обсуждения, что позволило существенно уточнить многие позиции, упростить и улучшить текст. Замечания и дополнения, которые были конструктивными и способствовали реальному улучшению документа, мы использовали при подготовке его окончательной редакции.
2. РЕЗИСТЕНТНАЯ АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
Проблема контроля артериальной гипертонии (АГ) в популяции больных АГ не теряет своей актуальности, несмотря на совершенствование подходов к диагностике, ведению АГ, постоянной коррекции тактики назначения антигипертензивной терапии с расширением показаний к комбинированным вмешательствам [1‒3].
В проспективном эпидемиологическом исследовании (The Prospective Urban Rural Epidemiologic (PURE) study 2012), в котором изучали распространенность, осведомленность и контроль АГ в широкой популяции пациентов различных стран, приводятся низкие данные по контролю АГ среди леченых больных – 32,5%. Среди факторов, влияющих на этот показатель, ведущими являются экономический статус страны, место проживания (деревня, город), образование пациента [4]. По данным крупных эпидемиологических исследований, распространенность АГ в российской популяции пациентов не снижается и составляет около 40%. Доля пациентов с целевыми цифрами артериального давления: 27–30% у женщин и 14–18% у мужчин [5, 6].
Часто в сознании врачей возникает терминологическая путаница. Что понимать под терминами «неконтролируемая АГ», «резистентная АГ», тождественные ли эти понятия? В соответствии с современными представлениями в случае недостаточного контроля АГ у каждого конкретного пациента врач должен выполнить определенный алгоритм диагностического поиска, подтвердить истинную резистентность АГ. Пациента с недостигнутым целевым уровнем АД на первых этапах анализа следует относить к категории неконтролируемой АГ, активно выявлять причины недостижения целевых цифр АД и грамотно регулировать назначенную антигипертензивную терапию.
2.1. Дефиниции: определение и классификация резистентной артериальной гипертензии
АГ считается резистентной к лечению, если адекватное изменение образа жизни в сочетании с терапией диуретиком и двумя другими антигипертензивными препаратами различных классов в оптимальных дозах (за исключением антагониста минералокортикоидных рецепторов) не позволяет снизить АД менее 140/90 мм рт.ст. соответственно [1]. Понятие резистентной артериальной гипертензии (РАГ) включает и тех пациентов, у которых АД успешно контролируется при назначении более чем трех препаратов.
Диагноз «резистентная АГ» должен стимулировать клинициста к диагностическому поиску потенциально устранимых причин гипертензии, а также к выявлению пациентов, нуждающихся в специализированной обследовании и лечении. В настоящее время не существует достоверной информации о распространенности РАГ, для точной оценки необходимо проведение крупномасштабных исследований со ступенчатым титрованием антигипертензивных препаратов. По результатам различных исследований, распространенность РАГ значительно варьируется в зависимости от популяции пациентов, качества проведенного обследования и составляет от 10 до 30% [7–8].
Показано, что частота сердечно-сосудистых событий у пациентов с РАГ значительно выше, чем в группе контролируемой АГ (18,0 и 13,5% соответственно, P <0,001, ОШ 1,47; 95% ДИ 1,33–1,62) [9]. Исследователем E.D. Frohlich в 1988 г. предложена подробная классификация резистентной АГ, которая не потеряла актуальности до настоящего времени [10].
«РЕЗИСТЕНТНЫЙ ПАЦИЕНТ»
А. Низкая приверженность к терапии:
1. Образ жизни
Употребление соли, алкоголя, неспособность снизить вес.
2. Лекарственная терапия
Отказ от приема назначенных препаратов.
Изменение доз препаратов.
Развитие побочных эффектов.
В. Прекращение терапии.
С. Отказ от дальнейшего наблюдения.
«РЕЗИСТЕНТНЫЙ ВРАЧ»
A. Неадекватное информирование пациента.
B. Неправильный терапевтический режим.
C. Неадекватная оценка потребления натрия (соли).
D. Неспособность оценить лекарственные взаимодействия.
E. Неправильный клинический диагноз.
«РЕЗИСТЕНТНАЯ АГ»
A. Псевдорезистентность:
1. «Офисная» гипертензия (гипертензия «белого халата»).
2. Псевдогипертензия.
B. Псевдотолерантность (перегрузка жидкостью и натрием).
C. Истинно резистентная артериальная гипертензия.
2.2. Алгоритм диагностического поиска при резистентной артериальной гипертензии
Алгоритм ведения пациента с резистентной АГ в соответствии с рекомендациями АНА (American Heart Association) 2008 г. представлен в табл. 1 [11].
«Резистентный пациент». Недостаточная приверженность пациента к терапии, неспособность модифицировать образ жизни являются одними из самых распространенных причин неконтролируемой АГ в популяции. Около 40% пациентов с АГ в течение первого года самостоятельно прекращают назначенное лечение [12]. Проблема низкой приверженности пациентов к терапии чрезвычайно сложна и тесно связана с экономическими, социокультурными, психологическими аспектами и не рассматривается в данном документе.
«Резистентный врач». Проблема терапевтической инертности очень остро стоит в современной гипертензиологии. Несмотря на разработку достаточно четких алгоритмов по ведению АГ в современных рекомендациях, до 50% врачей при нецелевом уровне АД не предпринимают никаких попыток модификации схемы терапии и ревизии диагноза. Исследование больных с резистентной АГ показало, что среди причин резистентности, связанной с неадекватной лекарственной терапией, на первом месте (58%) был неоптимальный режим лечения, а лекарственная непереносимость или неэффективность препаратов вместе составили лишь 6% [13].
Исходя из этого, упрощение схем терапии и тактики смены неэффективных препаратов поможет в том числе в преодолении терапевтической инертности.
В сферу компетенции врача также входит оценка лекарственных взаимодействий, с анализом принимаемой пациентом сопутствующей терапии. Список средств, способствующих повышению АД и эффекту «ускользания» на фоне подобранной антигипертензивной терапии, постоянно пополняется (см. табл. 1)
Псевдорезистентность. Псевдогипертензия часто наблюдается в пожилом и старческом возрасте и связана с тем, что давление внутри манжетки при изменении АД существенно превышает внутриартериальное в связи с высокой жесткостью и, как следствие этого, с несжимаемостью магистральных артерий. Этот феномен наиболее выражен при кальцификации артерий. Подозрение на псевдорезистентность возникает при клиническом диссонансе – несоответствии между уровнем измеряемого АД и степенью поражения органом-мишеней в сочетании с эпизодами ортостатической гипотонии.
Гипертония «белого халата». В исследовании Mezzertti et al. показано, что у пациентов с резистентной АГ на фоне трехкомпонентной схемы антигипертензивной терапии в 74,1% случаев регистрируется феномен гипертонии «белого халата». То есть эти пациенты имеют целевые цифры АД при амбулаторном мониторировании АД и не нуждаются в дополнительной диагностике возможных причин резистентности [14].
Ранее считалось, что этот феномен более характерен для молодых, эмоционально лабильных пациентов. Однако в настоящее время показано, что гипертония «белого халата» часто возникает и в пожилом возрасте, что в сочетании с высокой жесткостью магистральных артерий является частой причиной резистентности в старшей возрастной группе.
Неправильный клинический диагноз. Поиск вторичных причин артериальной гипертензии входит в алгоритм диагностики резистентной АГ. Данные о распространенности симптоматических АГ существенно разнятся (от 5 до 17%). Причинами этого являются разнородность клинических групп, включенных в анализ, различные диагностические возможности медицинских центров, проводящих исследование.
Тем не менее всеми экспертами признается, что у пациентов с РАГ превалируют вторичные причины АГ по сравнению с группой, контролируемой АГ. Наши представления о распространенности симптоматических АГ в последние годы претерпели значительные изменения. В предыдущих исследованиях среди наиболее частых причин вторичной АГ обсуждались паренхиматозные заболевания почек и стеноз почечной артерии. В настоящее время обструктивное апноэ сна (ОАС) позиционируется как наиболее частая причина резистентости АГ к проводимой терапии [11].
В соответствии с рекомендациями Американской ассоциации сердца (AHA) «Resistant Hypertension: Diagnosis, Evaluation and Treatment» к наиболее распространенным вторичным причинам резистентной АГ относятся:
- синдром обструктивного апноэ сна;
- реноваскулярная АГ/стеноз почечных артерий;
- первичный гиперальдостеронизм;
- паренхиматозные заболевания почек.
Менее распространенные причины классифицируются следующим образом:
- феохромоцитома;
- болезнь Кушинга;
- гиперпаратиреоидизм;
- коарктация аорты;
- внутричерепное новообразование.
В табл. 1 представлен алгоритм диагностического поиска при резистентной АГ.
КЛЮЧЕВЫЕ ПОЛОЖЕНИЯ. БЛОК 1
Резистентная артериальная гипертензия
- Резистентная артериальная гипертензия – состояние высокого сердечно-сосудистого риска.
- В случае недостаточного контроля АГ необходимо проведение алгоритма диагностического поиска для подтверждения истинной резистентности АГ.
- При РАГ чаще встречаются вторичные причины АГ.
- Обструктивное апноэ сна является одной из наиболее частых причин резистентной АГ.
3. ОБСТРУКТИВНОЕ АПНОЭ СНА
3.1. Терминология, определение и классификация обструктивного апноэ сна
С того момента, когда впервые была установлена обструктивная природа апноэ сна в 1965 г., было накоплено много новой информации об этом заболевании. По данным ряда популяционных исследований, апноэ сна диагностируется примерно у 10% взрослых лиц. Однако при ряде сердечно-сосудистых заболеваний, приводящих к задержке натрия и воды, распространенность заболевания может превышать 50% [15, 16]. Несмотря на то что в современных алгоритмах оценки кардиальных рисков апноэ сна формально не является необходимой переменной, существуют убедительные доказательства причинно-следственной связи апноэ сна с артериальной гипертензией, ишемической болезнью сердца, сердечной недостаточностью, фибрилляцией предсердий и инсультом. Неудивительно, что в большинстве случаев апноэ сна рассматривается как независимый предиктор преждевременной сердечно-сосудистой смерти [17].
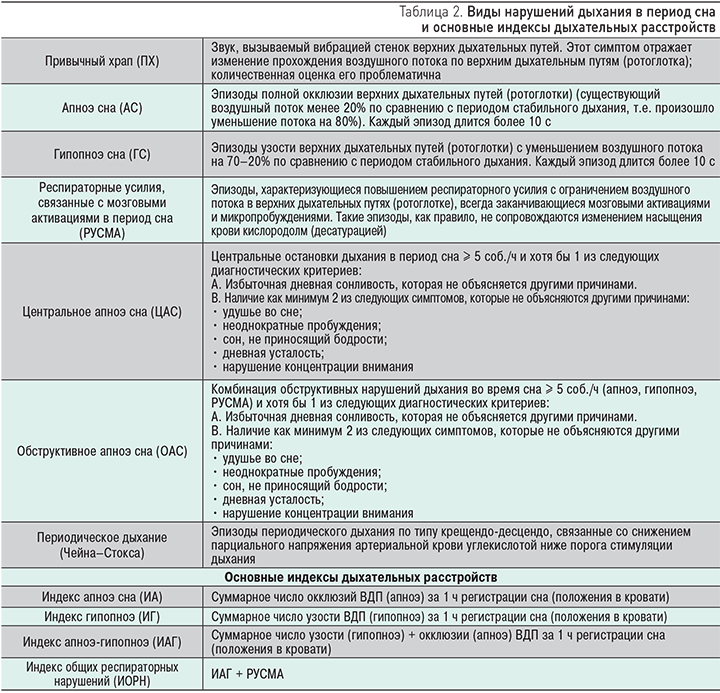
 К нарушениям дыхания в период сна относятся привычный храп (ПХ), обструктивное апноэ сна (ОАС), центральное апноэ сна (ЦАС), гипопноэ сна (ГС), респираторные усилия, связанные с мозговыми активациями в период сна (РУСМА), а также периодическое дыхание по типу крещендо-десцендо (дыхание Чейна–Стокса) [18, 19] (табл. 2).
К нарушениям дыхания в период сна относятся привычный храп (ПХ), обструктивное апноэ сна (ОАС), центральное апноэ сна (ЦАС), гипопноэ сна (ГС), респираторные усилия, связанные с мозговыми активациями в период сна (РУСМА), а также периодическое дыхание по типу крещендо-десцендо (дыхание Чейна–Стокса) [18, 19] (табл. 2).
На сегодняшний день существует клиническое определение «обструктивное апноэ сна», достигнутое путем консенсуса специалистов в области пульмонологии, кардиологии, медицины сна (Obstructive Sleep Apnea Syndrome (780.53-0). The International Classification of Sleep Disorders. American Academy of Sleep Medicine. 2010).
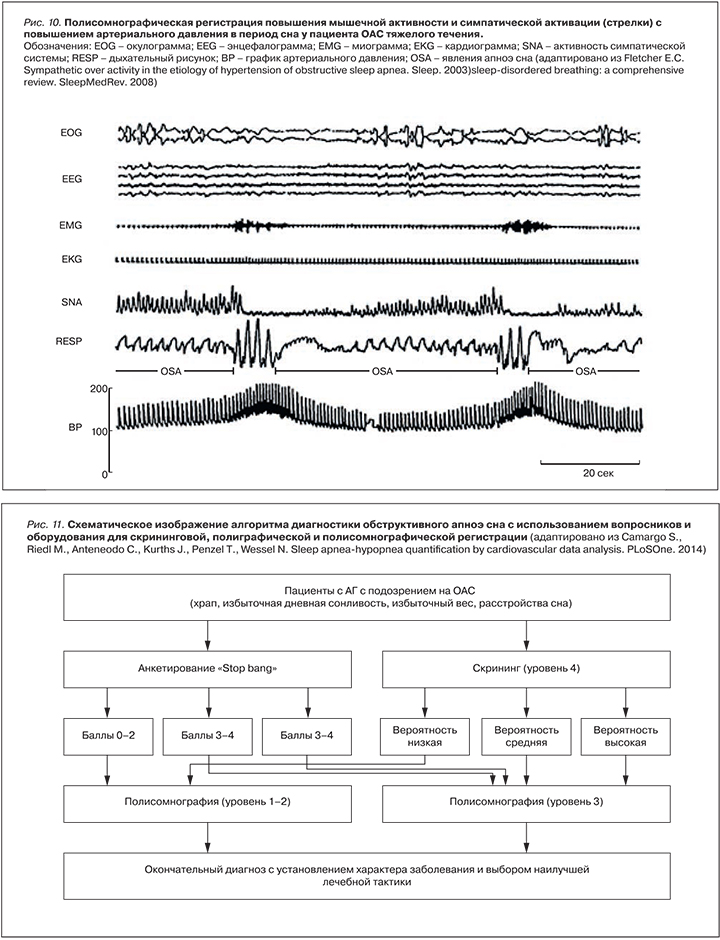
ОБСТРУКТИВНОЕ АПНОЭ СНА (ОАС) является гетерогенным парасомническим (сопровождающим сон) заболеванием, характеризующимся глоточными коллапсами (дыхательными паузами более 10 с) в период сна с сохраненными респираторными усилиями, частыми ночными десатурациями (падением насыщения артериальной крови кислородом) и наличием дневных проявлений (избыточная сонливость, артериальная гипертензия, сердечные аритмии, инсулинорезистентность, метаболические нарушения), варьирующих во времени и интенсивности, связанных с тяжестью заболевания (рис. 1).
Тяжесть заболевания описывается суммарным числом событий узости (гипопноэ) и окклюзии (апноэ) глотки к 1 ч регистрации сна (индекс апноэ-гипопноэ = ИАГ). Индексе ИАГ свыше 5 соб./ч соответствует началу болезни. ИАГ от 5 до 15 соб./ч соответствует легкому течению заболевания, ИАГ от 15 до 30 соб./ч – среднетяжелому течению, а ИАГ свыше 30 соб./ч – тяжелому течению заболевания [20]. Кроме того, при оценке тяжести учитывают уровень снижения сатурации и наличие в период десатурации клинически значимых событий (в первую очередь сердечно-сосудистых – подъемы АД, аритмии).
3.2. Эпидемиологические аспекты обструктивного апноэ сна и поражения сердечно-сосудистой системы
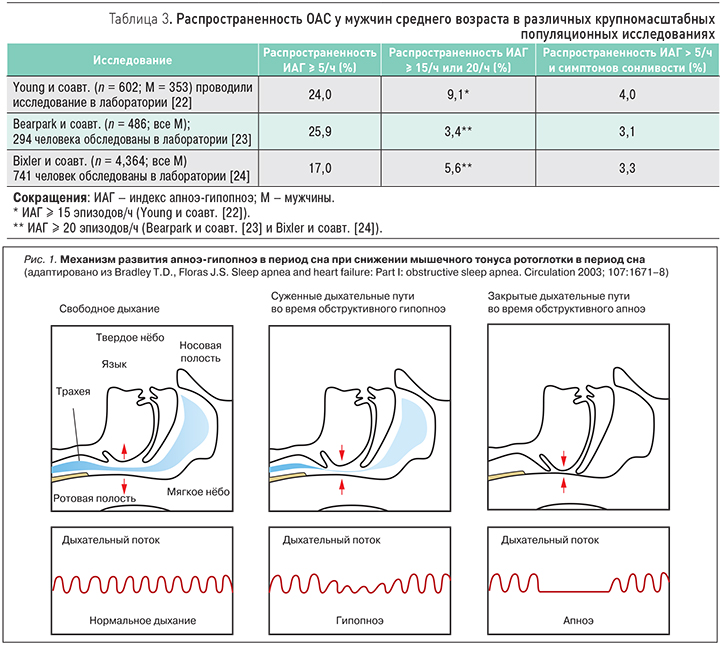
На протяжении 1990-х гг. в ряде исследований с устойчивым дизайном и с применением эпидемиологических методов изучалась распространенность нарушений дыхания во сне. Они основывались на ранее проводимых исследованиях по оценке распространенности ОАС, при этом в одном из них была показана возможность применения двухэтапной стратегии при формировании выборки больных для более точного определения его распространенности [21] (табл. 3).
Наиболее крупномасштабные исследования с участием взрослых лиц среднего возраста проведены среди государственных служащих в Висконсине (Wisconsin Sleep Cohort Study-WSCS) [22], в городе Буссельтон (Австралия) [23], а также в округах Дауфин и Лебанон в Пенсильвании [24, 25]. В ходе этих исследований были получены аналогичные показатели распространенности заболевания с различной степенью тяжести (см. табл. 3, 4). Распространенность оказалась выше у мужчин, чем у женщин, показатель соотношения мужчины/женщины составил 2–3:1. Особенно низкая распространенность выявляется у женщин в предклимактерическом периоде, с нарастанием после менопаузы (табл. 4).
Существует ряд факторов риска развития обструктивного апноэ сна (табл. 5).
Отдельного внимания заслуживают данные о распространенности ОАС среди пациентов с сердечно-сосудистыми заболеваниями и метаболическими нарушениями. Увеличение степени ожирения и ежедневного потребления воды и натрия за последние 20 лет существенно увеличили распространенность ОАС в общей популяции, а в особенности у больных с сердечно-сосудистыми заболеваниями [26–27] (табл. 6).
 Существуют двунаправленные связи между внезапной остановкой дыхания во сне и сердечно-сосудистым заболеванием. Распространенность АГ у пациентов ОАС варьирует от 35 до 80% и, по-видимому, зависит от тяжести ОАС. Более 60% пациентов ОАС с ИАГ> 30 соб./ч страдают АГ. И, наоборот, около 40% больных АГ имеют ОАС [28, 29]. Отчасти это объясняется тем, что апноэ сна индуцирует внутрисосудистое воспаление. Это существенно увеличивает сердечно-сосудистые риски, включая случаи артериальной гипертензии, дислипидемии, фибрилляции предсердий, инсульта, сердечной недостаточности, но чаще у мужчин, чем у женщин [30].
Существуют двунаправленные связи между внезапной остановкой дыхания во сне и сердечно-сосудистым заболеванием. Распространенность АГ у пациентов ОАС варьирует от 35 до 80% и, по-видимому, зависит от тяжести ОАС. Более 60% пациентов ОАС с ИАГ> 30 соб./ч страдают АГ. И, наоборот, около 40% больных АГ имеют ОАС [28, 29]. Отчасти это объясняется тем, что апноэ сна индуцирует внутрисосудистое воспаление. Это существенно увеличивает сердечно-сосудистые риски, включая случаи артериальной гипертензии, дислипидемии, фибрилляции предсердий, инсульта, сердечной недостаточности, но чаще у мужчин, чем у женщин [30].
Представляет интерес 10-летнее наблюдение за мужчинами в исследовании Sleep Heart Health Study (SHHS), показавшее возрастание на 58% случаев сердечной недостаточности у пациентов ОАС (ИАГ ≥ 30 соб./ч) по сравнению с не имеющими апноэ сна (ИАГ <5 соб./ч) [31].
10-летнее наблюдательное исследование среди испанских мужчин установило частоту сердечно-сосудистой смерти 0,3/100 человеко-лет у здоровых (n=264), возрастание до 0,55/100 человеко-лет при среднетяжелом ОАС (n=403) и драматический рост до 1,06/100 человеко-лет у пациентов с нелеченым тяжелым ОАС (n = 235). В этих группах отмечался аналогичный пошаговый рост числа не фатальных событий: 0,45; 0,89 и 2,13/100 человеко-лет [32]. Такая ассоциация тяжелого нелеченого ОАС с низкой вероятностью выживания и дожития была также подтверждена в Висконсинском исследовании (WSCS) [22] и в специальном анализе по результатам Sleep Heart Health Study [33].
3.3. Обструктивное апноэ сна и беременность
Отдельным состоянием, при котором также предполагается взаимосвязь АД и нарушений дыхания во время сна, является АГ на фоне беременности, но исследования в этой области имеют существенные методологические недостатки (небольшой размер выборки, малое число полисомнографических исследований). Патогенез развития нарушений дыхания во время сна на фоне беременности представлен на рис. 2.
Факторы, снижающие риск развития ОАС у беременных (адаптировано из C.E. Sullivan, N. Edwards. Sleep Apnea, Current Diagnosis and Treatment. 2006):
- Как правило, отсутствие анамнеза перед беременностью.
- Защитная роль эстрогенов.
- Молодой возраст.
Факторы, повышающие риск развития ОАС у беременных:
- Избыточный вес.
- Ограничение подвижности диафрагмы в III триместре беременности.
- Вазомоторный ринит беременных.
- Изменение обмена инсулина и лептина.
- Более выраженная сосудистая реакция на гипоксию и адреналин.
- Высокий риск повышенного АД.
- Сужение диаметра ВДП [34–36].
Неблагоприятные факторы влияния ОАС матери на плод:
- Негативное влияние перемежающейся гипоксии.
- Материнские пробуждения.
- Негативное влияние адреналовых выбросов.
- Возможное развитие фетоплацентарной недостаточности вследствие эндотелиальной дисфункции.
Распространенность ОАС у беременных:
- В общей популяции беременных около 10%.
- В группах риска (избыточный вес, повышенное АД перед беременностью, аномалии развития лицевого скелета) около 20%.
- Реже встречается апноэ, чаще симптом избыточного сопротивления верхних дыхательных путей [35].
Показания к обследованию:
- Наличие ОАС в анамнезе.
- Наличие клинических маркеров ОАС.
- Избыточная дневная сонливость.
- Инсомния.
- Синдром беспокойных ног (от 15% во II триместре до 27% в III триместре).
- Синдром хронической усталости.
- Избыточный вес перед беременностью.
- Аномальная прибавка веса.
- Частые ночные пробуждения.
- Аномалии развития лицевого скелета (микрогнатия, ретрогнатия, «кроличьи зубы»).
- Патология ЛОР-органов (искривление носовой перегородки, гипертрофия раковин, полипоз носа).
- Появление тяжелого храпа и остановок дыхания во сне.
- Артериальная гипертензия [35, 37].
Исследование с участием 220 беременных показало, что обструктивное апноэ сна, диагностированное по Берлинскому вопроснику, сопровождается АГ независимо от наличия ожирения. В этом исследовании у беременных, не имеющих ожирения (индекс массы тела – ИМТ <30 кг/м2), частота преэклампсии была значительно выше среди тех, у кого диагностировалась ОАС (скорректированное отношение шансов – ОШ 6,58; 95% Cl 1,04–38,51; р = 0,035) [38].
 При этом следует учитывать серьезные ограничения по использованию ряда групп антигипертензивных препаратов у беременных, что сужает возможности адекватного контроля АД. При этом ОАС может вносить существенный вклад в формирование резистентности АГ.
При этом следует учитывать серьезные ограничения по использованию ряда групп антигипертензивных препаратов у беременных, что сужает возможности адекватного контроля АД. При этом ОАС может вносить существенный вклад в формирование резистентности АГ.
Дополнительно патогенетическая связь между апноэ и гипертензией во время беременности подтверждается позитивным влиянием постоянного положительного давления в дыхательных путях (СРАР-терапии) на уровень АД у беременных. Лечение ОАС у беременных должно проводиться по тем же принципам, что и при отсутствии беременности, хотя нельзя рекомендовать лечение преэклампсии с помощью СРАР-терапии в качестве рутинного метода [39].
3.4. Патофизиологические аспекты обструктивного апноэ сна
Для пациентов ОАС характерно регулярное сужение верхних дыхательных путей даже в состоянии бодрствования, о чем свидетельствуют исследования с применением различных методов имидж-диагностики. Это справедливо как для взрослых, так и для детей, страдающих ОАС. У последних наиболее узким отделом дыхательных путей является область перекрытия глоточной и нёбных миндалин. У пациентов ОАС дыхательные пути не только сужены, но и более подвержены деформации [40].
Фарингальный коллапс, сопровождающийся храпом, считается основной проблемой таких пациентов. Особенностью коллапса является его развитие во время глубокого сна и сна со сновидением. Дыхательное усилие во периоде сна здоровых лиц постоянно и регулярно. При явлениях апноэ сна незначительная обструкция ВДП (апноэ или гипопноэ) способна полностью прекратить эффективную вентиляцию [41].
Обструкция верхних дыхательных путей (ВДП) чаще происходит между внутренними носовыми отверстиями (хоанами) и задней стенкой глотки, позади нёбной занавески и мягкого нёба (велофарингс), позади корня языка (орофарингс) или в различных комбинациях первых двух. Реже наблюдается коллапс воздухоносных путей на уровне эпиглоттиса (рис. 3).
Снижение или падение тонуса отдельных или большинства из указанных мышц достоверно уменьшает просвет воздухоносных путей, приводит к их полному закрытию. В человеческом организме существуют важные взаимоотношения между строением воздухоносных путей, их просветом, размером и тонусом глоточных мышц-дилататоров (рис. 4).
Исследования по изучению различных проекций глоточного отдела дыхательных путей (ДП) показали, что пациенты ОАС как в период бодрствования, так и во время сна имеют анатомически малый глоточный размер [41, 42].
Несмотря на существующие анатомические препятствия, у большинства пациентов ОАС в состоянии бодрствования ВДП являются полностью проходимыми. Причиной тому является защитный механизм в виде повышенного тонуса мышц-дилататоров, например подбородочно-язычной мышцы.
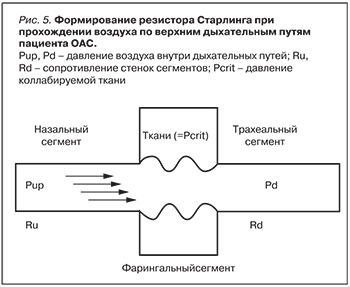
Объяснением является «модель равновесия сил». В рамках модели в состоянии бодрствования отрицательное (схлопывающее) давление преодолевается за счет активации мышц-дилататоров, обеспечивающих проведение необходимого дыхательного объема. Изучение механизмов коллапсов фарингального сегмента позволило предположить, что они совершаются по правилу резистора Старлинга и закону Бернулли. Критическое сужение сегмента существенно увеличивает скорость воздушного потока, что уменьшает внутреннее давление в этой зоне (рис. 5).
Таким образом, фарингальные коллапсы развиваются независимого от присасывающей силы диафрагмы, а их развитие инициировано дисбалансом воздухоносного (Pup) и тканевого давлений (Pcrit) [41].
Во время сна наблюдается уменьшение активности мышц-дилататоров верхних дыхательных путей (ВДП). В результате смещения равновесия происходит уменьшение просвета. Нейрогенный контроль активности двигательных нейронов ВДП является сложным. В нем активно участвуют нейромедиаторы, многие из которых подвержены воздействию сна. Наиболее важным для сна является серотонин (5-НТ). Серотонин является возбуждающим нейромедиатором, оказывающим стимулирующее действие на двигательные нейроны ВДП. Этот возбуждающий эффект в значительной степени опосредован подтипом серотонина 2А (5-НТ2А) [43]. Интересно, что лица с изначальным дефицитом серотонина (например, депрессия) предрасположены к развитию фарингальных коллапсов и апноэ во сне. К сожалению, рецепторы для агонистов 5-НТ2А не могут служить перспективной фармакологической мишенью у пациентов ОАС, поскольку такие препараты имеют значимые побочные эффекты, обусловленные активацией других нейронных путей.
Периодическое отсутствие вентиляции в период сна, происходящее по причине регулярных фарингальных коллапсов, приводит к нарушению газообменной функции у пациентов ОАС с формированием устойчивой ночной гипоксии (хронической ночной гипоксемии) и следующей за ней ночной гиперкапнией [44] (рис. 6).
Фактически возможно говорить синдроме дыхательной недостаточности (ДН) в период сна у пациентов ОАС, в то время как днем у такиx пациентов какие-либо его признаки могут полностью отсутствовать. Принято выделять условие, при котором наличие хронической ночной гипоксемии с гиперкапнией у пациентов считается важным в понимании патофизиологических последствий [44]:
A) SpO2 <90% более 5 мин времени сна с одномоментным падением <85%;
B) SpO2 <90% более 30% времени сна.
Наличие хронической ночной гипоксемии и результирующей гиперкапнии у пациентов ОАС тяжелого течения приводит к важным кардиоваскулярным последствиям (миокардиальной ишемии и сердечной недостаточности) [45].
Феномен циклической десатурации с быстрой реоксигенацией (рис. 7), известный как интермиттирующая гипоксемия, инициирует каскад механизмов повреждения эндотелия сосудов [46].
КЛЮЧЕВЫЕ ПОЛОЖЕНИЯ. БЛОК 2
Обстуктивное апноэ сна:
- Обстуктивное апноэ сна диагностируется у 10% взрослых.
- Распространенность ОАС растет в группе мужчин среднего возраста и у лиц, имеющих сердечно-сосудистые заболевания и метаболические расстройства (до 50%).
- Существует двунаправленная связь между ОАС и сердечно-сосудистыми заболеваниями.
- Причиной развития ОАС являются коллапсы гортанно-глоточной зоны вследствие анатомических особенностей и нейрогенных влияний. Метаболические расстройства (ожирение) и сердечно-сосудистые заболевания способствуют развитию ОАС.
- Установлена взаимосвязь между ОАС и АГ во время беременности и неблагоприятное влияние ОАС на плод и на развитие эклампсии.
- ОАС признается состоянием высокого сердечно-сосудистого риска.
4. РЕЗИСТЕНТНАЯ АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ И ОБСТРУКТИВНОЕ АПНОЭ СНА
4.1. Эпидемиология
Наличие причинно-следственной связи между обструктивным апноэ сна (ОАС) и АГ не вызывает сомнения [47]. В многочисленных исследованиях наличие апноэ/гипопноэ являлось независимым предиктором развития АГ, причем степень тяжести ОАС коррелировала с уровнем АД с исключением влияния таких конфаундеров, как возраст, ожирение, пол и т.д. [48, 49]. Так, в исследовании WSCS (Wisconsin Sleep Cohort Study) при индексе апноэ/гипопноэ (ИАГ) 15 соб./ч относительный риск развития АГ в течение 4 лет составил 2,89 в сравнении с ИАГ 0, также получена корреляционная связь между степенью тяжести ОАС и распространенностью АГ [48]. В исследовании Sleep Heart Health Study (6132 пациента) риск развития АГ увеличивался почти в 1,5 раза при наличии ОАС тяжелой степени [50].

В настоящее время ОАС признается как наиболее частая причина развития резистентной АГ. Эпидемиологические исследования свидетельствуют о наличии тесной связи между ОАС и неконтролируемой АГ: при повышении степени нарушений дыхания во время сна снижается вероятность достижения целевых уровней АД, несмотря на увеличение количества принимаемых антигипертензивных препаратов [51–56].
Доля пациентов с ОАС среди больных резистентной АГ, по данным различных исследований, достигает 64–83%. Впервые данная ассоциация была показана в работе Logan et al. (2001) среди больных с ожирением и истинно резистентной к терапии АГ, находившихся под наблюдением в университетской гипертензиологической клинике, 82,3% имели ОАС [57].
В работе R.P. Pedrosa et al. (2011) впервые была предпринята попытка комплексного обследования основных вторичных причин АГ у пациентов с РАГ и сравнения результатов двух центров при одинаковом дизайне исследования. После исключения пациентов с плохой приверженностью к терапии в исследование было включено 125 пациентов. Лабораторно-инструментальное обследование включало определение альдостерона и ренина плазмы, тесты на выявление первичного гиперальдостеронизма, определение функции щитовидной железы, методы визуализации (МРТ, КТ, допплерография и т.д.), полисомнографическое исследование. В результате проведенного анализа показано, что до 64% резистентности при АГ было связано с ОАС (рис. 8) [58].
Не зафиксировано статистически значимых отличий между двумя центрами в распространенности основных причин резистентности АГ. 6,4% пациентов с ОАС также имели другие причины вторичной АГ: первичный гиперальдостеронизм, заболевания почек, гипотиреоз, стеноз почечной артерии. Это подтверждает необходимость углубленного обследования больных с РАГ. В результате проведенного многофакторного анализа были выделены независимые предикторы ОАС среди пациентов с РАГ: мужской пол, охват шеи более 40 см, храп, метаболический синдром, возраст более 50 лет, нарушение суточного профиля САД и ДАД с повышением в ночные часы, ожирение [58].
4.2. Патогенетические механизмы формирования резистентности АГ при ОАС
В настоящее время не вызывает сомнения, что ОАС влияет на АД посредством механизмов, связанных с нейрогуморальной регуляцией (симпатоадреналовая система, активация РААС). Доказано усугубление поражения органов-мишеней при АГ, ассоциированной с ОАС, ускорение процессов сосудистого повреждения и атерогенеза на фоне нарушения функции эндотелия, активации процессов воспаления и оксидативного стресса. ОАС может приводить как к формированию АГ, так и усугублению существующей артериальной гипертензии, а также к формированию синдрома резистентности к антигипертензивной терапии [59].
У здоровых людей во время фазы медленного сна (в норме 85% от общего времени сна) активность симпатической нервной системы снижается и нарастает тонус блуждающего нерва, в результате чего снижается АД (dippers), уменьшается ЧСС, замедляются процессы метаболизма. Во время фазы быстрого сна (в норме 15% от общего времени сна) наблюдается физиологическая активация СНС с колебаниями ЧСС и АД [60, 61].
Пациенты с ОАС демонстрируют непрерывные значительные колебания гемодинамических параметров в течение ночи. АД, ЧСС, сердечный выброс постоянно флюктуируют из-за повторяющихся респираторных событий и частых изменений в цикле «сон‒бодрствование» (корковые микропробуждения). АД падает во время старта каждого эпизода апноэ, затем постепенно растет с пиковыми значениями в момент возобновления дыхания (восстановления проходимости дыхательных путей – микроактивация коры). АД может увеличиваться от 15 до 80 мм рт.ст. во время кортикального микропробуждения [62]. Эти колебания АД происходят под действием следующих механизмов, которые являются основой патогенеза ОАС: десатурация, гиперкапния, увеличение респираторного усилия с ростом отрицательного внутригрудного давления и микропробуждение в конце апноэ. Постоянное повторение этих стимулов каждую ночь приводят к функциональным изменениям в сердечно-сосудистой системе и структурному ремоделированию органов.

4.2.1. Гиперактивность симпатической нервной системы
Активация симпатической нервной системы (СНС) часто рассматривается как основной механизм повышения АД у пациентов с ОАС. Все патогенетические механизмы ОАС, особенно гипоксемические, гиперкапнические реакции, циклы гипоксемии/реоксигенации, провоцируемые эпизодами апноэ, повышают активность СНС. Хроническое повышение симпатической нервной активности ассоциировано с появлением, развитием и усугублением АГ у пациентов с ОАС [63].
К основным патогенетическим звеньям дисбаланса автономной нервной системы и активации СНС относят следующие:
- Во время эпизодов обструктивного апноэ происходит падение ударного объема (из-за повышения отрицательного внутригрудного давления), в результате которого снижается активация бароцепторов синокаротидной зоны, что приводит к активации сосудодвигательного центра, в результате увеличивается симпатическая импульсация. Кроме того, происходит прямое повреждение барорефлекторной зоны под воздействием циклов гипоксии/реоксигенации. Нарушение чувствительности барорефлекса к гипотензивным стимулам является постоянной детерминантой при ОАС и восстанавливается при длительной СРАР терапии.
- Гипоксия и в меньшей степени гиперкапния стимулируют центральные (продолговатый мозг) и периферические (аорта, синокаротидная зона) хеморецепторы. Повышенная импульсация от хеморецепторов возбуждает сосудодвигательный центр, в результате повышается симпатическая активность и снижается парасимпатическая (повышение АД и ЧСС). Показано, что тоническая активность хеморецепторов играет важную роль в развитии системной гипертензии у пациентов с ОАС.
- Уменьшается ингибирование центральной симпатической активности вследствие прекращения растяжения легочных рецепторов на вдохе (пульмональный барорефлекс).
- Фрагментация сна (микропробуждения с корковой активацией) напрямую увеличивает симпатическую нервную импульсацию и снижает активность блуждающего нерва [62‒64].
Особая роль в патогенезе вегетативных нарушений придается уменьшению чувствительности барорефлекса и повышению хеморецепторной импульсации, что напрямую приводит к повышению активности симпатических нервов в артериях, сердце и почках [62]. Как результат перечисленных процессов, мы наблюдаем постоянную флюктуацию АД и ЧСС [64, 65].
Также показано, что вибрационное воздействие во время храпа может приводить к прямому повреждению сонных артерий с нарушением каротидной барорефлекторной функции и хеморецепторной стимуляции и потенциально способствовать структурным изменениям с ускорением атеросклеротического поражения [66, 67].
В многочисленных исследованиях показано, что адренергическая стимуляция у пациентов с ОАС продолжается и в дневное время. Пациенты с ОАС демонстрируют постоянное повышение тонуса симпатической нервной системы. Данный факт доказан путем изучения концентрации норадреналина, норэпинефрила и мышечной симпатической активности посредством микронейрографии (muscle sympathetic nerve activity – MSNA) в группе ОАС. Показано устойчивое повышение симпатической нервной активности во время бодрствования при нормальной сатурации [68‒70]. Дисбаланс в вегетативной нервной системе с гиперактивацией СНС и снижением тонуса парасимпатического звена приводит к повышению ЧСС, снижению вариабельности сердечного ритма, повышению вариабельности АД, что является предикторами высокого сердечно-сосудистого риска. Симпатическая гиперактивация также оказывает прямое цитотоксическое действие, что проявляется повреждением кардиомиоцитов и проаритмогенными эффектами. Кроме того, ренальная симпатическая активация стимулирует выработку ренина в почках с запуском каскада РААС и повышением АД.
 4.2.2. Роль ренин-ангиотензин-альдостероновой системы
4.2.2. Роль ренин-ангиотензин-альдостероновой системы
Наличие взаимодействия обструктивного апноэ сна и активации РААС не вызывает сомнений, однако причинно-следственные связи до конца не выяснены. С одной стороны, ОАС приводит к активации РААС, и этот механизм лежит в основе резистентности АГ. С другой стороны, активация РААС с гипернатриемией и объемзависимыми механизмами приводит к задержке жидкости, в том числе в парафарингеальном сегменте, и усугублению дыхательных расстройств во время сна.
В недавнем метаанализе, посвященном изучению влияния ОАС на систему РААС, показано, что ОАС ассоциировано с повышением уровня ангиотензина II и альдостерона, особенно у пациентов с артериальной гипертензией, что подтверждает роль ОАС в развитии РАГ посредством активации нейрогуморальных систем [71]. Уровень ренина, по данным различных исследователей, в группе обструктивного апноэ сна либо не отличался от нормальных значений, либо был повышен и коррелировал со степенью тяжести ОСА [72‒73].
Повышение уровня альдостерона как у пациентов с РАГ, так и в группе РАГ и ОСА подтверждается во многих исследованиях [74‒77]. Впервые такая связь была отмечена в исследовании Calhoun et al., 2004, в котором обнаружена положительная корреляционная связь концентрации альдостерона в сыворотке крови с индексом апноэ-гипопноэ у пациентов с резистентной АГ в отличие от контрольной группы и группы больных АГ с целевыми значениями АД на фоне приема комбинированной антигипертензивной терапии [74]. В исследовании Gonzaga et al. также подтверждена связь между распространенностью и тяжестью ОАС и уровнем альдостерона: ОАС часто встречается у пациентов с РАГ, и тяжесть ОАС намного выше у пациентов с повышенным уровнем альдостерона [76].
Продемонстрировано увеличение частоты ОАС среди пациентов с гиперальдостеронизмом (18%) в сравнении с контролем (8,8%). Доказано, что риск ОАС увеличивается в 1,8 раз у пациентов с гиперальдостеронизмом даже при исключении влияния таких факторов, как пол, возраст, ИМТ, диабет, ХСН, раса. Это позволяет предположить, что повышение уровня альдостерона может являться причиной как развития резистентной АГ, так и прогрессирования дыхательных расстройств во время сна [78].
В одном из последних исследований Xiao Ke et al., 2017, на большом фактическом материале (534 пациента с резистентной АГ, средний возраст 57±11 лет, ИАГ 21,7±9,6) с использованием современных статистических методов (однофакторный регрессионный и многофакторный линейный регрессионный анализ) с исключением потенциальных конфаундеров окончательно подтверждена связь повышения уровня альдостерона и ОАС. Объем шеи, концентрация альдостерона в плазме, уровень альдостерона в суточной моче положительно ассоциировались с ИАГ независимо от таких факторов, как возраст, мужской пол, индекс массы тела (ИМТ), статус курения, активность ренина плазмы [79].
Несомненно, связь между ОАС и РАГ двунаправленная, двусторонняя. Ожирение и повышение альдостерона наиболее важные посредники (медиаторы) при этих состояниях.

С одной стороны, задержка натрия и жидкости – один из ведущих механизмов резистентности к терапии при АГ. Высокосолевая диета, гипернатриемия на фоне повышения альдостерона могут дополнительно приводить к увеличению количества межтканевой жидкости, в том числе и в верхних дыхательных путях. Задержка жидкости и ее перераспределение в горизонтальном положении из нижних конечностей к верхней части тела во время сна приводят к развитию отека тканей окологлоточного пространства, что предрасполагает к обструкции ВДП и развитию ОАС [54].
С другой стороны, повторяющиеся эпизоды гипоксемии активируют РААС с увеличением уровня альдостерона, что также может приводить к гипернатриемии и задержке жидкости [16, 80, 81]. Таким образом, патогенетический круг замыкается.
Ночное перераспределение жидкости из нижней части туловища с накоплением в области верхних дыхательных путей со снижением проходимости может играть значительную роль в патофизиологических механизмах у пациентов с РАГ и ОАС [82].
Объем шеи в дневное время точно не отражает ночные размеры верхних дыхательных путей. Кроме того, показано, что у пациентов с РАГ наблюдается большее перераспределение жидкости и большее сужение орофарингеальной области в ночные часы в сравнении с группой контролируемой АГ [83].
Исходя из вышеизложенного, не вызывает сомнения необходимость комплексного подхода к терапии описываемых расстройств: восстановление проходимости дыхательных путей, снижение веса, адекватная антигипертензивная терапия, воздействие на гиперволемию.
4.2.3. Нарушение механики дыхания: роль отрицательного внутригрудного давления
Правый желудочек. Безуспешные инспираторные усилия в момент обструкции ВДП приводят к нарастанию отрицательного внутригрудного давления (ВГД), что сопровождается увеличением венозного возврата к правому желудочку (ПЖ), увеличивая преднагрузку. Постнагрузка ПЖ также увеличена в условиях апноэ-индуцированной гипоксической пульмональной вазоконстрикции [84].
 Левый желудочек. В условиях объемной перегрузки ПЖ происходит смещение межжелудочковой перегородки в сторону левого желудочка (ЛЖ) во время диастолы, что уменьшает его объем. Отрицательное ВГД во время апноэ сна способно достигать величины 65 мм рт.ст. Кроме того, диастолическое наполнение ЛЖ уменьшается из-за нарушения его релаксации на фоне отрицательного ВГД. В результате увеличения разницы между экстракардиальным (отрицательное ВГД) и интракардиальным давлением растет трансмуральное давление ЛЖ, его конечно-систолический размер. Все вышеописанные механизмы вместе с периферической вазоконстрикцией приводят к увеличению постнагрузки ЛЖ. Пропорционально негативному ВГД во время обструктивных эпизодов комбинация сниженной преднагрузки и повышенной постнагрузки ЛЖ приводят к уменьшению ударного объема и фракции выброса левого желудочка. Вышеописанные гемодинамические нарушения в совокупности с изменениями ЛЖ, характерными для тяжелой АГ (гипертрофия, диастолическая дисфункция), предрасполагают к быстрому развитию сердечной недостаточности и нарушений ритма [85].
Левый желудочек. В условиях объемной перегрузки ПЖ происходит смещение межжелудочковой перегородки в сторону левого желудочка (ЛЖ) во время диастолы, что уменьшает его объем. Отрицательное ВГД во время апноэ сна способно достигать величины 65 мм рт.ст. Кроме того, диастолическое наполнение ЛЖ уменьшается из-за нарушения его релаксации на фоне отрицательного ВГД. В результате увеличения разницы между экстракардиальным (отрицательное ВГД) и интракардиальным давлением растет трансмуральное давление ЛЖ, его конечно-систолический размер. Все вышеописанные механизмы вместе с периферической вазоконстрикцией приводят к увеличению постнагрузки ЛЖ. Пропорционально негативному ВГД во время обструктивных эпизодов комбинация сниженной преднагрузки и повышенной постнагрузки ЛЖ приводят к уменьшению ударного объема и фракции выброса левого желудочка. Вышеописанные гемодинамические нарушения в совокупности с изменениями ЛЖ, характерными для тяжелой АГ (гипертрофия, диастолическая дисфункция), предрасполагают к быстрому развитию сердечной недостаточности и нарушений ритма [85].
Колебания интраторакального давления во время эпизодов апноэ создают трансмуральный градиент в предсердиях и желудочках, приводя к их растяжению. Предсердный натрийуретический пептид (ANP) и В-тип натрийуретического пептида (BNP) секретируются в ответ на растяжение предсердий и желудочков. Основные эффекты нутрийуретических пептидов связаны с воздействием на почки: расширение афферентной артериолы и сужение эфферентной артериолы с повышением внутриклубочкового давления и скорости фильтрации; снижение реабсорбции натрия в дистальном извитом канальце; ингибирование секреции ренина; снижение секреции альдостерона. Было отмечено повышение уровней натрийуретических пептидов, активация диуреза и натрийуреза у пациентов с ОАС. Уровень BNP у больных с нелеченным ОАС был повышен на 250%, особенно в ночные часы, и значительно снижался на фоне СРАР-терапии. Также отмечено повышение отношения натрий/креатинин в моче пациентов с ОАС в ночные часы. Поэтому пациенты часто жалуются на учащение мочеиспускания в ночной период [86, 87]. Снижение объема циркулирующей жидкости из-за усиления ночного диуреза, в свою очередь, стимулирует СНС и РААС (рис. 9).
4.2.4. Оксидативный стресс, системное воспаление и дисфункция эндотелия
Основной характеристикой ОАС являются интермиттирующие циклы гипоксии-реоксигенации, которые сходны с процессами ишемии/реперфузии при коронарной недостаточности по способности стимулировать образование активных форм кислорода (ROS – reactive oxygen species) и вызывать процессы оксидативного повреждения [88–90].
ROS, помимо прямого цитотоксического действия, запускают каскад воспалительных реакций. Гипоксия может также активировать ядерные транскрипционные факторы, включая ядерный фактор kВ (NF-kВ), который стимулирует выработку провоспалительных медиаторов и связанных цитокинов (фактор некроза опухолей альфа – TNF-α, интерлейкин-8 – IL-8). TNF-α принадлежит важная роль в воспалительном каскаде – экспрессия адгезивных молекул (молекула межклеточной адгезии – ICAM-I), которые потенцируют адгезию лейкоцитов к эндотелию, вызывая эндотелиальное повреждение. Активированные лейкоциты вырабатывают большое количество провоспалительных, адгезивных субстанций (ROS, провоспалительные цитокины, молекулы адгезии), которые приводят к формированию эндотелиальной дисфункции (нарушению эндотелийзависимой вазодилатации) с дальнейшим прогрессированием сосудистого повреждения и атерогенеза [91]. Гипоксические стимулы также стимулируют выработку эндотелина, циклические изменения уровня эндотелина во время интермиттриующей гипоксии в ночные часы ведут к развитию гипертензии [90, 92, 93].
В многочисленных исследованиях подтверждена связь воспалительных и оксидативных реакций, эндотелиальной дисфункции со степенью тяжести ОАС и коррекция этих изменений на фоне СРАР-терапии, что подтверждает ведущую роль гипоксии в оксидативном и воспалительном каскаде и сосудистом повреждении [89, 94–102].
У пациентов с РАГ и ОАС на фоне активации процессов оксидативного стресса и воспаления эндотелиальной дисфункции ускоряются процессы сосудистого повреждения с увеличением жесткости сосудистой стенки, ранним развитием атеросклеротического процесса, что ассоциировано с увеличением риска сердечно-сосудистых событий [103–105].
4.2.5. Хроническая болезнь почек, ОАС и РАГ-механизмы взаимного влияния
Наличие связи между ОАС и хронической болезнью почек (ХБП) не вызывает сомнений и в последних работах подтверждает двунаправленный характер взаимосвязи этих патологических состояний [106].
С одной стороны, ХБП увеличивает риск ОАС, с другой стороны, ОАС ускоряет прогрессию ХБП. Общим взаимно усугубляющим механизмом является развитие резистентной АГ, которое характерно для обоих патологических состояний.
 Показано, что до 50–70% больных с конечными стадиями ХБП (ESRD) имеют ОАС [107–109]. В ретроспективном когортном исследовании показано, что ОАС увеличивает риск развития ХБП в 1,94 раза и в 2,2 раза риск развития конечных стадий ХБП [110]. Также подтверждена корреляционная связь степени нарушения функции почек (скорость клубочковой фильтрации – СКФ) с ИАГ у пациентов со стабильной ХБП (СКФ <40 мл/ мин) [111]. Многие исследования показывают связь альбуминурии как независимого фактора со степенью тяжести ОАС и коррекцию альбуминурии на фоне СРАР-терапии [112–114].
Показано, что до 50–70% больных с конечными стадиями ХБП (ESRD) имеют ОАС [107–109]. В ретроспективном когортном исследовании показано, что ОАС увеличивает риск развития ХБП в 1,94 раза и в 2,2 раза риск развития конечных стадий ХБП [110]. Также подтверждена корреляционная связь степени нарушения функции почек (скорость клубочковой фильтрации – СКФ) с ИАГ у пациентов со стабильной ХБП (СКФ <40 мл/ мин) [111]. Многие исследования показывают связь альбуминурии как независимого фактора со степенью тяжести ОАС и коррекцию альбуминурии на фоне СРАР-терапии [112–114].
Почка – это основной эффекторный орган, регулирующий АД посредством активации РААС и симпатической активности, поддержания водно-солевого баланса. Поэтому артериальная гипертензия при ХБП – мультифакториальный феномен с частым формированием резистентности к антигипертензивной терапии [115]. ХБП и ОАС также часто ассоциированы с артериальной гипертензией, и эти состояния имеют общие патофизиологические механизмы:
- объемзависимые механизмы: задержка жидкости – это один из основных механизмов резистентности АГ и усугубления ОАС у пациентов с ХБП;
- активация симпатической нервной при ОАС, с одной стороны, способствует формированию резистентной АГ, с другой – напрямую приводит к почечному повреждению и формированию ХБП;
- повышение уровня альдостерона – ключевой фактор взаимосвязи между ОАС и АГ, который приводит к прогрессированию ХБП.
Неконтролируемая АГ сама по себе является фактором риска формирования ХБП, а нарушение функции почек приводит к перегрузке объемом и усугублению ОАС.
Таким образом, в рутинной клинической практике необходимо проводить скрининг и наблюдение за функцией почек в динамике у пациентов с РАГ и ОАС, помимо лечения ОАС и коррекции антигипертензивной терапии целесообразно активное внедрение нефропротективных стратегий. Необходимы дальнейшие исследования данной трехсторонней связи, которые могут поставить новые цели в ведении пациентов с ОАС, РАГ и ХБП.
5. КЛИНИКО-ФУНКЦИОНАЛЬНЫЕ ОСОБЕННОСТИ РАГ, АССОЦИИРОВАННОЙ С ОАС
Подтверждены следующие клинико-функциональные характеристики АГ у пациентов с ОАС:
- Высокая частота изолированной диастолической АГ [116–118].
- Высокая вариабельность АД и снижение вариабельности сердечного ритма [119, 120].
- Изменение циркадного ритма АД с увеличением количества пациентов, не снижающих или повышающих АД в пассивный период (non-dippers, night-peakers). Показано, что до 84% пациентов с легким и среднетяжелым ОАС имеют нарушенный циркадный ритм АД (non-dippers) [121–124].
При обнаружении вышеописанных изменений при анализе суточного мониторирования АД (СМАД) у пациентов с АГ необходимо предполагать наличие ОАС. Нарушение суточного профиля АД с повышением в ночной период является одним из механизмов, который может объяснить увеличение риска сердечно-сосудистых осложнений [22]. Повышение ночного АД,так же как недостаточное снижение АД в пассивный период, являются независимыми прогностическими факторами с большей значимостью, чем среднесуточное АД [125]. Кроме того, показана связь повышения ночного АД с субклиническим поражением органов мишеней при АГ [126–128].
КЛЮЧЕВЫЕ ПОЛОЖЕНИЯ. БЛОК 3
РАГ и ОАС. Эпидемиология, патогенез, клинико-функицональные особенности АГ:
- ОАС – наиболее частая причина развития резистентной АГ. Доля пациентов с ОАС в популяции РАГ достигает 64–83%.
- Основные патогенетические механизмы формирования резистентности АГ при ОАС: гиперактивация СНС, активация РААС (повышение уровня альдостерона), нарушения центральной гемодинамики из-за колебаний внутригрудного давления, сосудистое повреждение.
- Нейрогуморальная активация при РАГ с гипернатриемией и гиперволемией усугубляют тяжесть ОАС из-за задержки жидкости в орофарингеальной области.
- Нейрогуморальная активация и гемодинамические нарушения при ОАС и РАГ приводят к ремоделированию с развитием гипертрофии ЛЖ и ПЖ, диастолической дисфункции и быстрому развитию сердечной недостаточности и нарушений ритма.
- ОАС характеризуются активацией оксидативного стресса, системного воспаления, быстрым развитием дисфункции эндотелия с ускорением процессов сосудистого повреждения, что приводит к увеличению жесткости сосудистой стенки и раннему атеросклерозу.
- Клинико-функциональными характеристиками АГ при ОАС являются высокая частота изолированной диастолической АГ; высокая вариабельность АД со снижением вариабельности сердечного ритма; изменение суточного профиля АД с увеличением non-dippers и night-peakers.
6. АЛГОРИТМЫ ДИАГНОСТИКИ ОБСТРУКТИВНОГО АПНОЭ СНА
6.1. Клинические симптомы ОАС
В реальной клинической практике интернисты очень редко рассматривают ОАС как причину резистентности к проводимой антигипертензивной терапии. По данным различных исследователей, доля пациентов с недиагностированной ОАС при резистентной АГ достигает 90% [29, 57, 79, 129].
Именно поэтому в алгоритм диагностики резистентной АГ необходимо включать опросники для первичной диагностики ОАС и при подозрении на наличие дыхательных расстройств во время сна назначать необходимые инструментальные исследования.

В клинических рекомендациях Европейского респираторного общества и Европейского общества по изучению артериальной гипертонии «Сочетание обструктивного апноэ сна и артериальной гипертензии» 2013 г. сформулированы следующие признаки, позволяющие предположить наличие ОАС у пациента с АГ [130].
Клинические симптомы, характеристики и объективные данные, позволяющие с высокой вероятностью предположить ОАС (адаптировано из Parati G., Lombardi C., Hedner J. et al. ERS / ESH Task Force Report. Recommendations for the management of patients with obstructive sleep apnoea and hypertension. Eur. Respir. J. 2013)
Клинические симптомы, связанные с ОАС:
Ночные:
- эпизоды апноэ, засвидетельствованные очевидцами;
- частый и громкий прерывающийся храп;
- сухость во рту;
- жажда по ночам;
- никтурия;
- удушье и дискомфорт при дыхании по ночам;
- прерывистый сон;
- потливость и заложенность носа, в основном по ночам;
- семейный анамнез ночного храпа и апноэ сна.
Дневные:
- повышенная дневная сонливость;
- дневная усталость;
- нарушение концентрации внимания;
- плохая переносимость монотонной работы;
- боль в горле по утрам;
- головная боль, в основном по утрам.
Частые клинические признаки:
- мужской пол;
- женщины постменопаузального возраста;
- избыточная масса тела, в основном центральное ожирение;
- сердечно-сосудистые заболевания в анамнезе (ИБС, инсульт, ХСН);
- особенности верхних дыхательных путей (увеличение глоточных миндалин и язычка, аденоиды, макроглоссия, III стадия по классификации Фридмана);
- ретрогнатия.
Патология сердечно-сосудистой системы:
- рефрактерная АГ (вероятность ОАС 50–80% и выше);
- АГ, сохраняющаяся в ночное время (non dippers);
- гипертрофия ЛЖ;
- генерализованный атеросклероз;
- ночная бради и тахикардия, синоаурикулярная и атриовентрикулярная блокады во время сна, суправентрикулярная и желудочковая экстрасистолия во время сна, фибрилляция предсердий, пароксизмальная фибрилляция предсердий в ночное время;
- метаболические нарушения (ожирение, нарушение углеводного обмена).
6.2. Диагностика обструктивного апноэ сна у пациентов АГ
Диагноз обструктивного апноэ сна основан на сочетании симптомов, клинических данных и параметров сна и дыхания в течение ночи. Нарушения дыхания во время ночного сна подробно описаны в международных клинических рекомендациях [131].
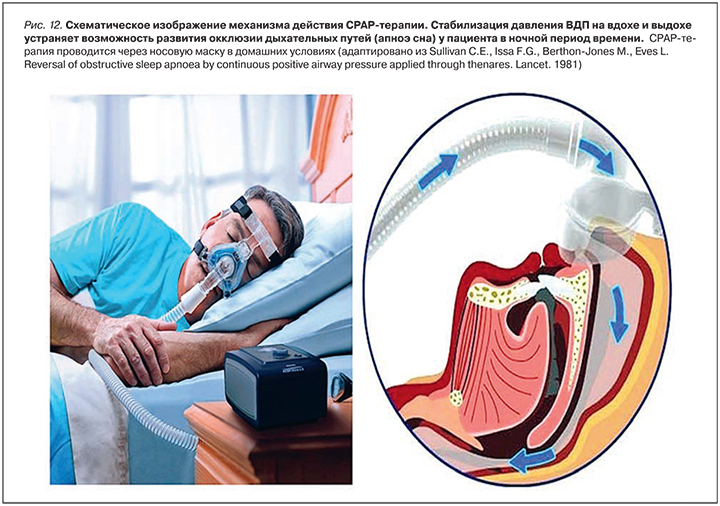
При оценке клинических проявлений ОАС в повседневной практике у пациентов АГ можно использовать специальные вопросники. Принято выделять клинические симптомы и маркеры заболевания, которые для удобства клинической верификации оценивают в баллах (шкала STOP BANG) (табл. 7).
Низкий риск верификации обструктивного апноэ сна соответствует уровню 0–2 балла; средний риск – уровню 3–4 балла; высокий риск – уровню 5–8 баллов. Все пациенты АГ, имеющие средний и высокий риск верификации ОАС, должны быть подвергнуты специализированной аппаратной диагностике в амбулаторных или стационарных условиях [132].

Для верификации заболевания ОАС (уровень ИАГ >5 соб./ч) шкала STOP BANG имеет чувствительность 65,6% и специфичность 60%, в то время как для среднетяжелого течения ОАС (ИАГ>15 соб./ч) чувствительность 74% и специфичность 53%, а для тяжелого течения ОАС (ИАГ>30 соб./ч) чувствительность 80% и специфичность 49%.
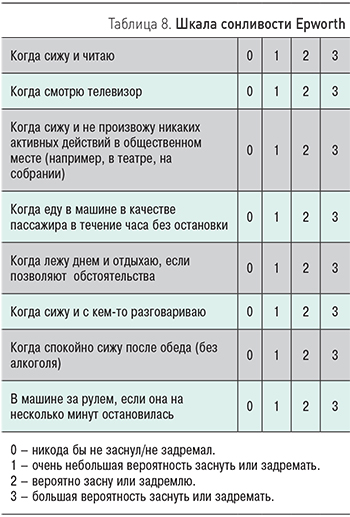
Для оценки выраженности дневной сонливости применяют шкалу Epworth (табл. 8).
Интерпретация: норма 0–7; легкая сонливость 8–11; умеренная сонливость 12–15; тяжелая сонливость 16–24.
6.3. Аппаратная диагностика обструктивного апноэ сна у пациентов с АГ
Методы диагностики ОАС включают полисомнографию (1-й и 2-й уровни), полиграфию (3-й уровень) и устройства с ограниченным числом каналов (4-й уровень) (табл. 9).
 Использование уровня 1 подразумевает наиболее высокую точность диагностики с возможностью дифференцировать эпизоды обструктивного апноэ от центрального апноэ и эпизодов периодического дыхания. При этом требуются специальные помещения и высокая квалификация медицинского персонала, связанная с интерпретацией данных ЭЭГ. При использовании уровня 2 требования к специально оборудованным помещениям отсутствуют. Относительно высокая стоимость исследований и дополнительные требования к уровню квалификации персонала делают нецелесообразным стартовое использование этих уровней. Предварительная оценка клинических маркеров ОАС, возможно, с дополнительной информацией о нарушении суточного ритма АД у больных РАГ по данным СМАД, позволяют с успехом использовать анкетирование и скрининг 4 уровня (рис. 10).
Использование уровня 1 подразумевает наиболее высокую точность диагностики с возможностью дифференцировать эпизоды обструктивного апноэ от центрального апноэ и эпизодов периодического дыхания. При этом требуются специальные помещения и высокая квалификация медицинского персонала, связанная с интерпретацией данных ЭЭГ. При использовании уровня 2 требования к специально оборудованным помещениям отсутствуют. Относительно высокая стоимость исследований и дополнительные требования к уровню квалификации персонала делают нецелесообразным стартовое использование этих уровней. Предварительная оценка клинических маркеров ОАС, возможно, с дополнительной информацией о нарушении суточного ритма АД у больных РАГ по данным СМАД, позволяют с успехом использовать анкетирование и скрининг 4 уровня (рис. 10).
Клиническое применение диагностического алгоритма возможно выполнить в стационарных и амбулаторных условиях, руководствуясь правилом предварительного отбора пациентов для диагностической процедуры (рис. 11) [133, 134].
КЛЮЧЕВЫЕ ПОЛОЖЕНИЯ. БЛОК 4
Диагностика ОАС при РАГ:
- Доля пациентов с недиагностированной ОАС при резистентной АГ достигает 90%.
- В алгоритм обследования при резистентной АГ необходимо включать опросники для первичной диагностики ОАС (шкала STOP BANG, шкала сонливости Epworth).
- При подозрении на ОАС (клинические маркеры, данные шкал) следует использовать аппаратные методы диагностики (полиграфия, полисомнография).
7. ТЕРАПЕВТИЧЕСКИЕ СТРАТЕГИИ У ПАЦИЕНТОВ С РАГ и ОАС
Лечение пациентов с резистентной АГ, ассоциированной с ОАС, должно быть комплексным и включать следующие позиции:
- изменение образа жизни (снижение массы тела, низкосолевая диета, ограничение алкоголя, аэробные физические нагрузки);
- антигипертензивную терапию;
- немедикаментозные методы лечения, направленные на восстановление проходимости дыхательных путей (СРАР-терапия, позиционное лечение, хирургическая коррекция верхних дыхательных путей, внутриротовые аппликаторы) [59].
7.1. Изменение образа жизни
Снижение массы тела. Несмотря на то что связь ОАС и АГ с ожирением очевидна, существует лишь ограниченное количество клинических исследований, подтверждающих влияние снижения массы тела на течение РАГ при ОАС и уменьшение степени тяжести дыхательных расстройств. В отдельных небольших исследованиях показано, что снижение массы тела на фоне различных вмешательств (диеты, лекарственной терапии, хирургических методов) приводило к уменьшению степени тяжести ОАС [135–137].
В работе С. Maki-Nunes et al. (2015) продемонстрировано, что редукция веса приводит к улучшению периферического и центрального хеморефлекса, тяжести ОАС и АД [138].
В недавнем рандомизированном исследовании сравнивались группы пациентов с редукцией веса, СРАР-терапией и комбинированным вмешательством. Терапия в течение 24 нед привела к максимальному снижению среднесуточного САД в группе комплексной терапии (-14,1 мм рт.ст.) в сравнении с монотерапией (-6,8 мм рт.ст. в группе снижения веса и -3,0 мм рт.ст. на фоне СРАР) [139].

Таким образом, только комбинация методов терапии (потеря веса и СРАР) способны значительно влиять на уровень АД.
Алкоголь. На фоне употребления алкоголя происходит снижение мышечного тонуса, в том числе верхних дыхательных путей, и подавляется реакция пробуждения во время эпизодов апноэ, что увеличивает степень тяжести ОАС. Кроме того, значительное употребление алкоголя способствует повышению АД и формированию резистентности к проводимой терапии.
Физические нагрузки. Известно, что аэробные физические нагрузки приводят к снижению АД. Однако данные об эффективности физических тренировок у пациентов с ОАС крайне ограниченны. Аэробные физические нагрузки должны входить в комплексную терапию пациентов с АГ и ОАС.
7.2. Антигипертензивная терапия при РАГ и ОАС
Так как неконтролируемая АГ является мощным предиктором сердечно-сосудистых осложнений, модификацию схем антигипертензивной терапии при РАГ, ассоциированной с ОАС, необходимо проводить максимально быстро и интенсивно, параллельно с подбором специфических методов терапии дыхательных расстройств и модификацией образа жизни.
7.2.1. Современные представления об антигипертензивной терапии при РАГ
В настоящее время не существует четких алгоритмированных подходов к подбору многокомпонентных схем антигипертензивной терапии при резистентной АГ. Первостепенное значение в этой ситуации имеет опыт врача, владение искусством комбинирования препаратов из основных и вспомогательных классов, индивидуализация терапии в соответствии с клиническим портретом пациента. Рекомендации по комбинированию препарата носят в основном эмпирический характер и основываются на сочетании лекарственных средств с различными механизмами действия. Наиболее рациональной с этой точки зрения является комбинация блокатора РААС (ИАПФ, АРА), блокатора кальциевых каналов (БКК) и тиазидного диуретика. Следующей ступенью является оптимизация диуретической терапии и добавление к схеме препаратов с другим механизмом действия ‒ β-адреноблокаторов (β-АБ), α-адреноблокаторов (α-АБ), центральных симпатолитических средств (моксонидин, рилменидин).
Краеугольным камнем антигипертензивной терапии при РАГ является оптимизация диуретической терапии. Известно, что одной из частых причин резистентности АГ является объемная перегрузка в связи с избыточной концентрацией натрия. Эффекты гипернатриемии принято разделять на прямые (объемзависимые механизмы, повышение чувствительности сосудистой стенки к прессорным агентам, повышение симпатической активности) и непрямые (нивелирование АД-снижающих эффектов антигипертензивных препаратов).
Основными принципами диуретической терапии при подозрении на резистентность являются:
- назначение тиазидного или тиазидоподобного диуретика в адекватных дозах;
- смена класса диуретика в соответствии с СКФ;
- назначение антагонистов альдостерона [1, 8, 11].
Как было сказано выше, АГ не может считаться резистентной, если в схему терапии не входит диуретик в адекватной дозе. При сохранении резистентности к терапии АГ на фоне многокомпонентной схемы терапии целесообразным считается включение в схему антагонистов минералокортикоидных рецепторов. При исключении первичного гиперальдостеронизма как причины резистентной АГ хороший ответ на антагонисты альдостерона объясняется наличием вторичного гиперальдостеронизма либо феноменом «ускользания» секреции альдостерона от раннего эффекта блокаторов РААС. Эффективность назначения верошпирона при резистентной АГ продемонстрирована в различных исследованиях. В работе F. Sousa et al. (2010) показано снижение САД/ДАД на 16/9 мм рт.ст. с достижением целевых цифр АД на фоне назначения 25‒50 мг спиронолактона [140]. Антагонисты минералокортикоидных рецепторов являются препаратами выбора для добавления к схеме терапии при РАГ с момента публикации результатов исследования PATHYWAY-2 [141].
Таким образом, применение спиронолактона в дозе 25‒50 мг в сутки следует считать необходимым компонентом терапии резистентной АГ.
7.2.2. Антигипертензивная терапия при РАГ, ассоциированной с ОАС
К сожалению, чрезвычайно мало работ, показывающих эффекты различных схем терапии при резистентной АГ в сочетании с ОАС. В предыдущих исследованиях в основном изучалась антигипертензивная эффективность различных препаратов в режиме монотерапии при контролируемой АГ.
Одна из старых работ Pelttari et al. (1998), посвященная антигипертензивной терапии у больных ОАС, была озаглавлена следующим образом: «Незначительный эффект традиционной антигипертензивной терапии на ночное АД у больных с дыхательными расстройствами во время сна». В этой и последующей работах действительно было показано изменение эффектов препаратов основных классов, традиционно используемых в терапии АГ, у пациентов с ОАС [142]. Тем не менее основные принципы антигипертензивной терапии (АГТ) можно сформулировать исходя из особенностей патогенеза (патофизиологические механизмы резистентности) и клинико-функциональных характеристик АГ при ОАС [143].
β-Адреноблокаторы, α-адреноблокаторы
Несмотря на отсутствие исчерпывающих данных об использовании β-адреноблокаторов при РАГ, ассоциированной с ОАС, назначение этого класса препаратов в комбинированных схемах оправдано исходя из их влияния на патогенетические механизмы АГ при ОАС (ингибирование симпатической активности и нормализация контроля автономной нервной системы).
Атенолол является наиболее исследованным β-адреноблокатором у пациентов с ОАС. Существуют относительные противопоказания к использованию неселективных β-адреноблокаторов (пропранолол), так как ранее было показано их отрицательное влияние на проходимость верхних дыхательных путей [122, 144].
В уже цитировавшейся работе Pelttari et al. (1998), в которой сравнивались различные режимы антигипертензивной терапии у больных ОАС, показано, что ДАД снизилось на 7 мм рт.ст. на фоне исрадипина, на 6 мм рт.ст. на фоне ИАПФ спираприла, на 3 мм рт.ст. при приеме гидрохлортиазида и на 12 мм рт.ст. на терапии атенололом [142]. Также показано, что атенолол обладает преимуществом в сравнении с эквивалентными дозами амлодипина, эналаприла, лозартана по степени снижения офисного ДАД и ночного ДАД и САД [145].
В последней работе Ziegler et al. (2017) сравнивались два режима антигипертензивной терапии у пациентов с АГ и ОАС: небиволол с титрацией от 5 до 10 мг и гидрохлортиазид 12,5–25 мг в сутки. На фоне приема небиволола произошло снижение офисного АД -11/-8 мм рт.ст. для САД и ДАД соответственно, в группе гидрохлортиазида -3/-1 мм рт.ст. (р <0,01), среднесуточное ДАД также значительнее снижалось на фоне небиволола. В дополнении были продемонстрированы и другие положительные эффекты небиволола: восстановление чувствительности барорефлекса, повышение вариабельности сердечного ритма, уменьшение сосудистой жесткости. Гидрохлортиазид осуществлял отрицательное статистически значимое воздействие на эти параметры. Авторы объяснили отсутствие клинически значимого эффекта на фоне приема тиазидового диуретика тем фактом, что у пациентов с ОАС и АГ происходит увеличение секреции предсердного натрийуретического пептида и дополнительное назначение тиазидового диуретика патогенетически не оправдано [146]. Так как постоянная активация СНС играет доминирующую роль в гипертензии у пациентов с ОАС, блокада адренорецепторов может быть особенно эффективной для снижения АД, и патогенетически оправданным является использование другого класса препаратов для контроля автономной нервной системы – α-адреноблокаторов. Однако, несмотря на снижение апноэиндуцированной симпатической активности на фоне применения доксазозина (дигитальная апноэзависимая вазоконстрикция), ночное САД и ДАД лучше контролировалось при использовании эквивалентных доз эналаприла [147]. В исследованиях у пациентов без ОАС ранее был подтвержден сопоставимый антигипертензивный эффект доксазозина и эналаприла при использовании в эквивалентных дозировках [148,149], что еще раз демонстрирует феномен инверсии антигипертензивной активности препаратов в условиях гипоксии, гиперкапнии и эпизодов десатурации/реоксигенации при ОАС.
Антагонисты РААС
Симпатическая стимуляция и натрийурез на фоне увеличения секреции натриуйретических пептидов при ОАС приводят к увеличению секреции ренина в почках. Однако данные об эффективности ИАПФ и БРА разноречивы, это соотносится с результатами некоторых исследований функционирования РААС при ОАС (низкий уровень ренина, высокий уровень ангиотензина II, гиперальдостеронизм). В одних работах показано преимущество ИАПФ (цилазаприл) и БРА [87, 150], в других преимущество препаратов других классов над блокаторами РААС [142, 145] либо сопоставимый антигипертензивный эффект [151–153].
При сравнении эффективности лозартана в группах пациентов с нелеченой АГ с ОАС и без дыхательных расстройств показана меньшая эффективность препарата у пациентов с ОАС, особенно в ночные и утренние часы. Также лозартан не оказывал влияния на уровень альдостерона в группе ОАС и значительно снижал его уровень в группе АГ без ОАС, что также подтверждает идею об изменении эффективности традиционных препаратов у больных АГ в сочетании с ОАС [154].
Существуют указания на ухудшение течения ОАС на фоне использования ИАПФ из-за нарушения проходимости верхних дыхательных путей. Описывается потенциальный механизм этого феномена: за счет повышения уровня брадикинина, который обладает провоспалительным и вазодилатирующим эффектами, может происходить потенцирование воспаления и накопления жидкости в верхних дыхательных путях. Причем данный феномен описан только для пациентов, у которых развивается кашель на фоне приема ИАПФ. Поэтому применение этих препаратов должно быть прекращено при развитии брадикининового кашля [87, 155].
Тем не менее необходимо принимать во внимание, что большинство пациентов РАГ и ОАС страдают метаболическим синдромом с нарушениями углеводного и липидного обменов, поэтому блокада РААС с максимальными органопротективными эффектами и влиянием на прогноз является обязательным терапевтическим вмешательством.
Диуретики
Тиазидовые диуретики (ТД) традиционно входят в схемы комбинированной терапии при РАГ, более того, наличие ТД наряду еще с двумя препаратами из других классов является критерием, определяющим наличие РАГ.
Подтверждено патогенетическое значение задержки натрия и гиперволемии не только при РАГ, но и при ОАС. С одной стороны, задержка жидкости – один из ведущих механизмов резистентной АГ. Во время сна перемещение жидкости из нижних конечностей приводит к перифарингеальному накоплению, сужению дыхательных путей и развитию ОАС [16, 80, 81].
С другой стороны, повторяющиеся эпизоды гипоксемии увеличивают активность РААС, что также ведет к увеличению натрия и задержке жидкости [16, 156].
Значительное уменьшение тяжести ОАС и снижение АД у пациентов с неконтролируемой АГ наблюдается после интенсификации диуретической терапии (увеличение дозы тиазидового диуретика метолазона и спиронолактона в два раза до 5 и 50 мг соответственно). Получена корреляционная зависимость между уменьшением ночных колебаний объема жидкости в нижних конечностях и снижением степени тяжести ОАС (уменьшение ИАГ) и объема шеи [157].
Однако при проведении сравнительных исследований антигипертензивных препаратов при ОАС тиазидовые диуретики показали меньший эффект в отношении снижения АД в сравнении с препаратами других классов [146, 142]. Меньшая чувствительность пациентов с ОАС к традиционной диуретической терапии объясняется повышением секреции натрийуретических пептидов в условиях перерастяжения камер сердца во время эпизодов апноэ с увеличением натрийуреза и диуреза. Пациенты с ОАС имеют собственную активную экскрецию натрия и осмотический диурез в ночные часы. Кроме того, наращивание доз тиазидовых и петлевых диуретиков в условиях гипоксии и симпатической гиперактивации может привести к ухудшению метаболического статуса пациентов и проаритмогенным эффектам.
Повышение уровня альдостерона и альдостерон-индуцированная задержка жидкости у пациентов с ОАС способна приводить к увеличению степени тяжести дыхательных расстройств и формированию резистентности АГ к проводимой терапии. Как известно, терапия спиронолактоном предпочтительна для выведения натрия и жидкости у пациентов с ОАС и РАГ и способна уменьшить обструкцию дыхательных путей и снизить АД.
В исследовании Lirui Yang et al. (2016) у пациентов с неконтролируемой АГ и ОАС на фоне приема антигипертензивных препаратов (ИАПФ, АРА, диуретики) присоединяли к терапии спиронолактон в дозе 20 мг с увеличением до 40 мг. Через 12 нед терапии индекс апноэ снизился с 20,4±17,2 до 8,4 ±7,4 (р <0,05 в сравнении с контрольной группой), индекс десатурации с 36,8±12,3 до 16,0±6,0 (р <0,05), офисное АД, среднесуточные дневные и ночные показатели СМАД также значительно снизились в группе терапии спиронолактоном в сравнении с группой плацебо [158].
В исследовании Kasai et al. (2009) показано, что интенсификация терапии диуретиками у пациентов с РАГ и ОАС приводит к уменьшению ИАГ с 57,7±33,0 до 48,5±2,2. Обнаружена обратная корреляционная связь между уменьшением ночного объема жидкости в нижних конечностях с редукцией ИАГ (r = –0,734; P <0,001) [157].
В недавнем метаанализе Khurshid et al. (2016), в котором изучались эффекты различных схем антигипертензивной терапии на степень тяжести ОАС, также показана более значительная динамика ИАГ на фоне использования схем с включением диуретиков, в том числе спиронолактона [159].
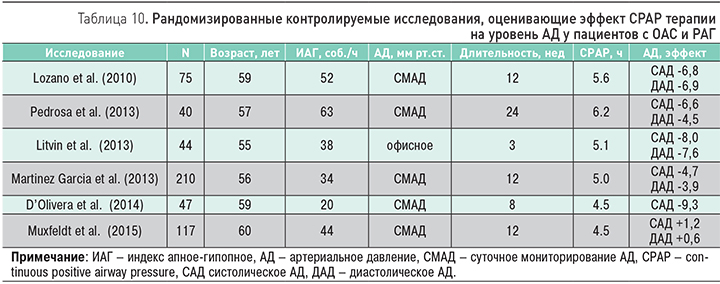
В работе Xiao Ke et al. (2017) на большом фактическом материале (543 пациента с РАГ, из которых 92,3% с ОАС, статистический анализ – многофакторный линейный регрессионный анализ с исключением потенциальных конфаундеров) показана связь степени тяжести ОАС с уровнем альдостерона. Кроме того, использование спиронолактона (не фуросемида и гидрохлортиазида) было связано с уменьшением индекса апноэ/гипопноэ независимо от таких факторов, как возраст, мужской пол, ИМТ, статус курения, активность ренина плазмы. Применение других препаратов-диуретиков, ИАПФ, БРА, антагонистов кальция не сопровождалось изменением степени тяжести дыхательных расстройств. Исследователи обратили внимание на экстремально низкую частоту использования спиронолактона в реальной клинической практике (около 15% пациентов с РАГ), что идет вразрез с рекомендациями по резистентной АГ [79].
Лишь в одной работе подтверждены эффекты другого антагониста минералокортикоидных рецепторов эплеренона у пациентов с РАГ и ОАС: добавление препарата к схеме антигипертензивной терапии привело с значительной редукции тяжести ИГА, объема шеи, АД, показателей жесткости сосудистой стенки [160].
Таким образом, оптимизация диуретической терапии с использованием комбинаций тиазидовый/петлевой диуретик + спиронолактон является основой терапии РАГ, особенно ассоциированной с ОАС.
Антагонисты кальция
Антагонисты кальция (АК) являются одним из пяти классов антигипертензивных препаратов, рекомендованных для лечения АГ как средство первого ряда. Этот класс препаратов часто входит в схемы комбинированной терапии при резистентной АГ.
Однако в настоящее время получены данные, что применение антагонистов кальция ассоциировано с нарушением сна среди пациентов с ОАС и АГ [161, 162].
В работе Fla´via B. Nerbassa et al. (2011) у 186 пациентов с РАГ и ОАС, которые получали антигипертензивную терапию различными классами препаратов (ИАПФ, БРА, диуретики, β-блокаторы и БКК), исследовались следующие параметры: общее время сна, эффективность сна с помощью полисомнографии. 39 пациентов получали БКК (амлодипин n=29; лацидипин n=2; дилтиазем n=8; верапамил n=4). Только возраст (р ≤0,001) и применение антагонистов кальция (р=0,037) были негативно и независимо связаны с общим временем сна. При одинаковом ИАГ и ИМТ пациенты на терапии БКК имели в среднем на 41 мин меньшую продолжительность сна (снижение на 10%) и ухудшение эффективности сна (находились большее время в фазе поверхностного сна), чем пациенты на терапии другими препаратами. В дополнение у пациентов на фоне терапии антагонистами кальция отмечалось в три раза больше время сна с сатурацией менее 90%, чем у пациентов других групп [161].
Авторы этого и других исследований делают следующий вывод: терапия АК негативно и независимо связана с короткой продолжительностью сна, со снижением его эффективности даже после коррекции на потенциальные конфаундеры, в том числе возраст с помощью многофакторный линейного регрессионного анализа. Другие антигипертензивные препараты не оказывали влияния на характеристики сна.
Существует несколько потенциальных механизмов, способных объяснить этот феномен:
- антагонисты кальция, подавляя гипоксическую вазоконстрикцию легочных сосудов, могут способствовать развитию гипоксии. Этот механизм был показан у пациентов с острой дыхательной недостаточностью на фоне терапии нифедипином [163];
- антагонисты кальция способны вызывать аккумуляцию жидкости в нижних конечностях в вертикальном положении за счет вазодилатации и активации капиллярной фильтрации в интерстиций. В ночные часы происходит перемещение жидкости из нижних конечностей в верхнюю половину туловища и легкие с отеком парафарингеальных тканей и усугублением ОАС.
Безусловно, для подтверждения полученных данных требуются дальнейшие исследования. У пациентов с РАГ антагонисты кальция традиционно входят в схемы антигипертензивной терапии. Однако мы должны понимать, что у пациентов с ОАС увеличение дозировок БКК является нежелательным и необходимо отменять эти препараты при первых признаках аккумуляции жидкости в нижних конечностях.
Принимая во внимание клинико-функциональные характеристики АГ при ОАС, целесообразно при назначении антигипертензивной терапии руководствоваться следующими принципами:
- использовать препараты с максимальной длительностью антигипертензивного эффекта для контроля АД в ночные часы;
- придерживаться принципов хронотерапии со смещением приема препаратов на вечернее время для улучшения контроля АД у пациентов с патологическим суточным профилем АД (non-dippers, nightpeakers);
- дополнительно назначать препараты короткой и средней длительности действия перед сном для предупреждения ночных подъемов АД;
- в качестве контроля эффекта антигипертензивной терапии необходимо использовать СМАД для оценки степени снижения АД в ночное время;
- использовать фиксированные комбинации антигипертензивных препаратов для улучшения приверженности к терапии.
При подборе схем антигипертензивной терапии следует принимать во внимание необходимость влияния на циркадные ритмы АД у пациентов с ОАС, стремиться к нормализации суточного профиля АД с максимальным влиянием на снижение АД в пассивный период. Использование принципов хронотерапии позволит перенести пик действия препаратов в наиболее уязвимый период максимального повышения АД. Недавний метаанализ показал, что каждое повышение ночного АД на 10 мм рт.ст. приводит к увеличению сердечно-сосудистого риска на 15% даже после контроля дневного АД [164].
В исследовании Alexandros Kasiakogias et al. (2015) показано, что перемещение приема препаратов (группа вальсартана и группа вальсартан + амлодипин) на вечернее время у пациентов с ОАС сопровождалось большим снижением офисного АД, ночного САД и ДАД и увеличением количества пациентов с нормальным суточным профилем АД (dippers) c 24 до 34% при утреннем приеме и до 64% при вечернем приеме препаратов [165]. Вечерний прием антигипертензивных препаратов способен улучшить контроль АД в популяции пациентов с резистентной АГ [166].
При планировании хронотерапии необходимо учитывать продолжительность действия используемых препаратов. При подобранной схеме АГТ и недостаточном контроле АД в ночные часы целесообразно присоединение препаратов с небольшой продолжительностью действия на ночь [59].
СМАД более информативно в сравнении с офисным АД и самоконтролем АД (СКАД) в диагностике и оценке эффективности терапии АГ у пациентов с хронической интермиттирующей гипоксией, в том числе с ОАС [167].
Исследования эффектов антигипертензивной терапии у пациентов с ОАС имеют целый ряд ограничений: малая выборка пациентов, часто отсутствие группы сравнения, различная методология, одноцентровые исследования, короткий период наблюдения. Исследований, посвященных изучению различных режимов АГТ при РАГ и ОАС, нет. В условиях отсутствия РКИ назначение АГТ должно происходить в соответствии с текущими рекомендациями по ведению АГ.
Однако получены данные о неэффективности, побочных действиях основных классов антигипертензивных препаратов у пациентов с РАГ и ОАС, которые невозможно не учитывать.
С другой стороны, в группе РАГ и ОАС рассуждения о преимущественном препарате ошибочны, так как пациенты с РАГ должны как минимум находиться на трехкомпонентной антигипертензивной терапии с обязательным включением в схему диуретика. Поэтому в случае РАГ и ОАС мы можем рассуждать только об оптимизации схемы АГТ – раннее включение спиронолактона, β-блокаторов, хронотерапия и т.д.
Кроме того, грамотно назначенная комбинированная антигипертензивная терапия с учетом патогенетических и клинико-функциональных особенностей АГ при ОАС способна не только улучшить контроль АД, но и уменьшить степень тяжести дыхательных расстройств.
Необходимы хорошо спланированные, многоцентровые, на больших выборках пациентов, с длительным периодом наблюдения, рандомизированные клинические исследования для того, чтобы дать подтвержденные рекомендации [168].
КЛЮЧЕВЫЕ ПОЛОЖЕНИЯ. БЛОК 5
Медикаментозная терапия РАГ и ОАС:
- У пациентов с РАГ и ОАС следует проводить коррекцию образа жизни (снижение массы тела, низкосолевая диета, ограничение алкоголя, аэробные физические назрузки).
- Получены данные о неэффективности, инверсии эффекта и побочных реакциях антигипертензивных препаратов при РАГ, ассооциированной с ОСА.
- Необходимо назначение комбинированной антигипертензивной терапии с обязательным включением в схемы диуретиков различных классов.
- Оптимизация диуретической терапии с использованием комбинаций тиазидовый/петлевой диуретик + спиронолактон является основой патогенетической терапии у пациентов с РАГ и ОАС.
- Грамотно назначенная АГТ способна не только стабилизировать АД, но и уменьшить степень тяжести ОАС. Показано уменьшение степени тяжести дыхательных расстройств при назначении комбинированных схем диуретической терапии с включением спиронолактона.
- Целесообразно раннее включение в схемы терапии β-адреноблокаторов как препаратов патогенетической терапии, показавших хороший антигипертензивный эффект в этой группе пациентов.
- У пациентов с ОАС и РАГ наращивание дозировок блокаторов кальциевых каналов является нежелательным, необходимо отменять препараты этого класса при первых признаках аккумуляции жидкости в нижних конечностях.
- Принципы антигипертензивной терапии при РАГ и ОАС: использовать препараты с максимальной продолжительностью действия для контроля АД в ночные часы; использовать хронотерапию; применять фиксированные комбинации для улучшения приверженности к терапии.
7.3. Ренальная денервация как метод преодоления резистентности при ОАС
В настоящее время в клинической практике используются два основных метода инвазивных нефармакологических вмешательств при РАГ – стимуляция барорецепторов каротидного синуса и денервация почек. Оба метода направлены на уменьшение симпатической гиперреактивности.
Радиочастотная абляция симпатических нервов почечных артерий до недавнего времени рассматривалась как наиболее эффективный метод нефармакологического вмешательства при РАГ. В европейских рекомендация по ведению АГ 2013 г. делается вывод о хорошей антигипертензивной эффективности этого метода воздействия, органопротективных эффектах и наибольшей перспективности в сравнении с другими инвазивными процедурами [1]. Однако по результатам исследования SIMPLICITYHTM-3 через 6 мес после вмешательства не получено статистически значимых отличий в динамике САД в группе активного лечения в сравнении с контрольной.
Среди возможных причин полученных результатов обсуждаются особенности состава исследуемой популяции, в частности, различия в эффективности в зависимости от этнической принадлежности; нечеткое соблюдение требований к стабильности комбинированной антигипертензивной терапии; дефекты техники проведения процедуры [169]. В результате дополнительного анализа исследования SIMPLICITYHTM-3 получено статистические значимое снижение уровня САД и ДАД при выделении группы пациентов с РАГ, страдающих ОАС, в сравнении с пациентами, не имеющими дыхательных расстройств (САД –17,0±22,4 vs. -6,3±26,1 мм рт.ст., р = 0,01) [170].
Wilkowski et al. (2011) исследовали эффекты ренальной денервации на ограниченной когорте пациентов с РАГ и ОАС. Показано значительное снижение САД и ДАД (-34/13/ мм рт.ст., р <0,01) и тенденция к снижению ИАГ (16,3 в исходе и 4,5 после терапии, р <0,059) [171].
Недавний метаанализ также показал, что ренальная денервация ассоциирована со значительным снижением ИАГ (-9,61 (95% ДИ 15,43–3,79), p = 0,001) через 6 мес после процедуры. Среди возможных механизмов снижения степени дыхательных расстройств обсуждаются уменьшение активации нейрогуморальных систем (СНС и РААС) со снижением реабсорбции натрия и гиперволемии с редукцией перифарингеального накопления жидкости [172].
Недавно представлены результаты последнего исследования SPYRAL HTN-OFF MED (2017) по изучению безопасности и эффективности снижения АД при использовании многоэлектродной системы ренальной денервации Symplicity Spyral. В исследование были включены пациенты с неконтролируемой АГ, не принимавшие ранее антигипертензивных препаратов или прекратившие прием медикаментов минимум за 4 нед до рандомизации. Пациенты были рандомизированы на группы, одна из которых проходила ренальную денервацию основных почечных артерий и их ветвей, вторая – sham-процедуру (иммитация процедуры). Показатели офисного АД и СМАД после денервации показали статистически значимое снижение по сравнению с исходным уровнем, в то время как в конрольной группе значимой динамики не отмечалось [173, 174].
Для включения ренальной денервации в схемы ведения пациентов с РАГ и ОАС необходимо проведение крупных рандомизированных клинических исследований.
7.4. Немедикаментозные методы лечения, направленные на восстановление
проходимости дыхательных путей. СРАР-терапия
7.4.1. СРАР-терапия: методология, аппаратура
Патогенетической терапией для пациентов ОАС является вентиляция легких с постоянным положительным давлением в дыхательных путях (СРАР-терапия) (от английского Continuous Positive Airway Pressure = СРАР) [175], по своей сути являющаяся вариантом неинвазивной вентиляции легких (НВЛ) – методом искусственной вентиляции легких, при котором проведение воздуха в дыхательные пути осуществляется через естественные отверстия без использования дополнительных инвазивных инструментов (трубок, расширителей, держателей). Использование носовых или лицевых масок позволило с легкостью применять указанный метод у пациентов ОАС в стационарных и амбулаторных условиях. На сегодняшний день СРАР-терапию выделяют в отдельную категорию – респираторную поддержку, поскольку она способна устойчиво контролировать просвет ВДП без влияния на дыхательный рисунок пациента (не требует синхронизации пациента с дыхательным оборудованием) [176] (рис. 12).
В успехе СРАР-терапии принципиальное значение имеют вопросы приверженности пациентов к этому виду лечения. Для преодоления низкого комплайенса и достижения необходимой эффективности необходимо учитывать ряд важных позиций:
- Разьяснение пациентам механизмов действия СРАР-терапии и правил использования аппаратов (подробный инструктаж пациентов по использованию приборов, плотное прилегание маски во избежание утечек воздуха, регулярное использование прибора в ночное время – не менее 4 ч в ночь, не менее 6 ночей в неделю, контроль увлажнения воздушной смеси, поведение при прерывании процедуры в ночное время, регулярный контроль качества и эффективности процедур, правила обработки аксессуаров и замены фильтров).
- Подбор маски. Для проведения СРАР-терапии используют носовые канюли, носовые и носоротовые маски с силиконовой прокладкой и регулируемой системой фиксации. Подбор маски должен проводится квалифицированным персоналом с учетом лицевых анатомических размеров с использованием специальных лекал, состояния носового дыхания (при нарушении проходимости преимущество имеют носоротовые маски) и удобства пациента. Системы фиксации должны быть настроены с учетом минимизации утечек воздуха и максимального удобства для пациента.
- Выбор аппарата для СРАР-терапии. В настоящее время практически не используются неавтоматизированные СРАР-аппараты. Современные устройства (autoCPAP) на основании регулярного измерения сопротивления воздушному потоку автоматически подбирают подаваемое давление на вдохе и выдохе в диапазоне от 5 до 20 см вод.ст. Современные устройства оснащены картами памяти, анализ которых при использовании соответствующих программ позволяет врачу оценивать эффективность СРАР-терапии по целому ряду параметров: уровеню ИАГ каждую ночь, времени и регулярности использования прибора, утечке воздуха из-под маски, среднему подаваемому давлению на вдохе каждую ночь и за весь период наблюдения, эпизодам апноэ без обструкции (центральное апноэ или периодическое дыхание). Принципиально важным является возможность приборов поддерживать режимы плавного изменения давления между фазами дыхания (режимы A-flex, E-adapt и др.). Другими дополнительными факторами выбора приборов являются портативность, низкий вес, возможность использования при отсутствии сети, малошумность и цена.
- Использование пробной терапии. Разумно использование пробной терапии в течение 5–7 дней после подбора аппарата и аксессуаров. Это позволяет объективно оценить эффективность терапии по уровню ИАГ, среднему давлению и утечкам, а также оценить приверженность пациента на основании удобства, времени и регулярности использования аппарата. В ряде случаев может потребоваться дополнительный инструктаж или замена аппарата или аксессуаров.
7.4.2. Влияние СРАР на уровень АД
В многочисленных исследованиях продемонстрирована эффективность этого метода лечения в коррекции дыхательных расстройств и снижении АД. Показана различная степень снижения АД на фоне СРАР-терапии от минимальной до значительной. У некоторых пациентов редукция АД составляет более 10 мм рт.ст., другие демонстрируют отсутствие динамики или рост АД. Показано, что 25–30% пациентов, использующих СРАР-терапию более 4 ч в течение ночи, не имеют положительного эффекта в отношении АД.
Результаты исследований по антигипертензивной эффективности СРАР у пациентов с контролируемой АГ
Многочисленные исследования, включающие пациентов с ОАС, как страдающих АГ, так и нормотоников, продемонстрировали различные антигипертензивные эффекты СРАР-терапии. В частности, показано отсутствие влияния на АД СРАР-терапии у нормотензивных пациентов [177, 178]. Некоторые исследования демонстрируют отсутствие динамики АД при использовании СРАР у больных АГ в группе без клинической картины ОАС (отсутствие дневной сонливости) [179].
В когортах пациентов с контролируемой АГ антигипертензивный эффект СРАР-терапии был минимальным. Показано снижение среднего САД как в активный, так и в пассивный период в диапазоне 1,9–3,3 мм рт.ст. и ДАД 1,1–2,5 мм рт.ст., в среднем около 2 мм рт.ст. [180–182].
Недавний метаанализ 7 рандомизированных исследований продемонстрировал, что СРАР-терапия значимо снижает САД (около 2,32 мм рт.ст.) и ДАД (около 1,98 мм рт.ст.). Авторы отметили, что СРАР приводит к более значительному снижению САД ночью и что пациенты с неконтролируемой АГ получают больше преимуществ от лечения [183].
Метаанализ, включивший 31 РКИ, продемонстрировал снижение САД и ДАД на 2,2±0,7 и 1,9±0,6 мм рт.ст. в дневной период и на 3,8±0,8 и 1,8±0,6 мм рт.ст. в ночной период. Метарегрессионный анализ показал наличие связи между степенью тяжести ОАС (индекс апноэ-гипопноэ) и степенью снижения АД [184].
Основными предикторами ответа на СРАР являются хорошая приверженность к терапии [184, 185, 186, 188, 189], степень тяжести ОАС (высокий ИАГ) [187–189], наличие и тяжесть сонливости [184, 186] и высокий уровень исходного АД [184, 187].
Кратковременное прерывание СРАР-терапии у пациентов, длительно леченных с хорошей приверженностью к терапии, – идеальная модель для подтверждения эффектов СРАР. В работе E.I. Schwarzetal (2016) группа пациентов с отменой терапии сравнивалась с группой, продолжающей СРАР. Перерыв в терапии в течение 2 нед ассоциировался со статистически значимым увеличением САД и ДАД на 9,0 и 7, 8 мм рт.ст. соответственно при использовании самоконтроля АД в домашних условиях и на 5,4 и 5,0 мм рт.ст. при офисном измерении. Также показан рост экскреции катехоламинов с мочой, усугубление эндотелиальной дисфункции на фоне отмены СРАР [190].
Результаты исследований по антигипертензивной эффективности СРАР у пациентов с резистентной АГ
Единственная когорта пациентов, у которой польза от применения СРАР-терапии не вызывает сомнений, – это пациенты с неконтролируемой и резистентной АГ. Метаанализ 28 рандомизированных исследований показал, что пациенты с неконтролируемой АГ в исходе продемонстрировали более значительную редукцию АД на фоне СРАР даже после исключения влияния таких факторов, как степень тяжести ОАС и наличие дневной сонливости [187]. В табл. 10 приведены результаты исследований по применению СРАР-терапии у пациентов с ОАС и РАГ.
В работе Lozano et al. (2010) подтвержден эффект СРАР-терапии в группе пациентов тяжелой ОАС и РАГ. В группе комбинированной терапии (СРАР + антигипертензивная терапия) получено более значительное снижение ДАД в сравнении с группой медикаментозной терапии. Доля пациентов, не снижающих АД в ночной период, статистически значимо снизилась только в группе комбинированной терапии [191].
Исследование HIPARGO (рандомизированное многоцентровое открытое в параллельных группах) включало пациентов с среднетяжелой и тяжелой ОАС и РАГ. Также было произведено разделение на две группы: лекарственная терапия АГ и комбинированная (лекарственная терапия + СРАР). После 12 нед терапии более выраженное снижение АД (среднесуточные ДАД и среднее АД) отмечалось в группе комбинированного вмешательства. Произошло восстановление нормального циркадного ритма АД: доля пациентов, не снижающих АД в ночной период (non-dippers), снизилась на 10% в группе с использованием СРАР и увеличилась на 4,4% в группе лекарственной терапии. Показана положительная корреляционная связь между продолжительностью использования СРАР и антигипетензивным эффектом. Линейный регрессионный анализ показал дополнительное снижение АД на 1,3 мм рт.ст. при каждом дополнительном часе использования СРАР [192].
В работе Pedrosa et al. (2013) исследовалась эффективность СРАР у пациентов с РАГ, не имеющих до включения диагноз ОАС, в двух группах (изолированная лекарственная терапия АГ и лекарственная терапия + СРАР). Дневное, но не ночное САД и ДАД значительнее снижалось на фоне терапии СРАР в сравнении с контрольной группой. Также отмечалось увеличение доли пациентов, достигших целевого АД на фоне комбинированного вмешательства. Различий в динамике циркадного ритма АД показано не было [193].
В другом исследовании (Olivera et al.) – рандомизированное, двойное слепое исследование СРАР-терапии в сравнении с контрольной группой (иммитация СРАР) у пациентов с ОАС средней степени тяжести и РАГ. Обе группы получали антигипертензивную терапию, которая не изменялась в процессе наблюдения. Получено большее снижение среднесуточного САД в группе СРАР, также значительно снизилось офисное АД. Однако не отмечено динамики циркадного ритма АД в обеих группах [194].
В работе Muxfeldt et al. (2015) отмечена лишь тенденция к снижению офисного и ночного САД в группе СРАР + антигипертензивная терапия в сравнении с изолированной медикаментозной терапией [195].
В недавнем метаанализе показано влияния СРАР на офисное АД у пациентов с РАГ: САД и ДАД снизились на 7,21 и 4,99 мм рт.ст. (р <0,001) [196].
Таким образом, в клинических исследованиях по эффективности СРАР-терапии получены различные, подчас противоречивые данные. Это связано с целым рядом ограничений выполненных исследований, которые можно разделить на две категории:
- Различные когорты пациентов, включенных в исследование (возраст, пол, ИМТ, степень АГ и адекватность антигипертензивной терапии, степень тяжести ОАС, коморбидный фон).
- Методологические факторы – количество включенных пациентов, характер исследования многоцентровое или одноцентровое, наличие терапии, метод измерения АД (офисное измерение, СМАД), разница в продолжительности исследования, приверженность к СРАР терапии (длительность использования СРАР в течение ночи).
Обсуждаются следующие причины вариабельности ответа на СРАР:
- Различия в степени тяжести ОАС и АГ.
- Наличие или отсутствие дневной сонливости.
- Различия в приверженности к СРАР терапии (продолжительность использования ночью должна быть как минимум 5 ч).
- Различная чувствительность к девайсам, измеряющим АД (влияние СМАД на качество сна).
- Сопутствующий прием антигипертензивных препаратов и изменения дозировок и схем терапии во время исследования (нивелирование эффектов СРАР).
- Использование имитации СРАР в контрольной группе (sharm СРАР) – нет данных о влиянии этого метода на АД.
- Несовершенство методов измерения АД в ночной период.
При классическом суточном мониторировании АД в пассивный период производится измерение АД раз в 30 мин. Однако максимальное повышение АД у пациентов с ОАС происходит в период апноэ, которые наступают с разной периодичностью. В небольшом количестве исследованиях на малых выборках пациентов показано, что во время эпизодов апноэ у пациентов с тяжелой ОАС происходит драматическое повышение САД. К сожалению, СМАД не способно зарегистрировать эти флюктуации АД и отражать истинный средний уровень АД в ночной период у пациентов с ОАС. Необходимо внедрение новых методов измерения АД. Одним из таких методов является мониторирование при каждом ударе сердца (beat-to-beat), которое позволяет точно оценивать вариабельность АД. Недостатки метода: вариант инвазивного устройства мало применим к реальной клинической практике, а неинвазивные устройства имеют невысокую точность измерения АД из-за искажения пульсовой волны в периферических артериях. Для объективизации антигипертензивного эффекта лечения необходимо использование новых методов измерения ночного АД. Одним из таких методов является trigger sleep BP monitoring (TSP), при котором обеспечивается автоматически фиксированный интервал измерения в дополнении к кислород-триггерной функции. Инициация измерения АД программируется в момент падения сатурации ниже зафиксированной [197].
Основной проблемой использования СРАР является низкая приверженность к терапии, особенно в когорте пациентов, не испытывающих дневной сонливости и ухудшения качества жизни на фоне ОАС [298]. Многие пациенты либо прекращают лечение из-за недостаточной комфортности процедур, либо ограничивают время использования СРАР в течение ночи даже при правильно подобранных режимах терапии.
7.4.3. Дополнительные эффекты СРАР-терапии
Эффекты СРАР-терапии связаны не только со снижением АД, но и опосредованы через другие механизмы. СРАР-терапия редуцирует симпатическую нервную активность (мышечная симпатическая активность и уровень норэпинефрина) [49, 63, 199–201], системное воспаление, оксидативный стресс [202–203], улучшает функцию эндотелия (эндотелийзависимая вазодилатация) [102, 203]. На фоне 6-месячной СРАР-терапии показано улучшение показателей жесткости сосудистой стенки (индекс аугментации, скорость распространения пульсовой волны) [105].
В исследовании Fabio de Souza et al. (2017) впервые продемонстрировано, что СРАР-терапия снижает уровень альдостерона у пациентов РАГ и среднетяжелой и тяжелой ОАС. В исследование было включено 117 пациентов с РАГ на комбинированной антигипертензивной терапии: группа СРАР-терапии и контрольная группа (без СРАР-терапии). Показано снижение показателя суточной экскреции альдостерона в моче в группе СРАР. Этот эффект особенно выражен у пациентов с оптимальной приверженностью к терапии (использование СРАР ≥4 ч в течение ночи), имеющих неконтролируемую АГ, не использующих антагонисты минералокортикоидных рецепторов, менее ожирелых, со сниженном сатурацией во время сна и имеющих паттерн non-dipper [204].
Исследователями высказывается предположение, что эти дополнительные эффекты СРАР-терапии могут объяснить положительное воздействие этого метода терапии, в том числе влияние на сердечно-сосудистые риски.
7.4.4. Место СРАР в терапии ОАС и РАГ
При использовании антигипертензивной терапии даже на фоне грамотно подобранной многокомпонентной схемы не удается достичь целевого АД. Показано, что трехкомпонентная схема терапии с включением диуретика при РАГ и ОАС не способна контролировать АД [53, 129]. Поэтому максимально рано необходимо переходить к комбинированным вмешательствам с использованием СРАР.
При сравнении различных режимов терапии у пациентов РАГ и ОАС (многокомпонентная антигипертензивная терапия, СРАР и сочетание этих методов) был сделан вывод о преимуществе комбинированного воздействия на уровень АД. Сочетанное применение грамотно назначенной комбинации антигипертензивных препаратов и СРАР является лучшей терапевтической стратегией у этой группы пациентов [188, 191].
Ни один метод лечения в виде монотерапии не способен достичь целевого АД в популяции пациентов с РАГ и ОАС. Вывод: необходимо комплексное, многокомпонентное воздействие с использованием медикаментозных и немедикаментозных методов с обязательной модификацией образа жизни.
7.4.5. ОАС и риск сердечно-сосудистых осложнений. Влияние СРАР-терапии
Влияние ОАС на риск сердечно-сосудистых осложнений не вызывает сомнений. 10-летнее наблюдение за 235 пациентами с тяжелой ОАС показало 4-кратное увеличение риска сердечно-сосудистой смертности, после исключения возможных конфаундеров (коррекция по другим факторам сердечно-сосудистого риска) в сравнении с группой без дыхательных расстройств [31]. В другом исследовании показано 6-кратное увеличение риска общей смертности независимо от традиционных сердечно-сосудистых факторов риска [205].
В метаанализе X. Ge et al. (2013) на основании результатов шести проспективных исследований было выявлено, что ОАС является независимым предиктором сердечно-сосудистой смертности и риск летального исхода увеличивается пропорционально степени тяжести дыхательных расстройств. У пациентов, получающих адекватную терапию ОАС, сердечно-сосудистые риски такие же, как у лиц, не страдающих обструктивными апноэ сна [206]. Но вопрос о влиянии СРАР на сердечно-сосудистые риски остается открытым. При проведении краткосрочных исследований было показано, что увеличение продолжительности эффективной СРАР-терапии может привести к большему снижению сердечно-сосудистого риска. Однако результаты международного многоцентрового исследования SAVE (Sleep Apnea Cardiovascular Endopoints), в которое вошло 2717 пациентов в возрасте 45–75 лет с сердечно-сосудистыми заболеваниями и ОАС от умеренной до тяжелой степени с минимальной дневной сонливостью, не показали снижения риска кардиовасулярных событий на фоне СРАР-терапии в сравнении с группой контроля (иммитация СРАР не проводилась) [207]. Средняя продолжительность СРАР-терапии составляла 3,3 ч в сутки, только 42% исследуемых пациентов использовали прибор около 4 ч в сутки. У пациентов с большей приверженностью был достоверно ниже риск инсульта и комбинированной конечной точки из всех цереброваскулярных событий.
При обсуждении результатов исследования было высказано предположение, что причиной негативного результата данного исследования была недостаточная приверженность к терапии в группе активного лечения.
На основании результатов исследования SAVE не рекомендовано применение СРАР с единственной целью уменьшения количества сердечно-сосудистых осложнений у пациентов с подтвержденными сердечно-сосудистыми заболеваниями с бессимптомным течением ОАС.
Продолжается многоцентровое проспективное исследование ISAACC (CPAP in Patients with Acute Coronary Syndrome and Obstructive Sleep Apnea), целью которого является определение возможности СРАР-терапии в снижении риска возникновения ИМ, нестабильной стенокардии, инсульта или сердечной недостаточности у пациентов с обструктивным апноэ сна, поступающих в клинику по поводу острого коронарного синдрома.
КЛЮЧЕВЫЕ ПОЛОЖЕНИЯ. БЛОК 6
РАГ и ОАС: эффекты СРАР терапии:
- Патогенетической терапией при ОАС является СРАР-терапия.
- В группе пациентов РАГ, ассоциированной с ОАС, показано значительное снижение АД на фоне СРАР терапии, нормализация циркадного ритма АД.
- Эффект СРАР связан не только со снижением АД. Доказано уменьшение симпатической гиперактивации, редукция уровня альдостерона, снижение системного воспаления, оксидативного стресса, улучшение функции эндотелия и показателей жесткости сосудистой стенки.
- Сочетанное применение грамотно назначенной антигипертензивной терапии и СРАР является лучшей терапевтической стратегией у пациентов этой группы.
7.4.6. Оральные аппликаторы
Показан умеренный антигипертензивный эффект оральных аппликаторов (MAD – mandibular advancemend device, внутриротовые устройства) у пациентов с ОАС и АГ [208, 209].
В небольшом рандомизиролванном исследовании Phillips et al. (2013) при сравнении двух групп терапии СРАР и MAD обнаружен лучший комплайс при использовании оральных аппликаторов, снижение среднесуточного АД составило около 2–3 мм рт.ст. без статистически значимой разницы между группами [210].
В недавнем метаанализе 7 исследований также подтвержден умеренный антигипертензивный эффект этих устройств (- 2,7/2,4 мм рт.ст. для САД и ДАД) и сделан вывод о том, что оральные аппликаторы могут быть альтернативой СРАР у больных с легкой и умеренной ОАС [211]. Основное ограничение данного метаанализа – включение только обсервационных исследований. Работ по использованию оральных аппликаторов в группе РАГ и ОАС до настоящего времени не было.
Несмотря на продемонстрированные некоторые положительные эффекты оральных аппликаторов в снижении АД, крупные и продолжительные РКИ необходимы, чтобы подтвердить эти эффекты.
7.4.7. Другие методы
Показано, что использование компрессионного трикотажа на нижние конечности у пациентов с ОАС приводит к уменьшению накопления жидкости в области нижних конечностей в дневное время, что играет значительную роль в редукции степени тяжести ОАС, особенно у пациентов с РАГ [82]. Использование хирургических методов (увулопалатофарингопластика, стентирование мягкого нёба, склерозирование корня языка и др.) в настоящее время рассматривается как способ борьбы с храпом (причем не всегда адекватный), но не с ОАС. Хирургическая коррекция носового дыхания (коррекция искривленной носовой перегородки, конхотомия при выраженной гиперплазии носовых раковин, аденоидэктомия) показаны главным образом при значительном носовом сопротивлении для улучшения эффекивности и переносимости СРАР-терапии. Оправдано применение челюстно-лицевых пластических вмешательств при выраженных врожденных (микрогнатия) и приобретенных (травмы, послеоперационные осложнения) аномалиях лицевого скелета. Оценить эффективность методики электростимуляции подъязычного нерва пока не представляется возможным [221].
8. ЗАКЛЮЧЕНИЕ
Таким образом, при ведении пациента с резистентной АГ клиницист должен пройти сложный диагностический алгоритм с анализом всех возможных причин резистентности. Врач должен обладать достаточным объемом знаний для исключения вторичных АГ, хорошо ориентироваться в возможностях комбинированной фармакотерапии, но даже в этом случае успех не может быть гарантирован.
Все клиницисты, которые ведут пациентов с резистентной АГ, должны быть осведомлены о высокой распространенности ОАС в популяции пациентов с РАГ. Необходимо ясно понимать патофизиологическую составляющую этих проблем для лучшего планирования терапевтических стратегий, владеть диагностическими алгоритмами. Это мультидисциплинарная проблема, которая требует от клиницистов выходить за рамки их специальности.
«Золотым» стандартом терапии ОАС является СРАР в сочетании с адекватной комбинированной медикаментозной антигипертензивной терапией. Эффект снижения АД на фоне СРАР-терапии наиболее выражен именно у пациентов с РАГ. СРАР – наиболее эффективная терапия ОАС, но и с наибольшими проблемами приверженности к лечению, для повышения которой необходимо тратить достаточное количество времени для разъяснения клинических причин для использования СРАР и объяснять ожидаемые эффекты и преимущества в улучшении исходов.
Необходимы хорошо спланированные, многоцентровые, на больших выборках пациентов с длительным периодом наблюдения, рандомизированные клинические исследования, для того чтобы сформулировать более подтвержденные рекомендации.



