Митоген-активируемый/стресс-активируемый (MAPK/SAPK) молекулярный каскад играет важную роль в обеспечении реактивности иммунокомпетентных клеток (ИКК) к разнообразным внешним стимулам и запуске ответа острой фазы (ООФ). При этом реализация клеточных реакций в рамках ООФ проявляется активацией клеток, усилением продукции ими активных форм кислорода (АФК), антимикробных пептидов, а также цитокинов [1]. Синтезируемые в рамках ООФ цитокины, связываясь с соответствующими цитоплазматическими рецепторами и воздействуя через сигнальные пути, среди которых JAK/STAT-сигнальный путь, инициируют воспалительный ответ, служащий важнейшей стадией процесса саногенеза.
При этом инициация ООФ требует активации транскрипционных факторов NF-κB и АР-1, что обеспечивается протеинкиназами JNK и p38 [2, 3]. Вместе с тем в отдельных случаях стимуляция сигнального пути сопровождается инициацией процесса апоптоза, вызываемого отдельными цитокинами, входящими в семейство фактора некроза опухоли (ФНО), в частности ФНОα, TRAIL, TWEAK, BAFF и др. Продукция цитотоксическими Т-лимфоцитами и NK-клетками, отдельных представителей цитокинов семейства ФНО, определяет противоопухолевую резистентность организма [3, 4]. Вместе с тем в зависимости от конкретных условий данные факторы могут стимулировать клеточную пролиферацию и дифференцировку, способствовать опухолевому росту. При этом влияние данных факторов на процессы пролиферации находится под контролем внутриклеточных механизмов, эффекторами которых являются протеины р53 и белок ретинобластомы (RB), предупреждающие избыточную активацию данных процессов [5].
Таким образом, MAPK/SAPK-сигнальный путь играет важную роль в первичном клеточном ответе на внешние стимулы, от активности которого зависит дальнейшая судьба клетки и ее жизненный цикл. В связи с этим представляет интерес исследование зависимости между ключевыми молекулярными механизмами в зависимости от активности MAPK/SAPK-сигнального пути.
На основании вышеизложенного целью настоящего исследования стало изучение характера зависимости между уровнем фосфорилирования терминальной протеинкиназы р38, отражающей состояние сигнального пути и содержание в клетке компонентов, регулирующих процессы пролиферации, дифференцировки и клеточной гибели у реконвалесцентов внебольничной пневмонии (ВП).
МАТЕРИАЛ И МЕТОДЫ
В соответствии с целью настоящей работы обследованы 30 пациентов мужского пола с бактериальной ВП нетяжелого течения на 15–17-е сутки заболевания, перед выпиской из стационара. Средний возраст обследованных пациентов основной группы составил 25±5,5 лет. Контрольную группу составили 15 практически здоровых молодых лиц из числа доноров крови в возрасте от 20 до 33 лет (средний возраст 26±4,3 года).
Материалом для исследования служила венозная кровь, забиравшаяся в утренние часы из локтевой вены обследуемых лиц. Для проведения исследования внутриклеточных маркеров 1 мл цельной крови вносили во флакон, содержащий 4 мл среды DMEM, гепарин (2,5 ЕД/мл), гентамицин (100 мкг/мл) и L-глютамин (0,6 мг/мл). Подготовленные таким образом образцы помещались на 3 и 24 ч в термостат при 37 °C с последующим выделением на градиенте фиколл-верографина (ρ=1,077) мононуклеарных лейкоцитов (МНК) и приготовлением лизатов, для чего использовали 1 мл клеточной суспензии содержащей 0,5×106 МНК [6]. Выделенные таким образом МНК дважды отмывали в фосфатно-солевом буфере, после чего лизировали, используя буфер следующего состава: 10 mM Tris, pH 7,4; 100 mM NaCl, 1 mM EDTA, 1 mM EGTA, 1 mM NaF, 20 mM Na4P2O7, 2 mM Na3VO4, 1% Triton X-100, 10% глицерола, 0,1% SDS, 0,5% деоксихолата, 1 mM PMSF (матричный 0,3 М раствор в DMSO). В лизирующий раствор добавляли (ex tempore) 1% коктейля ингибитора протеаз (Sigma-Aldrich, США), выдерживали на льду (при t=+4–5 °C) в течение 15 мин. Ядерно-цитоплазматические лизаты центрифугировали в течение 10 мин при 15 000 об./мин, с последующим аликвотированием и замораживанием при -76 °С.
Подсчет клеток и анализ жизнеспособности осуществляли с помощью счетчика TC20 (Bio-Rad, США). Жизнеспособность клеток подготовленных культур составляла не менее 90%.
В приготовленных ядерно-цитоплазматических лизатах методом иммуноферментного анализа (ИФА) оценивали концентрацию протеина р53, а также уровень цитохрома С. Также в ядерно-цитоплазматических лизатах определяли уровень фосфорилирования ингибитора фактора транскрипции NF-κB – IκBα по серину в положении 32, уровень фосфорилирования по серину в положении 780 белка ретинобластомы, по серину в положении 133 транскрипционного фактора CREB, по тирозину в положении 1007⁄1008 рецепторной протеинкиназы JAK2, фосфорилированной по тирозину в положении 705 формы STAT3, и по тирозину в положении 694 STAT5А. Кроме того, оценивали уровень фосфорилирования по треонину/тирозину в положении 180/182 митоген-активируемой протеинкиназы р38α и уровень фосфорилирования по треонину/тирозину в положении 183/185 стресс-активируемой протеинкиназы JNK1/2. Уровень фосфорилирования исследованных факторов оценивали в условных единицах на 1 нг протеина (ед./нг).
В клеточных супернатантах определяли концентрацию растворимых рецепторов DR5, DcR3, а также лиганда рецептора лимфотоксина β (LIGHT), ФНО-подобного слабого индуктора апоптоза (TWEAK), ФНО-зависимого лиганда, индуцирующего апоптоз (TRAIL), фактора активации В-клеток семейства ФНО (BAFF), а также концентрацию антиоксидантов (АОС).
При проведении ИФА использовали наборы реактивов Cusabio Biotech (КНР). Анализ проводили на анализаторе Personal LAB (Adaltis Italia S.p.A., Италия).
Статистическую обработку проводили в программе Statistica 7.0. Результаты исследования представлены в виде среднего значения признака (x), медианы (Ме), 25 и 75 процентилей выборки (25%; 75%). Статистическую значимость (р) межгрупповых различий в несвязанных выборках оценивали с помощью U-критерия Манна–Уитни. Взаимосвязь показателей исследовали методом многофакторного регрессионного анализа.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование уровня фосфорилирования терминальной протеинкиназы MAPK/SAPK-сигнального пути р38 показало, что средний уровень активности данного фактора в МНК реконвалесцентов ВП составляет 0,16 ед./нг. Уровень, соответствующий 1-му и 4-му квартилям выборочной совокупности, составил 0,13 и 0,19 ед./ нг при величине медианы выборки 0,15 ед./ нг. Таким образом, результаты анализа позволили сформировать две группы исследования: с низким (подгруппа 1) и высоким (подгруппа 2) уровнем фосфорилирования протеинкиназы р38 в образцах. При этом в первую группу (n=16) были включены образцы клеточных культур с содержанием фосфорилированной формы р38 0,16 ед./нг и менее, во вторую (n=24) – образцы с уровнем фосфорилирования 0,2 ед./нг и более.
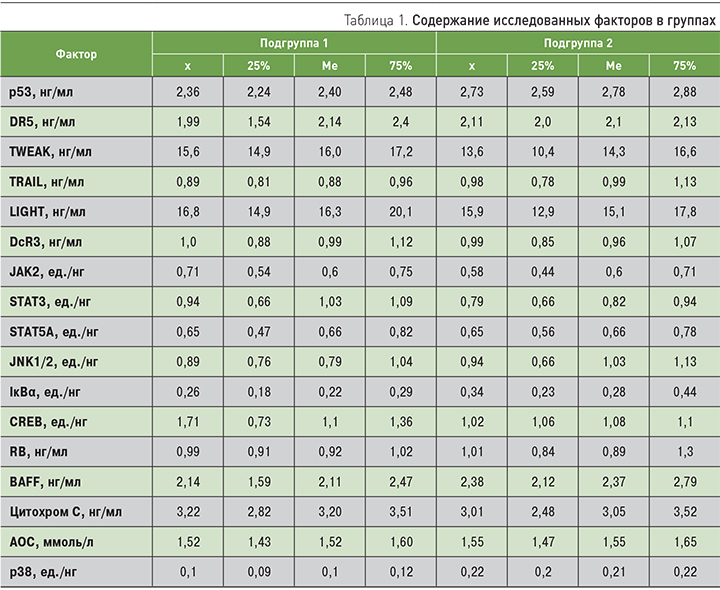
Содержание исследованных факторов в подгруппах представлено в табл. 1.
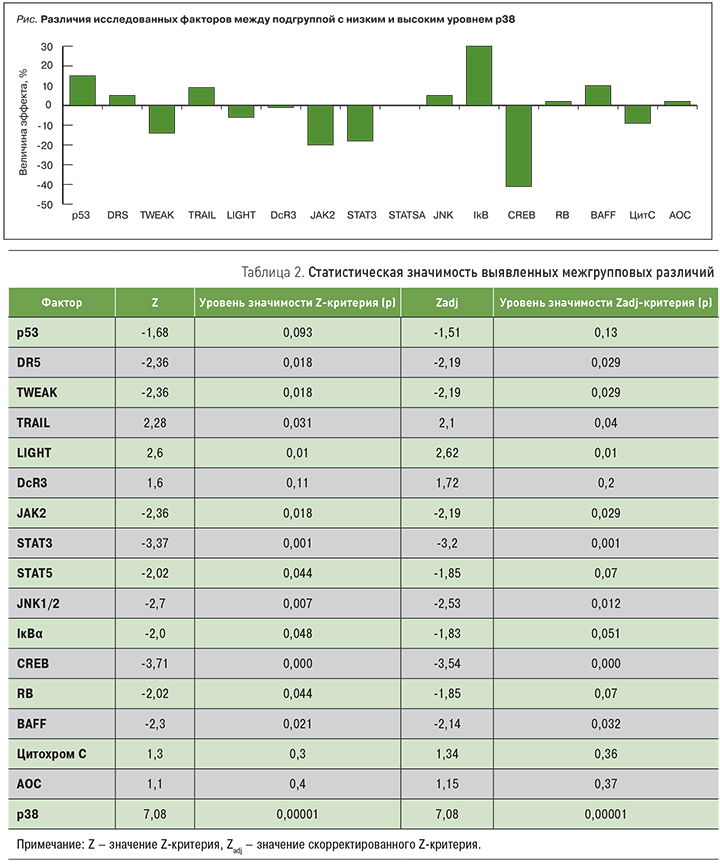
На рисунке представлено среднее значение различий уровня исследованных показателей в группах с максимальным и минимальным содержанием протеинкиназы р38α.
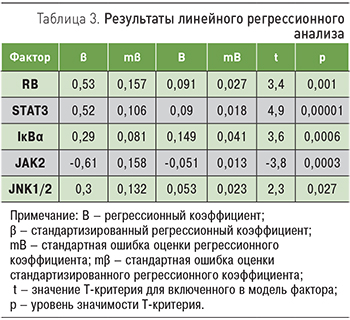 Статистическая значимость выявленных различий представлена в табл. 2.
Статистическая значимость выявленных различий представлена в табл. 2.
Результаты проведенного анализа свидетельствуют о том, повышение уровня фосфорилирования р38 ассоциировано со статистически значимым повышением экспрессии DR5, TRAIL, BAFF, RB, протеинкиназы JNK1/2 и IκBα, а также снижением уровня TWEAK, LIGHT, JAK2, STAT3 и CREB.
Исследование характера взаимосвязи между регуляторами апоптоза и р38 проведено методом линейного регрессионного анализа с пошаговым включением переменных в регрессионную модель. Результаты проведенного анализа представлены в табл. 3.
Результаты регрессионного анализа свидетельствуют о том, что коэффициент корреляции регрессионного уравнения (R), отражающий силу связи показателя активности протеинкиназы р38 с комбинацией факторов, включенных в модель, составил 0,96, коэффициент детерминации, определяющий долю изменчивости значений р38, объясняемую полученной математической моделью (R2), составил 0,93 (скорректированный коэффициент детерминации – 0,92), указывая на высокую степень взаимосвязи регуляторов апоптоза и активности р38.
Модель характеризуется статистической значимостью, на что указывает значение F-критерия (F=133,5; p <0,0000) и низкой корреляцией остатков (коэффициент Дарбина–Уотсона=1,16; коэффициент линейной корреляции остатков=0,42). Стандартная ошибка оценки модели 0,048 ед.
Анализ математической модели, в частности, стандартизированных коэффициентов корреляции, позволяет говорить о том, что наиболее значимая положительная взаимосвязь фосфорилирования р38 отмечается с уровнем фосфорилирования белка RB, а также STAT3. Менее выраженная взаимосвязь фосфорилирования р38 отмечается с уровнем фосфорилирования протеинкиназы JNK1/2 и ингибитора IκBα. Проведенный анализ также выявил отрицательную взаимосвязь фосфорилирования р38 и JAK2.
Результаты исследований свидетельствуют о том, что постклиническая фаза ВП сопровождается угнетением фосфорилирования компонентов JAK/STAT-сигнального пути, в частности STAT5A и STAT6, а также MAPK/SAPK-сигнального пути, в том числе протеинкиназы JNK, сопровождаясь при этом подавлением активности фактора транскрипции NF-κB на фоне дефицита антиоксидантов, отражающих дисрегуляцию системы АОЗ/ПОЛ у реконвалесцентов ВП.
В настоящем исследовании у реконвалесцентов ВП выявлены взаимосвязи фосфорилирования протеинкиназы р38 и регуляторов апоптоза. При этом установлена статистически значимая положительная взаимосвязь фосфорилирования р38 и уровня фосфорилирования белка ретинобластомы, STAT3, JNK1/2, IκBα, а также отрицательная с уровнем фосфорилирования протеинкиназы JAK2. Кроме того, в группах с низким и высоким уровнем р38 отмечается статистически значимое различие экспрессии DR5, TRAIL, BAFF, TWEAK, LIGHT, а также фосфорилирования протеина RB, протеинкиназ JNK1/2, IκBα, JAK2, факторов транскрипции STAT3 и CREB.
Результаты проведенного анализа свидетельствуют о том, повышение уровня фосфорилирования р38 ассоциировано со статистически значимым повышением экспрессии DR5, TRAIL, BAFF, снижением уровня TWEAK, LIGHT и фактора транскрипции CREB. Таким образом, повышение активности протеинкиназы р38 стимулирует DR5/TRAIL-сигнальный путь активации апоптоза ИКК, что в целом определяет формирование противовоспалительного эффекта [7]. При этом тенденция к повышению уровня р53, а также повышение фосфорилирования IκBα, способствующее активации ядерного фактора транскрипции NF-κB, также стимулируют TRAIL-индуцируемый апоптоз. Кроме этого, результаты исследования указывают на взаимосвязь у реконвалесцентов ВП активности р38 и продукции BAFF, указывающие на стимулирующее влияние р38 на дифференцировку и пролиферацию В-лимфоцитов по неканоническому пути [8]. Вместе с тем отмеченное статистически значимое различие содержания в подгруппах исследования факторов TWEAK и LIGHT, в частности снижение их экспрессии в группе с высоким уровнем фосфорилирования р38, свидетельствует о торможении у обследуемых процессов ангиогенеза и роста клеток, регулируемых TWEAK, а также Т-клеточного иммунитета и аутоиммунных реакций на его основе, регулируемых LIGHT [9]. В свою очередь, взаимосвязь фосфорилирования RB и р38, очевидно, отражает роль исследуемого фактора в репаративных процессах у реконвалесцентов ВП, в частности, регулируемых фактором роста TGFβ [10].
Выявленная отрицательная взаимосвязь уровня р38 и JAK2, свидетельствует о негативном влиянии цитокинов, в том числе, ИЛ-3, ИЛ-7 на митоген-активируемый сигнальный путь, отражая реципроктные взаимосвязи MAPK- и JAK/STAT-сигнальных путей у реконвалесцентов ВП, очевидно, за счет опосредуемого NF-κB и AP-1 повышения продукции супрессора цитокиновой сигнализации SOCS1 и фосфатазы PTP1B [11–13]. Значимая, умеренной силы положительная взаимосвязь р38 и IκBα, обеспечивающая суммацию сигналов, регулирующих активность транскрипционного фактора NF-κB, отражает важную роль исследуемой киназы в реализации саногенетических программ в фазу реконвалесценции бактериальной пневмонии.
ЗАКЛЮЧЕНИЕ
Результаты проведенного исследования свидетельствуют о том, что фосфорилирование протеинкиназы р38 в МНК находится в зависимости от уровня молекул, регулирующих апоптоз и пролиферацию, в частности р53, DR5, TRAIL, BAFF, TWEAK и LIGHT, что позволяет говорить о вовлечении МАРК-сигнального пути в регуляцию провоспалительной активности ИКК за счет стимуляции гуморального иммунного ответа и подавления клеточно-опосредованного аутоиммунного воспаления.
Взаимосвязь фосфорилирования р38 с компонентами JAK/STAT-сигнального пути, в том числе JAK2, STAT3 и STA5A, указывает на вовлеченность протеинкиназы р38 в реализацию эффектов цитокинов, передающих сигнал внутрь клетки с помощью gp130 (ИЛ-6, ИЛ-11), а также эритропоэтина и тромбопоэтина. Проведенный анализ показал, что у реконвалесцентов ВП протеинкиназа р38 вовлечена в реализацию процессов саногенеза, ее активность находится в зависимости от экспрессии рецепторов апоптоза, будучи связанной с активностью транскрипционных факторов NF-κB и CREB.
Таким образом, протеинкиназа р38, играя важную роль в регуляции физиологических процессов в ИКК, может рассматриваться в качестве терапевтической мишени с целью коррекции функционального состояния ИКК и процессов саногенеза у реконвалесцентов ВП [1, 2, 6, 14].



