Введение
Всемирной организацией здравоохранения в 1997 г. был введен термин «телемедицина», означающий «предоставление услуг здравоохранения в условиях, когда расстояние является критическим фактором, работниками здравоохранения, использующими информационно-коммуникационные технологии для обмена необходимой информацией в целях диагностики, лечения и профилактики заболеваний и травм, проведения исследований и оценок, а также для непрерывного образования медицинских работников в интересах улучшения здоровья населения и развития местных сообществ» [1].
Согласно данным литературы, около 7 млн людей в мире используют услуги телемедицины. К сожалению, их распределение по странам мира неравномерное: большинство людей, использующих данные услуги, находятся в США, Европе и Австралии [2]. Такие страны, как, в частности, Россия, намного отстают по данным позициям. Общеизвестный факт, что медицинская помощь, оказанная в срок, имеет на практике большое значение, так как благодаря дистанционному общению пациента и врача первые могут получить необходимую помощь в удобное для них время [3].
 Обращаясь к истории развития телемедицины, можно проследить, что еще в 1906 г. Эйнтховеном впервые были отправлены данные электрокардиографии по телефонной линии. В 1922 г. впервые сотрудниками Готтенбургского университета были проведены дистанционные консультации моряков по радиосвязи, в 1935 г. и в Италии появилась подобная система. В России с 60-х гг. используются возможности телемедицины: так, во время полета у первых космонавтов Ю.А. Гагарина, Г.С. Титова производилась передача с борта космического корабля данных электрокардиографии и физиологических параметров их организма [4].
Обращаясь к истории развития телемедицины, можно проследить, что еще в 1906 г. Эйнтховеном впервые были отправлены данные электрокардиографии по телефонной линии. В 1922 г. впервые сотрудниками Готтенбургского университета были проведены дистанционные консультации моряков по радиосвязи, в 1935 г. и в Италии появилась подобная система. В России с 60-х гг. используются возможности телемедицины: так, во время полета у первых космонавтов Ю.А. Гагарина, Г.С. Титова производилась передача с борта космического корабля данных электрокардиографии и физиологических параметров их организма [4].
В 2017 г. Госдумой был утвержден Федеральный закон № 242-ФЗ «О внесении изменений в отдельные законодательные акты Российской Федерации по вопросам применения информационных технологий в сфере охраны здоровья» [5]. Данный Закон вступил в силу с 1 января 2018 г.: в нем оговорена возможность выписывать электронные рецепты на лекарства, содержащие наркотические и психотропные вещества, дано определение телемедицинских технологий. Также в этом Законе прописано, что добровольное согласие на медицинскую помощь можно собирать в электронном виде по упрощенной схеме, что пациент имеет право запрашивать и получать медицинские данные о себе. Еще один важный пункт этого документа – разрешение удаленных консультаций, сбора информации, решения об очном визите, корректировки лечения, дистанционного наблюдения за больным с применением гаджетов [6].
Одним из важных направлений телемедицины является мобильное здравоохранение, в рамках которого как докторами, так и больными используются мобильные приложения на смартфонах [7]. Они предоставляют общую информацию о заболевании и позволяют следить пациенту и врачу за активностью болезни [8, 9].
В 2015 г. в ФГБНУ НИИР им. В.А. Насоновой было создано мобильное приложение ASpine для больных спондилитом (АС). Используя данное приложение, пациент 1 раз в неделю должен был заполнять опросники BASDAI, BASFI и отправлять информацию врачу. Кроме того, больной мог внепланово связаться с доктором при ухудшении самочувствия. В функции данного приложения входит и контроль выполнения рекомендаций по лечебной физической культуре, приему лекарств и визиту пациента к доктору. При повышении степени активности заболевания приложение автоматически оповещает врача об ухудшении состояния пациента и необходимости очного осмотра. При оценке клинического применения этого приложения авторами были получены данные, что средние значения индексов BASDAI (3,3±1,7 и 2,1±1,7, p >0,5) и BASFI (1,6±1,3 и 1,3±1,2, p >0,5) на момент включения и после 12 мес наблюдения статистически значимо не отличались. Это позволило сделать выводы о возможности использования мобильного приложения для более эффективного контроля над активностью заболевания и облегчения связи доктора и больного [10].
Во поисковой системе http://myhealthapps.net/, объединяющей мобильные приложения для здоровья, на данный момент во всем мире представлено лишь 3 интернет-системы для пациентов с ревматоидным артритом (РА), доступные на платформах apple, windows. Одним из таких приложений является APMAR – электронный дневник для больных с РА. Он напоминает пациентам о времени приема лекарств, дате посещения клиник и своевременном выполнении лабораторных анализов, предоставляет самую актуальную информацию и новости о РА, помогает больным в поиске контактных данных ревматологических учреждений. Данное приложение действует только на территории Италии [11].
Мобильная интернет-система RheumaTack в целом аналогична по функциям системе APMAR, но дополнительно позволяет пациентам оценивать свои функциональные способности по опросникам Funktionsfragebogen Hannover и FFbH, а также интенсивность боли по визуально-аналоговой шкале, длительность утренней скованности, количество болезненных и припухших суставов. Это приложение действует только на территории Канады [12].
 ArthritisID – мобильное приложение для больных РА в США. Оно включает информационную часть, в которой содержатся сведения о симптомах, диагностике, лечении и профилактике РА, дифференциальной диагностике с другими ревматическими заболеваниями. Пациенты могут обучиться лечебной физкультуре при этом заболевании, правильному питанию и образу жизни. Как и предыдущие два приложения, ArthritisID предусматривает заполнение опросников и включает функцию электронного дневника, напоминающего о времени приема лекарственных препаратов и дате посещения лечебных учреждений [13].
ArthritisID – мобильное приложение для больных РА в США. Оно включает информационную часть, в которой содержатся сведения о симптомах, диагностике, лечении и профилактике РА, дифференциальной диагностике с другими ревматическими заболеваниями. Пациенты могут обучиться лечебной физкультуре при этом заболевании, правильному питанию и образу жизни. Как и предыдущие два приложения, ArthritisID предусматривает заполнение опросников и включает функцию электронного дневника, напоминающего о времени приема лекарственных препаратов и дате посещения лечебных учреждений [13].
По официальным данным, в России недостаточно укомплектован штат врачей-ревматологов: их в стране всего 1600, что в 2 раза меньше требуемого количества) [14, 15]. Это может быть одной из причин того, что ремиссии достигают только 5–6% больных РА [17]. В связи с этим актуальность развития ревмотелемедицины в России, в частности, для ведения РА, особенно велика [16].
В 2015 г. нами был создан «Интернет-портал самоконтроля активности ревматоидного артрита», который содержит:
- фото- и видеоматериалы с информацией о РА;
- обучающие фото- и видеоматериалы по методике самооценки активности РА;
- личный кабинет для пациента и врача [18].
Ведение больных посредством этого интернет-портала предполагает персонифицированный подход взаимодействия врач–больной–врач. В личном кабинете врача представлена электронная медицинская карта пациента (рис. 1), содержащая клинико-демографические и лабораторно-инструментальные данные, информацию по лечению, данные опросников, которые заполняет как пациент, так и врач (рис. 2). Пациент осуществляет самооценку активности заболевания ежемесячно и внепланово при ухудшении течения РА: в своем личном кабинете он вносит на схему результаты по самооценке болезненных и припухших суставов, оценивает различные параметры по визуально-аналоговой шкале (ВАШ), заполняет опросники HAQ, EQ-5D.
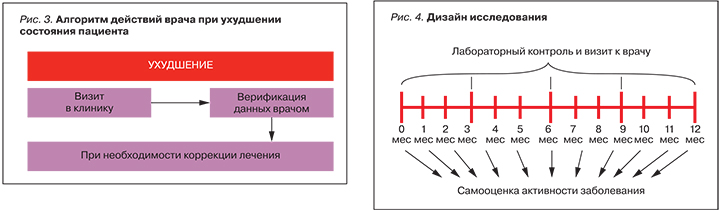
Врач своевременно получает информацию о самооценке РА пациентом в обработанном виде на свою электронную почту. При ухудшении течения заболевания и отсутствии какой-либо положительной динамики, по мнению больного, он приглашается в клинику, где данная информация верифицируется врачом и при необходимости производится коррекция терапии. Если, на взгляд пациента, наблюдается положительная динамика, то он не приходит на визит к врачу, а продолжает проводимую терапию (рис. 3).
 Таким образом, целью данного исследования стала оценка эффективности и безопасности ведения больных РА при применении «Интернет-портала самоконтроля активности ревматоидного артрита».
Таким образом, целью данного исследования стала оценка эффективности и безопасности ведения больных РА при применении «Интернет-портала самоконтроля активности ревматоидного артрита».
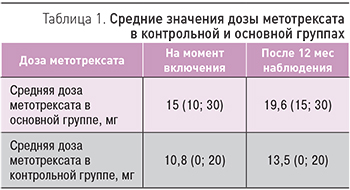
Дизайн исследования заключался в следующем: в течение годового периода наблюдения проводились обязательные очные встречи пациентов с врачом-ревматологом в клинике и лабораторный контроль активности заболевания 1 раз в 3 мес, а также при каждом ухудшении состояния здоровья, по мнению пациента. Исходно и через 12 мес всем больным проводилась рентгенография кистей и стоп (рис. 4).
Материалы и методы
В основную группу, использовавшую на протяжении 12 мес «Интернет-портал самоконтроля активности ревматоидного артрита», было включено 50 женщин с диагнозом РА, их средний возраст составил 56,3 лет (35; 76). В контрольную группу вошли 20 больных РА, все – лица женского пола, проходившие лечение в реальной клинической практике, сопоставимые по клинико-демографическим параметрам и степени активности заболевания с основной группой на момент включения в исследование.
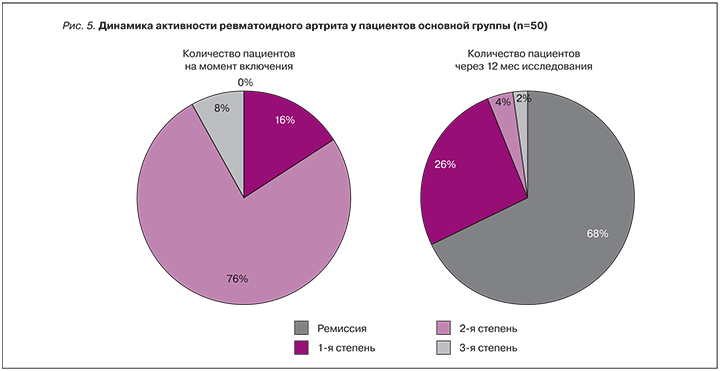
Исходно пациенты основной группы получали следующее лечение: 22 (44%) больных – монотерапию метотрексатом, 17 (34%) – метотрексат в комбинации с глюкокортикостероидами (ГКС), 4 (8%) – метотрексат и НПВП, 2 (4%) – ГКС и НПВП, 2 (4%) – метотрексат и сульфасалазин, 1 (2%) – сульфасалазин с метотрексатом и ГКС, 2 (4%) – монотерапию гидроксихлорохином (плаквенилом) и сульфасалазином. В целом 100% больных РА находились на базисной терапии; в частности, метотрексат из них получали 92%. Доза метотрексата была увеличена у 35 (70%) пациентов: на 2,5 мг у 5 (10%), на 5 мг у 20 (40%) и на 10 мг у 11 (22%) пациентов. 12 пациентам коррекция терапии метотрексатом не требовалась. 8 (16%) больным РА в качестве второго препарата комбинированной терапии был добавлен ГКС, 1 (2%) – сульфасалазин, еще 1 (2%) пациенту была увеличена доза гидроксихлорохина (плаквенила).
У 1 (2%) пациента возникли нежелательные реакции на прием метотрексата (повышение печеночных ферментов), в связи с чем возникла необходимость уменьшить его дозу.
Большая часть пациентов контрольной группы получала в качестве базисной терапии метотрексат. При этом лишь у 10 (47%) из них проводилась коррекция терапии при включении в протокол, которая была недостаточно эффективной: ни один из пациентов не достиг ремиссии. 2 (10,5%) пациента не получали препараты базисной линии, их терапия ограничивалась приемом НПВП. 4 (20%) находились на комбинированной терапии метотрексатом и ГКС, 1 (5%) – метотрексатом и сульфасалазином (табл. 1).
Результаты и обсуждение
В течение 12 мес все пациенты с РА из основной группы выполнили программу наблюдения по программе «Интернет-портала самоконтроля активности ревматоидного артрита». У них наблюдалось статистически значимое снижение среднего значения индекса активности заболевания DAS28 –наблюдения – с 4,023 на момент включения в исследование до 1,59 через 12 мес. При этом в контрольной группе никто из пациентов за 12 мес наблюдения и лечения в реальной клинической практике не достиг ремиссии: у них произошло лишь незначительное снижение индекса DAS28 – с 4,1 до 3,9 (табл. 2).
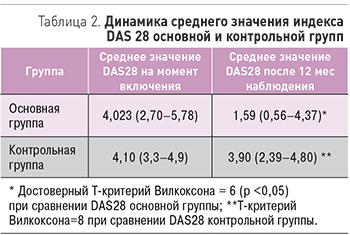
К 12 мес наблюдения 94% пациентов основной группы достигли ремиссии и более низкой степени активности РА: 34 больных (68%) – ремиссии, 13 (26%) – снижения степени активности (рис. 5).
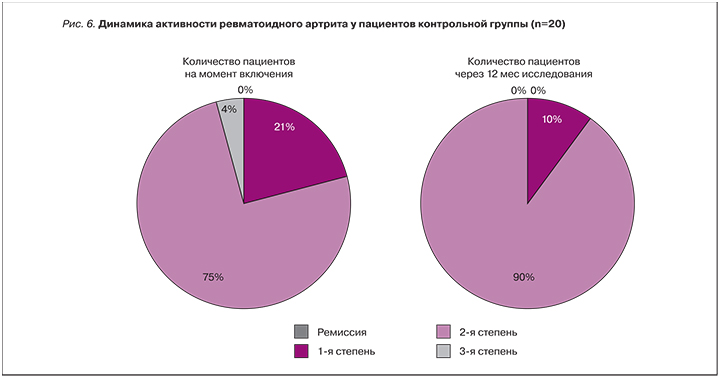
При этом снижение процесса активности РА и достижение ремиссии на протяжении года происходило постепенно: так, 8 (16%) больных достигли ремиссии к 3 мес исследования, 10 (20%) пациентов – к 6 мес, 10 (20%) – к 9 мес, и еще 6 (12%) – к 12 мес исследования. В контрольной группе такой положительной динамики течения РА не отмечалось (рис. 6). Более того, благодаря дистанционному мониторингу удалось выявить своевременное ухудшение состояния здоровья пациентов/обострения у 27 (54%) пациентов основной группы; у остальных 23 (46%) была адекватно подобрана терапия на исходном визите, в связи с чем обострений заболевания не наблюдалось.
Обращает на себя внимание высокий процент больных РА, достигших ремиссии (68%). Это превышает приводимые в литературе данные по достижению ремиссии в обычной клинической практике: так, согласно последним клиническим рекомендациям, ремиссии удается добиться, как правило, у 20–40% больных [19, 20]. Более того, в ряде исследований эти показатели были еще ниже. Например, по результатам данных шведского исследования, в которое было включено 29 084 пациента, по критериям ACR/EULAR–Boolean в течение 2,5 лет ремиссии достигли только 17,5% пациентов (p <0,001) [21]. Данные регистра NOAR (n=868) показывают аналогичную тенденцию: всего 12% пациентов достигли стойкой ремиссии в течение в среднем 5 лет [22].
Полученные нами результаты можно объяснить удобным и эффективным взаимодействием пациента и врача, что, в частности, позволило увеличить дозировку метотрексата под контролем клинической и лабораторной эффективности и достигать ремиссии заболевания постепенно в течение 12 мес наблюдения с максимальным результатом в течение первого полугодия (18 из 34).
Наконец, следует отметить, что тактика ведения пациентов РА при помощи интернет-портала обеспечивает высокую комплаентность общения больного и врача: это позволило всем 50 пациентам в течение 12 мес выполнить программу мобильного взаимодействия.
Невысокая эффективность ведения больных РА контрольной группы может быть объяснена более низкой частотой назначения и более низкими дозами метотрексата, а также отсутствием регулярной тактики ведения пациентов.
Таким образом, благодаря использованию самооценки активности заболевания и взаимодействию с врачом-ревматологом посредством интернет-портала пациенты основной группы значительно чаще достигали ремиссии/уменьшения степени активности РА, чем пациенты контрольной группы, которые наблюдались в условиях реальной практики. Это может свидетельствовать об эффективности и безопасности данной мобильной программы.
Выводы
- Ведение больных женщин РА посредством «Интернет-портала самоконтроля активности ревматоидного артрита» позволяет достичь основной цели лечения: ремиссии в 68% случаев и низкой активности РА в 26% в течение года и в короткие сроки (от 3 до 6 мес) у большинства больных.
- Активный самоконтроль активности заболевания со стороны пациента и дистанционный мониторинг со стороны врача дает возможность максимально быстро выявить обострение РА у 54% больных и провести коррекцию терапии.


