Открытие интерферона (ИФН) было признано одним из крупнейших событий в медицине и биологии нынешнего столетия. Это произошло в 1957 г., когда A. Isaacs и J. Lindenmann при проведении опытов на мышах сообщили, что клетки цыплят, инфицированные вирусом гриппа, вырабатывали секретируемый фактор, который опосредовал передачу вирусоустойчивого состояния, активного как против гомологичных, так и гетерологичных вирусов. Оказалось, что ИФН вырабатываются не только у мышей, но и у всех млекопитающих, в том числе у человека. Это основополагающее наблюдение, наряду с аналогичными выводами, сделанными Y. Nagano и Y. Kojima в 1958 г., заложило основу для последующих исследований, которые привели к подробному описанию системы ИФН [1]. ИФН – белковая молекула, обладающая неспецифической активностью и обеспечивающая противовирусный иммунитет. Клетки вырабатывают этот защитный белок в ответ на действие вирусов, бактерий, опухолевых клеток или продуктов их метаболизма.
В настоящее время ИФН представлены тремя типами: ИФН I типа (ИФН-α, ИФН-β, ИФН-ω, ИФН-τ, ИФН-δ, ИФН-κ, ИФН-ε, ИФН-ζ/limitin, ИФН-v) [2], II типа (только ИФН-γ) и ИФН III типа, семейство лямбда-интерферонов (ИФН-λ1/ интерлейкин-29 (ИЛ-29), ИФН-λ2/ ИЛ-28A, ИФН-λ3/ ИЛ-28B) [3]. ИФН разных типов отличаются по структуре, строению, утилизации клеточных поверхностных рецепторов и внутриклеточным сигнальным путям, которые обеспечивают экспрессию ИФН-стимулированных генов (ИСГ) [3, 4, 5].
В зависимости от условий, ИФН обладают способностью или подавлять выработку цитокинов, или способствовать увеличению их продукции при таких заболеваниях, как системная красная волчанка (СКВ), усиливать воспаление при бактериальных инфекциях, осложняющих предшествующее вирусное заболевание [4].
Функционирование системы ИФН складывается из строго следующих друг за другом этапов, представляющих своеобразную цепную реакцию клеток организма (индукция – продукция – действие – эффекты) в ответ на внедрение чужеродной информации или использование индукторов ИФН [3].
Известно, что в процессе онтогенеза происходит поэтапное созревание системы ИФН с изменением их биологических свойств и характеристик. Очевидно, что во многом благодаря несовершенству функционирования интерфероновой системы в раннем возрасте, новорожденные и дети первых лет жизни проявляют повышенную чувствительность к инфекционным болезням со склонностью к их более тяжелому и генерализованному течению с высоким риском осложнений и летальных исходов [6].
У человека появление так называемого раннего ИФН (р-ИФН) зафиксировано с 10-й недели внутриутробного развития, а к моменту рождения концентрация раннего ИФН в несколько раз превышает таковую у взрослых, с наиболее высоким уровнем у недоношенных. При этом р-ИФН характеризуется сниженной противовирусной и иммуномодулирующей активностью: в основном его действие направлено не на защиту, а на участие в развитии и дифференциации клеток плода и новорожденного[6].
В дальнейшем в становлении противоинфекционной защиты новорожденных принимает участие только α-звено интерфероновой системы. Однако синтез ИФН-α у новорожденных, особенно у недоношенных детей, в сравнении со взрослыми, резко снижен, что способствует смещению иммунорегуляторного индекса в сторону преобладания супрессорной активности Т-лимфоцитов и снижения киллерной активности клеток, усугубляя иммунологическую несостоятельность детей данной возрастной категории [6]. Одновременно с этим существуют убедительные доказательства более высокой продукции некоторых цитокинов (в том числе ИЛ-6, ИЛ-8) у новорожденных, особенно с дефицитом веса, в ответ на определенные микроорганизмы [7]. Наличие сильного цитокинового ответа, который формируется при участии TLR (TLR2) у новорожденных, во многом объясняет склонность к тяжелому генерализованному течению инфекций с развитием сходной клинической картины неонатального сепсиса вне зависимости от вида возбудителя.
Экзогенные интерфероны и индукторы интерферонов: особенности, преимущества, недостатки
Инфекции, особенно вирусной этиологии, индуцируют выработку огромного количества ИФН, в буквальном смысле наводняющего организм и длительно циркулирующего в крови с последующим метаболизмом в печени и почках. Возможность применения препаратов ИФН в ранний период жизни вызывала сомнения у многих исследователей. Причина: высокий уровень эндогенного ИФН, как и введение экзогенного ИФН новорожденным животным, приводили к подавлению их роста, некрозу клеток печени, развитию гломерулонефрита и даже гибели, что является доказательством цитопатического действия ИФН в этой возрастной группе [6]. В литературе описан новый тип интерферонопатий, связанных с генетически обусловленным переизбытком продукции ИФН I типа, ассоциированных с высоким уровнем детской заболеваемости и смертности от аутовоспалительного синдрома с развитием системного воспаления, лихорадки, васкулопатий, интерстициального поражения легких, дыхательной недостаточности [8].
Всего к настоящему времени описано более 300 различных эффектов ИФН, которые и определяют медицинскую значимость препаратов этого типа. Существующие медицинские препараты ИФН делятся по типу активного компонента на α, β и ɣ [3]. По способу производства существует 4 основных разновидности этого препарата: лейкоцитарный, лимфобластоидный, рекомбинантный и пегилированный (табл.).
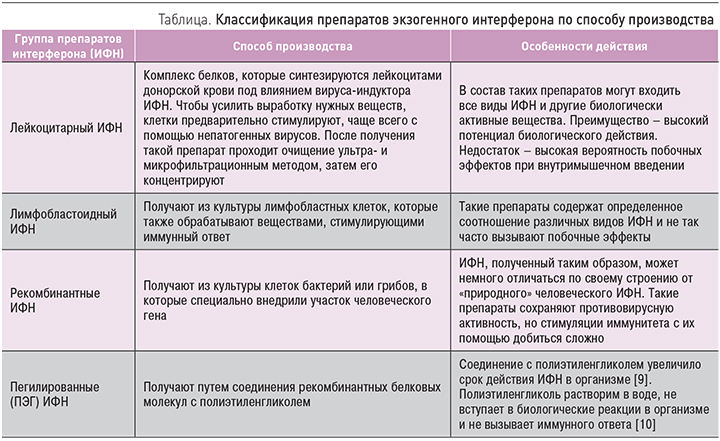
Считается доказанным, что в организм человека необязательно вводить препараты ИФН – стимулировать их выработку могут лекарственные препараты, называемые индукторами интерферона (ИИ) [11]. Заметим, что такой способностью обладают тысячи различных соединений, в первую очередь практически все известные вирусы, многие микроорганизмы (бактерии, риккетсии, микоплазмы, хламидии и др.), продукты из них, природные полифенолы и широкий круг синтетических веществ. В результате многолетнего целенаправленного скрининга отечественным исследователям удалось выявить несколько весьма перспективных для медицины ИИ, имеющих высокий химиотерапевтический индекс и пригодных для профилактики и лечения вирусных инфекций и ряда других заболеваний [3]. Основными требованиями при создании клинически пригодных ИИ были специфическая активность, низкая токсичность, отсутствие мутагенности, канцерогенности, эмбриотоксичности. Для эффективного использования ИИ необходимо знать, какие клетки продуцируют ИФН в ответ на введение индуктора и какой тип ИФН индуцируется в органах-мишенях [3].
Широкое системное использование ИИ различной природы показало, что их активность совпадает с ранее выявленной активностью экзогенных интерферонов. Клиническое применение ИИ касается гриппа и других ОРВИ, герпеса, вирусных гепатитов, энцефалитов, бешенства, медленных и смешанных инфекций. Обладая теми же иммуномодулирующими свойствами, что и собственно ИФН, ИИ стимулируют пролиферацию и дифференцировку клеток костного мозга, используя механизмы врожденного и адаптивного иммунитета [3].
Известно, что одно из свойств ИИ – формирование в организме длительной антивирусной резистентности. Сформировавшаяся на длительный период резистентность, по-видимому, является следствием непосредственного влияния ИИ на клеточный и гуморальный иммунитет [3].
ИИ в некоторых случаях имеют ряд преимуществ перед собственно ИФН:
- в отличие от наиболее широко используемых в настоящее время рекомбинантных ИФН не обладают антигенностью;
- синтез ИФН при введении ИИ сбалансирован и контролируется организмом, что предотвращает побочные эффекты, наблюдаемые при передозировке препаратов ИФН;
- однократное введение ИИ приводит к длительной продукции и поддержанию уровня ИФН в терапевтической концентрации;
- некоторые ИИ обладают уникальной способностью «включать» синтез ИФН в определенных популяциях клеток и органов, что в подчас дает им определенные преимущества перед поликлональной стимуляцией иммуноцитов интерфероном [3].
В то же время из-за того, что ИИ заметно различаются по способности «включать» синтез ИФН в различных органах (мозг, легкие, печень, селезенка и др.), это создает определенные проблемы в использования этой группы препаратов при различных вариантах органной патологии. При этом ИИ не только «включают» систему ИФН, но и вызывают образование ряда провоспалительных и противовоспалительных цитокинов, являясь биорегуляторами цитокиновой сети. Это определяет непредсказуемость эффектов применения некоторых разновидностей ИИ in vivo.
Эффекты и сфера применения интерферонов
Основные биологические эффекты ИФН включают:
- подавление роста внутриклеточных и внеклеточных инфекционных агентов вирусной и невирусной природы (хламидии, риккетсии, простейшие, бактерии);
- антипролиферативную активность;
- противоопухолевый эффект;
- антимутагенный эффект;
- антитоксическое действие;
- радиопротективный эффект;
- подавление или усиление продукции антител;
- стимуляцию макрофагов, усиление фагоцитоза;
- активацию цитотоксического действия сенсибилизированных лимфоцитов на клетки-мишени;
- активацию естественных киллерных клеток (NK-клеток);
- стимуляцию освобождения гистамина базофилами;
- индукцию синтеза простагландина E;
- усиление экспрессии антигенов главного комплекса гистосовместимости;
- усиление или ингибирование активности ряда клеточных ферментов;
- усиление цитотоксического действия дцРНК;
- подавление гиперчувствительности замедленного типа;
- многочисленные изменения клеточных мембран; стимуляцию выработки факторов и молекул адгезии [1].
Антипролиферативный эффект ИФН заключается в способности подавлять рост клеток за счет угнетения синтеза РНК и протеинов, а также ингибирования ростовых факторов, стимулирующих пролиферацию клеток [12, 13]. Это свойство ИФН активно изучают, препараты ИФН уже применяются в терапии рака [14, 15, 16]: они подавляют опухолевый рост как в режиме монотерапии, так и в сочетании с другими лекарственными средствами, потенцируя их противоопухолевые эффекты [13]. Более того, большинство исследователей склоняется к мнению, что именно бесперебойное функционирование системы ИФН I типа играет ключевую роль в способности макроорганизма подавлять спонтанный опухолевый рост [17].
Противоопухолевые эффекты ИФН делятся на прямые и непрямые [18]. Первые связаны со способностью ИФН оказывать непосредственное действие на опухолевые клетки, их рост и дифференцировку [18, 19], вторые – со способностью ИФН активировать противоопухолевые механизмы иммунной системы: стимуляцию активности клеток иммунной системы (макрофагов, NK-клеток, Т-цитотоксических лимфоцитов) [20], усиление экспрессии на клетках молекул гистосовместимости I класса [18, 21]. Известно, что обработка клеток ИФН I типа усиливает интенсивность апоптоза при последующей вирусной инфекции [22] и опухолевом росте [19, 23]. Кроме того, ИФН-α нарушают митотический цикл клетки, преимущественно блокируя его в цикле G1 или удлиняя все фазы цикла (G1, G2 и S) [20, 23].
Антипролиферативное действие ИФН-α связано и с их способностью опосредованно, через индукцию онкосупрессора р53 и подавление активности киназы клеточного цикла, замедлять переход клетки в S-фазу [20, 24].
Также ИФН обладают иммуномодулирующим действием, влияя практически на все звенья иммунного ответа. ИФН-α в эпителиальных клетках респираторного тракта индуцирует экспрессию рецепторов RIG-I и TLR3, влияя тем самым на процессы распознавания антигена [25]. ИФН увеличивают экспрессию молекул главного комплекса гистосовместимости (МНС) 1-го класса на всех видах клеток, улучшая благодаря этому распознавание инфицированных клеток цитотоксическими Т-лимфоцитами (ТCTL) [26]. Пролонгированная активация системы ИФН может способствовать активации аутоиммунного процесса в макроорганизме, что очень важно учитывать при назначении длительных курсов терапии как самими ИФН, так и их индукторами [26].
ИФН I типа регулируют пролиферацию В-лимфоцитов, способствуя их дифференциации в плазмобласты, которые не способны продуцировать большие количества иммуноглобулинов [27]. Доказано, что перечисленные и другие ИФН-зависимые пути активации В-клеток служат важными звеньями в патогенезе аутоиммунных заболеваний, в частности СКВ [26].
ИФН-α активно задействованы в подготовке и регуляции механизмов специфического иммунного ответа, участвуя в развитии Th1-ответа [28]. Они регулируют баланс хелперов Th1 и Th2, способствуя дифференциации Th0 в хелперы Th1 [22].
Нарушения периферической толерантности миелоидных дендритных клеток, которые связаны с избытком продукции ИФН I типа, могут быть причиной развития аутоиммунных заболеваний: СКВ [29], синдрома Шегрена [30, 31], сахарного диабета I типа [32, 33], склеродермии [26, 34], неврологических расстройств в виде синдрома Айкарди–Гутьереса [22].
Для ИФН-α, опыт клинического использования препаратов которого насчитывает более 30 лет, антивирусная активность является основной и наиболее детально изученной [26]. Многолетнее клиническое применение этой группы препаратов позволяет говорить об их универсально широком диапазоне противовирусных эффектов и возможности использования их при самых различных вирусных инфекциях.
ИФН служат первой линией защиты от вирусной инфекции, поскольку начинают синтезироваться уже в первые часы после контакта организма с вирусами как немедленный ответ на инфицирование [26]; при этом выраженность противовирусного ответа прямо пропорциональна заражающей дозе вируса [35]. Среди вирусов наиболее сильными индукторами ИФН являются РНК-геномные [36]. ДНК-содержащие вирусы – слабые индукторы ИФН (за исключением поксвирусов).
В клинической практике наиболее широко ИФН используются при вирусных инфекциях. В первую очередь это грипп и другие ОРВИ [37], различные герпетические поражения [38], а также острые и хронические вирусные гепатиты [39, 40, 41].
Проблемы применения
Известно, что любые попытки воздействия на вирус гриппа A с помощью блокаторов ионных каналов и ингибиторов нейраминидазы, благодаря высокой естественной мутационной его активности, сразу вызывают появление лекарственно устойчивых штаммов [42]. В целях защиты населения от новых штаммов вируса, недопущения развития лекарственной устойчивости и повышения эффективности лечения ОРВИ и гриппа были предприняты попытки применения альтернативных схем лечения. Первой линией терапии стали препараты ИФН-α. Однако применение препаратов данной группы при гриппе в эксперименте приводило к неожиданному эффекту повышения тяжести инфекционного процесса и увеличения смертности экспериментальных животных. Системное провоспалительное воздействие ИФН на клетки иммунной системы in vivo приводило к гиперцитокинемии и гиперхемокинемии, которые пагубно влияли на течение острой респираторной инфекции и утяжеляли ее клинические симптомы. Это сопровождалось повышением числа плазмацитоидных дендритных клеток и воспалительных моноцитов в легочной ткани и усиленным апоптозом эпителиоцитов дыхательных путей [43, 44]. Уже не вызывает сомнений, что вирус гриппа А сам вызывает апоптоз клеток эпителия дыхательных путей ИФН-опосредованным механизмом [45]. Добавление экзогенного ИФН-α может чрезмерно активировать эти механизмы, приведя к цитокиновому «шторму», повышению миграции воспалительных клеток в легкие, массовой гибели клеток эпителия дыхательных путей и смерти хозяина [37].
Бактериальные суперинфекции выступают основной причиной смерти во время пандемий и эпидемий гриппа [37, 45, 46]. Часто они обусловлены грамположительными возбудителями, такими как метициллин-устойчивый золотистый стафилококк (MRSA), большинство из которых проявляет высокую устойчивость к антибактериальной терапии [45]. Предшествующая инфекция вирусом гриппа A вызывает нарушение регуляции миграции и функций фагоцитов, ограничивая способность к защите организма от последующей бактериальной инфекции: это осуществляется через ИФН-опосредованный механизм [47]. Более того, последними исследованиями установлено, что экспрессия ИФН I типа может изменять восприимчивость макроорганизма к MRSA-инфекции: если ИФН-β снижает восприимчивость к MRSA, то ИФН-α повышает ее приблизительно к 7-му дню течения инфекционного процесса [45, 46, 48]. В связи с этим в эксперименте на мышах была продемонстрирована эффективность применения ингибиторов ИФН-α на 7-й день гриппозной инфекции в снижении риска развития смертельных постгриппозных осложнений [49].
Из всего вышесказанного следует, что безопасное и успешное лечение гриппа должно протекать без излишней иммуностимуляции, а использование ИФН-α провоцирует развитие иммунопатологии, особенно при применении в первые 48 ч острой гриппозной инфекции [42]. При этом профилактический прием ИФН при других ОРВИ, но только не при гриппе (!), одобрен большинством исследователей.
В свете вышесказанного не стоит относиться к ИФН как к панацее от всех бед. Следует обратить внимание и на другие проблемные аспекты применения этой группы лекарственных средств.
Во-первых, некоторые вирусы могут блокировать противовирусное действие ИФН. Например, аденовирусы продуцируют специфическую РНК, которая предотвращает активацию протеинкиназы [50]. Гемагглютинин вируса гриппа А вызывает деградацию рецепторов к ИФН I и II типа – IFNAR и IFNGR, тем самым ослабляя клеточный ответ на соответствующие ИФН [52]. NS1, белок вируса гриппа А, подавляет экспрессию ИФН с помощью различных механизмов, включая снижение продукции ИФН-ß [52]. Энтеровирус 71 и вирус Коксаки А16 способны вызывать деградацию эндосом эпителиальных клеток бронхов, что ведет к активации процессов их «самопереваривания», супрессии TLR9-опосредованного сигнального пути активации ИФН I типа и, как следствие, безудержной репликации вирусов [53]. Вирус иммунодефицита человека (ВИЧ) 1 типа через усиление активности CD169 (белок клеточной адгезии на дендритных клетках и макрофагах, являющийся фактором адгезии ВИЧ-1) и последующее усиление экспрессии CD169 нейтрализует противовирусное действие ИФН I типа, что способствует продуктивной инфекции ВИЧ-1 в миелоидных дендритных клетках и CD4+ Т-клетках [54]. Белки вируса Т-клеточной лейкемии человека подавляют активацию факторов клеточной транскрипции и ИФН-регулирующего фактора 3, осуществляя негативную регуляцию раннего β-интерферонового ответа на вирусную интервенцию [55].
Во-вторых, ИФН – это лишь первая «линия обороны», которая стимулирует другие звенья иммунитета и временно приостанавливает продвижение патогена по организму, давая время на активацию иммунных клеток, осуществляющих в том числе специфический иммунный ответ, и выработку антител.
В-третьих, основной механизм действия ИФН – подавление развития и деления. В физиологических дозах этот эффект контролирует размножение вирусов и опухолевых клеток. Но при введении значительных доз «чужеродного» вещества могут пострадать и собственные ткани организма, которые быстро обновляются. В первую очередь речь о клетках крови. Поэтому, прежде чем начинать лечение препаратами ИФН, нужно внимательно изучить пользу и возможный вред от их применения.
Многолетние исследования показали, что использование препаратов ИФН для профилактики и лечения вирусных инфекций не всегда приводит к однозначному эффекту. К настоящему времени накоплен огромный пласт данных о клиническом опыте применения препаратов ИФН и сопровождающих его многочисленных побочных действиях и осложнениях [56]. Зачастую выраженные нежелательные явления приводят к прекращению курса лечения ИФН или необходимости снижения дозы препаратов, что, безусловно, снижает эффективность проводимого лечения [57].
Прежде всего выраженность побочных эффектов и нежелательных явлений связана с необходимостью длительного введения высоких доз ИФН-α для лечения некоторых инфекций (гепатитов B и C) и опухолей [56]. Следствием системного провоспалительного действия ИФН в таких ситуациях становятся проявления гриппоподобного синдрома различной степени выраженности (лихорадка, ломота в теле, головная боль и др.) [58]. Угнетение костно-мозгового кровообращения как проявление антипролиферативных эффектов ИФН относится к распространенным нежелательным явлениям ИФН-терапии [58]. Часто применение ИФН может сопровождаться значительным снижением качества жизни пациентов с развитием тревожности и депрессии [59].
К общим осложнениям интерферонотерапии, независимо от ее продолжительности, относится индукция антитиреоидных аутоантител без нарушения функции щитовидной железы. Введение в практику длительных терапевтических режимов лечения ИФН-α увеличило риск развития деструктивного тиреоидита во много раз [60]. В литературе описаны случаи тиреотоксикоза, наблюдаемые у пациентов после лечения ИФН, без каких-либо признаков аутоиммунного процесса в щитовидной железе [61].
Повреждение дистальных регуляторных путей обмена глюкозы в организме пациентов, принимающих ИФН-α, может привести к гипрегликемии, нарушению секреции инсулина, развитию синдрома инсулинорезистентности [62], сахарного диабета 1 и 2 типа [32, 33, 62].
Не вызывает сомнений непосредственное участие препаратов ИФН-α в развитии аутоиммунных заболеваний, в первую очередь СКВ [26, 34] и склеродермии [63].
Имеются сообщения о случаях обострения ранее существовавшего псориаза и дебюте этого заболевания у подростков с гепатитом С на фоне лечения ИФН-α [64]. Лихеноидные высыпания в полости рта также относятся к ИФН-индуцированным дерматологическим осложнениям, нарушающим качество жизни пациентов [65]. Применение топического интерферона α-2b при лечении плоскоклеточной неоплазии глаз может привести к развитию реактивной лимфоидной гиперплазии в тканях глаза [66]. Имеются сообщения о возникновении аритмий, инфаркта миокарда, кардиомиопатии, миокардита, перикардита, перикардиального выпота и диастолической дисфункции на фоне лечения препаратами ИФН [67].
Время приема ИФН для профилактики или лечения инфекций также может влиять на развитие побочных эффектов. Экспериментальные исследования показали, что если профилактический прием ИФН при некоторых вирусных заболеваниях у птиц обеспечивал защиту от последующего заражения вирусом, то добавление ИФН в инфицированные клеточные культуры в ранние сроки после инфицирования, способствовало массовой апоптотической гибели клеток макроорганизма с тяжелыми деструктивными явлениями в тканях [68].
Таким образом, многолетняя клиническая практика показывает, что «безопасных» препаратов ИФН не существует, и даже местное их применение чревато серьезными и подчас необратимыми последствиями.



