Иммуноглобулиновый-А нефрит (ИГА-н) характеризуется отложением в клубочках иммунных комплексов, содержащих иммуноглобулины А (ИГА). ИГА-н известен также как гематурический нефрит, или болезнь Берже. Ранее его морфологически относили к мезангиопролиферативному гломерулонефриту (ГН) с депозитами ИГA. В последние годы было доказано, что нефрит включает и другие морфологические варианты (мезангиокапиллярный, с полулуниями, минимальными изменениями, фокально-сегментарный гломерулосклероз) [1].
ИГА-н идиопатический – наиболее часто встречающийся в мире: в Азии на него приходится 30–35% всех первичных ГН, Японии –50% новых случаев ГН и 40% всех случаев терминальной почечной недостаточности (ТПН), Европе и России – 30–40%, США – 2–12% (наиболее частая форма первичного ГН среди белого населения молодого возраста). Мужчины болеют чаще женщин: в России и Японии это соотношение составляет 2:1, в Северной Европе и США – 6:1 [1, 2].
Патогенез ИГА-н связан с выработкой иммунной системой слизистых оболочек полимерной формы ИГА-1, дефицитной по галактозе. Обладая антигенными свойствами, ИГА-1 вызывает выработку антител. Образовавшиеся иммунные комплексы с ИГA-1, чаще в сочетании с третьей фракцией комплемента (С3), откладываются в мезангии, вызывая его пролиферацию и расширение. Иммунофлуоресцентное исследование c обнаружением в клубочке светящихся ИГA является основой диагностики ИГА нефропатии. Депозиты в стенке капилляров ассоциируются с более выраженной гистологической активностью, протеинурией и худшими исходами. [3].
Дебют ИГА-н проявляется в основном двумя основными вариантами клинического течения и различным прогнозом. Для 1 варианта характерна внезапно появившаяся макрогематурия, часто с болями в боку, возникающая на фоне фарингеальной или других острых стрептококковых или вирусных инфекций слизистых оболочек, гастроэнтеритов или вакцинаций. Встречается во всех возрастных группах, но наиболее часто у мужчин молодого возраста. Прогноз благоприятный.
2 вариант характеризуется скрытым началом нефрита. В моче протеинурия (ПУ) обычно умеренная, дисморфные эритроциты, патологические цилиндры, снижена скорость клубочковой фильтрации (СКФ). Часто выявляется случайно, при обращении в медицинское учреждение по другому поводу (профосмотр, диспансеризация, получение справки, другое заболевание). Характерно прогрессирующее течение со снижением СКФ и постепенным развитием ТПН. Прогноз неблагоприятный.
Прогрессирующее течение формируется у 20–50% пациентов с ИГА-н. Пациенты с ПУ и повышением креатинина сыворотки крови достигают ТПН в течение 10–20 лет после установления диагноза. У 30–50% пациентов течение ИГА-н не прогрессирующее. Предложена стратификация больных ИГA-н по риску прогрессирования в зависимости от ПУ, артериальной гипертензии (АГ), исходного уровня СКФ, позволяющая в том числе осуществлять отбор на лечение, опираясь на прогноз [1, 4–6]:
- 1-я группа. Низкий риск прогрессирования: пациенты без ПУ или с ПУ <0,5 г/сут, нормальным артериальным давлением (АД) и СКФ;
- 2-я группа. Умеренный риск прогрессирования: пациенты с ПУ >0,5–1,0 г/сут и сохранной функцией почек и/или с умеренно сниженной СКФ (не <50 мл/мин/1,73 м2) и/или с АГ;
- 3-я группа. Высокий риск прогрессирования: пациенты с ПУ >3 г/сут и/или с СКФ <30 мл/мин/1,73 м2 или с быстро прогрессирующим ГН (БПГН).
Из дополнительных предикторов прогрессирования ИГА обсуждаются курение, уровень мочевой кислоты, избыточное потребление соли и белка, прием анальгетиков. Хотя эти факторы и не включены в шкалу оценки риска прогрессирования хронической болезни почек (ХБП), их роль в прогрессировании этой патологии не отрицается. Поэтому они должны быть исключены или минимизированы из образа жизни, питания и лечения таких пациентов. Необходимо также трудоустройство пациентов с исключением переохлаждения, физической перегрузки, стрессов [7–10].
Лечение ИГА-н осуществляется в соответствии с международными и национальными рекомендациями и основывается на снижении риска прогрессирования нефрита: подавлении активности, снижении гемодинамической перегрузки клубочков (внутриклубочковой гипертонии и гиперфильтрации), уменьшении гиперпероксидации, эндотелиальной дисфункции, гиперлипидемии [1, 10].
Всем больным, независимо от группы риска прогрессирования, показана упорная терапия инфекций при их предполагаемой роли в развитии нефрита, поскольку после устранения инфекции у части пациентов может наступить полная ремиссия.
Не рекомендуется проводить тонзиллэктомию при ИГА-н, но она возможна у отдельных больных с рецидивами заболевания на фоне обострений хронического тонзиллита при неэффективности консервативных мер (рекомендация 10.5.3.1) [10–13].
Лекарственная терапия ИГА-н включает:
- ингибиторы АПФ или блокаторы рецепторов ангиотензина (БРА);
- глюкокортикостероиды (ГКС);
- иммуносупрессивные препараты (циклофосфамид, азатиоприн, циклоспорин) в дополнение к ГКС. Не рекомендуется использовать микофенолат мофетил для лечения ИГА-н (рекомендация 10.4.3);
- другие лекарственные препараты: рыбий жир при персистировании протеинурии >1,0 г/сут, несмотря на 3–6-месячное лечение ингибиторами АПФ или БРА и контроль АД (рекомендация 10.5.1.1). Не рекомендуется использовать дезагреганты для лечения ИГА-н (рекомендация 10.5.2.1). Cтатины назначаются при гиперлипидемии, учитывая ее влияние на прогрессирование нефросклероза и риск сердечно-сосудистых осложнений, с достижением целевого уровня холестерина сыворотки крови менее 4 ммоль/л и липопротеидов низкой плотности менее 2,5 ммоль/л при высоком риске и менее 1,8 ммоль/л при очень высоком риске сердечно-сосудистых осложнений.
Назначение терапии при ИГА-н ступенчатое, агрессивность его нарастает от 1-й к 3-й группе риска:
- 1-я группа. Медикаментозное лечение не показано. Пациенту назначается наблюдение нефролога и обследование 1 раз в 6–12 мес (оценка ПУ, уровня креатинина, СКФ, АД) для своевременного выявления показаний к началу терапии;
- 2-я группа. Показан длительный прием ингибиторов АПФ или БРА при ПУ более 0,5–1,0 г/ сут с целью ее снижения менее этого уровня и достижения целевого АД <130/80 мм рт.ст. при ПУ <1 г/ сут и АД <125/75 мм рт.ст. при ПУ >1 г/ сут (рекомендации 10.2.1–10.2.4). При сохранении ПУ > 1 г/ сут, несмотря на терапию ингибиторами АПФ/БРА в течение 3–6 мес и адекватный контроль АД, назначают ГКС (преднизолон 1 мг/ кг/ сут). Возможно присоединение рыбьего жира [1, 10];
- 3-я группа. При ПУ нефротического уровня или развитии острого поражения почек назначаются ГКС. В отсутствие эффекта от преднизолона показано присоединение цитостатиков – циклофосфана (при мезангиопролиферативном варианте ГН) или циклоспорина (при фокально-сегментарном гломерулосклерозе) при СКФ >50 мл/ мин/1,73 м2. Назначение цитостатиков при СКФ <50 мл/мин/1,73 м2 показано только при ИГА с полулуниями и быстро прогрессирующем снижении функции почек (рекомендации 10.4.1–10.4.2).
КЛИНИЧЕСКИЙ ПРИМЕР
Пациентка Н., 25 лет, 14.04.2014 обратилась к нефрологу c жалобами на субфебрильную температуру без ознобов с марта 2013 г. после перенесенной ангины, частую боль в горле, заложенность носа, головную боль, общую слабость, похудание за год на 3–4 кг, нарушения сна.
 Анамнез: считает себя больной с марта 2013 г., лечилась у отоларинголога по поводу обострения тонзиллита, пансинусита. Получала последовательно антибиотики: амоксициллин + клавулановую кислоту, азитромицин, левофлоксацин; симптоматические препараты – мометазон, комбинированный назальный спрей состава дексаметазон + неомицин + полимиксин B. Заложенность носа уменьшилась, температура снижалась на 3–5 дней и вновь повышалась. С ноября 2013 г. в моче появилась эритроцитурия. Страдает частыми простудными заболеваниями. Заболевания почек в анамнезе отрицает.
Анамнез: считает себя больной с марта 2013 г., лечилась у отоларинголога по поводу обострения тонзиллита, пансинусита. Получала последовательно антибиотики: амоксициллин + клавулановую кислоту, азитромицин, левофлоксацин; симптоматические препараты – мометазон, комбинированный назальный спрей состава дексаметазон + неомицин + полимиксин B. Заложенность носа уменьшилась, температура снижалась на 3–5 дней и вновь повышалась. С ноября 2013 г. в моче появилась эритроцитурия. Страдает частыми простудными заболеваниями. Заболевания почек в анамнезе отрицает.
Объективны данные: астенична, рост 175 см, индекс массы тела 19,8. Зев слегка гиперемирован, миндалины без особенностей. Кожа, лимфатическая, костно-мышечная, сердечно-сосудистая системы, органы дыхания и пищеварения без особенностей. АД 120/70 мм рт.ст., частота дыханий 18/мин. Отеков нет.
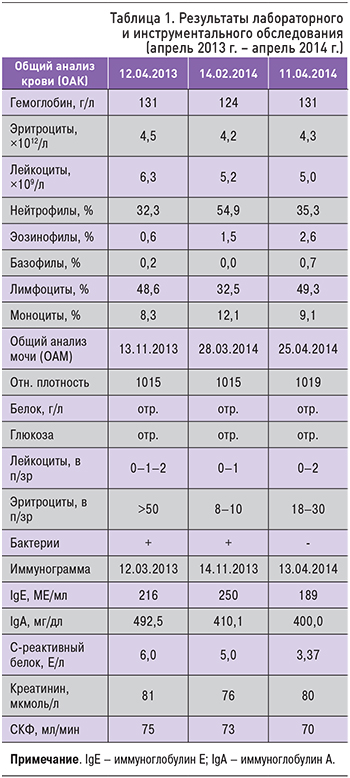
В течение года до обращения к нефрологу в связи с длительным субфебрилитетом и похуданием проведено обследование для исключения инфекций и онкопатологии (табл. 1).
В ОАК обращает на себя внимание относительная нейтропения с абсолютным лимфоцитозом, в иммунограмме – повышение уровней IgА и IgЕ. В моче эритроцитурия, отсутствие протеинурии и небольшое снижение СКФ.
Результаты обследования, проведенного в 2013 г.:
- УЗИ почек 10.10.2013: справа расширение чашечно-лоханочной системы, нефроптоз 1 ст.;
- посев крови на стерильность от 14.10.2013 и 14.03.2014 – отрицательно;
- мультиспиральная компьютерная томография придаточных пазух носа (04.11.2013) – признаки риносинусита;
- консультация невролога (по поводу постоянных головных болей) 18.12.2013: синдром вегетативной дисфункции описторхоза с астеническим компонентом. Головные боли напряжения;
- серологические маркеры инфекций (14.11.2013–10.04.2014): антитела к антигенам (IgG, IgМ), эхинококкоза, токсокароса, трихинеллеза, Giardia lamblia (IgM, IgA, IgG), Helicobacter рylori (IgG, IgА, IgМ), Toxoplasma gondii (IgG), Ascaris lumbricoides (IgG) – отрицательно. Специфические IgE к панелям аллергенов: клещевых аллергенов, плесени, бытовых, растений, животных – отрицательно;
- онкомаркеры (11.03.2014): α-фетопротеин, РЭА, СА 19-9, Са 125, СА 15-3, СА 72-4, SCCA (антиген плоскоклеточной карциномы) – отрицательно. Антитела к ядерным антигенам (12.03.2014) – отрицательно;
- посев на микрофлору с миндалин и глотки (10.04.2014): из носа – Streptococcus 104, из зева – Candida albicans 103. Исследование мазка из влагалища (10.04.2014) – микрофлора кокковая, споры мицелия. Риноцитограмма (24.03.2014) – повышены эозинофилы, кокки+. Посев мочи на микрофлору (01.03.2014) – Citrobacter freundii 103. Анализ крови на вирусы, в том числе на вирус Эпштейна–Барр, цитомегаловирус (IgG) от 11.04.2014 – положительны;
- двухстаканная проба мочи (01.03.2014): эритроциты+++ в обеих порциях;
- экскреторная урография (02.03.2014): нефроптоз справа 1 ст. Синдром Фролея справа.
Результаты консультации узких специалистов:
- аллерголог/пульмонолог (10.11.2013): субфебрилитет. Хронический тонзиллит. Повышение уровня IgE;
- уролог (01.03.2014): нефроптоз справа 1 ст. Синдром Фролея справа. Хронический правосторонний пиелонефрит вне обострения, вторичная эритроцитурия, бессимптомная бактериурия;
- гематолог (10.03.2014): нейтропения, лимфоцитоз: субфебрилитет неясного генеза. Хроническая вирусная инфекция (вирусемия Эпштейна–Барр, цитомегаловирусемия?). Лимфоцитоз абсолютный, не исключается на фоне вирусной инфекции;
- оториноларинголог (12.02.2014): назначено местное лечение фарингита – хлоргексидин, мирамистин, повидон-йод.
Температура у пациентки снизилась на 2 нед до нормы, но затем снова стала субфебрильной. Через 1 мес вновь появились головная боль в теменной области, отмечалась слабость, отсутствие аппетита. АД повысилось до 130–140/90 мм рт.ст. Пациентке был назначен эналаприл по 25–50 мг 2 раза в сутки. Проведена тонзиллэктомия, которая в соответствии с последними Международными рекомендациями не рекомендована пациентам с ИГA-н.
Результаты консультации у нефролога (14.04.2014): назначено дообследование для исключения:
- туберкулеза мочевых путей (ДНК Mycobacterium tuberculosis) – отрицательно;
- волчаночного нефрита (волчаночный антикоагулянт, LE клетки, АНЦА, АТ к ДНК) – отрицательно;
- парапротеиноза (лимфомоноцитоз!):
- кровь на легкие цепи Ig – отрицательно;
- протеинограмма – норма;
- моча на белок Бенс-Джонса – отрицательно.
- иммунофенотипирование – данных в пользу лимфопролифативного процесса нет.
04.12.2014 у пациентки случился гипертонический криз с подъемом АД до 170/110 мм рт.ст., она была госпитализирована в стационар. Сохранялись боль в горле, пониженный аппетит, плохой сон, субфебрилитет.
В стационаре пациентка консультирована эндокринологом: симптоматическая гипертензия? Назначена магнитно-резонансная томография (МРТ) головного мозга: данных в пользу очаговых процессов не выявлено.
После консультации с нефрологом (04.12.2014) пациентке была назначена нефробиопсия, проведена 12.12.2014. Результаты гистологического исследования нефробиоптата (№ 56787):
- световая микроскопия:
- 10–11 клубочков, из них 1 (~9–10%) склерозирован полностью, признаки сегментарного склероза не выявлены, 1 клубочек коллабирован;
- клубочки с немногочисленными синехиями и адгезиями, один из клубочков с перигломерулярным склерозом;
- в 3–4 клубочках (~30–40%) сегментарное увеличение мезангиальной клеточности слабой выраженности, а также неравномерное накопление мезангиального матрикса с участками интерпозиции на капиллярные петли;
- в препаратах, окрашенных трихромом, выявлены фуксинофильные дисковидные депозиты;
- гломерулярная базальная мембрана тонкая;
- в строме единичные лимфоидные микроинфильтраты;
- дегенеративные изменения эпителия канальцев слабой выраженности в форме гиалиновой зернистости цитоплазмы; канальцы с признаками атрофии отсутствуют;
- артериолы с нерезким утолщением медии, единичные – с явлениями гиалиноза стенки; увеличение клеточности юкстагломерулярного аппарата;
- иммунофлуоресценция:
- в биоптате 3–4 клубочка;
- крупногранулярная мезангиальная экспрессия IgА 2–3+, СЗ 2+, карра и lambda 2–3+;
- сегментарная мелкогранулярная мезангиальная экспрессия ИГM 1+; ИГG, C1q -.
 Заключение: ИГА нефропатия, III класс по системе М. Нaas: фокальный мезангиопролиферативный гломерулонефрит, гломерулосклероз 10%, артериолопатия слабой выраженности.
Заключение: ИГА нефропатия, III класс по системе М. Нaas: фокальный мезангиопролиферативный гломерулонефрит, гломерулосклероз 10%, артериолопатия слабой выраженности.
Нефролог: ИГА нефрит, фокальный мезангиопролиферативный, активный, ХБП 2 стадии. Хронический фарингит.
К лечению был добавлен преднизолон по 0,5 мг/ кг в сутки (30 мг/сут) в течение 1,5–2 мес с последующим снижением дозировки до отмены.
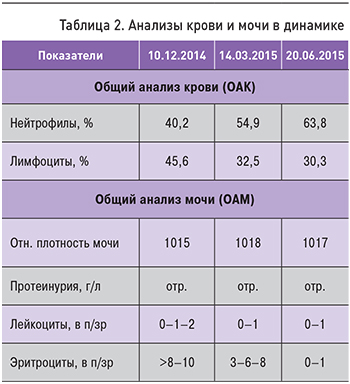
Через 1 мес у пациентки наблюдалась нормализация самочувствия, температуры и аппетита, стабилизация массы тела. Через 1,5 мес начато снижение дозы преднизолона по 2,5 мг в неделю. Через 3 мес прекратилась головная боль. АД достигло уровня 120–130/80 мм рт.ст. Температура нормализовалась, пациентка прибавила в весе 3 кг. В общем анализе крови была отмечена нормализация уровня нейтрофилов и лимфоцитов, в моче снижение эритроцитурии, которая еще через 3 мес исчезла (табл. 2).
После отмены преднизолона и через 11 мес (20.01.2016) самочувствие пациентки не имело отрицательной динамики: головная боль не беспокоит, температура в норме, прибавила в весе 1 кг. Результаты общего анализа крови и мочи в норме. В период наблюдения после ремиссии с 2014 по 2018 г. сохраняется стойкая ремиссия ИГA-н.
ЗАКЛЮЧЕНИЕ
Длительный этап диагностики в рассмотренном клиническом случае был обусловлен наличием системных проявлений – лихорадки, похудания, слабости, а также нетипичных изменений в крови в виде лимфоцитоза и нейтропении, что требовало исключения инфекций, болезней крови, онкопатологии и системных заболеваний с поражением почек. Лечение хронического тонзиллита антимикробными препаратами, местное лечение антисептиками, тонзиллэктомия и длительный прием эналаприла не привели к положительной динамике. Включение преднизолона позволило добиться стойкой ремиссии нефрита. На основании представленного случая рекомендуется использовать современные клинические рекомендации по ведению больных ИГА-н и наш опыт ведения и лечения пациентки с этим заболеванием.



