Особое внимание ревматологов занимают проблемы ведения пациенток с ревматоидным артритом (РА) в период беременности. Следует отметить, что в реальной клинической практике нередко женщинам с РА беременность не рекомендовалась в связи с рисками ухудшения течения основного заболевания на фоне гестации, а также из-за возможного неблагоприятного влияния данного вида патологии на беременность (ее материнские и плодные исходы) [1, 2].
Так, 54% женщин откладывают планирование беременности из-за опасений, связанных с основным заболеванием, 46% из них боятся передать заболевание ребенку, 23% сомневаются, что смогут забеременеть и выносить ребенка, 69% пациенток просили врача рассказать о вопросах планирования семьи. При этом каждая 5 женщина самостоятельно принимает решение о прекращении или продолжении использования болезнь-модифицирующих противоревматических и генно-инженерных биологических препаратов [2, 3].
В последние десятилетия в связи с совершенствованием диагностики, ранним и адекватным лечением, внедрением новых лекарственных препаратов увеличились продолжительность и качество жизни больных, что позволило внести целый ряд рекомендаций по планированию беременности и ее сохранению у женщин с РА [1, 2].
В 2016 г. EULAR опубликовала принципы использования противоревматических препаратов до и во время беременности, а также в период кормления грудью, включающие 4 базовых правила [5, 6]:
- При лечении каждой пациентки детородного возраста необходимо принимать во внимание аспект планирования семьи и корректировать терапию перед планированием беременности.
- Лечение пациенток с ревматическим заболеванием до и во время беременности и грудного вскармливания должно быть направлено на предотвращение или подавление активности заболевания у матери и отсутствие риска для плода/ребенка.
- Риск лекарственной терапии для ребенка необходимо сравнить с риском, который несет для пациентки и плода или ребенка заболевание матери при отсутствии лечения.
- Решение о лекарственной терапии во время беременности и кормления грудью должно основываться на согласии между ревматологом, акушером-гинекологом, а в ряде случаев других медицинских работников.
В последнее десятилетие генно-инженерные биологические препараты (ГИБП) используются для лечения больных ревматическими заболеваниями с возрастающей частотой, что повышает важность вопроса их безопасности для плода у женщин, забеременевших во время лечения [5, 6].
Несмотря на широкое применение ГИБП, данные об их безопасности при беременности и лактации недостаточны или противоречивы. Так, в опубликованном K. Mirdamadi в 2018 г. метаанализе выявлено снижение массы тела новорожденных и частоты живорождение в когорте женщин, получавших ГИБП во время беременности [7]. В ряде других публикаций высказывается мнение о безопасности данного класса терапии, и делаются предположения о влиянии высокого уровня провоспалительных цитокинов у женщины на негативные материнские и плодные исходы [8]. Таким образом, все вышеперечисленные факты явились основанием для проведения анализа безопасности применения ингибиторов фактора некроза опухоли у пациенток с ревматоидным артритом во время беременности.
Цель – изучить особенности течения ревматоидного артрита при беременности, после родоразрешения на фоне терапии ГИБП – ингибиторами фактора некроза опухоли-α (иФНО-α).
МАТЕРИАЛ И МЕТОДЫ
В основу работы будут положены результаты проспективного наблюдения в период гестации и 12 мес после родов 19 пациенток. Период наблюдения май 2011 г. – январь 2019 г.
В исследование были включены беременные с ревматическими заболеваниями, поступившие в стационар СЗГМУ им. И.И. Мечникова, медицинской компании «АВА-Петер» и «Скандинавия» на сроке не позднее 25 нед, при условии подписания информированного согласия, а также возможностью наблюдения в клиниках во время беременности и в течение 12 мес после родоразрешения.
Все перечисленные беременности на фоне генно-инженерной биологической терапии являлись исходами «аварийной контрацепции». Все пациентки подписали информированное согласие.
Пациентки обследовались амбулаторно и/или стационарно (в зависимости от клинико-лабораторной активности ревматических заболеваний, акушерско-гинекологической патологии) в каждом триместре беременности (на 10–12-й, 20–22-й, 30–32-й неделях) и через 12 мес после родов. На каждом визите проводилось комплексное клинико-лабораторное обследование по стандартам Ассоциации ревматологов России. Варианты небиологической медикаментозной терапии, в зависимости от клинических проявлений, нозологической принадлежности, а также активности иммуно-воспалительного процесса, проводились согласно рекомендациям Ассоциации ревматологов России (2017) [9].
Для оценки эффективности проводимого лечения использовался комбинированный индекс DAS28 CRP, рекомендованный ELUAR: DAS28 <2,6 – ремиссия, DAS28 ≤3,2 – низкая степень активности заболевания, 3,2 >DAS28≤5,1 – умеренная активность, DAS28 >5,1 – высокая степень активности заболевания [8].
Статистическая обработка данных осуществлялась с использованием программы Statistica 8.0 (StatSoft, США), включая общепринятые методы параметрического и непараметрического анализа. Критерием статистической достоверности получаемых выводов считали общепринятую в интерпретации медико-биологических исследований величину p <0,05.
РЕЗУЛЬТАТЫ
В исследование было включено 19 женщин, получавшие различные виды иФНО-α во время I–II триместров гестации. Клиническая характеристика пациенток, а также результаты лабораторного обследования представлены в таблице 1.
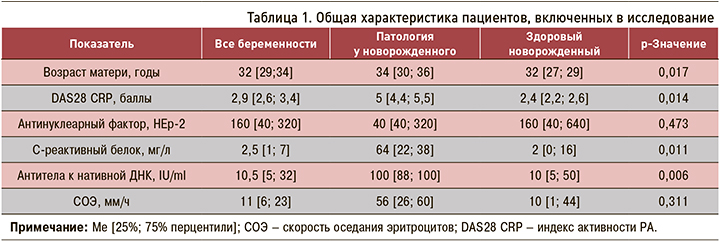
В обследованной когорте более 70% женщин относились к группе старшего репродуктивного возраста (старше 30 лет для первородящей и старше 35 лет для повторнородящей), а 75% имели осложненный акушерско-гинекологический анамнез. Пациентки с активным РА (DAS28 CRP >3,2) имели повышенный риск осложненного течения и неблагоприятного исхода беременности, в частности, невынашивания, преждевременных родов, низкого веса новорожденного, осложнений в перинатальном или послеродовом периоде.
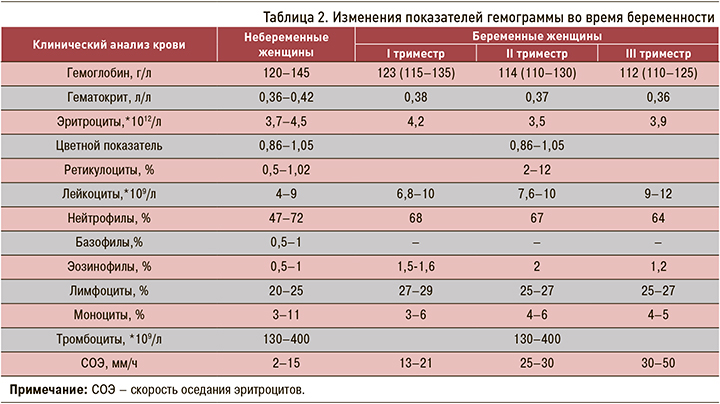
Для небеременных пациенток нормальным показателем скорости оседания эритроцитов (СОЭ, далее по методу Панченкова) является 15 мм/ч, но с наступлением зачатия эти данные изменяются и могут варьировать в зависимости от триместра гестации. До 12-й недели наблюдается некоторое повышение СОЭ – 15–25 мм/ч. В течение II триместра отмечается дальнейшее увеличение СОЭ до 20–30 мм/ч. К тIII триместру СОЭ может достигать 50 мм/ч.
В целом нормы СОЭ при вынашивании неоднозначны и являются весьма усредненными. Отклонения бывают даже у полностью здоровых пациенток. Необходимо обязательно учитывать, что СОЭ 50 мм/ч нормальна только для III триместра, длящегося с 28-й по 40-ю неделю (табл. 2). Если же подобный показатель наблюдается у беременной уже на ранних сроках, то его стоит расценивать как проявление иммуно-воспалительной активности РА.
У беременных в норме концентрация высокоспецифичного СРБ не должна превышать 15 мг/л. Даже незначительное увеличение (более 20 мг/л) этого острофазового маркера коррелирует с риском осложненного течения РА и требует интенсификации противовоспалительной терапии.
Определение антинуклеарного фактора (АНФ) является «золотым стандартом» выявления антинуклеарных антител и диагностики ревматических заболеваний. Положительный результат теста не является абсолютным доказательством наличия аутоиммунного заболевания. У здоровых людей в 3–13% случаев титр АНФ повышен и достигает 1:320. У беременных пациенток может быть обнаружено мелкогранулярное свечение при низких, умеренных или даже высоких титрах АНФ, но в норме крупнозернистые или гомогенные типы свечения не должны определяться. Результаты теста необходимо оценивать в комплексе с клиническими данными и другими лабораторными показателями. При положительном результате исследования рекомендовано определить специ-фичность АНФ иммуноблотом [10].
Выявление антител к нативной ДНК является неблагоприятным маркером и может явиться фактором риска развития неблагоприятных плодных исходов. Несмотря на то что высокий показатель антител к ДНК характерен для системной красной волчанки, их низкая концентрация также обнаруживается в крови пациентов и с некоторыми другими аутоиммунными заболеваниями, а также могут быть следствием применения иФНО-α.
Материнские и плодные исходы при применении иФНО-α представлены в таблице 3.
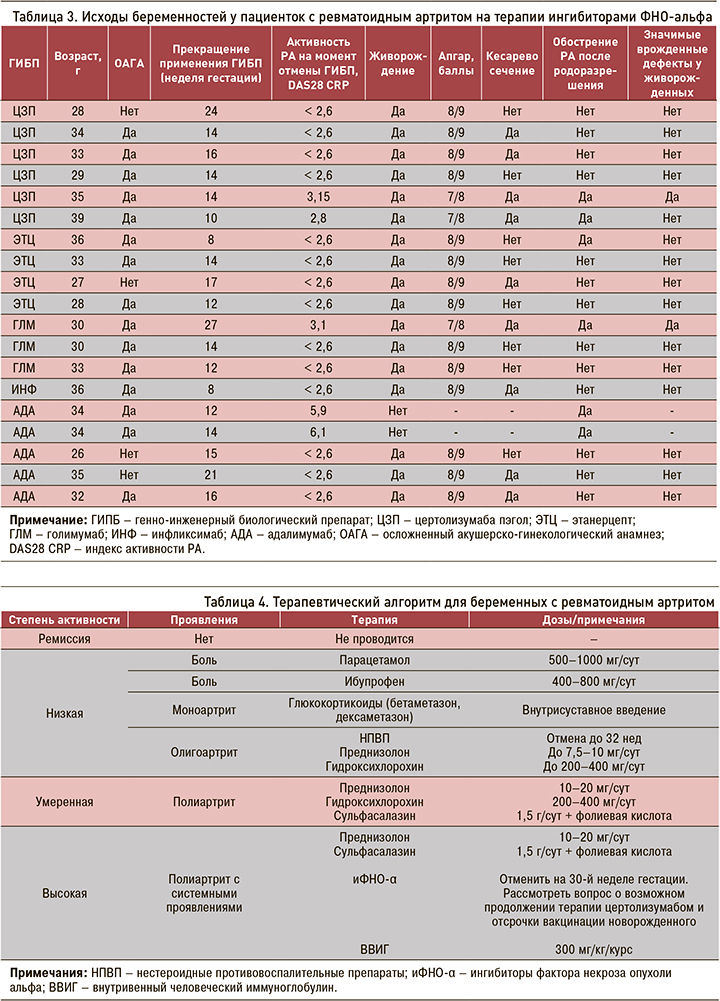
В двух случаях по медицинским показаниям на сроке 12–14 нед было выполнено прерывание беременности. В обоих случаях отмечалось увеличение толщины воротниковой зоны (пространства) более 2,7 мм (6,5 и 6,9 мм соответственно). Хромосомной патологии выявлено не было, однако были диагностированы грубые изменения сонографических изображений четырехкамерного среза сердца. Например, сочетание эктопии сердца и общего артериального ствола, гипопластический синдром левых отделов сердца, сопровождавшийся выраженной диспропорцией камер.
Искусственное родоразрешение (операция кесарева сечения) встречалась в 45%. Следует отметить, что при отсутствии сочетания беременности и РА средняя частота оперативного родоразрешения в России составляет 29%. Все операции носили плановый характер.
ОБСУЖДЕНИЕ
По сравнению с общей популяцией у пациенток с РА имеется повышенный риск неблагоприятных исходов беременности, в том числе преждевременные роды, низкая масса тела при рождении, малые размеры при рождении, перинатальная смертность, преэклампсия и кесарево сечение.
У женщин с РА повышен риск самопроизвольного аборта на раннем и позднем сроках беременности по сравнению с общей популяцией. У женщин с самопроизвольным абортом, как правило, показатель активности болезни был выше [11].
У пациенток с хорошим контролем заболевания исходы беременности были сопоставимы с таковым в общей популяции. Высокая активность заболевания была связана с риском преждевременных родов и малым гестационным размером плода [2, 3].
Влияние беременности на РА. Улучшение наступает в 43–66 % случаев. Клиническое улучшение отмечается с I триместра беременности и сохраняется на протяжении всего гестационного периода. Могут уменьшаться не только явления артрита и скованность в суставах, но и другие клинические проявления РА.
Полная ремиссия наблюдается у 13,8–27 % пациенток, которые не нуждаются ни в какой терапии в последнем триместре беременности. Течение заболевания остается активным в продолжение всей беременности и требует лечения приблизительно у 25 % беременных с РА.
Влияние РА на беременность. При отсутствии активности РА беременность протекает без осложнений и оканчивается естественными родами в срок с рождением здорового доношенного ребенка.
При активном РА и глюкокортикоидной терапии в период гестации повышена частота преждевременных родов, родоразрешения кесаревым сечением и низкого веса (<2500 г) плода при рождении. Частота преэклампсии, внутриутробной задержки развития плода не повышена. Принципы терапии РА при беременности приведены в таблице 4.
Беременность у больных РА должна быть планируемой, так как течение основного заболевания на фоне гестации, а также ее исходы в полной мере определяются активностью болезни и проводимой терапией. Вопросы планирования беременности должны обсуждаться с каждой пациенткой фертильного возраста.
При высокой активности заболевания ревматолог может принять решение о продолжении терапии беременной ингибиторами фактора некроза опухоли альфа (иФНО-α). В этом случае препарат должен быть отменен на 30-й неделе гестации для предупреждения ослабленного иммунного ответа и риска инфекций у плода и новорожденного [9].
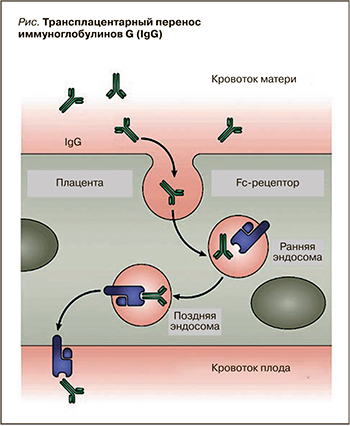 Перенос антител через плаценту осуществляется с помощью Fc-рецептора. Сначала синциотрофобласт неспецифически захватывает антитела из материнского кровотока. Внутри клетки по мере созревания эндосомы происходит закисление рН. В это время антитела через Fc-фрагмент могут связаться с Fc-рецептором. Это связывание защищает их от деградации и после слияния эндосомы с плазматической мембраной антитела высвобождаются в кровоток плода. Так в организм ребенка попадают все IgG классической формы.
Перенос антител через плаценту осуществляется с помощью Fc-рецептора. Сначала синциотрофобласт неспецифически захватывает антитела из материнского кровотока. Внутри клетки по мере созревания эндосомы происходит закисление рН. В это время антитела через Fc-фрагмент могут связаться с Fc-рецептором. Это связывание защищает их от деградации и после слияния эндосомы с плазматической мембраной антитела высвобождаются в кровоток плода. Так в организм ребенка попадают все IgG классической формы.
Большинство ГИБП является моноклональными антителами IgG1-класса, состоят из Fab- и Fc-фрагментов IgG и активно передаются через плаценту посредством Fc-рецепторов трофобласта (рис.).
Во всех исследованиях на животных, использованных для тестирования токсичности, воздействие IgG на плод было очень низким в течение органогенеза, т.е. на ранних сроках беременности. Плацентарная передача начинается со II триместра гестации и нарастает до родов, когда материнские и плодные сывороточные уровни препарата становятся эквивалентными или даже повышенными в сыворотке пуповинной крови.
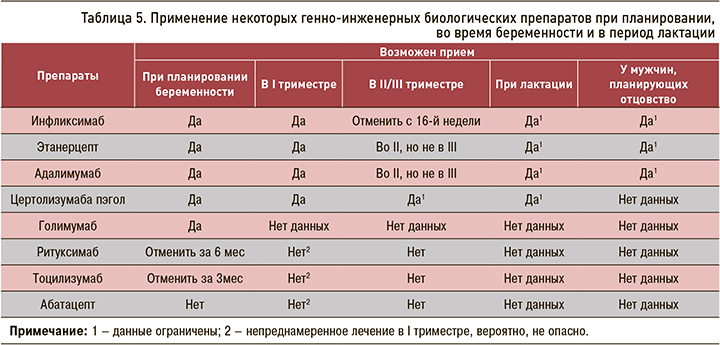
Предполагается, что иФНО-α являются препаратами низкого риска у беременных [8, 9]. Решение о терапии иФНО-α, особенно во второй половине гестации, должно основываться на оценке риска для ребенка и ожидаемого контроля за активность РЗ у матери (табл. 5).
Для того чтобы обеспечить низкий уровень препарата или его отсутствие в пуповинной крови новорожденного, иФНО-α должны быть отменены при установлении факта беременности или, если это оправдывается заболеванием матери, в II триместре беременности.
В связи с использованием иФНО-α во время беременности параметры нормального иммунного ответа новорожденного могут измениться.
Живые вакцины не должны назначаться новорожденным, родившимся от матерей, получавших иФНО-α или ритуксимаб во второй половине беременности. Вакцинацию следует отложить на 6 мес.
ЗАКЛЮЧЕНИЕ
Беременность у больных РА должна быть планируемой, так как течение основного заболевания на фоне гестации, а также ее исходы в полной мере определяются активностью болезни и проводимой терапией.
Решение о терапии в течение беременности, и особенно во второй половине беременности, должно основываться на оценке риска для ребенка и ожидаемого контроля за активностью заболевания матери.
Для того чтобы обеспечить низкий уровень препарата или его отсутствие в пуповинной крови новорожденного, иФНО-α должны быть отменены при установлении факта беременности или, если это оправдывается заболеванием матери, во II триместре беременности.
Для определения уровня активности РА на фоне беременности рекомендуется использовать индекс DAS28 CRP на каждом визите.


