Остеоартрит (ОА) остается актуальной и серьезной медицинской проблемой современности [1, 5, 16]. В структуре ОА важное место занимает гонартроз (ГА) [2, 3, 8].
Существующие клинические рекомендации предполагают использование клинических и рентгенологических критериев для диагностики ГА [6, 10]. При этом современные методы цифровой визуализации гиалинового хряща, такие как УЗИ и МРТ, убедительно показывают, что к моменту постановки диагноза ГА по клинико-рентгенологическим критериям толщина суставного хряща существенно снижена [4, 7, 9, 11].
Известно, что препараты, обладающие хондропротективным эффектом, не восстанавливают пораженный хрящ, а всего лишь приостанавливают его разрушение [12–15]. Все перечисленное определило цель нашего исследования – изучить состояние гиалинового хряща коленных суставов у пациентов, имеющих высокий риск ГА, но без клинических и рентгенологических критериев заболевания, а также установить целесообразность проведения хондропротективной терапии на доклинической стадии.
МАТЕРИАЛ И МЕТОДЫ
В течение 10-летнего периода (с 2008 по 2017 г.) на базе кардиоревматологического отделения Пермской краевой клинической больницы и Ревматологического центра обследован 361 пациент с высоким риском возникновения ГА. Высокий риск ГА определялся наличием ОА другой локализации (коксартроз, узелковая форма Гебердена и Бушара и др.), клинической и МРТ-документированной дорсопатии (протрузии межпозвоночных дисков, спондилез, спондилоартроз), ожирения с ИМТ >30.
У 63% пациентов имелся ОА (исключая ГА), у 71% – дорсопатия, у 35% – ожирение. При этом ни у кого из обследованных не было ни клинических признаков, ни рентгенологических проявлений ГА. Эти пациенты составили основную группу исследования.
В контрольную группу вошел 31 пациент, сопоставимых по полу и возрасту с основной группой, но не имевших факторов высокого риска развития ГА.
Основная группа была разделена на две подгруппы. Первую составили 190 больных, которые в течение 2 лет не принимали хондропротективные препараты, а использовали для купирования болевого синдрома НПВП в режиме «по требованию». Вторую подгруппу сформировал 171 больной, которые в течение тех же 2 лет применяли комбинированную хондропротективную терапию: внутрь фиксированную комбинацию хондроитина сульфата и глюкозамина гидрохлорида по 1 г/сут, внутримышечно Алфлутоп по 1 мл, 20 инъекций на один курс ежедневно с периодичностью 2 курса в год (всего 4 курса).
Алфлутоп представляет собой оригинальный комплексный препарат, содержащий биоактивный экстракт из мелкой морской рыбы, в состав которого входят хондроитин-4-сульфат, хондроитин-6-сульфат, дерматансульфат, кератансульфат, глюкуроновая кислота – «предшественница» гиалуроновой кислоты, миоинозитолфосфат, аминокислоты и микроэлементы. Препарат обладает противовоспалительным, антиоксидантным действием, улучшает функциональный статус хондроцитов, уменьшает разрушение матрикса хряща и гиалуроновой кислоты, увеличивает синтез гиалуроновой кислоты и основных макромолекул хряща.
Все пациенты подписали информированное согласие об участии в клиническом исследовании. Обследуемым определялся индекс массы тела, проводилось стандартное рентгенологическое исследование коленных и других пораженных суставов при наличии ОА, а также МРТ шейного, грудного и поясничного отделов позвоночника при клинических проявлениях дорсопатии. У пациентов с ОА различной локализации оценивались острофазовые тесты, индексы Лекена, WOMAC, ВАШ болевого синдрома, показатель качества жизни HAQ. Всем проводилось УЗИ коленных суставов: оно осуществлялось линейным датчиком с частотой 12 МГц на аппарате ALOKA PRO SOUND F37 в режиме нативной гармоники. Толщину суставного хряща определяли по стандартной методике в четырех участках: в медиальных и латеральных мыщелках бедренной и большеберцовой костей. Для каждого пациента определялась минимальная толщина гиалинового хряща, которая в большей степени, чем другие параметры, отражает его структурные изменения. Также оценивались характеристики синовиальной оболочки, наличие суставного выпота, степень пролабирования менисков, выраженность остеофитов.
Статистический анализ данных выполнялся при помощи программы Statistica версии 12. Для описания количественных признаков использовались значения М±σ, где М – среднее арифметическое значение, а σ – стандартное отклонение. Оценка статистической достоверности различий р между группами проводилась с использованием стандартного непараметрического теста Манна–Уитни для парных сравнений. Различия между группами считали статистически значимыми при р <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Пациенты обеих подгрупп основной группы были сопоставимы между собой и пациентами контрольной группы по возрасту и соотношению полов (табл. 1). В каждой группе преобладали женщины, что соответствует литературным данным о более частой встречаемости ОА у представительниц этого пола. Достоверное превышение у пациентов основных исследуемых подгрупп уровня ИМТ и величины острофазовых тестов относительно контрольной группы объясняется наличием у них факторов высокого риска ГА – ожирения, ОА и дорсопатии.
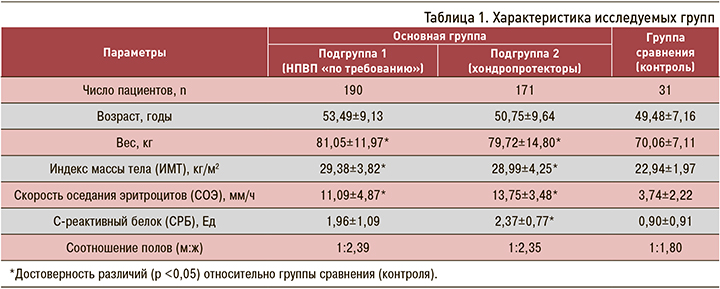
Несмотря на то что пациенты двух подгрупп основной группы не имели клинических и рентгенологических данных в пользу ГА, наличие факторов высокого риска этой формы ОА определило у них достоверное снижение минимальной высоты гиалинового хряща коленного сустава относительно контрольной группы (1,96±0,42; 2,12±0,47 мм в первой и второй подгруппах основной группы против 2,89±0,14 мм в группе контроля; р <0,05) (табл. 2). Это свидетельствует о наличии ранних доклинических структурных изменений гиалинового хряща и влиянии на его величину коморбидной патологии, которой в отношении ГА выступает ОА любой локализации, дорсопатия и ожирение.
Пациенты второй подгруппы основной группы принимали в течение 2 лет комбинированную хондропротективную терапию. Основанием для ее назначения было наличие у больных этой подгруппы ОА другой локализации и дорсопатии. Сравнительные показатели высоты суставного хряща коленного сустава в подгруппах основной группы и контрольной группе исследования приведены в таблице 2.
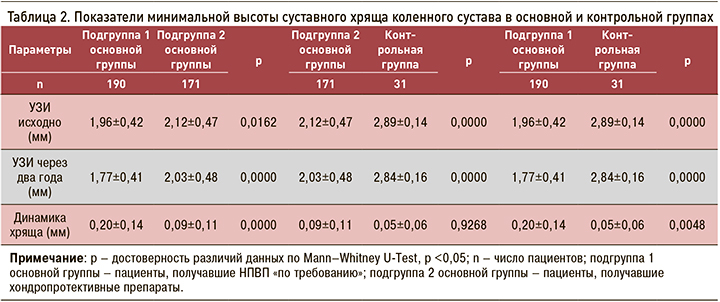
Пациенты всех изучаемых групп в течение двух лет наблюдения теряли гиалиновый хрящ. Но если у пациентов первой подгруппы основной группы (без хондропротективных препаратов, получавших НПВП «по требованию») через 2 года произошла достоверно значимая потеря хряща и составила 0,20±0,14 мм, то у пациентов второй подгруппы, принимавших комбинированные хондропротекторы, эта потеря была менее выраженной и составила лишь 0,09±0,11мм. Разница в уменьшении суставного хряща между первой и второй подгруппами основной группы оказалась достоверной (р <0,05) (рис. 1, 2).
Добавим, что наименьшее снижение минимальной высоты гиалинового хряща наблюдалось в контрольной группе (на 0,05±0,06 мм; р <0,05 относительно подгрупп основной группы), т.е. среди лиц, вовсе не имевших факторов высокого риска развития ГА. Вкупе с результатами, полученными в подгруппах основной группы исследования, это свидетельствует о том, что хотя комбинированная хондропротективная терапия значимо приостанавливает процесс деструкции хряща, однако не может полностью нивелировать действие факторов высокого риска ОА. В связи с этим для оптимизации терапии доклинического ГА необходимо наряду с хондропротективной терапией проводить коррекцию ожирения, дорсопатии и других факторов риска ГА.
Полученные данные позволяют предположить наличие ранней субклинической стадии ГА и сформулировать гипотезу о том, что хондропротективные препараты максимально проявляют свой структурно-модифицирующий эффект на самых ранних стадиях заболевания, когда гиалиновый хрящ еще сохранен. Для подтверждения этой гипотезы мы разделили каждую подгруппу основной группы на две категории в зависимости от исходного состояния величины гиалинового хряща в коленном суставе (≥2 и <2 мм) (табл. 3).
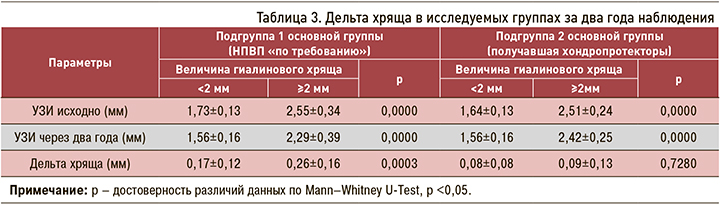
Оказалось, что максимальная потеря гиалинового хряща за 2 года (0,26±0,16 мм) происходит у пациентов, не принимающих хондропротекторы, в большей степени при исходно сохраненном хряще. По мере снижения высоты гиалинового хряща скорость его потери в абсолютных величинах снижается: при исходной величине гиалинового хряща <2 мм эта потеря составила 0,17±0,12 мм, что достоверно меньше, чем у пациентов с исходным уровнем хряща ≥2 мм (рис. 3). Вероятно, это связано с компенсаторными механизмами регенерации.
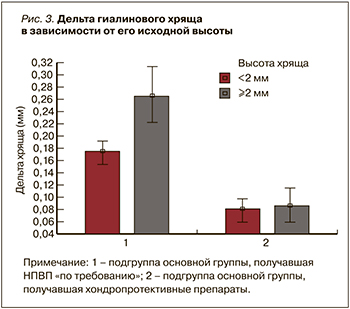 Прием комбинированной хондропротективной терапии снижает потерю гиалинового хряща и нивелирует межгрупповую разницу в зависимости от исходной величины хряща (см. табл. 3).
Прием комбинированной хондропротективной терапии снижает потерю гиалинового хряща и нивелирует межгрупповую разницу в зависимости от исходной величины хряща (см. табл. 3).
ЗАКЛЮЧЕНИЕ
- У пациентов с высоким риском развития ГА, не имеющих клинических и рентгенологических проявлений заболевания, выявляются структурные изменения при ультрасонографии коленного сустава.
- Наличие дорсопатии, ожирения, остеоартрита любой локализации определяет высокий риск гонартроза.
- У пациентов с высоким риском ГА целесообразно вычленение ранней доклинической и дорентгенологической стадии.
- Ультрасонографический метод эффективен в определении ранних субклинических проявлений ГА.
- Комбинированная длительная хондропротективная терапия (в нашем исследовании фиксированная комбинация хондроитина сульфата и глюкозамина гидрохлорида для приема внутрь + внутримышечное введение препарата Алфлутоп) эффективна и должна применяться на ранней субклинической стадии ГА у лиц с высоким риском его развития.


