Подагра является заболеванием, социальное и медицинское значение которого определяется не только поражением опорно-двигательного аппарата, но и комплексным влиянием болезни на организм, приводящим к снижению качества и продолжительности жизни. В связи c этим вопрос адекватного лечения подагрического артрита представляется задачей первостепенной важности в современной ревматологии.
Традиционно медикаментозное лечение подагры складывается из двух составляющих – купирования обострения подагрического артрита и проведения уратснижающей терапии (УСТ). Несмотря на то что алгоритмы лечения подагры разработаны достаточно подробно, тем не менее целевые уровни мочевой кислоты (МК) (360 мкмоль/л) в крови у пациентов с подагрой достигаются далеко не во всех случаях. Это может быть связано с назначением неадекватных доз уратснижающих препаратов, низкой приверженностью пациентов к терапии, а также проблемой коморбидности. Эффективное лечение и предупреждение хронизации течения подагры может быть достигнуто только в результате тесного взаимодействия врача и пациента, в котором врач обладает глубокими знаниями о заболевании, а пациент демонстрирует приверженность назначенной терапии в межприступные периоды течения подагры [1–4]. Следует признать, что низкая приверженность лечению во многом связана с недостаточной эффективностью выбранной тактики лечения пациента. В результате этого нередко возникают обострения подагрического артрита.
Особая трудность в выборе алгоритма ведения больных подагрой связана с коморбидной патологией, которая не только влияет на течение заболевания, но и негативно сказывается на эффективности проводимой терапии. Помимо комплаентности и приверженности к терапии, важным аспектом является частое поражение почек у больных подагрой и необходимость коррекции дозы тех или иных препаратов в зависимости от скорости клубочковой фильтрации (СКФ).
Цель настоящего исследования – на основании данных регистра пациентов с подагрой в Санкт-Петербурге за 2016–2018 гг. оценить эффективность лечения подагрического артрита (ПА) в реальной клинической практике.
МАТЕРИАЛ И МЕТОДЫ
Оценка особенностей терапии ПА проводились на основании данных амбулаторных карт пациентов, обратившихся в Санкт-Петербургский городской центр подагры с активным подагрическим артритом в период с 01.01.2016 по 31.12.2018 и включенных в Санкт-Петербургский городской регистр больных подагрой. Участие пациентов в регистре проводилось при наличии информированного согласия на включение анонимизированных данных амбулаторных карт пациентов в базы данных и регистры.
В регистр также включали сведения о первичной или вторичной природе подагры, характере течения артрита (острый, хронический, рецидивирующий), особенностях текущего приступа ПА, по поводу которого пациент обратился в центр подагры (острый артрит, затяжной приступ, хронический артрит), функциональной недостаточности суставов (ФНС) и уровне МК (мкмоль/л) сыворотки крови. Отмечали гиперсекреторный, гипоэкстреторные и смешанный варианты развития ПА.
Регистр сформирован на базе облачной электронной системы хранения данных GALENOS (©OOOTexЛаб).
Формирование регистра подагры было одобрено комитетом по этике СПб ГБУЗ «Клиническая ревматологическая больница № 25». Все данные вносились в регистр и хранились в системе в анонимном виде, не позволяющем идентифицировать отдельного пациента как личность.
Статистический анализ проводился с использованием программ Microsoft Office Exсel 2007 (MicrosoftCorp., США) и STATISTICA 8.0 (StatSoftInc, США). Характер распределения данных оценивался графическим методом и с использованием критерия Шапиро–Уилка. В случае нормального распределения признака его описывали в виде среднее±стандартное отклонение (M±SD). При описании признаков, отличных от нормального распределения, результаты представлены в виде Ме [Q1; Q3], где Me – медиана, Q1 и Q3 – первый и третий квартили. При характере распределения данных, отличном от нормального, применялись непараметрические методы: критерий Манна – Уитни, критерий Вальда–Вольфовица, критерий χ2, критерий Вилкоксона, критерий знаков. Корреляционные взаимосвязи между количественными признаками рассчитывались с применением коэффициентов корреляции Спирмена или Пирсона. Различия и взаимосвязи считали достоверными при p ≤0,05.
РЕЗУЛЬТАТЫ
Суммарно в регистр включили 1393 пациента с активным ПА. Среди них 100 пациентов госпитализировались повторно, 26 человек имели 3 госпитализации, по одному человеку – 4, 5 и 9 госпитализаций. Все они были включены в статистический анализ (табл. 1).
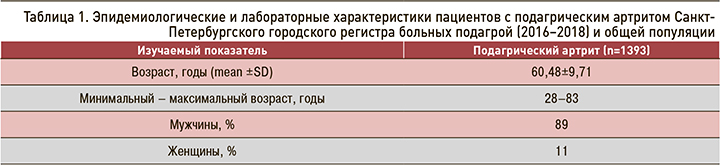
Средние значения концентрации МК в сыворотке крови, скорости оседания эритроцитов (СОЭ) и С-реактивного белка (СРБ) в начале госпитализации и при выписке из стационара достоверно различались (p <0,001) (табл. 2).
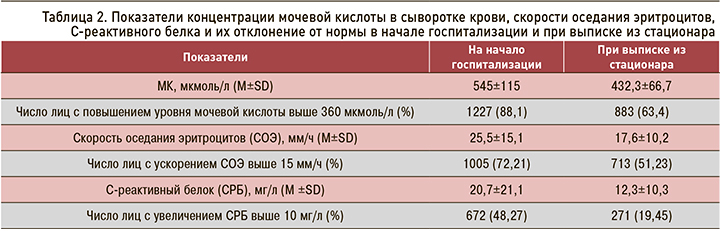
Для купирования обострения ПА нестероидные противовоспалительные препараты (НПВП) использовались у 1269 (87,65%) пациентов, глюкокортикостериды (ГКС) – у 959 (55,99%), сочетанное применение НПВП и ГКС – у 700 (50,17%). УСТ проводилась аллопуринолом у 1207 (86,64%) пациентов и фебуксостатом – у 47 (3,37%). Цитратная смесь блемарен применялась у 479 (34,39%) больных. Колхицин принимали 107 (7,68%) пациентов. Часть больных не была включена в статистический анализ в виду отсутствия данных. В таблицах 3 и 4 представлены дозы лекарственных средств и схемы их применения, применявшиеся для лечения пациентов с ПА.
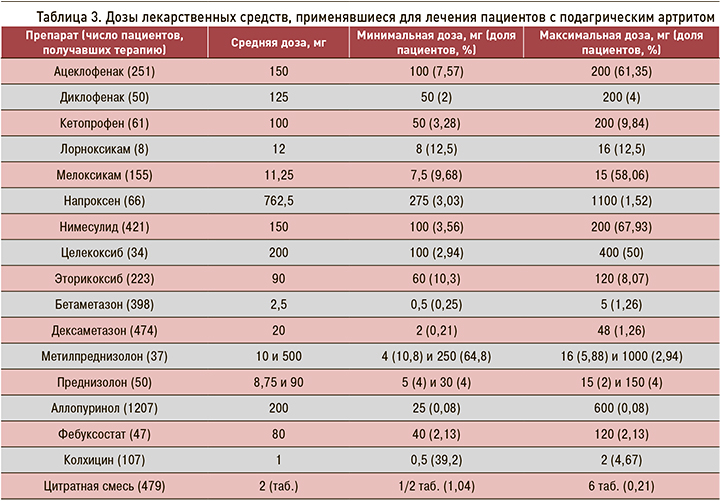
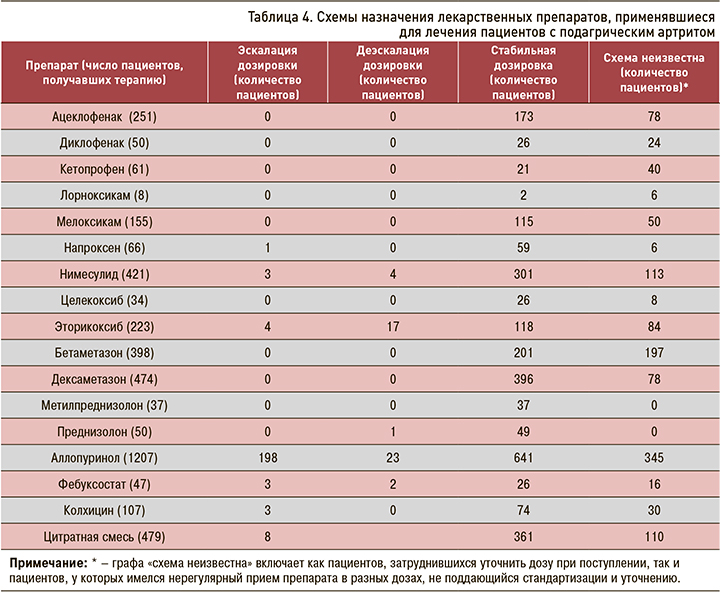
Изменение режима дозирования препаратов при повторных госпитализациях не оценивалось ввиду большого количества разнонаправленных изменений дозировок.
113 (8,11%) пациентам с высокой клинико-лабораторной активностью, значительным снижением показателей функции почек (клубочковая фильтрация, клиренс и экскреция мочевой кислоты) проводили плазмообмен экстракорпорально модифицированной аутоплазмой (ПОЭМП) по методике: до 5 процедур с интервалом в 1–2 дня, после каждой процедуры внутривенное введение различных доз ГКС. Внутривенное лазерное облучение крови в нашем исследовании выполнялось 189 (13,57%) пациентам по следующей методике: 5 процедур ежедневно с использованием низкоинтенсивного лазерного излучения с длиной волны 650–670 нм.
ОБСУЖДЕНИЕ
Известно, что препаратами выбора для купирования обострения подагрического артрита служат НПВП, колхицин и ГКС. Выбор препарата или их комбинации остается за лечащим врачом с учетом их эффективности, переносимости и наличия у пациента коморбидной патологии, которая может ограничивать применение тех или иных лекарственных средств [1]. По мнению экспертов, селективные ингибиторы ЦОГ-2 могут иметь преимущество перед неселективными НПВП при ПА. Для больных подагрой, у которых метаболические нарушения, как и злоупотребление алкоголем, распространены широко, это положение является весьма актуальным. При ПА показана эффективность таких НПВП как напроксен, диклофенак, нимесулид, мелоксикам и эторикоксиб [2, 4].
Эффективность колхицина также была показана в нескольких исследованиях. В настоящее время считается обоснованным использование низких доз этого лекарственного средства: прием 1–1,5 мг/сут является менее токсичным [4] и столь же эффективным по сравнению с приемом высоких доз [5]. Исключение составляют ситуации, приводящие к кумуляции препарата (нарушение функции почек, сочетание с кларитромицином, циклоспорином). Колхицин назначают главным образом при наличии противопоказаний к приему НПВП или их неэффективности [2].
Другой альтернативой НПВП при их неэффективности служат ГКС. В исследовании [6] купирование артрита коротким курсом ГКС было получено в 41% случаев. При сравнении эффективности различных лекарственных форм и способа введения ГКС (метилпреднизолон по 500 мг внутривенно в течение двух дней и бетаметазон по 7 мг внутримышечно однократно) различий получено не было [7]. Проводилась оценка частоты возникновения нежелательных лекарственных реакций после введения ГКС. Зафиксированные метаболические эффекты кратковременной парентеральной ГКС-терапии, такие как повышение артериального давления, ЭКГ-изменения, повышение уровня глюкозы в сыворотке крови и изменения липидного обмена, носили в основном транзиторный характер. Исключение составляли лишь больные с уже имеющимися метаболическими нарушениями, у которых эти изменения были более стойкими [8]. Метод внутрисуставного введения ГКС также является эффективным и сопряжен с минимальными и транзиторными побочными эффектами [5].
На сегодняшний день имеется положительный опыт применения плазмафереза у больных подагрой [9, 10]. Данных по применению лазерного облучения крови при ПА в литературе немного [11].
Препараты, снижающие уровень МК в крови, можно разделить на неселективные, опосредованно влияющие на обмен МК (статины, фенофибрат, лозартан, дигидропиридиновые антагонисты кальциевых каналов) [5, 12–14], и селективные, созданные специально для коррекции пуринового обмена. К группе селективных препаратов относятся урикостатики – препараты, уменьшающие продукцию мочевой кислоты (аллопуринол, фебуксостат), урикозуретики – лекарства, увеличивающие выделение МК с мочой (бензбромарон, лезинурад, веринурад), и уриколитики – разрушители мочевой кислоты (пеглотиказа) [5, 14]. Эффективность аллопуринола и фебуксостата, преимущества фебуксостата были показаны как в крупномасштабных (FACT, FOCUS, APEX, EXCEL, CONFIRMS и CARES), так и отдельных исследованиях [15–20]. При нефролитиазе может быть использован блемарен – цитрат-гидрокарбонат-калий-натриевая смесь [21]. Побочные эффекты при приеме этого препарата развиваются редко, при незначительном снижении функции почек коррекция его дозы не требуется [22, 23].
В ходе настоящего исследования получены данные, свидетельствующие о высокой частоте использования НПВП и ГКС, их комбинации и УСТ у пациентов с ПА. Терапия НПВП, ГКС и колхицином приводила к уменьшению интенсивности болевого синдрома, синовита и снижению острофазовых показателей. В исследованиях [2, 6–8,10] была также показана эффективность использования различных форм ГКС и НПВП коротким курсом с минимальными побочными эффектами.
Как уже отмечалось, исследований по применению эфферентных методов лечения у больных подагрой в литературе немного [9–11], однако, исходя из полученных результатов, нам представляется, что и плазмаферез, и лазерное облучение крови эффективны в комплексной терапии обострения ПА.
УСТ в основном была представлена аллопуринолом, в меньшей степени фебуксостатом, что может быть неверным с учетом высокой частоты неудач УСТ при применении аллопуринола. На фоне активной терапии в условиях стационара произошло достоверное снижение уровня МК в ходе госпитализации. Согласно полученным нами данным, острофазовые показатели, отражающие обострение ПА, были исходно повышены у 72% пациентов, тогда как при выписке – у 48 %, а уровень МК был повышенным у 88% больных с ПА на момент обращения в Центр подагры. Схожие результаты были получены и в другом исследовании [18], где у 100% больных подагрой при обращении за медицинской помощью отмечался повышенный уровень МК.
Приведенные сведения позволяют предположить, что перед госпитализацией пациенты имеют еще больший уровень МК. Именно этот бессимп-томный (скрытый) период гиперурикемии представляет особую опасность для здоровья пациента, поскольку в этот момент не происходит адекватной коррекции нарушений пуринового обмена, развивается поражение почек, снижается СКФ, формируется сердечно-сосудистая патология, в том числе артериальная гипертензия, которая, в свою очередь, способствует замыканию «порочного круга» в поражении почек. Отсутствие адекватной УСТ также способствует обострению ПА и формированию тофусной подагры, о чем свидетельствуют результаты ранее проведенного нами исследования [26]. Соответственно вопрос достижения целевых уровней МК при ПА остается актуальным, несмотря на имеющиеся широкие терапевтическое возможности.
ЗАКЛЮЧЕНИЕ
По данным городского регистра подагры Санкт-Петербурга, подавляющее большинство пациентов с ПА на момент обращения в центр нуждалось в терапии НПВП (87,65%) и ГКС (55,99 %), а также УСТ. Это свидетельствует о неадекватной коррекции пуринового обмена на догоспитальном этапе, представленной в 86,64% случаев аллопуринолом (средняя доза 200 мг/сут) и в 3,37% случаев – фебуксостатом (средняя доза 80 мг/сут). Более трети пациентов не могли уточнить характера проводимого амбулаторного лечения, что отражает низкую приверженность терапии и малую информированность больных ПА о своем здоровье.
В ходе госпитализации достигнуто значимое уменьшение уровня воспалительной активности и улучшение показателей пуринового обмена.



